夏季斑枯病是草坪上一种重要的根部病害,常引起草坪草叶尖枯死及根部坏死,最终在草坪上形成大小不一的圆形或蛙眼状黄褐色斑块,由于该病害主要发生在高温高湿的夏季,因此得名夏季斑[1]。夏季斑枯病主要由真菌Magnaporthe poae Landschoot & Jackson引起,称为夏季斑枯病菌,该菌主要侵染冷季型草坪草,包括一年生早熟禾 Poa annua L.、草地早熟禾Poa pratensis L.、羊茅Festuca spp.和匍匐翦股颖Agrostis palustris Huds.[2-5]。在中国,草地早熟禾被广泛应用于城市绿化及高尔夫球场球道中,而匍匐翦股颖则是高尔夫球场果岭的常用草种,目前在这两个草种上均已发现夏季斑枯病菌为害[6-7]。化学药剂仍是防治夏季斑枯病最有效的方式,其中甲氧基丙烯酸酯类杀菌剂 (QoIs) 嘧菌酯的防效较好[8],在该病害防治上已使用多年,但目前尚未见有关夏季斑枯病菌群体对嘧菌酯敏感性的研究报道。
QoIs主要作用于电子传递链的复合物III,阻止电子传递,抑制能量合成。一些植物病原菌可通过旁路氧化呼吸 (AOX) 途径抵抗QoIs的抑制[9],而病原菌的AOX途径可被水杨肟酸 (SHAM) 等抑制[10],因此,SHAM常被用于植物病原菌对QoIs的敏感性测定中,以消除AOX途径对敏感性测定的影响[11]。但也有研究显示,添加或不添加SHAM,一些植物病原菌对QoIs的敏感性并无明显变化[11-12];在添加SHAM后,QoIs对有些植物病原菌的EC50值甚至较不添加时反而有所升高[10, 13-14];表明不同植物病原菌在受到QoIs选择压力时启动AOX途径的水平存在差异[10]。而有关夏季斑枯病菌在QoIs药剂选择压力下利用AOX途径的能力尚不明确。
嘧菌酯是由先正达公司开发的第一个QoIs杀菌剂,对植物病原菌孢子及菌丝阶段均具有良好的抑制活性[9],但病原菌极易对其产生抗性,属于高抗药性风险杀菌剂[15]。已有研究表明,病原菌对QoIs抗性的产生主要与其细胞色素b基因 (Cytb) 上的点突变相关,目前发现主要有3种点突变可引起对QoIs的抗性:143位密码子由甘氨酸突变为丙氨酸 (G143A),129位密码子由苯丙氨酸突变为亮氨酸 (F129L),以及137位密码子由甘氨酸突变为精氨酸 (G137R)。其中G143A突变最为常见,在多种病原菌中均可导致高抗性,而F129L和G137R突变则较少,且主要导致低水平抗性[11, 16]。然而,也有研究显示,一些对QoIs敏感性下降的植物病原菌在Cytb基因上并未发生任何突变,其抗性机制尚不明确[14, 17-18]。
基于以上背景,本研究测定了SHAM对夏季斑枯病菌菌丝生长的影响,以及添加SHAM对病原菌对嘧菌酯敏感性的影响,以评估旁路氧化呼吸途径在夏季斑枯病菌对嘧菌酯敏感性测定中的作用;在此基础上,测定了北京地区不同地理及寄主来源夏季斑枯病菌对嘧菌酯的敏感性,建立了相对敏感性基线,以监测该病原菌对嘧菌酯的敏感性变化;比对分析并克隆了夏季斑枯病菌Cytb基因部分序列,探寻是否存在与抗药性相关的点突变。以期为夏季斑枯病的有效防治及抗药性治理提供依据,同时为QoIs抗性机制的研究提供参考。
1 材料与方法 1.1 供试菌株2015—2016连续两年于北京地区8个地块采集具有典型夏季斑枯病症状的草地早熟禾和匍匐翦股颖病样,其中7个采集地为高尔夫球场球道或果岭 (分别用符号BX、TX、APEC、JH、JSH、QHW和TA表示),均有QoIs施用历史,1个采集地为城市绿化草坪 (用CAU表示),无QoIs施用历史,该采样点的夏季斑枯病菌群体被认为是对QoIs敏感的群体。室内条件下采用Bassoriello等[2]报道的方法进行病原菌的分离,获得具有一致菌落形态的真菌分离物,经形态鉴定确定其为夏季斑枯病菌M. poae[19]。切取菌丝块转至灭菌的2 mL冻存管,加入1.5 mL灭菌的20%甘油,使菌丝块完全浸入甘油中,菌株置于10 ℃培养箱中进行长期保存。供试菌株信息见表1。
|
|
表 1 北京地区草坪草夏季斑枯病菌菌株信息 Table 1 The information of M. poae isolates from turfgrass in Beijing |
1.2 供试药剂
98%的嘧菌酯 (azoxystrobin) 原药,由江苏省农业科学院植物保护研究所刘永锋实验室提供,用甲醇溶解,配成1 × 104 μg/mL的母液;99%的水杨肟酸 (SHAM),购自美国Sigma-Aldrich公司,用甲醇溶解,配成1 × 105 μg/mL的母液。所有母液于4 ℃保存,备用。TSINGKE master mix,擎科生物有限公司 (南京)。
1.3 水杨肟酸对菌丝生长的影响随机选取9株夏季斑枯病菌,采用菌丝生长速率法[20]测定SHAM对菌丝生长的影响。用甲醇将SHAM母液稀释成系列浓度并制成含药PDA平板,使SHAM最终质量浓度分别为1、10、20、40、60、80和100 μg/mL,以加入等体积甲醇 (0.1%) 的平板为对照。供试菌株在PDA培养基上生长7 d后,沿菌落边缘打取直径5 mm的菌饼并转接至含药平板中心,置于25 ℃、黑暗条件下培养5 d,测量菌落直径。每处理重复3次。按公式 (1) 求出不同浓度SHAM对菌丝生长的抑制率 (%)。
| $\begin{split}{\text{菌丝生长抑制率}}/{\text{%}} =\quad\quad\quad\quad\quad\quad\quad\quad\quad\quad\\ \frac{{\text{对照菌落直径} - \text{处理菌落直径}}}{{\text{对照菌落直径} - \text{菌饼直径}}} \times 100\end{split}$ | (1) |
随机选取12株夏季斑枯病菌,以1.3节试验确定的对病原菌菌丝生长影响较小 (抑制率 < 20%) 的SHAM浓度进行处理,确定SHAM在菌株对嘧菌酯敏感性测定中的影响。用甲醇将嘧菌酯母液稀释成系列浓度,制成嘧菌酯终浓度分别为0.000 1、0.001、0.01、0.1、1及10 μg/mL的含药平板;用甲醇将SHAM母液稀释后与上述系列浓度嘧菌酯一起添加至PDA培养基中,制得同时含SHAM及相同系列终浓度嘧菌酯的含药平板。分别以仅添加等体积甲醇和SHAM的PDA培养基为对照,每处理重复3次。同1.3节采用菌丝生长速率法测定各处理菌落直径,计算药剂对菌丝生长的抑制率。
1.5 菌株对嘧菌酯的敏感性测定参照1.4节方法,测定嘧菌酯对所有供试114株夏季斑枯病菌的EC50值。
1.6 夏季斑枯病菌Cytb部分序列分析选取对嘧菌酯敏感性存在差异的12株夏季斑枯病菌,用于探寻病原菌对嘧菌酯抗性的分子机制。采用同属稻瘟病菌M. grisea的Cytb部分序列 (KP877608.1) 在夏季斑枯病菌线粒体基因组 (M. poae ATCC 64411 mitochondrial supercontigs) 数据库中进行BLAST同源性搜索[21],得到夏季斑枯病菌Cytb部分核苷酸序列,其包含了编码与对嘧菌酯抗性产生相关的129、137及143位氨基酸[11]的碱基序列。利用Primer 3设计引物 (MpCytb_F: AAATCGGCACAGACTCAATCG,MpCytb_R: GGCTACAAAACCTCAGAAAAC) 扩增与对嘧菌酯抗性相关区域。PCR反应总体系为30 μL,包含1 × TSINGKE master mix,200 nmol/L前引物和后引物,以及50~100 ng的基因组DNA。PCR反应程序为:94 ℃ 2 min;94 ℃ 15 s,62 ℃ 30 s,72 ℃ 1 min,30个循环;最后于72 ℃延伸10 min。用1%琼脂糖凝胶电泳检测,将割胶纯化回收后的PCR产物送至上海生工生物有限公司进行测序。通过BioEdit软件进行序列比对分析。
1.7 数据统计分析以菌丝生长抑制率几率值为纵坐标 (y),添加和不添加SHAM条件下嘧菌酯系列浓度的对数为横坐标 (x),得到毒力回归方程y = bx + a及相关系数 (r),计算EC50值。采用DPS 7.05软件比较不同SHAM添加浓度对夏季斑枯病菌菌丝生长抑制率的差异显著性 (α = 0.05),比较添加和不添加SHAM时EC50值在α = 0.05水平的差异显著性。通过DPS 7.05软件分析供试114株夏季斑枯病菌对嘧菌酯的敏感性频率分布,绘制敏感性频率分布图,并进行Shapiro-Wilk正态性检验,同时采用最小显著性差异法 (LSD) 比较不同地理及寄主来源夏季斑枯病菌对嘧菌酯敏感性的差异显著性 (α = 0.05)。
2 结果与分析 2.1 水杨肟酸对菌丝生长及其对嘧菌酯敏感性的影响结果 (表2) 显示:SHAM对夏季斑枯病菌菌丝生长具有明显的抑制作用,且不同浓度下抑制率差异显著 (F = 20.812,P < 0.000 1)。其中,当SHAM质量浓度为1、10和20 μg/mL时,其对菌丝生长的影响与对照相比并无显著差异;当SHAM质量浓度为40 μg/mL时,抑制率在6.08%~14.42%之间;当SHAM超过40 μg/mL时,对部分菌株的抑制率超过20%,且随其浓度升高抑制率可进一步升到36.90%。根据已有研究中通常以对病原菌菌丝生长有一定抑制作用但抑制率小于30%的SHAM浓度作为适宜的添加浓度 [22],本研究确定了后续试验中SHAM的添加水平为40 μg/mL。结果 (表3) 表明:添加和不添加SHAM条件下,嘧菌酯对12株夏季斑枯病菌的EC50值仅1株 (LT122) 存在显著差异,其余均无显著差异;嘧菌酯对12株夏季斑枯病菌的平均EC50值也无显著差异 (F = 0.041 0,P = 0.842 3)。
|
|
表 2 不同浓度水杨肟酸对9株夏季斑枯病菌菌丝生长的抑制作用 Table 2 Mycelial growth inhibition of 9 isolates of M. poae with salicylhydroxamic acid (SHAM) at different concentrations |
|
|
表 3 添加及不添加水杨肟酸条件下夏季斑枯病菌对嘧菌酯的敏感性 Table 3 Sensitivity of M. poae isolates to azoxystrobin with or without salicylhydroxamic acid (SHAM) |
2.2 夏季斑枯病菌对嘧菌酯的敏感性
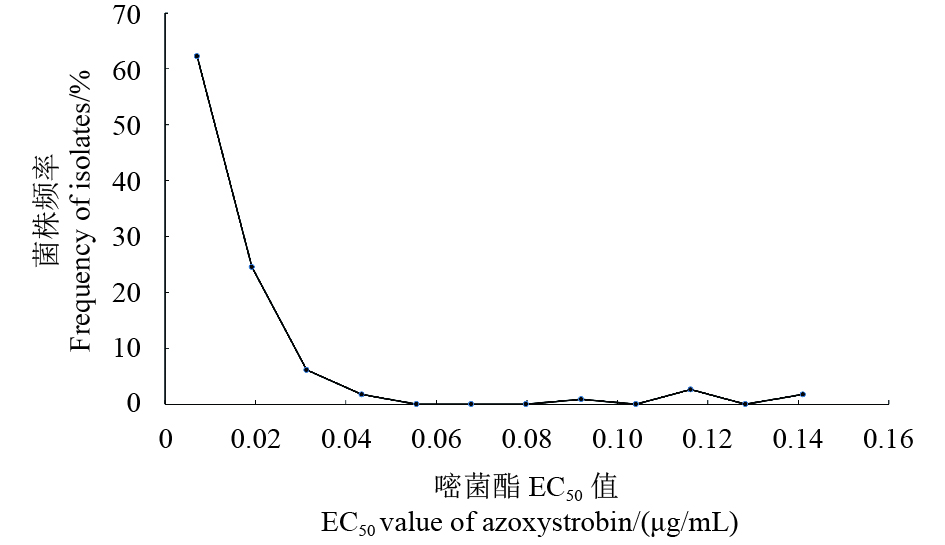
嘧菌酯对114株夏季斑枯病菌的EC50值范围为0.001 0~0.146 5 μg/mL,平均EC50值为 (0.017 4 ± 0.026 1) μg/mL,EC50最大值和最小值相差146.5倍。Shapiro-Wilk正态性检验结果显示,夏季斑枯病菌对嘧菌酯的敏感性频率不符合正态分布 (W = 0.499 7, P < 0.05)( 图1)。
|
图 1 供试114株夏季斑枯病菌对嘧菌酯的敏感性频率分布 Fig. 1 Frequency distribution of the sensitivity of 114 M. poae isolates to azoxystrobin |
分析不同地理来源夏季斑枯病菌对嘧菌酯的敏感性,结果 (表4) 显示:无QoIs施用历史地区采集的病原菌敏感群体 (CAU) 的平均EC50值为 (0.011 8 ± 0.009 3) μg/mL;有QoIs施用历史地区病原菌夏季斑枯病菌群体的平均EC50值为 (0.017 9 ± 0.027 0) μg/mL,其中,最大值为 (0.043 8 ± 0.068 6) μg/mL,来自北京净山湖高尔夫球场 (JSH),最小值为 (0.010 3 ± 0.007 1) μg/mL,来自北京天安假日高尔夫球场 (TA)。LSD检验结果显示,来自APEC会都高尔夫俱乐部和净山湖高尔夫球场的夏季斑枯病菌的平均EC50值与敏感群体 (CAU) 相比存在显著差异 (表4)。进一步分析不同寄主来源病原菌群体对嘧菌酯的敏感性差异 (表5),发现嘧菌酯对草地早熟禾和匍匐翦股颖上夏季斑枯病菌的平均EC50值亦无显著差异 (F = 0.404 0,P = 0.526 5)。
供试菌株对嘧菌酯的敏感性虽然呈现一定程度的分化,但仍有70.18%的菌株位于图1中相应的主峰范围,Shapiro-Wilk正态性检验结果显示,这部分菌株对嘧菌酯的敏感性频率呈近似正态分布 (W = 0.970 8,P = 0.064 0 > 0.05),其平均EC 50值为 (0.007 8 ± 0.003 7) μg/mL,因此可将此EC50平均值作为夏季斑枯病菌对嘧菌酯的相对敏感性基线。
|
|
表 4 不同寄主来源夏季斑枯病菌对嘧菌酯的敏感性 Table 4 Sensitivity of M. poae isolates from different turfgrass species to azoxystrobin |
|
|
表 5 不同寄主来源夏季斑枯病菌对嘧菌酯的敏感性 Table 5 Sensitivity of M. poae isolates from different turfgrass species to azoxystrobin |
2.3 Cytb序列分析
BLASTN分析显示,夏季斑枯病菌线粒体基因组上有4个区域 (分别为311、165、200和66 bp) 与稻瘟病菌Cytb参考序列的相似度达到了82%~87%(E值 < 4 × 10 –13),通过比对分析,从夏季斑枯病菌线粒体基因组中获得了该菌 Cytb的部分序列 (8 639 bp),该序列包含了编码与嘧菌酯抗性相关的3个密码子 (F129、G137和G143) 碱基序列,进一步分析显示,其143位和144位密码子之间插入了一段长为1 956 bp的内含子 (图2A)。根据内含子5′ 剪切位点上游外显子最后一个碱基为T,以及内含子3′ 剪切位点为G的特点,认为该内含子为 I 型内含子[23]。通过设计引物MpCytb_F/MpCytb_R,用于扩增供试菌株中包含3个抗性位点及143和144位密码子间部分内含子的序列,比对结果显示,所有菌株均含有I型内含子,且在上述3个位点上碱基序列一致,未出现与抗性相关的点突变 (图2B)。

|
注:A为细胞色素b部分序列中外显子和内含子结构示意图,方框表示外显子,线型表示内含子,黑色粗线表示包含与QoIs抗性相关的3个密码子部分序列;B为对嘧菌酯敏感性存在差异的12株夏季斑枯病菌Cytb基因部分序列比对结果,129、127和143位密码子在图中用粗体字标识。 Note: A, structure at the exon-intron junction in the partial Cytb fragment, boxes indicate exons and line indicates intron, bold black line illustrates the amplified region containing the three codons conferring QoIs resistance. B, alignment of the partial nucleotide sequences of the Cytb gene from 12 M. poae isolates, codon 129, 137 and 143 are in bold. 图 2 夏季斑枯病菌细胞色素b基因部分序列信息 Fig. 2 Partial characterization of the M. poae cytochrome b (Cytb) |
3 结论与讨论
嘧菌酯是1996年诞生的第一个QoIs产品,目前已广泛应用于多种农业植物病害的防治[9],且已在草坪病害防治中使用多年[24-25]。本研究测定了北京地区114株不同地理和寄主来源草坪草夏季斑枯病菌对嘧菌酯的敏感性,发现不同菌株间敏感性存在显著差异,EC50最大值与最小值相差146.5倍,其中与无QoIs药剂施用历史地区的夏季斑枯病菌群体 (CAU) 相比,部分有QoIs药剂施用历史地区的菌株群体 (APEC和JSH) 对嘧菌酯的敏感性存在显著差异,表明北京地区夏季斑枯病菌群体已出现对嘧菌酯敏感性下降的现象,因此应密切关注其田间抗性发展动态。本研究同时建立了夏季斑枯病菌对嘧菌酯的相对敏感性基线,可为夏季斑枯病菌对嘧菌酯的田间抗性监测提供参考。
SHAM作为AOX途径的抑制剂,常被用于QoIs的室内敏感性测定中[11, 16],但针对不同病原菌,SHAM的添加浓度存在差别[10-11, 22, 26]。本研究通过比较SHAM不同添加水平下对夏季斑枯病菌菌丝生长的影响,发现随着SHAM浓度升高,其对菌丝生长的抑制作用趋于明显,其中,当SHAM添加水平为40 μg/mL时,抑制作用较明显,但抑制率未超过20%,该浓度可作为敏感性测定中适宜的SHAM添加浓度[22]。SHAM对菌丝生长的抑制作用在其他植物病原真菌上也有报道[10, 22, 26]。本研究还比较了添加和不添加40 μg/mL SHAM条件下,夏季斑枯病菌对嘧菌酯的敏感性,发现二者间并不存在显著差异。综上,我们认为,夏季斑枯病菌在受到嘧菌酯胁迫时,不会启动AOX途径,因此,在进行夏季斑枯病菌对嘧菌酯的敏感性测定时,可不用添加SHAM。
已有研究表明,病原菌Cytb基因上的点突变可引起对QoIs的抗性,目前已报道3种相关的点突变,其中G143A的突变可引起高抗性,而F127L及G137R的突变可引起低或中等抗性[23, 27]。本研究通过同源比对分析获得夏季斑枯病菌的部分Cytb序列,结果显示,该菌Cytb序列的143位密码子下游插入了一段1 956 bp的内含子,这是首次发现夏季斑枯病菌Cytb基因在143位密码子下游有内含子插入。根据已有报道,该内含子属于I型内含子[23]。I型内含子具有自我剪切功能,而在外显子和内含子连接区发生的碱基突变可能会破坏其剪切过程,造成Cytb转录及表达水平下降以及细胞色素bc1复合物产能的降低,并最终影响病原菌的呼吸功能[23]。因此,在下游有内含子插入的情况下,G143A位点的突变可能会降低病原菌的田间生存适合度,使得该突变群体更容易被自然淘汰[23, 28]。Cytb基因143位密码子下游插入内含子的现象在其他病原菌中也有报道,如锈菌属真菌 (Puccinia spp.)、链格孢属真菌 (Alternaria spp.)、灰霉病菌Botrytis cinerea、山核桃疮痂病菌Fusicladium effusum、褐霉病菌Monilinia fructicola以及柑橘黑斑病菌Guignardia citricarpa等[10, 23, 29-34],但目前并未见具有该内含子的病原菌发生G143A突变的报道,G143A的突变仅发生在Cytb基因143位密码子下游无内含子插入的病原菌中[28]。由此推测夏季斑枯病菌不易对QoIs产生高水平抗性。敏感性测定结果也显示,田间尚未出现夏季斑枯病菌对QoIs产生高抗性的菌株。进一步选取对嘧菌酯敏感性不同的夏季斑枯病菌,设计引物、扩增并比对了包含上述3个位点以及部分内含子的核苷酸序列,结果显示,所有菌株均在Cytb 143位密码子下游插入了I型内含子,且在与QoIs抗性相关的3个位点均未发生突变,进一步证明了上述推测。
有研究认为,植物病原菌对QoIs抗性的产生除了AOX途径的启动、Cytb基因上的点突变外,可能还存在其他未知的机制[14]。本研究显示,夏季斑枯病菌对嘧菌酯的敏感性呈现下降,但在嘧菌酯胁迫下该菌并未启动AOX途径,且在分子水平上未发现与嘧菌酯抗性相关的点突变,因此,笔者推测夏季斑枯病菌对嘧菌酯敏感性的降低可能也涉及其他分子机制。类似结果在其他一些植物病原菌中已有报道,如芸薹生链格孢A. brassicicola和桃褐腐病菌M. fructicola对嘧菌酯表现为敏感性下降,但在其Cytb基因上与嘧菌酯抗性相关的3个位点均未检测到突变,且抗性的产生与AOX途径无关[17, 31]。进一步发现,所有芸薹生链格孢和部分桃褐腐病菌菌株Cytb基因143位密码子下游同样也出现了内含子的插入[17, 34]。研究者认为,植物病原菌对QoIs的抗性,除了由Cytb基因点突变引起的质量抗性外,还存在其他未知机制引起的数量抗性,且质量抗性可能会紧随数量抗性之后而发生[17-18]。本研究中,夏季斑枯病菌对嘧菌酯敏感性下降的准确机制还需进一步研究确定,同时应密切关注夏季斑枯病菌对嘧菌酯的敏感性变化动态,及时避免或延缓抗药性的发生、发展。
| [1] | LANDSCHOOT P J, JACKSON N. Magnaporthe poae sp. nov., a hyphopodiate fungus with a Phialophora anamorph from grass roots in the United States [J]. Mycol Res, 1989, 93(1): 59–62. doi:10.1016/S0953-7562(89)80137-6 |
| [2] | BASSORIELLO M M I, JORDAN K S. First report of Magnaporthe poae, cause of summer patch disease on annual bluegrass, in Canada [J]. Plant Dis, 2012, 96(11): 1698. |
| [3] | SWIFT C E, BLESSINGER A, BRANDT N, et al. First report of summer patch of Kentucky bluegrass caused by Magnaporthe poae in Colorado [J]. Plant Dis, 2007, 91(11): 1519. |
| [4] | TREDWAY L P. First report of summer patch of creeping bentgrass caused by Magnaporthe poae in North Carolina [J]. Plant Dis, 2005, 89(2): 204. |
| [5] | BUNTING T E, PLUMLEY K A, CLARKE B, et al. Identification of Magnaporthe poae by PCR and examination of its relationship to other fungi by analysis of their nuclear rDNA ITS-1 regions [J]. Phytopathology, 1996, 86(4): 398–404. doi:10.1094/Phyto-86-398 |
| [6] | LIU Q Y, LIU M H, LI T, et al. First report of summer patch of Kentucky bluegrass caused by Magnaporthe poae in China [J]. Plant Dis, 2017, 101(1): 250. |
| [7] | HU J, LIU Q Y, LIU M H, et al. First report of summer patch of creeping bentgrass caused by Magnaporthe poae in China [J]. Plant Dis, 2017, 101(4): 634. |
| [8] | ZHAO S, CLARKE B B, SHEN Q, et al. Development and application of a TaqMan real-time PCR assay for rapid detection of Magnaporthe poae [J]. Mycologia, 2012, 104(5): 1250–1259. doi:10.3852/11-365 |
| [9] | BARTLETT D W, CLOUGH J M, GODWIN J R, et al. The strobilurin fungicides[J]. Pest Manag Sci, 2002, 58(7): 649–662. doi:10.1002/(ISSN)1526-4998 |
| [10] | SEYRAN M, BRENNEMAN T B, STEVENSON K L. In vitro toxicity of alternative oxidase inhibitors salicylhydroxamic acid and propyl gallate on Fusicladium effusum [J]. J Pes Sci, 2010, 83(4): 421–427. doi:10.1007/s10340-010-0312-7 |
| [11] | HINCAPIE M, WANG N Y, PERES N A, et al. Baseline sensitivity of Guignardia citricarpa isolates from Florida to azoxystrobin and pyraclostrobin [J]. Plant Dis, 2014, 98(6): 780–789. doi:10.1094/PDIS-03-13-0335-RE |
| [12] |
吴娥娇, 沈国桢, 刘训达, 等. 水杨肟酸对致病疫霉生长及其对嘧菌酯敏感性的影响[J]. 农药学学报, 2015, 17(4): 384–390.
WU E J, SHEN G Z, LIU X D, et al. Effect of salicylhydroxamic acid (SHAM) on the mycelium growth and sensitivity of Phytophthora infestans to azoxystrobin [J]. Chin J Pestic Sci, 2015, 17(4): 384–390. |
| [13] |
皇甫运红, 戴德江, 时浩杰, 等. 浙江省果蔬灰霉病菌对嘧菌酯的抗药性研究[J]. 农药学学报, 2013, 15(5): 504–510.
HUANGFU Y H, DAI D J, SHI H J, et al. Study on resistance of Botrytis cinerea to azoxystrobin collected from fruits and vegetables in Zhejiang Province [J]. Chin J Pestic Sci, 2013, 15(5): 504–510. |
| [14] | WALKER A S, AUCLAIR C, GREDT M, et al. First occurrence of resistance to strobilurin fungicides in Microdochium nivale and Microdochium majus from French naturally infected wheat grains [J]. Pest Manag Sci, 2009, 65(8): 906–915. doi:10.1002/ps.v65:8 |
| [15] | ISHII H, HOLLOMON D W. Fungicide resistance in plant pathogens: principles and a guide to practical management[M]. Tokyo: Springer, 2015: 3-12. |
| [16] | WISE K A, BRADLEY C A, PASCHE J S, et al. Baseline sensitivity of Ascochyta rabiei to azoxystrobin, pyraclostrobin, and boscalid [J]. Plant Dis, 2008, 92(2): 295–300. doi:10.1094/PDIS-92-2-0295 |
| [17] | PEREIRA W V, PRIMIANO I V, MORALES R G F, et al. Reduced sensitivity to azoxystrobin of Monilinia fructicola isolates from Brazilian stone fruits is not associated with previously described mutations in the cytochrome b gene [J]. Plant Dis, 2017, 101(5): 766–773. doi:10.1094/PDIS-09-16-1247-RE |
| [18] | KÖLLER W, PARKER D M, TURECHEK W W, et al. A two-phase resistance response of Venturia inaequalis populations to the QoI fungicides kresoxim-methyl and trifloxystrobin [J]. Plant Dis, 2004, 88(5): 537–544. doi:10.1094/PDIS.2004.88.5.537 |
| [19] | CLARKE B B, GOULD A B. Turfgrass patch diseases caused by ectotrophic root-infecting fungi[M]. St. Paul, MN: The American Phytopathological Society Press, 1993. |
| [20] |
李波涛, 吴隆起, 倪笑霞, 等. 水稻稻瘟病菌对烯肟菌胺的抗性风险评估及抗性机制初探[J]. 植物病理学报, 2014, 44(1): 80–87.
LI B T, WU L Q, NI X X, et al. Risk assessment and molecular mechanism of the resistance of Magnaporthe oryzae from rice to SYP-1620 [J]. Acta Phytopathologica Sinica, 2014, 44(1): 80–87. |
| [21] | OKAGAKI L H, NUNES C C, SAILSBERY J, et al. Genome sequences of three phytopathogenic species of the Magnaporthaceae family of fungi[J]. G3: Genes Genom Genet, 2015, 5(12): 2539–2545. |
| [22] | REBOLLAR-ALVITER A, MADDEN L V, JEFFERS S N, et al. Baseline and differential sensitivity to two QoI fungicides among isolates of Phytophthora cactorum that cause leather rot and crown rot on strawberry [J]. Plant Dis, 2007, 91(12): 1625–1637. doi:10.1094/PDIS-91-12-1625 |
| [23] | STANDISH J R, AVENOT H F, BRENNEMAN T B, et al. Location of an intron in the cytochrome b gene indicates reduced risk of QoI fungicide resistance in Fusicladium effusum [J]. Plant Dis, 2016, 100(11): 2294–2298. doi:10.1094/PDIS-05-16-0658-RE |
| [24] | YOUNG J R, TOMASO-PETERSON M, TREDWAY L P, et al. Occurrence and molecular identification of azoxystrobin-resistant Colletotrichum cereale isolates from golf course putting greens in the Southern United States [J]. Plant Dis, 2010, 94(6): 751–757. doi:10.1094/PDIS-94-6-0751 |
| [25] | UDDIN W, VIJI G, VINCELLI P. Gray leaf spot (blast) of perennial ryegrass turf: an emerging problem for the turfgrass industry[J]. Plant Dis, 2003, 87(8): 880–889. doi:10.1094/PDIS.2003.87.8.880 |
| [26] | LIANG H J, DI Y L, LI J L, et al. Baseline sensitivity of pyraclostrobin and toxicity of SHAM to Sclerotinia sclerotiorum [J]. Plant Dis, 2015, 99(2): 267–273. doi:10.1094/PDIS-06-14-0633-RE |
| [27] | CASTROAGUDÍN V L, CERESINI P C, DE OLIVEIRA S C, et al. Resistance to QoI fungicides is widespread in Brazilian populations of the wheat blast pathogen Magnaporthe oryzae [J]. Phytopathology, 2015, 105(3): 284–294. doi:10.1094/PHYTO-06-14-0184-R |
| [28] | VALLIÈRES C, TROUILLARD M, DUJARDIN G, et al. Deleterious effect of the Qo inhibitor compound resistance-conferring mutation G143A in the intron-containing cytochrome b gene and mechanisms for bypassing it [J]. Appl Environ Microbiol, 2011, 77(6): 2088–2093. doi:10.1128/AEM.02548-10 |
| [29] | BANNO S, YAMASHITA K, FUKUMORI F, et al. Characterization of QoI resistance in Botrytis cinerea and identification of two types of mitochondrial cytochrome b gene [J]. Plant Pathol, 2009, 58(1): 120–129. doi:10.1111/ppa.2009.58.issue-1 |
| [30] | GRASSO V, PALERMO S, SIEROTZKI H, et al. Cytochrome b gene structure and consequences for resistance to Qo inhibitor fungicides in plant pathogens [J]. Pest Manag Sci, 2006, 62(6): 465–472. doi:10.1002/(ISSN)1526-4998 |
| [31] | LUO C X, HU M J, JIN X, et al. An intron in the cytochrome b gene of Monilinia fructicola mitigates the risk of resistance development to QoI fungicides [J]. Pest Manag Sci, 2010, 66(12): 1308–1315. doi:10.1002/ps.v66:12 |
| [32] | MIESSNER S, MANN W, STAMMLER G. Guignard ia bidwellii, the causal agent of black rot on grapevine has a low risk for QoI resistance [J]. J Plant Dis Protect, 2011, 118(2): 51–53. doi:10.1007/BF03356381 |
| [33] | SIEROTZKI H, FREY R, WULLSCHLEGER J, et al. Cytochrome b gene sequence and structure of Pyrenophora teres and P. tritici-repentis and implications for QoI resistance [J]. Pest Manag Sci, 2007, 63(3): 225–233. doi:10.1002/(ISSN)1526-4998 |
| [34] | KREIS R A, DILLARD H R, SMART C D. Population diversity and sensitivity to azoxystrobin of Alternaria brassicicola in New York State [J]. Plant Dis, 2016, 100(12): 2422–2426. doi:10.1094/PDIS-03-16-0414-RE |
 2018, Vol. 20
2018, Vol. 20


