2. 密苏里大学哥伦比亚分校 化学工程系,美国 密苏里州哥伦比亚
2. Department of Chemical Engineering, University of Missouri-Columbia, Columbia MO, America
王铜 (copper oxychloride) 又名碱式氯化铜,难溶于水,常以粒子形式粘附在叶片表面,依靠植物表面水的酸化逐步释放铜离子,是一种无机铜保护性杀菌剂,作为一种“固定的铜”而具有“缓释”效应,与传统的硫酸铜相比对植株更安全、使用期长、药害小,已成为含铜新制剂中最主要的有效成分[1]。目前,王铜在中国的登记作物有番茄、柑橘、花生、黄瓜、人参、水稻和烟草等[2]。
由于铜是人体所必需的微量元素,所以普通人群因铜摄入超标而引发的中毒事件鲜有发生。从农业生产和人体健康的角度看,作物残留的铜污染问题并不明显[3],因此目前中国尚未见到对无机铜制剂残留限量的规定,仅在生活饮用水卫生标准中规定了铜的最大残留限量 (MRL) 值为1 mg/L[4]。但无机铜既不会降解,也很少移动,长期施用仍会在土壤中积累并对生态环境造成污染[5],尤其在水环境中,游离态的铜离子能与水生生物蛋白质中的巯基结合,干扰巯基酶的活性,从而对水生生物造成危害[6],因此有必要对其在水中的浓度进行检测。
目前,铜的检测方法有分光光度法[7-9]、原子吸收法[10-11]、电化学法[12-13]、离子色谱法[14]、电感耦合等离子体质谱法[15-16]和离子印迹法[17]等。分光光度法较易受到基质干扰,其他方法则大多需要特殊仪器或耗材。高效液相色谱法具有较好的选择性,且普及率高,操作简便,但常规的紫外检测器无法直接对铜进行检测,因而目前较少将高效液相色谱法用于农药制剂中王铜的检测。
二乙基二硫代氨基甲酸钠 (DDTC-Na) 是一种常见的铜衍生化试剂,能与Cu2+ 反应生成黄棕色胶体配合物 (Scheme 1)。GB/T 5750.6—2006中介绍了DDTC-Na分光光度法测定生活饮用水及其水源水中的铜,最低检测质量为2 μg[18]。本研究以DDTC-Na为衍生化试剂,采用柱前衍生法将Cu2+ 转化为带发色光团的有机配合物,同时利用色谱柱的分离能力排除其他干扰,以建立一种王铜的高效液相色谱检测方法,并应用于不同水样中王铜残留量的测定。
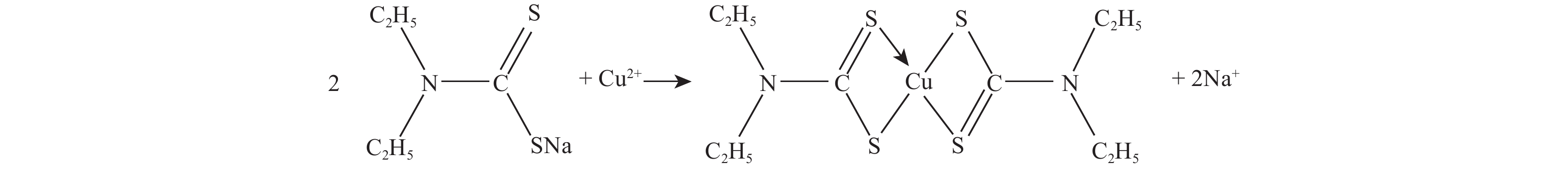
|
图式1 |
1 材料与方法 1.1 仪器与药剂
Thermo Dionex UltiMate 3000高效液相色谱系统,配可变波长检测器 (variable wavelength detector,VWD)(美国Thermo公司);SB25-12DT超声波清洗仪 (宁波新芝生物科技股份有限公司);XS105DU分析天平 (美国梅特勒-托利多集团);纯水仪 (美国Millipore公司)。
甲醇和冰乙酸均为色谱纯 (美国Fisher公司);王铜 (copper oxychloride) 标准品 (99.0%,Dr. Ehrenstorfer);三水合二乙基二硫代氨基甲酸钠 (DDTC-Na·3H2O,分析纯,国药集团化学试剂有限公司);鱼类养殖用水[19]、ISO标准稀释水[20]、OECD培养基[21]均由苏州西山中科药物研究开发有限公司提供。
1.2 标准溶液配制称取20.2 mg (精确至0.1 mg) 王铜标准品于200 mL烧杯中,加入150 mL 10%乙酸溶液,超声溶解,冷却至室温后转移到200 mL容量瓶中,用10%乙酸溶液定容,混匀,配成100 mg/L的王铜储备液。移取1 000 μL 100 mg/L的王铜储备液于10 mL容量瓶中,用10%乙酸溶液稀释,配成10 mg/L的王铜工作溶液,再逐级稀释成0.06、0.2、0.5、1和2 mg/L的王铜标准溶液。
1.3 模拟样品的制备称取10.1 mg (精确至0.1 mg) 王铜标准品于200 mL烧杯中,加入100 mL不同水样 (分别为鱼类养殖用水、ISO标准稀释水及OECD培养基),搅拌48 h,制得100 mg/L的王铜悬浮液;取王铜悬浮液过0.45 μm水系滤膜,制得王铜饱和溶液,作为模拟样品。
1.4 衍生化处理准确称取 (0.2 ± 0.04) g DDTC-Na·3H2O于100 mL烧杯中,加入80 mL甲醇,超声溶解,冷却至室温后转移到100 mL容量瓶中,用甲醇定容,混匀,配成2 000 mg/L的DDTC-Na溶液。
量取500 μL待测样品于2 mL EP管中,加入500 μL 10%的乙酸溶液酸化,混匀 (pH 3) 后取500 μL加入到装有500 μL 2 000 mg/L DDTC-Na溶液的EP管中,混匀,静置2 h后转移到一次性注射器中,过0.22 μm有机滤膜,待测。
1.5 高效液相色谱检测条件Waters XBridgeTM C18反相色谱柱 (4.6 mm × 250 mm,5 μm);流动相为V (甲醇) : V (水) = 85 : 15,等度洗脱;进样体积为50 μL;流速为1 mL/min;VWD检测器检测波长305 nm;运行时间9 min。
1.6 基质效应鱼类养殖用水、ISO标准稀释水和OECD培养基分别是常见的鱼类、大型溞类及藻类养殖用水,含有各种微量元素及金属离子,其中钙离子质量浓度分别为50、80和5 mg/L,ISO标准稀释水和OECD培养基中还各含有12 mg/L和3 mg/L的镁离子。为考察本方法对不同金属离子的抗干扰能力,分别用以上3种水进行了基质干扰试验。分别移取500 μL 3种供试水样于3个2 mL EP管中,进行衍生化前处理,按1.5节的条件测定。
1.7 添加回收试验分别以鱼类养殖用水、ISO标准稀释水和OECD培养基为溶剂,稀释王铜工作溶液配成质量浓度为0.06、0.2和1 mg/L的添加回收溶液,进行添加回收试验,各5个平行样品,衍生化后测定,计算平均回收率及相对标准偏差 (RSD)。
2 结果与讨论 2.1 样品衍生化时的酸化处理王铜在水中的形态有Cu2+、Cu(OH)+和Cu(OH)2。通过0.45 μm水系滤膜的过滤,可将实际样品中可能存在的不溶于水的部分去除,同时考虑到随着pH值的增大,Cu2+ 会逐渐生成Cu(OH)2,导致水中的Cu2+ 浓度降低,影响其实际浓度的测定精度,因此本研究在衍生化前使用10%的乙酸溶液酸化样品,以保证样品中可溶性Cu2+ 形态的稳定。
2.2 配制DDTC-Na溶液时溶剂的选择由于DDTC-Na溶于水和甲醇,可以选择水或甲醇作为衍生化试剂的溶剂,但以水为溶剂配制的DDTC-Na溶液与王铜标准溶液混合后会出现褐色沉淀,而以甲醇为溶剂时与王铜标准溶液混合后没有沉淀,说明衍生化后的物质能溶于甲醇,难溶于水,因此本研究选择甲醇为溶剂配制DDTC-Na溶液。
2.3 色谱条件的优化由于DDTC-Na溶于水和甲醇,不溶于乙腈,而衍生化后溶液中残留较多的DDTC-Na,因此选择甲醇为流动相的有机相。
在检测过程中发现,不同基质模拟样品衍生化后,在最大吸收波长270 nm下测定时目标峰附近出现较多干扰,而在波长305 nm处左右未出现明显干扰,因此检测波长选择干扰较少的305 nm。
2.4 衍生化时间的比较预试验中发现,将2 000 mg/L的DDTC-Na溶液与王铜标准溶液混合后,溶液颜色不稳定,先变深再变浅,说明衍生化过程需要一定的时间才能达到平衡。因此本研究考察了不同静置时间对紫外吸光度响应值的影响,结果见图1。由图中可知,DDTC-Na与王铜标准溶液反应迅速,但峰高响应值随静置时间增加而上升,在60 min到达峰值,然后有所下降。在静置2 h后,色谱峰高的吸光度响应值趋于稳定,因此衍生化时间选定为2 h。
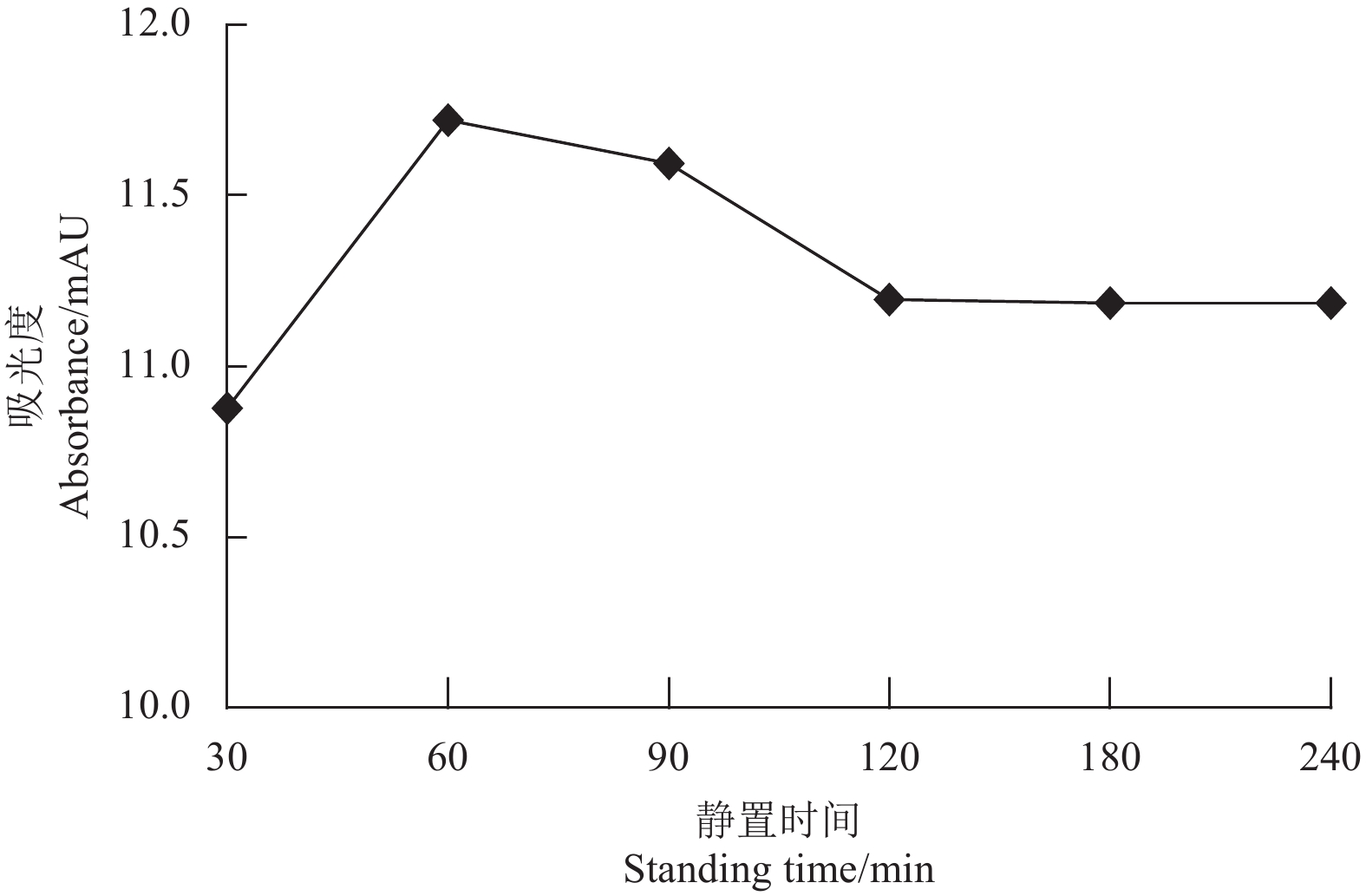
|
图 1 静置时间对衍生化产物吸光度 (色谱峰高) 的影响 Fig. 1 Influence of standing time on the absorbance (peak height) of the derivatization product |
2.5 方法学验证 2.5.1 基质干扰
由图2可知:王铜衍生物的保留时间在7 min左右 (图2a),3种空白基质在此处均不存在干扰,说明Ca2+ 和Mg2+ 均不影响本方法对Cu2+ 的测定。
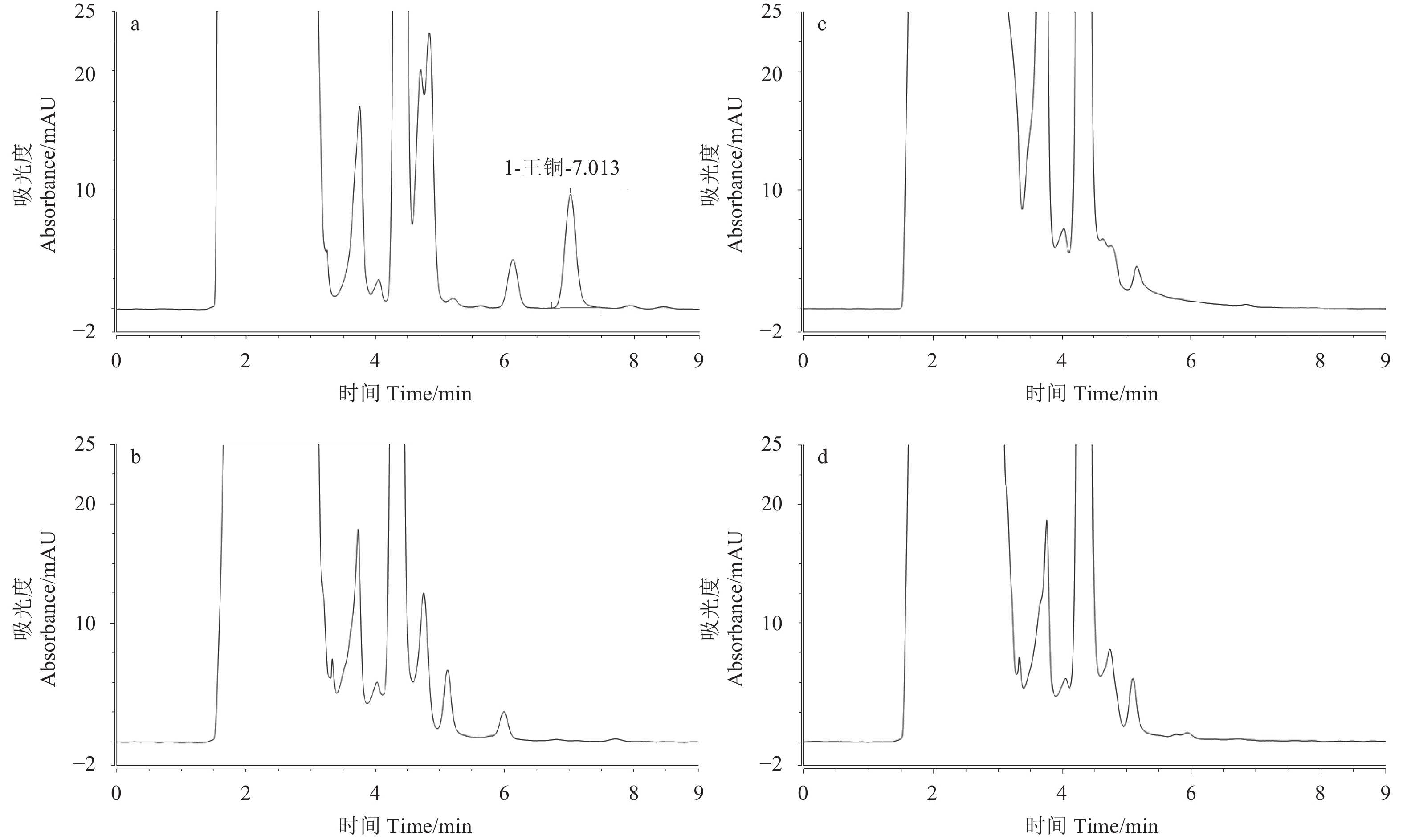
|
a. 0.5 mg/L王铜标准溶液;b. 鱼类养殖用水空白基质;c. ISO标准稀释水空白基质;d. OECD培养基空白基质。 a. 0.5 mg/L copper oxychloride standard solution; b. fish breeding water blank matrix; c. ISO standard dilutes water blank matrix; d. OECD medium blank matrix. 图 2 王铜标准溶液 (0.5 mg/L) 及3种空白基质的色谱图 Fig. 2 The chromatogram of copper oxychloride standard solution (0.5 mg/L) and three blank matrices |
2.5.2 方法的线性范围、检出限和定量限
将王铜标准溶液衍生化处理后测定,绘制方法标准曲线。结果表明:在0.06~2 mg/L范围内,衍生化产物线性关系良好,相关系数r > 0.999。3种不同水样中,方法的检出限 (LOD)( S/N = 3) 均为0.02 mg/L,定量限 (LOQ)(S/N = 10) 为0.06 mg/L。
2.5.3 添加回收试验结果添加回收试验结果 (表1) 表明:在0.06、0.2和1 mg/L添加水平下,王铜在鱼类养殖用水、ISO标准稀释水和OECD培养基中的平均回收率在85%~108%之间,相对标准偏差 (RSD) 在2.2%~14%之间,证明不同水样中所含有的微量元素及Ca2+ 和Mg2+ 的存在均不影响本方法对王铜残留量测定的准确性。
|
|
表 1 不同基质中王铜的添加回收率及相对标准偏差 (n = 5) Table 1 Recoveries and relative standard deviations of copper oxychloride in different matrices (n = 5) |
2.5.4 模拟样品的测定
为了验证方法的有效性,分别测定了以鱼类养殖用水、ISO标准稀释水和OECD培养基3种基质为溶剂配制的基质匹配王铜饱和溶液,实测值分别为0.11 mg/L (鱼类养殖用水)、0.12 mg/L (ISO标准稀释水)、0.09 mg/L (OECD培养基)。色谱图见图3,衍生化产物的保留时间在7 min左右,且目标峰附近无明显干扰,说明本方法能够满足实际水样检测对专属性和灵敏度的要求。

|
a. 鱼类养殖用水;b. ISO标准稀释水; c. OECD培养基。 a. Fish breeding water; b. ISO standard dilutes water; c. OECD medium. 图 3 3种基质匹配王铜饱和溶液色谱图 Fig. 3 Chromatograms of saturated solution of copper oxychloride in three matrices |
3 结论
本研究通过对衍生条件和色谱参数的优化,开发了一种检测水中王铜的柱前衍生-高效液相色谱分析方法。该方法样品前处理过程简单、灵敏、准确,方法检出限 (LOD) 为0.02 mg/L,定量限 (LOQ) 为0.06 mg/L。鱼类养殖用水、ISO标准稀释水、OECD培养基3种基质对王铜的检测均不造成干扰,说明本方法能够有效地避免复杂基质中钙离子和镁离子可能带来的干扰和影响,适合于水中王铜浓度的检测。此外,该方法减少了检测所需的样本体积和试剂体积,避免了大量使用有机试剂所带来的污染,对其他铜制剂在水中浓度的检测也具有一定的参考价值。但如何继续优化条件,如利用固相萃取等其他前处理方法提高检测方法的灵敏度和专属性,并将其推广到初级农产品及土壤样品中铜残留量的测定,有待进一步研究。
| [1] | Information on plant protection products-databases on registered plant protection products in Europe[DB/OL]. [2017-08-02]. http://www. eppo.int/PPPRODUCTS/information/ information_ppp.htm. |
| [2] |
中国农药信息网. PD20110181、PD20110182、PD167-92、PD20100349农药登记数据[DB/OL].[2017-08-02]. http://www.chinapesticide.gov.cn/yxcftozw.jhtml.
China Pesticide Information Network. Pesiticide registration data of PD20110181, PD20110182, PD167-92, and PD20100349 [DB/OL]. [2017-08-02]. http://www.chinapesticide.gov.cn/yxcftozw.jhtml. |
| [3] |
郑袁明, 宋波, 陈同斌, 等. 北京市菜地土壤和蔬菜中铜含量及其健康风险[J]. 农业环境科学学报, 2006, 25(5): 1093–1101.
ZHENG Y M, SONG B, CHEN T B, et al. A survey of copper concentrations in vegetables and soils in Beijing and their health risk[J]. J Agro-Environ Sci, 2006, 25(5): 1093–1101. |
| [4] |
生活饮用水卫生标准: GB 5749—2006[S]. 北京: 中国标准出版社, 2007.
Standards for drinking water quality: GB/T 5749—2006[S]. Beijing: Standards Press of China, 2007. |
| [5] |
戚燕, 杜鹏飞, 张悦, 等. 壬菌铜和吡唑醚菌酯在苹果和土壤中的残留及消解动态[J]. 农药学学报, 2017, 19(1): 76–83.
QI Y, DU P F, ZHANG Y, et al. Determination and dissipation dynamics of cuppric nonyl phenolsulfonate and pyraclostrobin in apples and soil[J]. Chin J Pest Sci, 2017, 19(1): 76–83. |
| [6] |
杨润萍, 李晓霞, 丁磊, 等. 污染水中铜离子浓度的快速测定[J]. 中国卫生检验杂志, 2007, 17(12): 2217–2218.
YANG R P, LI X X, DING L, et al. Determination of copper ions in polluted water[J]. Chin J Health Lab Technol, 2007, 17(12): 2217–2218. doi:10.3969/j.issn.1004-8685.2007.12.036 |
| [7] |
白利涛, 张丽萍, 林红, 等. 铜含量测定方法研究[J]. 应用化工, 2011, 40(5): 903–905.
BAI L T, ZHANG L P, LIN H, et al. Study on the determination method of the content of copper[J]. Appl Chem Ind, 2011, 40(5): 903–905. |
| [8] |
余倩, 黄典文, 李小如, 等. Cu(Ⅱ)-H2O2-甲基蓝体系催化动力学光度法测定水中痕量铜的研究
[J]. 冶金分析, 2005, 25(4): 73–75.
YU Q, HUANG D W, LI X R, et al. Study on catalytic kinetic spectrophotometric determination of trace copper with Cu(Ⅱ)-H2O2-methyl blue system [J]. Metall Anal, 2005, 25(4): 73–75. |
| [9] |
阮琼, 胡秋芬, 杨光宇, 等. 2-(2-吡啶偶氮)-5-二乙氨基酚固相萃取光度法测定水中痕量铜[J]. 冶金分析, 2003, 23(2): 38–39.
RUAN Q, HU Q F, YANG G Y, et al. Spectrophotometric determination of copper in water by solid phase extraction with 2-(2-pyridyazo)-5-diethylaminaphenol[J]. Metall Anal, 2003, 23(2): 38–39. |
| [10] |
顾咏红. 火焰、石墨炉原子吸收法测定地表水中铜和镉[J]. 环境监测管理与技术, 2005, 17(5): 31–32.
GU Y H. To detect Cu and Cd in surface water with flame AAS and graphite furnace AAS[J]. Admin Tech Environ Monit, 2005, 17(5): 31–32. |
| [11] |
张利敏, 程浩川, 万豆豆, 等. 二硫代乙二酰胺改姓硅胶固相萃取-火焰原子吸收光谱法测定水中的痕量铜和铅[J]. 理化检验: 化学分册, 2015, 51(10): 1400–1405.
ZHANG L M, CHENG H C, WAN D D, et al. Determination of trace copper and lead in water by FAAS combined with SPE using dithiooxamide Modified Silica[J]. Phys Test Chem Anal Part B: Chem Anal, 2015, 51(10): 1400–1405. |
| [12] |
牙禹, 王天顺, 莫磊兴, 等. 基于有序介孔碳/纳米金/L-半胱氨酸修饰电极测定铜(Ⅱ)
[J]. 分析试验室, 2014, 33(12): 1447–1450.
YA Y, WANG T S, MO L X, et al. Sensitive determination of cooper (Ⅱ) based on an ordered mesoporous carbon/nano-gold/L-cysteine modified electrode [J]. Chin J Anal Lab, 2014, 33(12): 1447–1450. |
| [13] |
王嘉博, 杨国程, 王璐, 等. 对氨基苯甲酸修饰玻碳电极方波伏安检测铜离子[J]. 长春工业大学学报 (自然科学版), 2011, 32(1): 88–91.
WANG J B, YANG G C, WANG L, et al. Square wave voltammetric determination of copper (Ⅱ) ion with 4-aminobenzoic acid modified glassy carbon electrode[J]. J Changchun Univ Technol (Nat Sci Ed), 2011, 32(1): 88–91. |
| [14] |
武鹏, 于荣, 王胜翔. 王铜悬浮剂离子色谱分析方法研究[J]. 农药科学与管理, 2005, 36(Suppl.1): 17–19.
WU P, YU R, WANG S X. Analytical method of sedaxane TC by ICS[J]. Pest Sci Admin, 2005, 36(Suppl.1): 17–19. |
| [15] |
李业军, 张青, 李永太. 电感耦合等离子体质谱法测定土壤中重金属元素[J]. 当代化工, 2015, 44(4): 864–867.
LI Y J, ZHANG Q, LI Y T. Determination of heavy metal elements in soil by inductively coupled plasma mass spectrometry[J]. Contemp Chem Ind, 2015, 44(4): 864–867. |
| [16] |
吴开华, 杜林峰. 电感耦合等离子体质谱法测定灌溉水中 7 种重金属及其定性分析[J]. 现代科学仪器, 2011(1): 104–107.
WU K H, DU L F. The determination and qualitative analysis of heavy metals in irrigation water by ICP-MS[J]. Modern Sci Inst, 2011(1): 104–107. |
| [17] |
王欣然, 李博伟, 尤慧艳, 等. 基于量子点的荧光传感微流纸基芯片离子印迹法检测铜离子[J]. 分析化学, 2015, 43(10): 1499–1504.
WANG X R, LI B W, YOU H Y, et al. An ion imprinted polymers grafted paper-based fluorescent sensor based on quantum dots for detection of copper ions[J]. Chin J Anal Chem, 2015, 43(10): 1499–1504. doi:10.11895/j.issn.0253-3820.150437 |
| [18] |
生活饮用水标准检验方法 金属指标: GB/T 5750.6—2006[S]. 北京: 中国标准出版社, 2007.
Standard examination methods for drinking water-metal parameters: GB/T 5750.6—2006[S]. Beijing: Standards Press of China, 2007. |
| [19] |
化学农药环境安全评价试验准则 第 12 部分: 鱼类急性毒性试验: GB/T 31270.12—2014[S]. 北京: 中国标准出版社, 2015.
Test guidelines on environmental safety assessment for chemical pesticides-part 12: fish acute toxicity test: GB/T 31270.12—2014 [S]. Beijing: Standards Press of China, 2015. |
| [20] |
化学农药环境安全评价试验准则 第 13 部分: 溞类急性活动抑制试验: GB/T 31270.13—2014 [S]. 北京: 中国标准出版社, 2015.
Test guidelines on environmental safety assessment for chemical pesticides-Part 13: Daphnia sp. acute immobilisation test: GB/T 31270.13—2014 [S]. Beijing: Standards Press of China, 2015. |
| [21] | OECD Guidelines for the testing of Chemicals, 201: freshwater alga and cyanobacteria, growth inhibition test[S/OL]. [2017-08-02]. Paris: OECD, 2011. http://dx.doi.org/10.1787/9789264069923-en. |
 2017, Vol. 19
2017, Vol. 19


