2. 山东省联合农药工业有限公司,济南 250100
2. Shandong United Pesticide Industry Co., Ltd., Ji’nan 250100, China
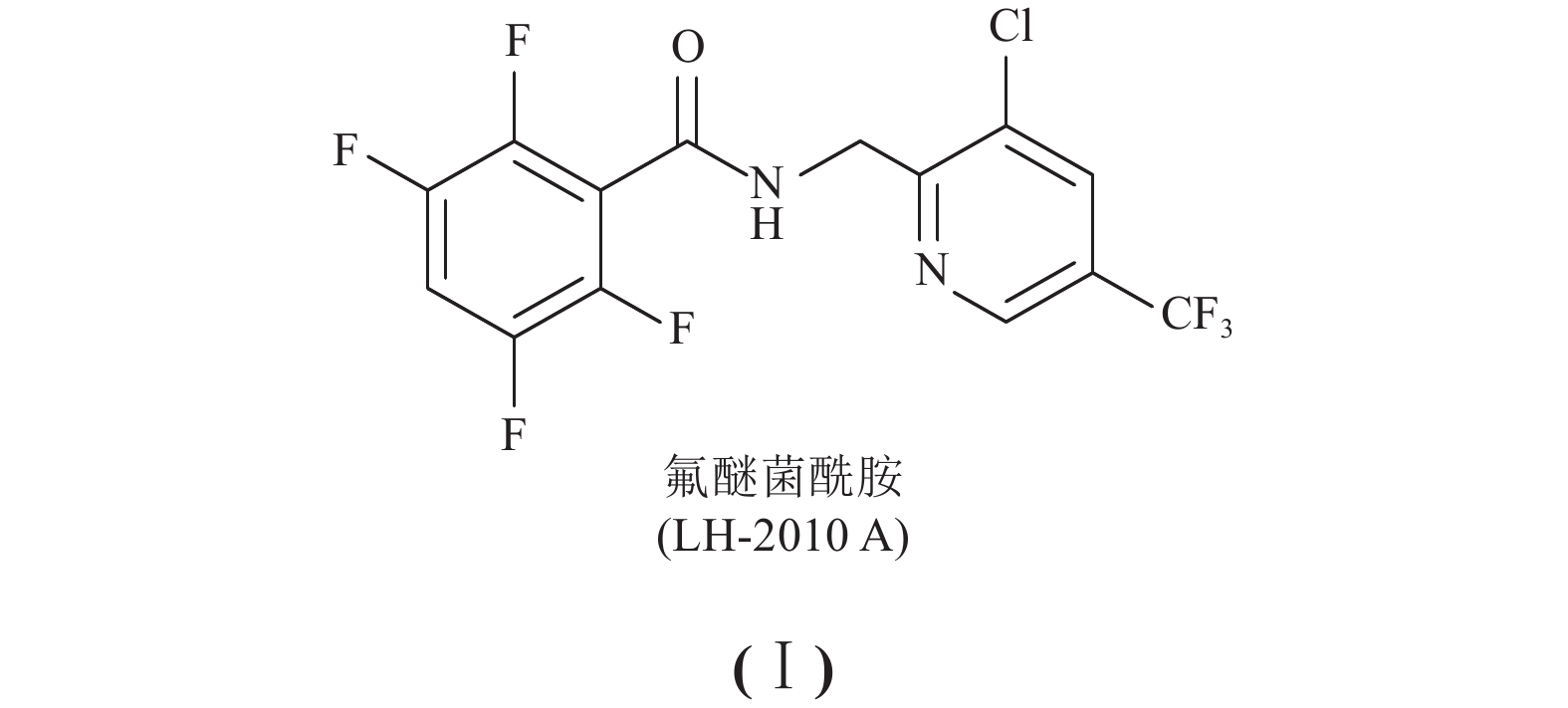
氟醚菌酰胺 [LH-2010A,结构见式(Ⅰ)],化学名称为N-(3-氯-5-(三氟甲基) 吡啶-2-甲基)-2,3,5,6-四氟-4-甲氧基苯甲酰胺,是山东农业大学和山东省联合农药工业有限公司联合创制合成的一种新型含氟苯甲酰胺类杀菌剂[1]。研究表明:氟醚菌酰胺具有高效、广谱的抑菌活性,对辣椒疫病、黄瓜霜霉病和棉花立枯病具有较好防效[1-3]。
|
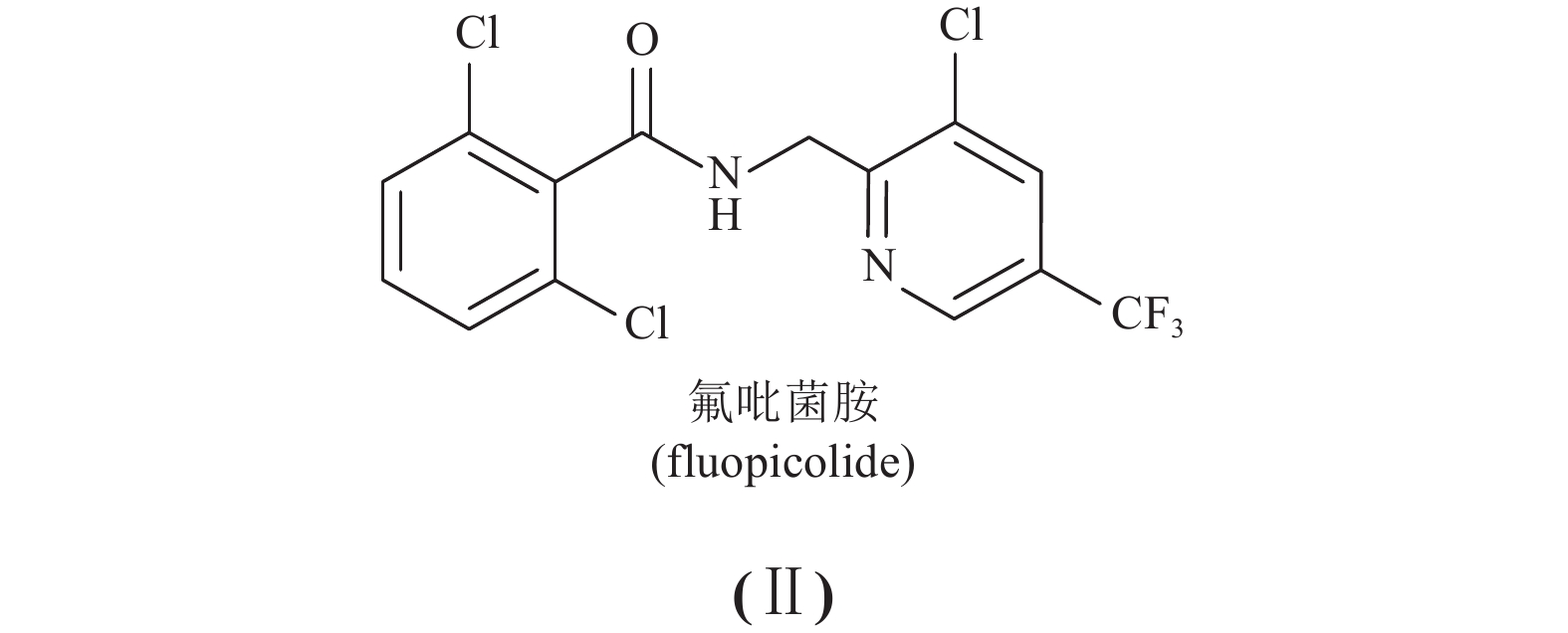
目前有关氟醚菌酰胺的文献报道较少,主要集中在毒力测定[1-3]、抗性风险评估[4-5]和作用机理探索[1, 6]等,而有关氟醚菌酰胺的残留分析方法尚未见报道。目前,中国正在进行氟醚菌酰胺防治马铃薯晚疫病的正式登记,急需提供氟醚菌酰胺在马铃薯上安全使用的技术支持。因此,开展马铃薯等基质中氟醚菌酰胺残留试验及建立分析其在马铃薯和土壤中残留的有效方法势在必行。由于氟醚菌酰胺在结构上与拜耳公司开发的氟吡菌胺 [fluopicolide, 结构见(Ⅱ)] 相似,因而考虑两者分析方法也应该有相似之处。氟吡菌胺残留的分析方法主要有气相色谱法[7-9]、液相色谱法[10]和高效液相色谱-串联质谱法[11]。而高效液相色谱-串联质谱法因选择性强、灵敏度高而得以广泛使用,故本研究选用此方法,采用改进的QuEChERS方法提取净化,高效液相色谱-电喷雾串联四极杆质谱快速检测马铃薯各基质中氟醚菌酰胺的残留。
|
1 材料与方法 1.1 仪器与药剂
LCMS-8040高效液相色谱-质谱联用仪 (SHIMADU公司);XBLL-25A多功能食品加工机 (上海帅佳电子科技有限公司);JA21002电子天平 (上海精密科学仪器有限公司);TDL-5-A离心机 (上海安亭科学仪器厂)。
氯化钠和无水硫酸镁 (分析纯,国药集团化学试剂有限公司);乙腈 (色谱纯,瑞典欧森巴克环境化学公司);十八烷基硅烷 (C18)、N-丙基乙二胺 (PSA) (40~60 μm,天津博纳艾杰尔科技有限公司);氟醚菌酰胺 (LH-2010A) 标准品 (纯度为98.0%,山东省联合农药工业有限公司) 。
1.2 样品提取与净化准确称取混匀样品10.0 g (植株5.0 g) 于50 mL具塞塑料离心管中,加入5 mL超纯水和10 mL乙腈,涡旋5 min,加入4 g氯化钠,剧烈振荡1 min,4 000 r/min下离心5 min。取马铃薯植株1 mL上层清液至加有100 mg C18和100 mg无水硫酸镁的2 mL离心管中,涡旋1 min,取上清液过0.22 μm微孔滤膜,待测;马铃薯样品净化填料为100 mg PSA,其他处理同马铃薯植株;土壤样品取1 mL上清液过0.22 μm微孔滤膜,待测。
1.3 色谱及质谱检测条件色谱条件:Shim-pack XR-ODSⅡ色谱柱 (75 mm × 2.0 mm,2.2 μm);柱温为室温;样品室温度15 ℃;进样体积2 μL;流速0.4 mL/min;流动相V(0.1%甲酸水溶液) : V(乙腈)=15 : 85。
质谱条件:电喷雾离子源 (ESI+);毛细管电压3.5 kV;加热块温度400 ℃;干燥器温度250 ℃;干燥气流量15 L/min;雾化气流量3 L/min;反应气 (Ar) 压力:230 kPa。氟醚菌酰胺保留时间0.62 min左右。
1.4 标准曲线制作用乙腈溶解氟醚菌酰胺标准品,配制成1 000 mg/L的氟醚菌酰胺标准溶液,分别用乙腈、马铃薯空白基质溶液、马铃薯植株空白基质溶液和土壤基质空白溶液稀释,配制成1、0.1、0.05、0.01、0.002 mg/L系列标准溶液,按1.3节条件测定。以溶液质量浓度为横坐标,峰面积为纵坐标,绘制工作曲线。外标法定量。
1.5 添加回收试验在空白马铃薯、马铃薯植株和土壤样品中添加氟醚菌酰胺标准溶液,添加水平为0.005、0.05和0.5 mg/kg,每个水平5次重复。按1.2节方法进行提取、净化,按1.3节条件测定,计算日内添加平均回收率和日间添加平均回收率,其中日间添加平均回收率连续测定3 d。
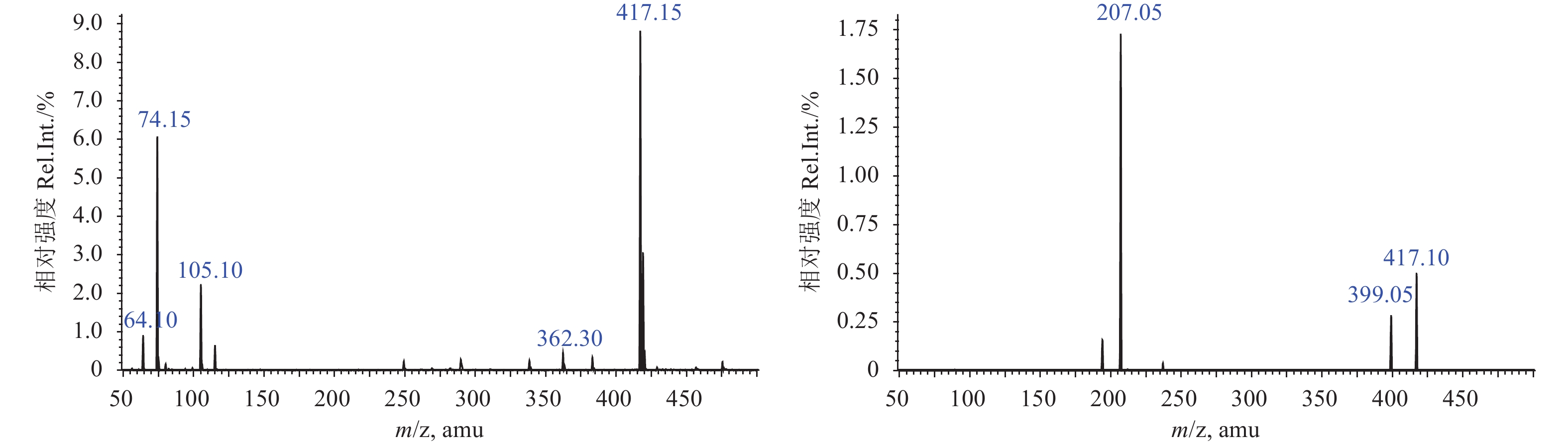
2 结果与分析 2.1 质谱条件优化为获得最佳的灵敏度和分离效果,选用1 mg/L的氟醚菌酰胺标准溶液,在不同流动相条件下,采用电喷雾离子源正/负模式下进行全扫描 (m/z 50~600),分别得到氟醚菌酰胺准分子离子峰[M+1]峰 (m/z 417.15) 和[M–1]峰 (m/z 415.15)。通过比较仪器响应值发现,以乙腈和甲酸水溶液作为流动相时,正离子采集模式的响应值显著高于其他溶剂配比,故选用正离子模式的氟醚菌酰胺[M+1]峰 (m/z 417.15) 为母离子。通过进一步优化碰撞池电压,分别获得定量离子对m/z 417.15/207.00和定性离子对m/z 417.15/399.00(图1)。
|
图 1 氟醚菌酰胺的全扫描质谱图和二级质谱图 Fig. 1 Scan and product ion spectra of LH-2010A |
2.2 提取方法选择
QuEChERS前处理方法具有快速、简易、价廉的特点,在农药残留分析中广泛应用,但该方法主要针对含水量较高的水果、蔬菜等样品前处理,且样品量和提取剂的体积比多采用1:1[12]。本研究中通过比较不同提取方法发现,在样品中加入5 mL去离子水,对体积较大的植株样品用体积相当于2倍样品量的提取剂提取,回收率和相对标准偏差均能得到满意的结果。
2.3 方法线性范围及基质效应结果表明,在0.002~1 mg/L范围内,氟醚菌酰胺在乙腈、马铃薯空白基质溶液、马铃薯植株空白基质溶液和土壤空白基质溶液中定量离子峰面积与进样质量浓度间均呈良好的线性关系 (表1),相关系数 (r) 都大于0.999 9。电喷雾电离离子化效率易受样品基质的影响。采用基质标准曲线斜率和溶剂标准曲线斜率之比 (k) 来评价基质效应:当k > 1.1时为基质增强效应,k < 0.9为基质减弱效应,而当 k在0.9~1.1之间时为基质效应不明显[13]。本研究中氟醚菌酰胺在马铃薯等基质中均存在不同程度的基质效应。由表1可知,马铃薯和马铃薯植株基质能显著降低氟醚菌酰胺在仪器上的信号响应,而土壤基质无明显基质效应。为保证方法的通用性和适用性,本研究采用基质匹配标准溶液校正消除基质效应影响。按照信噪比 (S/N)=10计算,氟醚菌酰胺在马铃薯等基质中的定量限均为0.001 mg/kg。
|
|
表 1 氟醚菌酰胺的线性方程、相关系数、斜率比和定量限 Table 1 Regression equations, correlation coefficients (r), slope of matrix/slope of solvent (k) and limit of quantitation (LOQ) for LH-2010A in different matrices |
2.4 氟醚菌酰胺的添加回收率和精密度
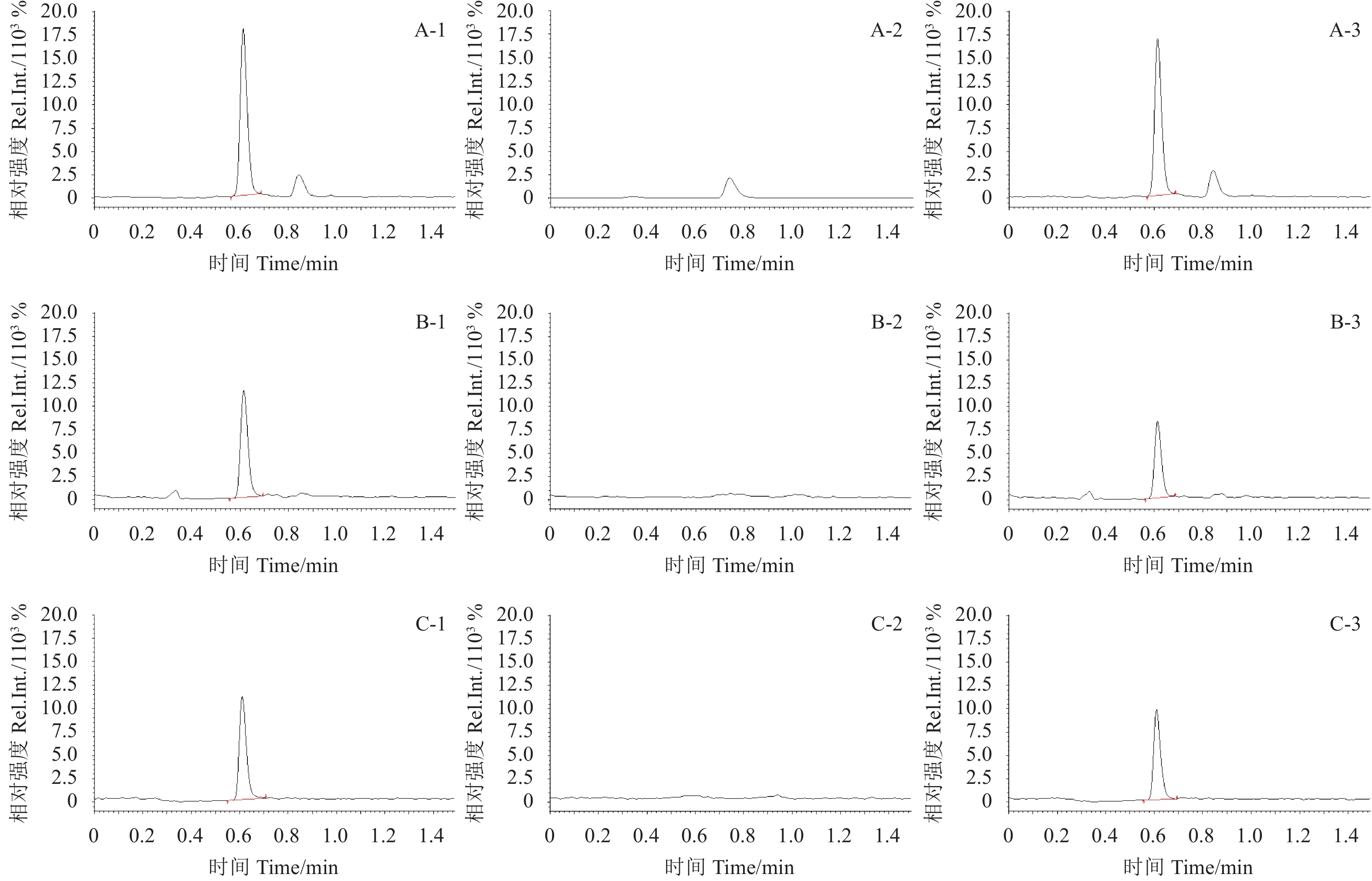
结果 (表2) 表明:在0.005~0.5 mg/kg 3个添加水平下,氟醚菌酰胺在3种基质中的日内平均回收率和日间平均回收率分别为81%~98%和75%~106%,相对标准偏差分别在2.2%~13%和0.6%~11%之间。表明该方法具有较好的准确性和稳定性,满足农药残留分析的要求。典型谱见图2。
|
|
表 2 氟醚菌酰胺在3种基质中的添加回收率及相对标准偏差 Table 2 Recoveries and relative standard deviation of the LH-2010A in three different matrices |
|
A-1.马铃薯基质标样 (0.005 mg/kg); A-2.马铃薯空白; A-3.马铃薯添加 (0.005 mg/kg); B-1.马铃薯植株基质标样 (0.0025 mg/kg); B-2.马铃薯植株空白; B-3.马铃薯植株添加 (0.005 mg/kg); C-1.土壤基质标样 (0.005 mg/kg); C-2.土壤空白; C-3.土壤添加 (0.005 mg/kg)。 A-1. potato matrix standard(0.005 mg/kg); A-2. blank potato; A-3. spiked potato sample(0.005 mg/kg); B-1. potato plant matrix standard(0.0025 mg/kg); B-2. blank potato plant; B-3. spiked potato plant sample(0.005 mg/kg);C-1. soil matrix standard(0.005 mg/kg); C-2. blank soil; C-3. spiked soil sample(0.005 mg/kg). 图 2 氟醚菌酰胺在马铃薯、马铃薯植株和土壤中典型谱图 Fig. 2 Typical chromatograms of LH-2010A in potato, potato plant and soil |
2.5 实际样品检测
应用本研究所建立的方法,于2015—2016年分别测定了山东淄博和吉林长春2地马铃薯样品中氟醚菌酰胺的残留量。结果表明,2年2地马铃薯样品中氟醚菌酰胺残留量均小于0.05 mg/kg,残留量较低。
3 结论本研究应用QuEChERS前处理方法,建立了高效液相色谱-串联质谱快速检测马铃薯、马铃薯植株和土壤样品中氟醚菌酰胺残留量的分析方法。该方法简单快速、准确可靠,可满足农药残留分析要求,适用于大量样品的快速检测。
| [1] |
张化霜, 翟明涛, 王开运, 等. 新化合物氟醚菌酰胺的抑菌活性及其对棉花立枯丝核菌的作用方式研究[J]. 农药学学报, 2013, 15(4): 405–411.
ZHANG H S, ZHAI M T, WANG K Y, et al. Study on fungicidal activity and mode of action of a novel fungicidal agent, LH-2010A against Rhoizoctonia solani [J]. Chin J Pestic Sci, 2013, 15(4): 405–411. |
| [2] |
翟明涛, 张化霜, 王红艳, 等. 氟醚菌酰胺和5种常用杀菌剂对辣椒疫霉菌不同子实体的毒力比较[J]. 农药, 2013, 52(10): 765–767.
ZHAI M T, ZHANG H S, WANG H Y, et al. Comparison of the toxicity of LH-2010A with several conventional fungicides against Phytophthora capsici’s different fruiting bodies [J]. Agrochemicals, 2013, 52(10): 765–767. |
| [3] |
张睿, 许辉, 唐剑锋, 等. 新型杀菌剂氟醚菌酰胺对黄瓜霜霉病的毒力和田间药效评价[J]. 农药, 2013, 52(8): 596–598.
ZHANG R, XU H, TANG J F, et al. The evaluation of toxicity and field efficacy of a new fungicide LH-2010A against cucumber downy mildew[J]. Agrochemicals, 2013, 52(8): 596–598. |
| [4] |
翟明涛. 辣椒疫霉对氟醚菌酰胺的抗性风险评价[D]. 泰安: 山东农业大学, 2014.
ZHAI M T. Resistance-risk assessment of Phytophthora capsici to LH-2010A[D]. Taian: Shandong Agricultural University, 2014. |
| [5] |
张秀焕. 水稻纹枯病菌对氟醚菌酰胺的抗性风险评价[D]. 泰安: 山东农业大学, 2015.
ZHANG X H. The resistance risk assessment of Rhizoctonia solani to LH-2010A[D]. Taian: Shandong Agricultural University, 2015. |
| [6] |
何玲, 袁会珠, 唐剑锋, 等. 新型杀菌剂氟醚菌酰胺对辣椒疫霉的作用机制初探[J]. 农药学学报, 2016, 18(2): 185–193.
HE L, YUAN H Z, TANG J F, et al. Preliminary studies on the action mechanism of the novel fungicide LH-2010A against Phytophthora capsici [J]. Chin J Pestic Sci, 2016, 18(2): 185–193. |
| [7] |
樊晓青, 占绣萍, 马琳. 分散固相净化-气相色谱法检测蔬菜中氟吡菌胺等15种农药残留[J]. 现代农药, 2014, 13(1): 41–43.
FAN X Q, ZHAN X P, MA L. Determination of 15 pesticide residues including fluopicolide in vegetable by dispersive solid phase cleanup and GC[J]. Mod Agrochem, 2014, 13(1): 41–43. |
| [8] | MOHAPATRA S, AHUJA A K, DEEPA M, et al. Persistence and dissipation of fluopicolide in/on grape berries and soil under semi arid tropical climatic conditions of India[J]. Bull Environ Contam Toxicol, 2011, 86(2): 238–241. doi:10.1007/s00128-011-0193-3 |
| [9] | SAHOO S K, MANDAL K, KUMAR R, et al. Analysis of fluopicolide and propamocarb residues on tomato and soil using QuEChERS sample preparation method in combination with GLC and GCMS[J]. Food Anal Methods, 2014, 7(5): 1032–1042. doi:10.1007/s12161-013-9709-2 |
| [10] | JIANG L L, WANG H Y, XU H, et al. Transportation behaviour of fluopicolide and its control effect against Phytophthora capsici in greenhouse tomatoes after soil application [J]. Pest Manag Sci, 2015, 71(7): 1008–1014. doi:10.1002/ps.3879 |
| [11] |
陈靓, 井乐刚. 基于超高效液相色谱串联质谱法的番茄果实和土壤中氟吡菌胺残留测定[J]. 安全与环境学报, 2017, 17(1): 341–345.
CHEN L, JING L G. Determination of the fluopicolide residue in the tomato fruit and the soil via UPLC-MS/MS [J]. J Saf Environ, 2017, 17(1): 341–345. |
| [12] | ANASTASSIADES M, LEHOTAY S J, ŠTAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and ‘dispersive solid-phase extraction’ for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412–431. |
| [13] | LIU X G, XU J, LI Y B, et al. Rapid residue analysis of four triazolopyrimidine herbicides in soil, water, and wheat by ultra-performance liquid chromatography coupled to tandem mass spectrometry[J]. Anal Bioanal Chem, 2011, 399(7): 2539–2547. doi:10.1007/s00216-010-4606-7 |
 2017, Vol. 19
2017, Vol. 19


