2. 上海林克司乡村俱乐部有限公司,上海 201201
2. Shanghai Links Country Club Co., Ltd., Shanghai 201201, China
币斑病菌Sclerotinia homoeocarpa F. T. Bennett是一种丝状子囊真菌,目前被划分在柔膜菌目 (Helotiales) 核盘菌科 (Sclerotiniaceae) 核盘菌属 (Sclerotinia)[1],但对其分类地位一直存在争议。该菌寄主范围广,可侵染几乎所有冷季型和暖季型草坪草,同时也是造成草坪产业经济损失最严重的一种重要植物病原菌[2]。币斑病菌在世界范围内分布广泛[2],在中国,20余省区近几年均出现了不同程度的币斑病发生和流行[3-5],对该病害的有效防治在草坪草有害生物防治中备受关注,并已成为研究热点。
化学防治以其快速、高效的特点成为了控制币斑病最有效的手段。当前生产中用于币斑病防治的药剂主要包括保护性和内吸性杀菌剂。保护性杀菌剂有取代苯基类 (百菌清) 和二硝基苯胺类 (氟啶胺);内吸性杀菌剂有苯并咪唑类 (甲基硫菌灵)、二甲酰亚胺类 (异菌脲、乙烯菌核利)、甾醇脱甲基化抑制剂类 (DMIs,如丙环唑、苯醚甲环唑、戊唑醇等) 以及琥珀酸脱氢酶抑制剂类 (SDHIs,如噻呋酰胺、氟唑菌酰胺等) 等[6]。随着杀菌剂的广泛使用,币斑病菌对杀菌剂的抗药性问题逐渐显现,目前国外已报道币斑病菌对多种作用机制的杀菌剂均产生了不同程度的抗药性[7-11],而中国还鲜有关于币斑病菌抗药性的报道[12]。
在此背景下,本研究测定了不同地理来源的114株草坪草币斑病菌对甲基硫菌灵、异菌脲及丙环唑的敏感性,分析病原菌对不同杀菌剂的敏感性频率分布,比较不同地理来源币斑病菌的敏感性差异,并尝试分析了病原菌对异菌脲和丙环唑敏感性的相关性,以期了解中国草坪草币斑病菌对杀菌剂的抗性发展动态,为币斑病的有效管理以及杀菌剂的合理使用提供参考。
1 材料与方法 1.1 供试培养基马铃薯葡萄糖酸化培养基 (APDA)[11]:待121 ℃湿热灭菌20 min的PDA培养基温度降至60 ℃左右后,向1 L培养基中加入1 mL质量分数为85%的乳酸。
基础培养基 (MM)[7, 13]:葡萄糖10 g,K2HPO4 1.5 g,KH2PO4 2 g,(NH4)2SO4 1 g,MgSO4·7H2O 0.5 g,酵母浸粉2 g,琼脂粉15 g,加去离子水溶解并定容至1 L,121 ℃湿热灭菌20 min。
1.2 菌株采用专用土壤取样器切取直径4 cm、高8~10 cm具有典型币斑病症状的病、健交接处植株及土壤样本,于4 ℃保存;将病样置于光照培养箱中保湿培养2~3 d,培养条件为25 ℃光照16 h,20 ℃黑暗8 h;挑取草坪草或土壤表面长出的细丝状菌丝接种于APDA上[9],每个病样挑取3个菌丝体,25 ℃黑暗条件培养2 d;待气生菌丝长出后,切取菌落边缘的菌丝尖端转入新的APDA培养基上,25 ℃黑暗条件培养3~5 d,得到纯化菌株,通过与已知的币斑病菌菌落形态进行比较,确定为币斑病菌Sclerotinia homoeocarpa F. T. Bennett;将病原菌菌丝块置于体积分数为20%的甘油中,于10 ℃下长期保存。供试菌株信息如表1所示。
|
|
表 1 草坪草币斑病菌菌株信息 Table 1 The information of S. homoeocarpa isolated from turfgrass |
1.3 供试药剂
80% 甲基硫菌灵 (thiophanate-methyl) 可湿性粉剂 (WP) 购于日本曹达株式会社,96%异菌脲 (iprodione) 原药及96.3%丙环唑 (propiconazole) 原药由南京农业大学植物保护学院周明国教授实验室提供,保存于4 ℃冰箱中。
1.4 敏感性测定采用MM培养基测定币斑病菌对甲基硫菌灵、异菌脲及丙环唑的敏感性[7, 9]。甲基硫菌灵用丙酮配成250 mg/mL的母液,异菌脲和丙环唑用丙酮配制成1 × 104 μg/mL的母液,现配现用。向100 mL MM培养基中加入400 μL甲基硫菌灵母液,制成鉴别浓度为1 000 μg/mL的含药平板,用于区分币斑病菌对甲基硫菌灵的抗性及敏感菌株群体 (在此浓度下培养3 d,菌丝能生长的为抗性菌株,反之为敏感菌株)[9, 11]。将异菌脲和丙环唑母液用丙酮稀释成系列浓度,配制成异菌脲终浓度分别为质量浓度0.1、0.4、0.7和1.0 μg/mL,丙环唑分别为0.000 1、0.001、0.01和0.1 μg/mL的含药平板[8]。
供试菌株在MM培养基上、25 ℃黑暗条件培养3 d后,于菌落边缘打取直径5 mm的菌饼,接种至含药平板上,于25 ℃恒温培养箱中黑暗培养3 d,采用十字交叉法测量各处理菌落直径。每浓度重复3次,以加入等体积丙酮的无药平板为对照。按照公式 (1) 求出各浓度下异菌脲和丙环唑对菌丝生长的抑制率。
| $\begin{split}{\text{菌丝生长}}&{\text{抑制率}}/{\%} =\\ &\frac{{{\text{对照菌落直径}} - {\text{处理菌落直径}}}}{{{\text{对照菌落直径}} - {\text{菌饼直径}}}} \times 100\end{split}$ | (1) |
以抑制率的几率值为y轴,药剂浓度的对数为x轴,求出毒力回归方程y = a + bx和相关系数 (r),计算异菌脲和丙环唑对病菌的抑制中浓度 (EC50,μg/mL)。
1.5 数据统计分析采用DPS 7.05软件分析114株草坪草币斑病菌对异菌脲的敏感性频率分布,以EC50值为x轴,相应的频率 (%) 为y轴,制作敏感性频率分布图,并进行Shapiro-Wilk正态性检验。使用SPSS 19.0软件绘制不同地理来源币斑病菌对异菌脲的敏感性箱线图,比较其差异显著性 (α = 0.05)。通过Spearman’s秩相关系数,分析114株币斑病菌对异菌脲和丙环唑敏感性的相关性,进一步以无药剂施用历史的敏感菌株群体 (NAU) 以及分别对异菌脲和丙环唑最不敏感的10株币斑病菌为对象,分析其对两种杀菌剂的敏感性之间是否存在相关性。
2 结果与分析 2.1 币斑病菌对甲基硫菌灵的敏感性结果 (表2) 显示:从未施用过相关药剂地区采集的币斑病菌对甲基硫菌灵均表现为敏感,而有药剂施用历史地区采集的菌株对甲基硫菌灵的敏感性存在显著差别。114株币斑病菌中,对甲基硫菌灵敏感的有98株,占总数的85.96%,抗性菌株16株,占总数的14.04%;8个有施药历史的采样点中,5个采样点检测到了甲基硫菌灵的抗性菌株,其中4个为北京的采样点,而海南4个采样点中只有1个检测到了抗性菌株。
|
|
表 2 中国不同地理来源币斑病菌对杀菌剂的室内敏感性 Table 2 In vitro fungicide sensitivity of S. homoeocarpa isolates collected from different locations in China |
2.2 币斑病菌对异菌脲的敏感性
异菌脲对114株币斑病菌的EC50值范围为0.012 1~1.264 4 μg/mL,平均EC50值为 (0.566 3 ± 0.214 4) μg/mL,其最小EC50值和最大EC50值相差104.7倍,其中有2株的EC50值大于1 μg/mL,且均来自同一地区 (海南“三公里高尔夫俱乐部”)。Shapiro-Wilk正态性检验结果显示,币斑病菌对异菌脲的敏感性频率不符合正态分布 (W = 0.935, P < 0.05)( 图1)。从未施过相关药剂地区币斑病菌群体的EC50值范围在0.012 1~0.175 0 μg/mL之间,平均值为 (0.101 0 ± 0.047 6) μg/mL,而有施药历史地区群体的平均EC50值最低为 (0.368 2 ± 0.069 7) μg/mL (来自海南“鹿回头高尔夫俱乐部”),最高为 (0.717 3 ± 0.010 9) μg/mL (来自北京“鸿华高尔夫俱乐部”)。与敏感群体相比,有施药历史地区菌株群体的平均EC50值升高了3.6~7.0倍,整体升高了5.2倍,且均差异显著 (表2)。
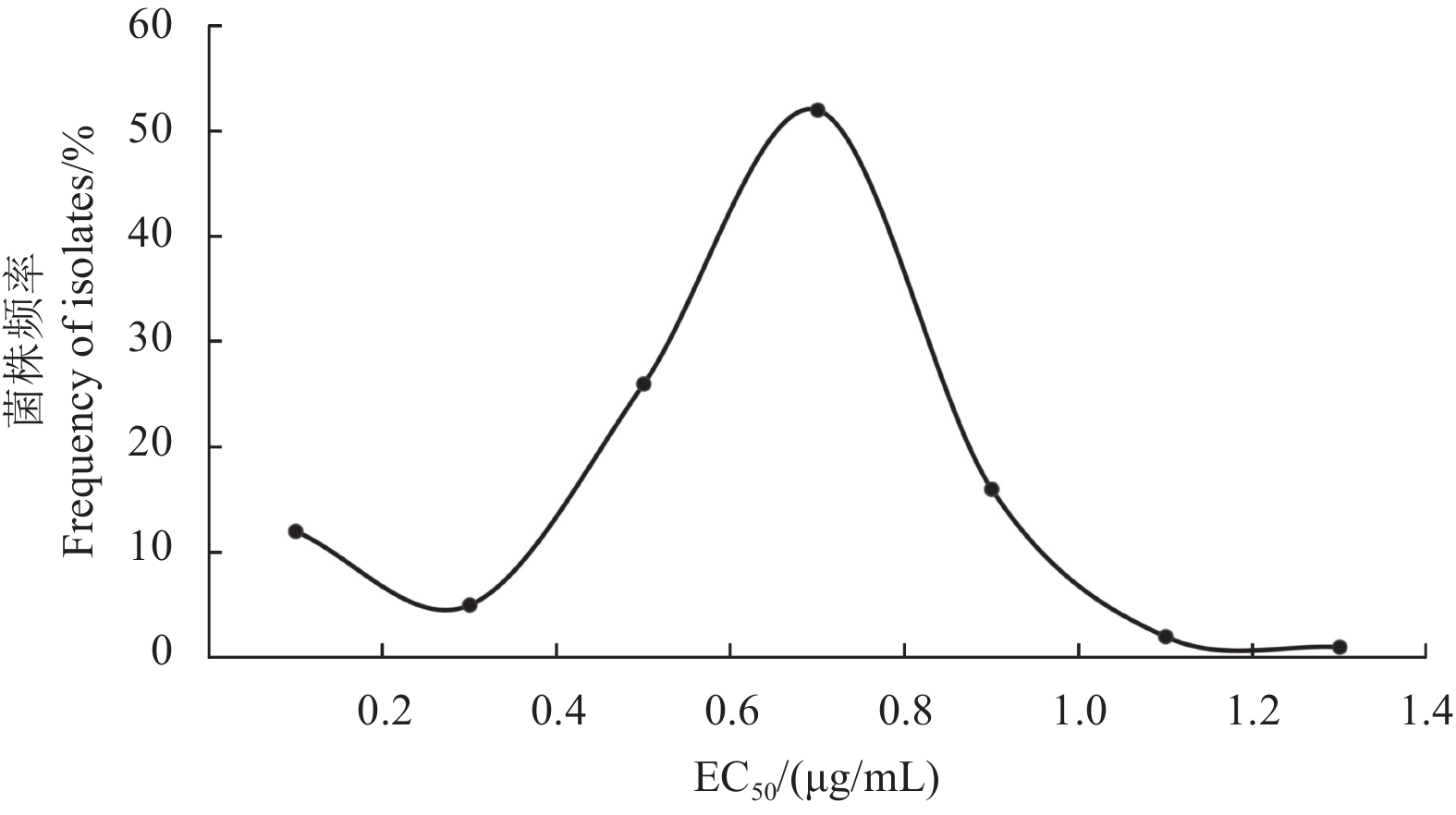
|
图 1 供试114株币斑病菌对异菌脲的敏感性频率分布 Fig. 1 Distribution of sensitivity frequency of 114 S. homoeocarpa isolates to iprodione |
2.3 币斑病菌对丙环唑的敏感性
丙环唑对114株币斑病菌的EC50值范围在0.000 4~0.100 4 μg/mL之间,平均EC50值为 (0.015 2 ± 0.020 1) μg/mL,其最大EC50值和最小EC50值相差251倍。Shapiro-Wilk正态性检验结果显示,币斑病菌对丙环唑的敏感性频率不符合正态分布 (W = 0.694, P < 0.05)( 图2)。从未施过相关药剂地区币斑病菌群体的EC50值范围在0.000 7~0.006 4 μg/mL之间,平均值为 (0.002 8 ± 0.001 7) μg/mL,而有施药历史地区群体的平均EC50值最低为 (0.002 1 ± 0.000 7) μg/mL (来自海南“三公里高尔夫俱乐部”),最高为 (0.027 4 ± 0.030 7) μg/mL (来自北京“净山湖高尔夫俱乐部”)。与敏感群体相比,有施药历史地区菌株群体的平均EC50值升高了0.75~9.75倍,整体升高了5.4倍,部分群体差异显著 (表2)。
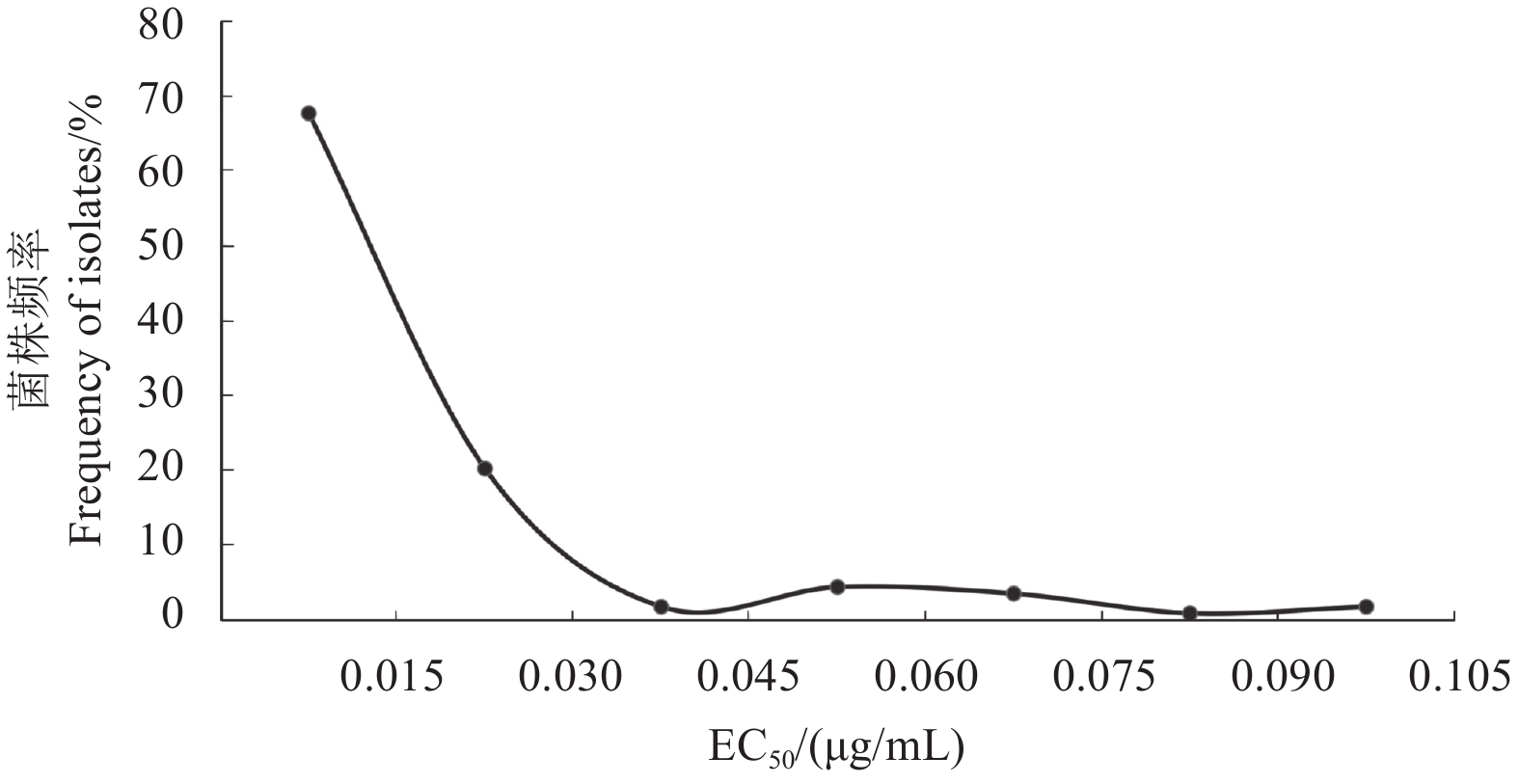
|
图 2 供试114株币斑病菌对丙环唑的敏感性频率分布 Fig. 2 Distribution of sensitivity frequency of 114 S. homoeocarpa isolates to propiconazole |
2.4 币斑病菌对异菌脲和丙环唑敏感性的相关性
相关性分析结果显示:114株币斑病菌对异菌脲和丙环唑的敏感性之间无显著相关性 (ρ = 0.162,P > 0.084 5)( 图3A);而其中对丙环唑最不敏感的10株币斑病菌 (EC50 > 0.050 0 μg/mL) 对2种杀菌剂的敏感性之间则存在一定的相关性 ( ρ = 0.755,P < 0.000 1)( 图3B);进一步分析对异菌脲最不敏感的10株币斑病菌 (EC50 > 0.795 6 μg/mL),发现其对2种杀菌剂的敏感性之间无显著相关性 ( ρ = 0.429,P > 0.010 0)( 图3C)。这10株对异菌脲最不敏感的币斑病菌中,有5株来自海南“博鳌乡村高尔夫俱乐部”,其EC50值均大于0.01 μg/mL,与敏感群体相比,表现出对丙环唑敏感性下降的现象,有3株来自海南“三公里高尔夫俱乐部”,其EC50值均小于0.003 μg/mL,仍表现为敏感 (表3)。

|
注:A为供试的114株币斑病菌;B为南京农业大学(NAU)敏感群体和对丙环唑最不敏感的10株币斑病菌;C为NAU敏感群体和对异菌脲最不敏感的10株币斑病菌。 Note: A represents all 114 isolates, B represents Nanjing Agricultural University (NAU) sensitive population and 10 isolates with the least sensitivity to propiconazole, C represents NAU sensitive population and 10 isolates with the least sensitivity to iprodione. 图 3 币斑病菌对异菌脲和丙环唑敏感性的相关性 Fig. 3 Sensitivity correlations between iprodione and propiconazole in S. homoeocapa |
|
|
表 3 对异菌脲和丙环唑最不敏感的10株币斑病菌菌株信息 Table 3 The information of 10 S. homoeocarpa isolates with the least sensitivity to iprodione and propiconazole |
3 结论与讨论
币斑病菌对多种不同作用机制杀菌剂产生抗药性的问题在国际上已十分普遍[7, 9-11, 14-17],但中国目前还鲜有相关报道。本研究测定了不同地理来源共114株币斑病菌对常用杀菌剂甲基硫菌灵、异菌脲和丙环唑的敏感性,旨在了解中国币斑病菌的抗性发展动态。研究发现,中国草坪草币斑病菌对甲基硫菌灵已产生一定程度的抗药性,对异菌脲和丙环唑则均呈现出敏感性下降的趋势,其对异菌脲和丙环唑的具体抗性情况还需通过抗性分子机制等研究进一步明确。所得结果可为币斑病菌的化学防治以及抗药性治理提供参考。
鉴别浓度在敏感性测定中常被用来区分抗性和敏感菌株群体,或用于大样本量病原菌EC50值的估测,目前已被有效应用于币斑病菌对苯并咪唑类杀菌剂敏感性的测定中[8-9]。通常币斑病菌对甲基硫菌灵的抗药性是以其在1 000 μg/mL的含药平板上生长与否作为判断标准的,可正常生长即为抗性,反之为敏感[9]。然而采用该方法进行抗性和敏感菌株划分时可能会存在一定误差。作者在预试验中还设定了1和100 μg/mL两个处理浓度,发现在1 000 μg/mL含药平板上被完全抑制的菌株,部分在1和100 μg/mL含药平板上并无明显抑制情况,推测这部分菌株可能为中等程度抗性。因此在使用单一浓度 (1 000 μg/mL) 进行抗性和敏感菌株鉴别时,可能会误将部分中等抗性菌株划分为敏感菌株,从而低估了田间真实的抗性频率。
币斑病菌对甲基硫菌灵的抗性可能为质量性状控制型,即病原菌很容易突变而产生对甲基硫菌灵的抗性,抗性一旦产生,甲基硫菌灵的田间防治将会失效[11]。而币斑病菌对异菌脲和丙环唑的抗性则呈现出数量性状遗传型,其抗性发展较缓慢[8]。本研究结果很好地支持了以上观点,与无药剂施用历史地区的菌株群体相比,有施药历史的菌株群体对异菌脲和丙环唑的敏感性均呈现下降趋势。虽然本研究中有施药历史地区菌株群体对异菌脲和丙环唑的敏感性仅比无施药历史的群体下降了数倍,但本研究也同时检测到了对2种药剂敏感性均降低了100倍以上的菌株,因此关于币斑病菌对这两类杀菌剂的抗药性问题也同样需密切关注。此外,菌株敏感性下降是否会导致田间药剂防效下降,仍需通过进一步的田间药效试验加以明确。
植物病原菌对以甲基硫菌灵为代表的苯并咪唑类杀菌剂的抗药性主要是由其β-微管蛋白上氨基酸的突变引起的[18-20]。通过克隆比对本文的抗性及敏感币斑病菌β-微管蛋白序列将有助于明确币斑病菌对甲基硫菌灵的抗性机制。已有研究表明,币斑病菌对异菌脲的抗性与其组氨酸激酶基因 (Shos1) 的366位点氨基酸突变以及ATP结合盒多药转运相关蛋白基因 (ShPDR1) 的过量表达相关[21],而其对丙环唑的抗性与甾醇14α-脱甲基化酶基因 (CYP51) 和ShPDR1的过量表达相关[7, 13],其中与ShPDR1过量表达相关的币斑病菌存在多药抗药性,且已有田间多药抗药性的相关报道[7]。本研究分析了币斑病菌对异菌脲和丙环唑的敏感性相关关系,发现对丙环唑最不敏感的10株币斑病菌对异菌脲的敏感性均呈现下降趋势,并存在一定的正相关关系,推测这部分菌株可能存在多药抗药性。后续拟进一步开展分子机制相关研究,以明确供试币斑病菌中是否存在多药抗药性现象。本研究中还分析了对异菌脲最不敏感的10株币斑病菌,发现其对丙环唑的敏感性呈现分化现象,即部分菌株对丙环唑敏感性下降,部分仍表现为敏感,由此推测币斑病菌对异菌脲敏感性的降低可能是由不同机制引起的。
综上所述,甲基硫菌灵、异菌脲和丙环唑是目前生产上用于币斑病防治的常用杀菌剂,但由于药剂作用位点单一及用药方式不合理等原因,中国币斑病菌已对这些杀菌剂产生了一定程度的敏感性下降现象。如来自北京市“净山湖高尔夫俱乐部”的币斑病菌群体对甲基硫菌灵的抗性频率达70%,而来自海南省“博鳌乡村高尔夫俱乐部”的群体中已发现6株币斑病菌对异菌脲和丙环唑的敏感性均表现为下降。因此,在生产上应密切关注币斑病菌对常规药剂的抗性发展动态,通过科学轮换或合理使用不同作用机制的杀菌剂,以达到有效防治病害及延缓病原菌抗药性发生与发展的目的。
| [1] | BENNETT F T. Dollarspot disease of turf and its causal organism, Sclerotinia homoeocarpa n.sp. [J]. Ann Appl Biol, 1937, 24(2): 236–257. doi:10.1111/aab.1937.24.issue-2 |
| [2] | WALSH B, IKEDA S S, BOLAND G J. Biology and management of dollar spot (Sclerotinia homoeocarpa); an important disease of turfgrass [J]. HortScience, 1999, 34(1): 13–21. |
| [3] |
章武, 刘国道, 南志标. 4 种暖季型草坪草币斑病病原菌鉴定及其生物学特性[J]. 草业学报, 2015, 24(1): 124–131.
ZHANG W, LIU G D, NAN Z B. Identification and characterisation of Sclerotinia homoeocarpa causing leaf blight in 4 warm-season turfgrass species [J]. Acta Pratacul Sinica, 2015, 24(1): 124–131. doi:10.11686/cyxb20150116 |
| [4] | LV C C, LUO L X, LI J Q, et al. First report of dollar spot of seashore paspalum (Paspalum vaginatum) caused by Sclerotinia homoeocarpa in South China [J]. Plant Dis, 2010, 94(3): 373. |
| [5] | LV C C, HSIANG T, LI J Q, et al. First report of dollar spot of Agrostis stolonifera, Poa pratensis, Festuca arundinacea and Zoysia japonica caused by Sclerotinia homoeocarpa in China [J]. New Dis Rep, 2011, 23: 37. doi:10.5197/j.2044-0588.2011.023 |
| [6] | LATIN R. Dollar spot control 2014: new fungicides and modern approaches[DB/OL]. (2014-03-13) [2017-11-09]. http://www. golfdom.com/dollar-spot-control-2014-new-fungicides-and-modern-approaches/. |
| [7] | SANG H, HULVEY J, POPKO J T JR, et al. A pleiotropic drug resistance transporter is involved in reduced sensitivity to multiple fungicide classes in Sclerotinia homoeocarpa (F.T.Bennett) [J]. Mol Plant Pathol, 2015, 16(3): 251–261. doi:10.1111/mpp.2015.16.issue-3 |
| [8] | PUTMAN A I, JUNG G, KAMINSKI J E. Geographic distribution of fungicide-insensitive Sclerotinia homoeocarpa isolates from golf courses in the northeastern United States [J]. Plant Dis, 2010, 94(2): 186–195. doi:10.1094/PDIS-94-2-0186 |
| [9] | KOCH P L, GRAU C R, JO Y K, et al. Thiophanate-methyl and propiconazole sensitivity in Sclerotinia homoeocarpa populations from golf courses in Wisconsin and Massachusetts [J]. Plant Dis, 2009, 93(1): 100–105. doi:10.1094/PDIS-93-1-0100 |
| [10] | JO Y K, CHANG S W, BOEHM M, et al. Rapid development of fungicide resistance by Sclerotinia homoeocarpa on turfgrass [J]. Phytopathology, 2008, 98(12): 1297–1304. doi:10.1094/PHYTO-98-12-1297 |
| [11] | JO Y K, NIVER A L, RIMELSPACH J W, et al. Fungicide sensitivity of Sclerotinia homoeocarpa from golf courses in Ohio [J]. Plant Dis, 2006, 90(6): 807–813. doi:10.1094/PD-90-0807 |
| [12] |
胡健, 蒋勤军, 韩烈保, 等. 草坪草病原菌的抗药性现状及研究进展[J]. 草业学报, 2009, 18(2): 194–204.
HU J, JIANG Q J, HAN L B, et al. Status and research advances on fungicide resistance in turfgrass pathogens[J]. Acta Pratacul Sinica, 2009, 18(2): 194–204. doi:10.11686/cyxb20090228 |
| [13] | HU M J, LUO C X, GRABKE A, et al. Selection of a suitable medium to determine sensitivity of Monilinia fructicola mycelium to SDHI fungicides [J]. J Phytopathol, 2011, 159(9): 616–620. doi:10.1111/j.1439-0434.2011.01815.x |
| [14] | MA B Y, TREDWAY L P. Induced overexpression of cytochrome P450 sterol 14α-demethylase gene (CYP51) correlates with sensitivity to demethylation inhibitors (DMIs) in Sclerotinia homoeocarpa [J]. Pest Manage Sci, 2013, 69(12): 1369–1378. doi:10.1002/ps.2013.69.issue-12 |
| [15] | DEVRIES R E, TRIGIANO R N, WINDHAM M T, et al. Genetic analysis of fungicide-resistant Sclerotinia homoeocarpa isolates from Tennessee and Northern Mississippi [J]. Plant Dis, 2008, 92(1): 83–90. doi:10.1094/PDIS-92-1-0083 |
| [16] | HSIANG T, YANG L, BARTON W. Baseline sensitivity and cross-resistance to demethylation-inhibiting fungicides in Ontario isolates of Sclerotinia homoeocarpa [J]. Eur J Plant Pathol, 1997, 103(5): 409–416. doi:10.1023/A:1008671321231 |
| [17] | GOLEMBIEWSKI R C, VARGAS J M, JONES A L, et al. Detection of demethylation inhibitor (DMI) resistance in Sclerotinia homoeocarpa populations [J]. Plant Dis, 1995, 79(5): 491–493. doi:10.1094/PD-79-0491 |
| [18] | YANG F, ABDELNABBY H, XIAO Y N. Novel point mutations in β-tubulin gene for carbendazim resistance maintaining nematode pathogenicity of Paecilomyces lilacinus [J]. Eur J Plant Pathol, 2015, 143(1): 57–68. doi:10.1007/s10658-015-0665-0 |
| [19] | CAI M, LIN D, CHEN L, et al. M233I mutation in the β-tubulin of Botrytis cinerea confers resistance to zoxamide [J]. Sci Rep, 2015, 5: 16881. doi:10.1038/srep16881 |
| [20] |
宋丹丹, 张伊莹, 张琳婧, 等. 杨树炭疽病菌对多菌灵及 3 种DMIs杀菌剂的敏感性[J]. 农药学学报, 2016, 18(5): 567–574.
SONG D D, ZHANG Y Y, ZHANG L J, et al. Sensitivities of poplar anthracnose fungi isolates to carbendazim and three C-14α-demethylation inhibitors [J]. Chin J Pestic Sci, 2016, 18(5): 567–574. |
| [21] | SANG H, POPKO J T JR, CHANG T, et al. Molecular mechanisms involved in qualitative and quantitative resistance to the dicarboximide fungicide iprodione in Sclerotinia homoeocarpa field isolates [J]. Phytopathology, 2017, 107(2): 198–207. doi:10.1094/PHYTO-05-16-0211-R |
 2017, Vol. 19
2017, Vol. 19


