氨基葡萄糖-6-磷酸合成酶 (GlmS) 是氨基己糖生物合成途径的首步关键酶[1],其代谢产物氨基葡萄糖-6-磷酸用于合成N-乙酰氨基葡萄糖-6-磷酸 (GlcNAc-6-P),进而合成细菌细胞壁、肽聚糖以及脂多糖,也是合成几丁质的原料[2-3]。GlmS催化的氨基己糖生物合成途径是合成氨基葡萄糖-6-磷酸的唯一反应[5-6],近年来以其为靶标的抑制剂的研究日益引起人们的关注[7],但目前发现的对该酶具有较好抑制活性的化合物普遍存在活体杀菌活性差的问题,其原因在于这些化合物不能通过自由扩散穿过细胞膜,而是在作用到靶标前就被吸收降解了[8]。
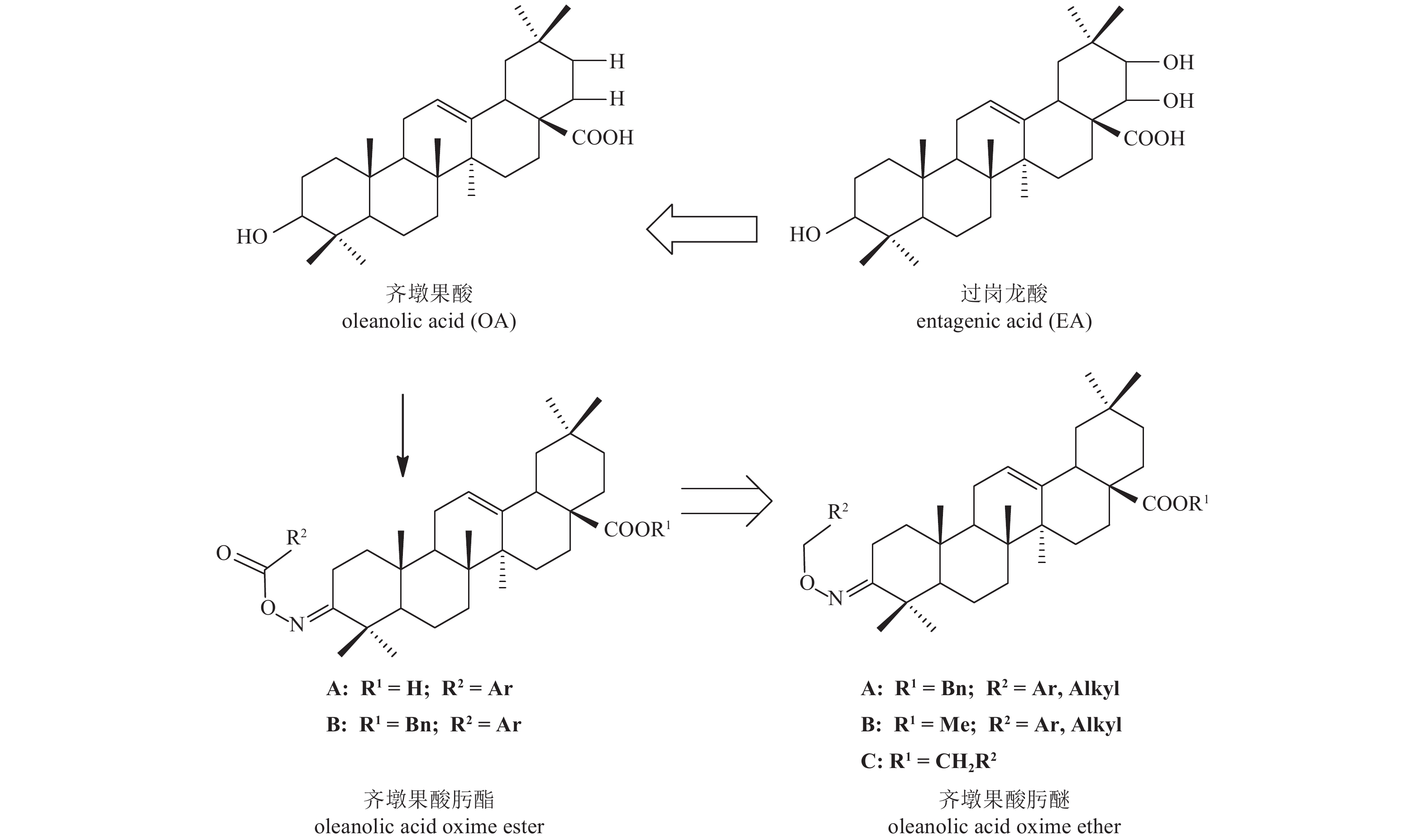
齐墩果酸 (oleanolic acid,OA,图式 1) 是一类五环三萜类天然产物,是治疗黄疸型肝炎和慢性肝炎的常用药物[9-11],并具有多种生物活性[12-18]。2011年Shimoga等报道了天然产物过岗龙酸 (entagenic acid, EA,图式 1) 对蜡状芽孢杆菌Bacillus cereus和枯草芽孢杆菌Bacillus subtilis具有较好的抗菌活性,并通过分子对接实验确认其具有较好的抑制GlmS活性[19]。这一发现为研究新的GlmS抑制剂提供了新的思路。由于齐墩果酸和过岗龙酸结构高度相似,笔者曾以齐墩果酸为先导,根据活性亚结构拼接原理,在其结构中引入农药有效活性基团肟酯结构,设计合成了一系列新型齐墩果酸肟酯类化合物 (图式 1),生物活性测定结果表明,部分化合物具有较好的杀菌活性,同时在0.35 mmol/L下对GlmS抑制率达到40% [20]。
|
图式1 过岗龙酸 (EA)、齐墩果酸 (OA) 及其衍生物结构 Scheme1 The structural formula of entagenic acid, oleanolic acid and oleanolic acid derivatives |
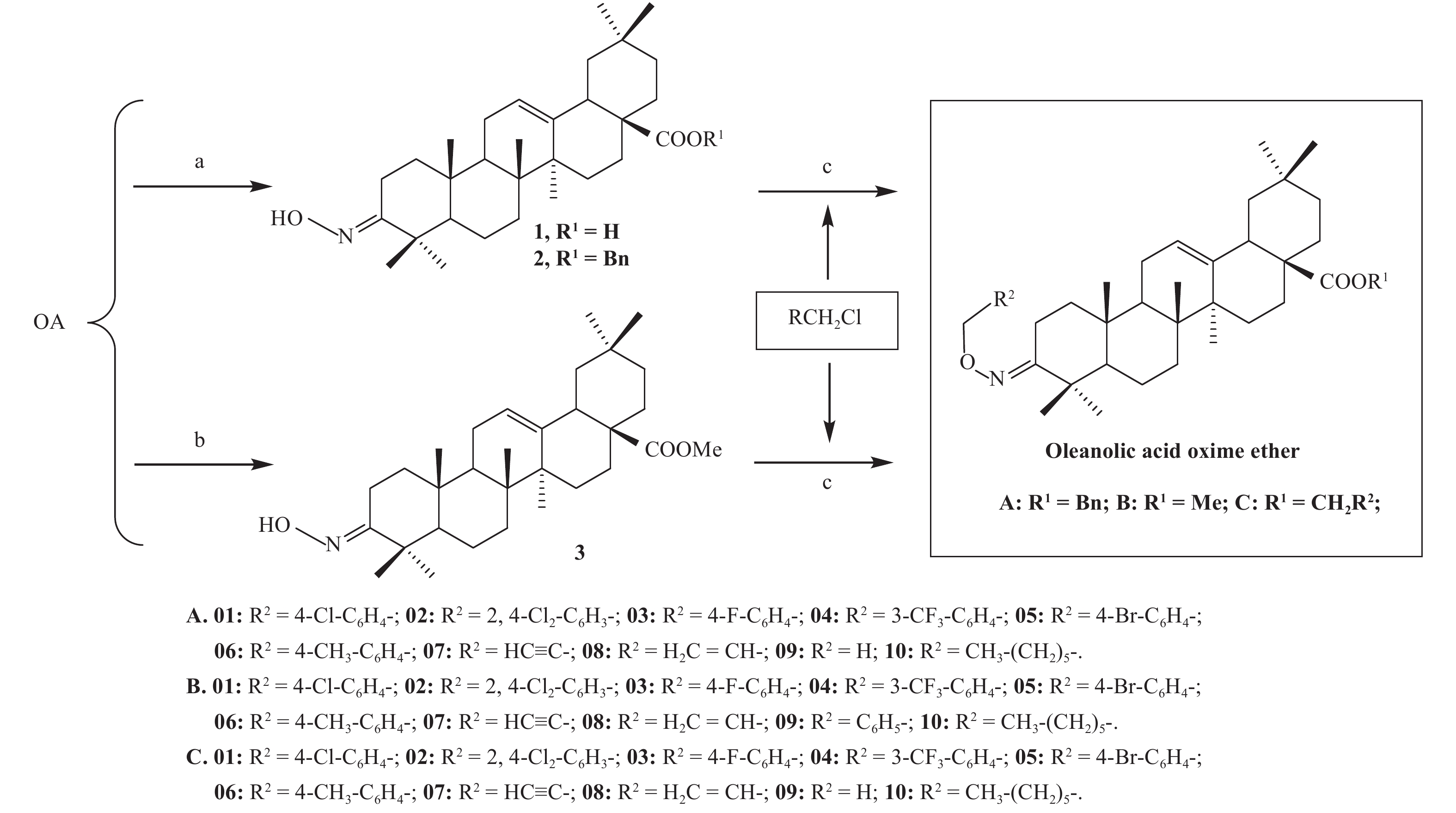
鉴于肟醚类化合物良好的生物活性和广泛的使用范围,本研究中笔者同样根据活性亚结构拼接原理,利用农药活性基团肟醚结构代替肟酯结构,同时借鉴齐墩果酸肟酯结构与生物活性的关系规律和经验,分别在齐墩果酸羧酸位置引入甲基、苄基和取代芳烃,以提高目标化合物肟醚的脂溶性,设计合成了3个系列共30个齐墩果酸肟醚类化合物 (A/B/C),其中29个为新化合物。初步测定了目标化合物对GlmS的抑制活性及对几种常见病原菌的杀菌活性。目标化合物的合成路线见图式 2。
|
Reagents and conditions: (a) BnBr, K2CO3, DMF, r.t.; Ac2O, PDC, CH2Cl2, reflux 3-4 h; NH2OH·HCl, Py, 80 ℃, 1 h. 89% for 1, 87% for 2. (b) CH3I, K2CO3, DMF, r.t.; Ac2O, PDC, CH2Cl2, reflux 3-4 h; NH2OH·HCl, Py, 80 ℃, 1 h. 71% for 3. (c) NaH, DMF, r.t., 4 h. 65%-85% for A, 71%-84% for B, 65%-90% for C. 图式2 目标化合物A/B/C的合成路线 Scheme2 Synthetic routes to the compounds A, B and C |
1 实验部分 1.1 仪器与试剂
X-5 型熔点测定仪 (温度计未校正);50-Conc型紫外-可见分光光度计 (VARIAN公司);Bruker 300-MHz型核磁共振仪 (TMS为内标,溶剂为CDC13)。白色念珠菌Candida albicans菌株ATCC10231(青岛绿谷分装)。
GlmS酶提取液由本实验室参考文献[20]制备,采用Elson Morgan法[21]确证所得酶及进行活性检测,通过考马斯亮蓝法 (Bradford法)[22]检测溶液中蛋白质的质量浓度为1.7 mg/mL,并于 –80 ℃分装保存。每次测定时设平行对照。所有试剂均为市售AR或CR级,部分有特殊要求的试剂经无水处理。氨基葡萄糖盐酸盐标准溶液 (1 mmol/L):0.021 6 g氨基葡萄糖盐酸盐溶于100 mL水中,4 ℃保存。
1.2 化合物的合成中间体1[21]、2[21]和3[23]分别参考文献方法制备,再将其与相应卤代烃反应得到目标化合物齐墩果酸肟醚A、B和C。
1.2.1 齐墩果酸-3-肟醚 (A-01)在50 mL圆底烧瓶中,加入苄基保护的齐墩果酸肟2 (0.5 g, 0.88 mmol) 和50% NaH(0.4 g, 8.3 mmol),用干燥DMF(15 mL) 溶解,–5 ℃下加入4-氯-苄氯 (0.2 g)。室温下搅拌4.5 h,薄层层析[TLC,V (石油醚) : V (乙酸乙酯)=6 : 1]监测至反应结束。用二氯甲烷稀释,水洗2次,合并有机相。无水硫酸钠干燥,浓缩,经柱层析[V (石油醚) : V (乙酸乙酯)=10 : 1]纯化得白色固体A-01 (0.46 g,76%)。同法制备齐墩果酸-3-肟醚 (A-02~A-10)。
1.2.2 齐墩果酸-3-肟醚 (B-01)在50 mL圆底烧瓶中,加入甲基保护的齐墩果酸肟3 (0.5 g, 1.05 mmol) 和50% NaH(0.1 g),用干燥DMF (15 mL) 溶解,–5 ℃下加入4-氯-苄氯 (0.25 g),室温下搅拌4 h,TLC[V (石油醚) : V (乙酸乙酯)=6 : 1]监测至反应结束。按1.2.1节方法纯化,得白色固体B-01 (0.54 g, 84%)。同法制备齐墩果酸-3-肟醚 (B-02~B-10)。
1.2.3 齐墩果酸-3-肟醚 (C-01)在50 mL圆底烧瓶中,加入齐墩果酸肟1 (0.5 g, 1.07 mmol) 和50% NaH(0.1 g),用干燥DMF(15 mL) 溶解,低温下加入4-氯-苄氯 (0.5 g)。室温下搅拌6 h,TLC [V (石油醚) : V (乙酸乙酯)=6 : 1]监测至反应结束。按1.2.1节方法纯化得白色固体C-01 (0.62 g, 81%)。同法制备齐墩果酸-3-肟醚 (C-02~C-10)。
1.3 酶抑制活性测定采用优化后的Elson Morgan法[21]测定目标化合物对白色念珠菌中GlmS的抑制活性。反应中用的标准体系为15 mmol/L的Fru-6-P、10 mmol/L的L-Gln、1 mmol/L的EDTA、1 mmol/L的DTT和25 mmol/L磷酸钾缓冲液,pH 6.8。加入待测目标化合物,最后加入酶提取液,适当调整酶提取液的体积,保证每组试验含有相同的酶比活力 (0.037 U),总体积为0.5 mL。在37 ℃下反应30 min,再在100 ℃下加热煮沸1 min,以终止反应。离心去除沉淀。取0.4 mL上清液,加入0.2 mL饱和碳酸氢钠溶液和0.1 mL V (醋酸酐) : V (丙酮)=1 : 10的混合液 (使用前新配制),剧烈摇晃,在室温下放置3 min。加热煮沸3 min (终止乙酰化反应) 后,在冰上冷却。向体系中加入0.2 mL 0.8 mol/L的K2B4O7溶液,pH 9.2,在100 ℃下反应3 min,冰上冷却。最后加入5 mL Elson-Morgan试剂 (1 g 4-二甲氨基苯甲醛溶解于100 mL冰醋酸中,其中含有1.25 mL浓盐酸),37 ℃下反应20 min,用紫外-可见分光光度计测定溶液在585 nm下的吸光度;与此同时,用1.0 mmol/L的氨基葡萄糖盐酸盐标准溶液进行梯度稀释,配制成5个浓度梯度 (0.2、0.4、0.6、0.8、1.0 mmol/L),并分别测定5个浓度梯度下氨基葡萄糖盐酸盐溶液的吸光度,用所得吸光度值对氨基葡萄糖盐酸盐的浓度绘制标准曲线,通过标准曲线计算生成的氨基葡萄糖-6-磷酸的量。每组设2个对照,一个没有GlmS,另一个没有底物Fru-6-P和L-Gln。根据公式 (1) 计算酶抑制率。
| $I_{\rm{1}}/{\%} = \frac{{{{\overline M }_{\rm{0}}} - \overline M }}{{{M_{\rm{0}}}}} \times {\rm{100 }}$ | (1) |
I1表示抑制率,
采用菌丝生长速率法[24]。供试菌株分别为油菜菌核病菌Sclerotinia sclerotiorum (Lib.) de Bary、茄子绵疫病菌Phytophthora capasici Leonian、番茄灰霉病菌Botrytis cinerea Pers.、苗床立枯病菌Rhizoctonia solani Kuhn、稻瘟病菌Pyricularia oryzae Cav.、棉花枯萎病菌Fusarium oxysporum Schl. F. sp. vasinfectum (Atk.) Snyd. & Hans.,均为中国农业科学院植物保护研究所保存菌种,扩繁后备用。制备含药50 μg/mL的PDA平板。以96.0%的百菌清 (chlorothalonil) 原药 (常熟恒荣商贸有限公司) 为药剂对照,设二甲基亚砜为溶剂对照,同时设空白对照,3次重复。按公式 (2) 计算抑菌率。
| $I_2/{\%} = \frac{{{{\overline D }_1}^2 - {{\overline D }_0}^2}}{{{{\overline D }_1}^2}} \times 100 $ | (2) |
I2是抑菌率,
3个系列的目标化合物是由相应的肟和苄卤取代反应而成,产率在60%~90%之间。目标产物的理化性质及高分辨质谱数据见表1,核磁共振氢谱及碳谱数据见表2。
|
|
表 1 目标化合物A/B/C的理化数据及高分辨质谱数据 Table 1 Physical properties and HRMS data of compounds A, B and C |
|
|
表 2 化合物A/B/C的 1H NMR和 13C NMR数据 Table 2 NMR date of compounds A/B/C |
|
|
表 2 (续表) Table 2 (Continued) |
|
|
表 2 (续表) Table 2 (Continued) |
2.2 酶抑制活性
在0.35 mmol/L下,目标化合物对GlmS的抑制率见表3。结果表明:部分目标化合物对GlmS表现出一定的抑制活性,抑制率与先导化合物齐墩果酸相当或略高,如化合物A-01、A-02、A-04、B-02、C-04和C-05;也有少量化合物抑制率较差,这和之前报道的肟酯系列化合物情况类似。初步构效关系分析结果表明,苯环上具有吸电子取代基的齐墩果酸肟醚 (取代基为4-Cl-C6H4-,2, 4-Cl2-C6H3-,3-CF3-C6H4-) 的酶抑制活性优于给电子取代基的 (取代基为4-CH3-C6H4-),芳基取代基的 (A/B/C 3个系列的1~5化合物) 优于脂肪族取代基的 (A/B/C 3个系列的7-10化合物),而脂肪链长度 (A/B/C 3个系列的7~10化合物) 对酶抑制活性影响不大。
|
|
表 3 在0.35 mmol/L下目标化合物对GlmS的抑制率 Table 3 Enzyme inhibition rate of compounds A, B and C at 0.35 mmol/L |
2.3 杀菌活性
结果表明:在50 μg/mL下,目标化合物对茄子绵疫病、苗床立枯病和棉花枯萎病抑制效果一般,抑制率分别在5%~25%、10%~30%和10%~20%,但对油菜菌核病、番茄灰霉病和稻瘟病表现出较好的杀菌活性,其中又以对油菜菌核病的效果更为明显,对番茄灰霉病次之。化合物A-01~A-05、B-02~B-04、B-06、B-09、B-10、C-03~C-05和C-09对油菜菌核病菌的抑菌活性较为突出,抑制率在80%以上,但低于对照药剂百菌清。A系列化合物整体上对油菜菌核病和番茄灰霉病的抑制活性略优于B系列和C系列,但是差别不明显。
|
|
表 4 目标化合物居50 μg/mL下对3种病原菌的抑制活性 Table 4 Inhibition activity of target compounds (50 μg/mL) against three fungi |
|
|
表 4 (续表) Table 4 (Continued) |
3 结论
本研究以几丁质合成过程的首步关键酶GlmS为研究对象,着重探究和发现以该酶为靶标的新型酶抑制剂,设计合成了30个齐墩果酸肟醚类化合物,其中29个为新化合物,所有化合物均经1H NMR、13C NMR和高分辨质谱确证。活性测定结果表明:在0.35 mmol/L下,部分目标化合物对GlmS具有一定的抑制活性,与先导化合物齐墩果酸相当;在50 μg/mL下,目标化合物对油菜菌核病、苗床立枯病和番茄灰霉病的杀菌活性明显优于齐墩果酸,部分化合物对油菜菌核病菌的抑菌活性尤为明显,抑制率在80%以上,但低于商品化对照药剂百菌清。初步构效关系分析结果表明,目标化合物的酶抑制活性和杀菌活性呈正相关,即具有较好酶抑制活性的化合物同时也表现出良好的活体杀菌活性,这为解决目前该类酶抑制剂杀菌活性差的问题提供新的思路,为以该酶为作用靶标的研究奠定一定的基础,进一步的研究正在进行中。
致谢:感谢中国农业大学张建军教授在酶活性研究中提供果糖-6-磷酸及乙酰氨基葡萄糖对硝基苯苷 (国家125科技支撑计划No.2015BAK45B01支持研制) 试剂的帮助。
| [1] | DURAND P, GOLINELLI-PIMPANEAU B, MOUILLERON S, et al. Highlights of glucosamine-6P synthase catalysis[J]. Arch Biochem Biophys, 2008, 474(2): 302–317. |
| [2] | BROWNLEE M. Biochemistry and molecular cell biology of diabetic complications[J]. Nature, 2001, 414(6865): 813–820. |
| [3] | BUSE M G. Hexosamines, insulin resistance, and the complications of diabetes: current status[J]. Am J Physiol Endocrinol Metab, 2006, 290(1): E1–E8. |
| [4] | GHOSH S, BLUMENTHAL H J, DAVIDSON E, et al. Glucosamine metabolism. V. Enzymatic synthesis of glucosamine 6-phosphate[J]. J Biol Chem, 1960, 235: 1265–1273. |
| [5] | VALERIO-LEPINIEC M, AUMONT-NICAISE M, ROUX C, et al. Analysis of the Escherichia coli glucosamine-6-phosphate synthase activity by isothermal titration calorimetry and differential scanning calorimetry [J]. Arch Biochem Biophys, 2010, 498(2): 95–104. |
| [6] | BOROWSKI E. Novel approaches in the rational design of antifungal agents of low toxicity[J]. Il Farmaco, 2000, 55(3): 206–208. |
| [7] | JANIAK A M, HOFFMANN M, MILEWSKA M J, et al. Hydrophobic derivatives of 2-amino-2-deoxy-D-glucitol-6-phosphate: a new type of D-glucosamine-6-phosphate synthase inhibitors with antifungal action[J]. Bioorg Med Chem, 2003, 11(8): 1653–1662. |
| [8] | LIU Y P, HARTLEY D P, LIU J. Protection against carbon tetrachloride hepatotoxicity by oleanolic acid is not mediated through metallothionein[J]. Toxicol Lett, 1998, 95(2): 77–85. |
| [9] | JEONG H G. Inhibition of cytochrome P450 2E1 expression by oleanolic acid: hepatoprotective effects against carbon tetrachloride-induced hepatic injury[J]. Toxicol Lett, 1999, 105(3): 215–222. |
| [10] | LIU J, LIU Y, PARKINSON A J, et al. Effect of oleanolic acid on hepatic toxicant-activating and detoxifying systems in mice[J]. J Pharmacol Exp Ther, 1995, 275(2): 768–774. |
| [11] | SINGH G B, SINGH S, BANI S, et al. Anti-inflammatory activity of oleanolic acid in rats and mice[J]. J Pharm Pharmacol, 1992, 44(5): 456–458. |
| [12] | MENGONI F, LICHTNER M, BATTINELLI L, et al. In vitro anti-HIV activity of oleanolic acid on infected human mononuclear cells [J]. Planta Med, 2002, 68(2): 111–114. |
| [13] | ZHU Y M, SHEN J K, WANG H K, et al. Synthesis and anti-HIV activity of oleanolic acid derivatives[J]. Bioorg Med Chem Lett, 2001, 11(24): 3115–3118. |
| [14] | HSU H Y, YANG J J, LIN C C. Effects of oleanolic acid and ursolic acid on inhibiting tumor growth and enhancing the recovery of hematopoietic system postirradiation in mice[J]. Cancer Lett, 1997, 111(1-2): 7–13. |
| [15] | TAN G T, LEE S, LEE I S, et al. Natural-product inhibitors of human DNA ligase I[J]. Biochem J, 1996, 314(3): 993–1000. |
| [16] | MAHATO S B, GARAI S. Triterpenoid saponins[J]. Fortschr Chem Org Naturst, 1998, 74: 1–196. |
| [17] | KAMINSKYY D, BEDNARCZYK-CWYNAR B, VASYLENKO O, et al. Synthesis of new potential anticancer agents based on 4-thiazolidinone and oleanane scaffolds[J]. Med Chem Res, 2012, 21(11): 3568–3580. |
| [18] | PAPADOPOULOU K, MELTON R E, LEGGET M, et al. Compromised disease resistance in saponin-deficient plants[J]. Proc Natl Acad Sci USA, 1999, 96(22): 12923–12928. |
| [19] | VIDYA S M, KRISHNA V, MANJUNATHA B K, et al. Antibacterial and molecular docking studies of entagenic acid, a bioactive principle from seed kernel of Entada pursaetha DC [J]. Med Chem Res, 2012, 21(7): 1016–1022. |
| [20] | SACHADYN P, JĘDRZEJCZAK R, MILEWSKI S, et al. Purification to homogeneity of Candida albicans glucosamine-6-phosphate synthase overexpressed in Escherichia coli [J]. Protein Express. Purificat, 2000, 19(3): 343–349. |
| [21] | ZHAO H Q, ZHOU M J, DUAN L F, et al. Efficient synthesis and anti-fungal activity of oleanolic acid oxime esters[J]. Molecules, 2013, 18(3): 3615–3629. |
| [22] | BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal. Biochem, 1976, 72: 248–254. |
| [23] |
徐小军, 赖声洪, 季明华, 等. 弥拜霉素类似物的合成、表征和杀虫活性研究[J]. 有机化学, 2012, 32(6): 1084–1092.
XU X J, LAI S G, JI M H, et al. Synthesis, characterization and insecticidal activity of milbemycin analogues[J]. Chin J Org Chem, 2012, 32(6): 1084–1092. |
| [24] |
陈年春. 农药生物测定技术[M]. 北京: 北京农业大学出版社, 1991.
CHEN N C. Pesticides bioassay technology[M]. Beijing: Beijing Agricultural University Press, 1991. |
| [25] | GAO P, GUO W, XUE J J, et al. Iridium(III)-catalyzed direct arylation of C–H bonds with diaryliodonium salts[J]. J Am Chem Soc, 2015, 137(38): 12231–12240. |
 2017, Vol. 19
2017, Vol. 19


