γ-氨基丁酸 (GABA) 是哺乳动物及昆虫神经系统中重要的抑制性神经传导递质,GABA与其受体结合,使氯离子通道开放,氯离子内流抑制神经兴奋性[1]。GABA受体是杀虫剂的重要作用靶标之一[2],其拮抗剂分为非竞争性拮抗剂 (noncompetitive antagonists, NCAs) 和竞争性拮抗剂 (competitive antagonists, CAs) 两种。NCAs的结合位点有别于激动剂的结合位点,其与受体其他位点结合后通过变构调节阻碍激动剂与受体进行特异性结合;而CAs则是与相应的激动剂竞争同一结合位点,从而调节受体的功能[3]。目前,GABA受体的NCAs作为杀虫剂在农业及卫生领域已广泛应用,此类杀虫剂直接作用于氯离子通道,阻滞氯离子内流,致使神经兴奋不能得到有效抑制,最终导致昆虫死亡[4]。传统的GABA受体NCA类杀虫剂主要包括环戊二烯类、多氯环烷烃类、苯基吡唑类和大环内酯类等[5]。其中,苯基吡唑类杀虫剂氟虫腈,对水生生物毒性较大,对环境存在潜在风险[6-7];多数环戊二烯及多氯环烷烃类杀虫剂因蓄积毒性问题,目前在国内农业生产中已被禁用[8]。近年的研究表明,GABA受体CAs也具有一定杀虫活性[9-10],但其作用位点及作用机制与NCAs有较大区别。NCAs直接作用于GABA受体氯离子通道跨膜段,而CAs则作用于细胞膜外区的GABA识别位点,竞争性抑制GABA与其受体结合,从而使氯离子通道开启受阻,对昆虫产生致毒作用。由于GABA受体CAs与NCAs具有调节该受体的不同机理,因此GABA受体CAs有潜力开发为作用机理新颖的杀虫剂。本文拟对近年来关于GABA受体CAs的研究进展进行综述,旨在为此类杀虫剂进一步深入研究提供思路和建议。
1 昆虫GABA受体GABA是哺乳动物及昆虫神经系统中的主要抑制性神经递质。GABA通过释放到神经突触间隙,与代谢型和离子型两种类型受体结合[分别称为代谢型GABA(GABAB) 受体和离子型GABA(GABAA和GABAC) 受体],从而对神经产生抑制作用,代谢型GABA受体是二聚的G-蛋白偶联受体,离子型GABA受体属于半胱氨酸环超家族[11-12](本文中如无特殊说明,所述GABA受体均指离子型GABA受体)。GABA受体是由5个亚基构成的五聚配体门控离子通道[13],每个亚基主要包括3部分:较长的N-端细胞外结构,约含有220个氨基酸残基;4个疏水的跨膜结构 (TM1~TM4);处于细胞内连接TM3和TM4的环状结构。5个亚基跨膜段的TM2形成离子通道孔的内壁 (图1)。2014年,Miller等[14]成功解析出了人类GABAA受体的一个三维结构 (由5个β3亚基构成的同源五聚体)。这是目前唯一被报道的GABA受体的完整三维结构,该结构的发现为GABA受体的研究奠定了科学依据和理论基础。

|
图 1 A. GABAA受体模型的侧视图,包括胞外域 (ECD) 和跨膜结构域 (TMD);B. GABAA受体的五聚体装配结构俯视图;C. GABA受体跨膜区示意图,每个亚基包括4个疏水跨膜结构(TM1~TM4),5个亚基的TM2组成离子通道内壁 Fig. 1 A. Side view of the GABAA receptor model, containing the extracellular domain (ECD) and the transmembrane domain (TMD); B. Top view of the pentameric assembly of the GABAA receptor; C. View of the GABA receptor transmembrane region, indicating the four hydrophobic transmembrane domains(TM1-TM4) of GABA receptor subunits, five subunits of TM2 form an ion channel wall |
GABA受体在昆虫的中枢神经系统和周缘神经系统中均发挥着重要的生理作用[15]。迄今为止,来自黑腹果蝇Drosophila melanogaster的3个昆虫GABA受体亚基已被鉴定并成功克隆,分别是RDL (resistance to dieldrin)、LCCH3 (ligand-gated chloride channel homologue 3) 和GRD (GABA and glycine-like receptor of Drosoplila)[16]。其中,RDL亚基因其对环戊二烯类杀虫剂狄氏剂 (dieldrin) 产生抗性突变而得名[17]。研究表明,在果蝇中所发现的3种亚基中,只有RDL亚基能形成功能性的GABA门控氯离子通道,具有与哺乳动物GABA受体相似的功能[18],因此昆虫GABA受体也叫RDL受体。
自从RDL亚基通过果蝇被成功克隆后,其同源基因在其他昆虫中也陆续被克隆,如褐飞虱Laodelphax striatella、家蝇Musca domestica、斜纹夜蛾Spodoptera litura和德国小蠊Blattella germanica等[19]。这为研究昆虫GABA受体的生理功能提供了基础。此外,对果蝇RDL亚基编码基因RDL的外显子3和6进行选择性剪接 (外显子3包含a和b两种类型,外显子6包括c和d两种类型),可以得到RDL亚基的4种剪接变异体 (RDLac、RDLad、RDLbc和RDLbd)[20],这种剪切模式为后来研究和判断其他昆虫RDL亚基的类型提供了参考[21]。研究表明,部分GABA受体激动剂对这4种剪接变异体的敏感性存在差异,因此选择性剪接有可能增加昆虫GABA受体的药理学多样性[22]。
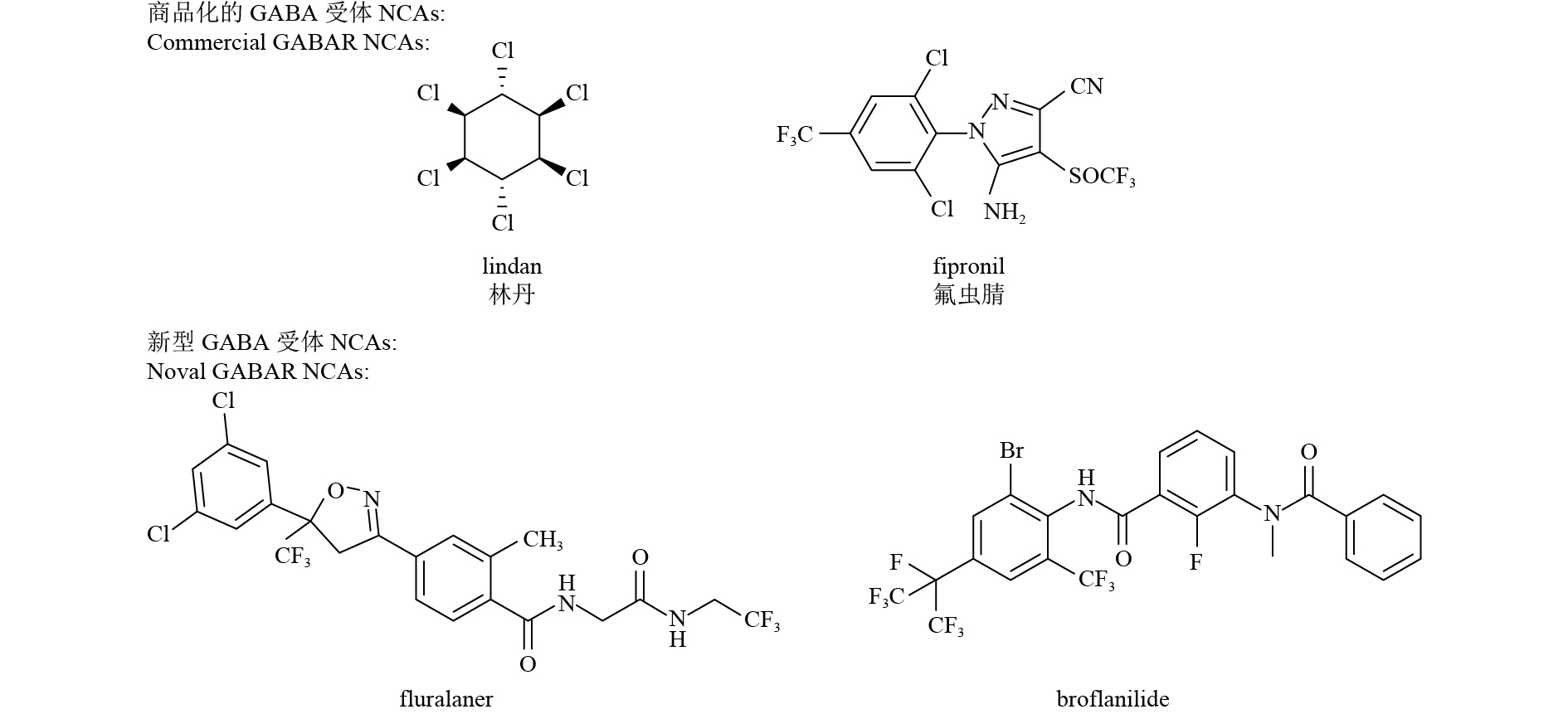
2 传统GABA受体拮抗剂昆虫GABA受体已被证实具有多个作用靶点,并且这些靶点之间没有交互抗性[23]。目前主要是通过使用特异性放射性配体、抗性品系、定点突变和分子模拟相结合的方法来分析GABA受体所包含靶点的作用机理[24]。传统的作用于GABA受体的杀虫剂均是非竞争性拮抗剂 (NCAs),其直接作用于氯离子通道,阻滞氯离子内流,使昆虫的神经传导不能得到有效抑制,进而导致昆虫死亡[18]。已成功开发并商品化的NCA类杀虫剂主要包括苯基吡唑类、环戊二烯类和多氯环烷烃类等[25],如林丹和氟虫腈 (图式 1)。除这些传统的杀虫剂外,最近有学者报道了两类具有杀虫活性的新型GABA受体NCAs:异鰁唑啉类 (代表性化合物fluralaner,图式 1) 和3-苯甲酰氨基-N-苯基苯甲酰胺类 (代表性化合物broflanilide, 图式 1)[23, 26-27]。研究表明,该两类化合物的结合位点可能位于受体跨膜段TM1和TM3附近,对其作用机制和结合位点的研究仍在进行中[28-29]。由于这两类化合物的作用位点不同于传统的NCA类杀虫剂,所以若将其成功开发为商品化杀虫剂,有望克服目前日益严重的昆虫抗药性问题。
|
图式1 典型的GABA受体非竞争性拮抗剂结构 Scheme1 Structures of typical GABA receptor NCAs |
3 昆虫GABA受体竞争性拮抗剂
GABA受体竞争性拮抗剂 (CAs) 作用于细胞膜外区的GABA识别位点,与NCAs的作用机制不同[22, 30]。研究发现,CAs在哺乳动物中具有一定的生物活性,如亚甲基蓝可用于对某些疾病的诊断,在临床观察和实验研究中发现,亚甲基蓝可对人类中枢神经产生影响,能够竞争性地抑制GABAA受体功能[31]。最近有报道指出,昆虫GABA受体CAs具有一定的杀虫活性[32],具有开发为新型、高效杀虫剂的潜力。下面分别介绍目前文献报道的三类昆虫GABA受体CAs。
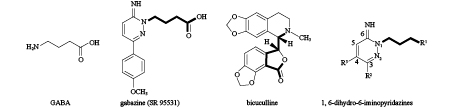
3.1 Gabazine类似物的竞争性拮抗效应20世纪80年代中期,Wermuth等[33]报道了大鼠GABAA受体的一个典型CA—gabazine(SR95531,图式 2),其结构是GABA中的氨基被芳氨基哒嗪所替代。对gabazine进行结构修饰,在其哒嗪环的3位引入芳香基团,所得衍生物对猪蛔虫Ascaris suumGABA受体具有较好的竞争性拮抗活性,其Ki值达微摩尔级,但该类衍生物对大鼠GABA受体的拮抗活性有所降低,这种选择性对设计新型安全的杀寄生虫剂有一定的指导意义[34-36]。荷包牡丹碱 (bicuculline,图式 2) 是哺乳动物GABAA受体CAs的另一个代表性化合物,但其对大多数昆虫GABA受体无拮抗效应[37],表明GABA受体CAs在哺乳动物和昆虫之间具有选择性。
|
粗线表示所包含的GABA结构支架,1,6-二氢-6-亚氨基哒嗪的碳原子数在其侧面表示。 Bold lines indicate the GABA structural scaffold. The numbering of the carbon atoms in the 1,6-dihydro-6-iminopyridazines are indicated. 图式2 GABA、Gabazine(SR 95531)、荷包牡丹碱和1,6-二氢-6-亚氨基哒嗪的化学结构 Scheme2 Chemical structures of GABA, Gabazine (SR 95531), Bicuculline and 1,6-dihydro-6-iminopyridazines |
Rahman等[38]对gabazine哒嗪环的3位和4位进行修饰,合成了一系列1,6-二氢-6-亚氨基哒嗪类衍生物 (1,6-dihydro-6-iminopyridazines,图式 2),生物活性测定发现,其对昆虫GABA受体存在竞争性拮抗作用。当哒嗪环的3位取代基 (R2) 为芳环时,所得衍生物对昆虫GABA受体有明显增强的拮抗作用,特别是R2为2-萘基时,所得衍生物在100 μmol/L下,对褐飞虱、斜纹夜蛾和美洲蟑螂Periplaneta americana的GABA受体均表现出较好的拮抗活性;但若在其4位引入环丁基,则会降低化合物对昆虫GABA受体的拮抗活性。此外,Rahman等[36]发现,若将哒嗪环1位的羧丁基替换为氰基丁基,化合物对昆虫GABA受体的拮抗活性则没有明显改变,证明对于昆虫GABA受体而言,此类化合物的氰基可能是羧酸的生物电子等排体。Rahman等[38]的研究表明,亚氨基哒嗪类衍生物可以作为昆虫GABA受体CAs的先导化合物被进一步研究。
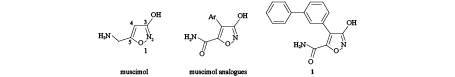
3.2 蝇蕈醇类似物的竞争性拮抗效应Johnston[39]曾报道,蝇蕈醇 (muscimol) 是离子型GABA受体的选择性激动剂。研究发现,蝇蕈醇是GABA的3-羟基异鰁唑生物电子等排体。Liu等[9]合成了一系列4,5-双取代蝇蕈醇衍生物 (图式 3),并测定了其对家蝇GABA受体4个剪接变异体 (ac, ad, bc和bd) 的活性。结果表明,蝇蕈醇对4个剪接变异体的激动活性高于GABA,而改造后的4,5-双取代蝇蕈醇衍生物则没有表现出激动作用,反而表现出拮抗作用。通过在蝇蕈醇的4位引入双环芳香族基团,同时在5位引入氨基甲酰基,得到6个4-芳基-5-氨基甲酰基-3-羟基异鰁唑衍生物 (图式 3, muscimol analogues)。生物测定结果表明,6个目标化合物均表现出明显增强的拮抗作用,其对ac剪接变异体的IC50值在微摩尔级水平;其中,5-甲酰氨基-4-(3-联苯基)-3-异鰁唑醇 (化合物1,图式 3) 具有竞争性拮抗作用,且活性最高,其在家蝇GABA受体的ac、bc、ad和bd 4个剪接变异体中的IC50值分别为30、34、107和96 μmol/L,并对家蝇表现出一定的杀虫活性,LD50值为5.6 nmol/fly。这些研究结果表明,4-芳基-5-甲酰氨基-3-异鰁唑醇类衍生物属于昆虫GABA受体CAs,可作为先导化合物,用于进一步设计和开发昆虫GABA受体CA类杀虫剂。
|
图式3 蝇蕈醇及其类似物的化学结构 Scheme3 Chemical structures of muscimol and its analogues |
3.3 5-(4-哌啶基)-3-异噻唑醇类似物的竞争性拮抗效应
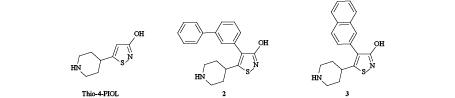
近几年,Frølund等[40]合成并报道了一系列五元杂环化合物,如异鰁唑类、异噻唑类和吡唑类等,发现这些化合物对哺乳动物GABAA受体有竞争性拮抗作用,但关于其对昆虫GABA受体的活性报道较少。Liu等[10]研究发现,5-(4-哌啶基)-3-异噻唑醇 (Thio-4-PIOL,图式 4) 在褐飞虱、斜纹夜蛾和家蝇GABA受体中均未表现出激动活性,但其对褐飞虱和斜纹夜蛾的GABA受体具有较弱的拮抗效应,在100 μmol/L下,其对GABA诱导电流的抑制率分别为34.4%和8.8%,而Thio-4-PIOL是哺乳动物GABAA受体的部分激动剂,这表明Thio-4-PIOL在昆虫和哺乳动物GABA受体之间存在药理学差异。
Liu等[10]对Thio-4-PIOL类衍生物在昆虫GABA受体中的竞争性拮抗效应进行了进一步研究,通过对Thio-4-PIOL的结构进行修饰,发现在异噻唑环的4位引入大的芳香基团有利于提高活性,尤其是5-(4-哌啶基)-4-(3-联苯基)-3-异噻唑醇 (化合物2,图式 4) 和5-(4-哌啶基)-4-(2-萘基)-3-异噻唑醇 (化合物3,图式 4) 对家蝇GABA受体表现出了较强的拮抗效应,其IC50值在微摩尔水平。分子对接研究表明,家蝇GABA受体CA结合位点含有两个较大的空腔,可以容纳Thio-4-PIOL类似物的双环芳香基团。此外,Thio-4-PIOL类似物在哺乳动物GABAA受体 (α1β2γ2s) 中显示出纳摩尔级的竞争拮抗活性,与之相比,在昆虫GABA受体中该类化合物的活性仍然较低[41],因此针对这类化合物,有较大的提升空间来设计和合成更有效的昆虫GABA受体CAs。
|
图式4 5-(4-哌啶基)-3-异噻唑醇 (Thio-4-PIOL) 及其类似物的化学结构 Scheme4 Chemical structures of 5-(4-piperidinyl)-3-isothiazolol (Thio-4-PIOL) and its analogues |
4 小结和展望
安全、高效、经济及使用方便是未来杀虫剂的研发方向,随着对昆虫GABA受体结构和功能多样性的深入研究,以该受体为靶标、结构多样性的杀虫化合物有望被研发。昆虫GABA受体NCAs作为杀虫剂的成功研发,对害虫的有效控制和农业可持续性发展起到了重要作用,但长期使用这些杀虫剂所带来的环境安全和害虫抗药性等问题已日益严峻,农业生产中亟需研发安全高效的新型杀虫剂。尽管目前对于昆虫GABA受体CAs的药理学和选择性研究还比较局限,其作为杀虫剂的研发仍然处于起步阶段,但已发现一些GABA受体CAs具有一定的杀虫活性[9-10],且其与GABA受体的结合位点和作用机制有别于NCAs,因此,具有高亲和力的昆虫GABA受体CAs作为杀虫剂研发具有广阔的前景。
| [1] | OLSEN R W. Allosteric ligands and their binding sites define γ-aminobutyric acid (GABA) type A receptor subtypes[J]. Adv Pharmacol, 2015, 73: 167–202. doi:10.1016/bs.apha.2014.11.005 |
| [2] |
魏琪, 吴顺凡, 高聪芬. 杀虫剂靶标离子型 γ-氨基丁酸受体研究进展
[J]. 农药, 2014, 53(12): 859–863.
WEI Q, WU S F, GAO C F. Advances in the molecular target for insecticides of ionotropic γ-aminobutyric acid receptors [J]. Agrochemicals, 2014, 53(12): 859–863. |
| [3] |
程瑾. 昆虫和哺乳动物GABA受体同源模建及杀虫剂分子设计[D]. 武汉: 武汉工程大学, 2009.
CHENG J. Homology modeling of insect and mammalian GABA receptors and insecticide design[D]. Wuhan: Wuhan Institute of Technology, 2009. |
| [4] | LUMMIS S C R. Locating GABA in GABA receptor binding sites[J]. Biochem Soc Trans, 2009, 37(6): 1343–1346. doi:10.1042/BST0371343 |
| [5] | WEI Q, WU S F, NIU C D, et al. Knockdown of the ionotropic γ-aminobutyric acid receptor (GABAR) RDL gene decreases fipronil susceptibility of the small brown planthopper, Laodelphax striatellus (Hemiptera: Delphacidae) [J]. Arch Insect Biochem Physiol, 2015, 88(4): 249–261. doi:10.1002/arch.v88.4 |
| [6] | WESTON D P, LYDY M J. Toxicity of the insecticide fipronil and its degradates to benthic macroinvertebrates of urban streams[J]. Environ Sci Technol, 2014, 48(2): 1290–1297. doi:10.1021/es4045874 |
| [7] | GIBBONS D, MORRISSEY C, MINEAU P. A review of the direct and indirect effects of neonicotinoids and fipronil on vertebrate wildlife[J]. Environ Sci Pollut Res, 2015, 22(1): 103–118. doi:10.1007/s11356-014-3180-5 |
| [8] |
赵春青, 韩召军, 唐涛. 杀虫剂 fluralaner 及其衍生物的生物效应和毒理学研究进展[J]. 农药学学报, 2015, 17(3): 251–256.
ZHAO C Q, HAN Z J, TANG T. Research progress on bioeffect and toxicology of insecticide fluralaner and its derivatives[J]. Chin J Pestic Sci, 2015, 17(3): 251–256. |
| [9] | LIU G Y, OZOE F, FURUTA K, et al. 4,5-Substituted 3-isoxazolols with insecticidal activity act as competitive antagonists of housefly GABA receptors[J]. J Agric Food Chem, 2015, 63(28): 6304–6312. doi:10.1021/acs.jafc.5b01843 |
| [10] | LIU G Y, FURUTA K, NAKAJIMA H, et al. Competitive antagonism of insect GABA receptors by 4-substituted 5-(4-piperidyl)-3-isothiazolols[J]. Bioorg Med Chem, 2014, 22(17): 4637–4645. doi:10.1016/j.bmc.2014.07.021 |
| [11] |
袁莲芳, 陈果, 贾宏阁, 等. GABAA 受体研究现状
[J]. 现代临床医学, 2014, 40(2): 89–92.
YUAN L F, CHEN G, JIA H G, et al. Current status of GABAA receptors [J]. J Mod Clin Med, 2014, 40(2): 89–92. |
| [12] | HEANEY C F, KINNEY J W. Role of GABAB receptors in learning and memory and neurological disorders [J]. Neurosci Biobehav Rev, 2016, 63: 1–28. doi:10.1016/j.neubiorev.2016.01.007 |
| [13] | COMITANI F, LIMONGELLI V, MOLTENI C. The free energy landscape of GABA binding to a pentameric ligand-gated ion channel and its disruption by mutations[J]. J Chem Theory Comput, 2016, 12(7): 3398–3406. doi:10.1021/acs.jctc.6b00303 |
| [14] | MILLER P S, ARICESCU A R. Crystal structure of a human GABAA receptor [J]. Nature, 2014, 512(7514): 270–275. doi:10.1038/nature13293 |
| [15] |
卢文才, 何林, 薛传华, 等. 昆虫 γ-氨基丁酸受体研究现状
[J]. 昆虫知识, 2009, 46(1): 152–158.
LU W C, HE L, XUE C H, et al. Advances in research of γ-aminobutyric acid receptors of insects [J]. Chin Bull Entomol, 2009, 46(1): 152–158. doi:10.7679/j.issn.2095-1353.2009.031 |
| [16] | TAYLOR-WELLS J, HAWKINS J, COLOMBO C, et al. Cloning and functional expression of intracellular loop variants of the honey bee (Apis mellifera) RDL GABA receptor [J]. Neuro Toxicol, 2016, 60: 207–213. |
| [17] | THOMPSON M, STEICHEN J C, FFRENCH-CONSTANT R H. Conservation of cyclodiene insecticide resistance-associated mutations in insects[J]. Insect Mol Biol, 1993, 2(3): 149–154. doi:10.1111/imb.1993.2.issue-3 |
| [18] |
汪小芬, 任天瑞, 姚建华. 氟虫腈与斑马鱼 GABAA 及果蝇 RDL 受体作用的差异性研究
[J]. 农药学学报, 2014, 16(3): 259–270.
WANG X F, REN T R, YAO J H. Differences of interactions between fipronil with zebrafish GABAA and Drosophila melanogaster RDL receptor [J]. Chin J Pestic Sci, 2014, 16(3): 259–270. |
| [19] | NAKAO T. Mechanisms of resistance to insecticides targeting RDL GABA receptors in planthoppers[J]. NeuroToxicology, 2016, 60: 293–298. |
| [20] | FFRENCH-CONSTANT R H, ROCHELEAU T A. Drosophila γ-aminobutyric acid receptor gene Rdl shows extensive alternative splicing [J]. J Neurochem, 1993, 60(6): 2323–2326. doi:10.1111/jnc.1993.60.issue-6 |
| [21] | CHUA H C, CHEBIB M. GABAA receptors and the diversity in their structure and pharmacology [J]. Adv Pharmacol, 2017, 79: 1–34. doi:10.1016/bs.apha.2017.03.003 |
| [22] | RATRA G S, KAMITA S G, CASIDA J E. Role of human GABAA receptor β3 subunit in insecticide toxicity [J]. Toxicol Appl Pharmacol, 2001, 172(3): 233–240. doi:10.1006/taap.2001.9154 |
| [23] | CASIDA J E, DURKIN K A. Novel GABA receptor pesticide targets[J]. Pestic Biochem Physiol, 2015, 121: 22–30. doi:10.1016/j.pestbp.2014.11.006 |
| [24] | YAMAURA K, KIYONAKA S, NUMATA T, et al. Discovery of allosteric modulators for GABAA receptors by ligand-directed chemistry [J]. Nat Chem Biol, 2016, 12(10): 822–830. doi:10.1038/nchembio.2150 |
| [25] | ZHANG Y X, MENG X K, YANG Y X, et al. Synergistic and compensatory effects of two point mutations conferring target-site resistance to fipronil in the insect GABA receptor RDL[J]. Sci Rep, 2016, 6: 32335. doi:10.1038/srep32335 |
| [26] | ABBAS N, IJAZ M, SHAD S A, et al. Assessment of resistance risk to fipronil and cross resistance to other insecticides in the Musca domestica L. (Diptera: Muscidae) [J]. Vet Parasitol, 2016, 223: 71–76. doi:10.1016/j.vetpar.2016.04.026 |
| [27] | CASIDA J E. Golden age of RyR and GABA-R diamide and isoxazoline insecticides: common genesis, serendipity, surprises, selectivity, and safety[J]. Chem Res Toxicol, 2015, 28(4): 560–566. doi:10.1021/tx500520w |
| [28] | ASAHI M, KOBAYASHI M, MATSUI H, et al. Differential mechanisms of action of the novel γ-aminobutyric acid receptor antagonist ectoparasiticides fluralaner (A1443) and fipronil [J]. Pest Manag Sci, 2015, 71(1): 91–95. doi:10.1002/ps.2015.71.issue-1 |
| [29] | NAKAO T, BANBA S, NOMURA M, et al. Meta-diamide insecticides acting on distinct sites of RDL GABA receptor from those for conventional noncompetitive antagonists[J]. Insect Biochem Mol Biol, 2013, 43(4): 366–375. doi:10.1016/j.ibmb.2013.02.002 |
| [30] | OTHMAN N A, GALLACHER M, DEEB T Z, et al. Influences on blockade by t-butylbicyclo-phosphoro-thionate of GABAA receptor spontaneous gating, agonist activation and desensitization [J]. J Physiol, 2012, 590(1): 163–178. doi:10.1113/jphysiol.2011.213249 |
| [31] | CHEN Z L, LIU R, YANG S H, et al. Methylene blue inhibits GABAA receptors by interaction with GABA binding site [J]. Neuropharmacology, 2017, 119: 100–110. doi:10.1016/j.neuropharm.2017.04.002 |
| [32] | FFRENCH-CONSTANT R H, WILLIAMSON M S, DAVIES T G E, et al. Ion channels as insecticide targets[J]. J Neurogenet, 2016, 30(3-4): 163–177. doi:10.1080/01677063.2016.1229781 |
| [33] | WERMUTH C G, BOURGUIGNON J J, SCHLEWER G, et al. Synthesis and structure-activity relationships of a series of aminopyridazine derivatives of γ-aminobutyric acid acting as selective GABA-A antagonists [J]. J Med Chem, 1987, 30(2): 239–249. doi:10.1021/jm00385a003 |
| [34] | DUITTOZ A H, MARTIN R J. Antagonist properties of arylaminopyridazine GABA derivatives at the Ascaris muscle GABA receptor [J]. J Exp Biol, 1991, 159: 149–164. |
| [35] | MARTIN R J, SITAMZE J M, DUITTOZ A H, et al. Novel arylaminopyridazine-GABA receptor antagonists examined electrophysiologically in Ascaris suum [J]. Eur J Pharmacol, 1995, 276(1-2): 9–19. doi:10.1016/0014-2999(94)00778-6 |
| [36] | RAHMAN M M, LIU G Y, FURUTA K, et al. Synthesis of 1,3-di- and 1,3,4-trisubstituted 1,6-dihydro-6-iminopyridazines as competitive antagonists of insect GABA receptors[J]. J Pestic Sci, 2014, 39(3): 133–143. doi:10.1584/jpestics.D14-052 |
| [37] | JOHNSTON G A. Advantages of an antagonist: bicuculline and other GABA antagonists[J]. Br J Pharmacol, 2013, 169(2): 328–336. doi:10.1111/bph.12127 |
| [38] | RAHMAN M M, AKIYOSHI Y, FURUTANI S, et al. Competitive antagonism of insect GABA receptors by iminopyridazine derivatives of GABA[J]. Bioorg Med Chem, 2012, 20(19): 5957–5964. doi:10.1016/j.bmc.2012.07.049 |
| [39] | JOHNSTON G A R. Muscimol as an ionotropic GABA receptor agonist[J]. Neurochem Res, 2014, 39(10): 1942–1947. doi:10.1007/s11064-014-1245-y |
| [40] | FRØLUND B, JENSEN L S, STORRUSTOVU S I, et al. 4-Aryl-5-(4-piperidyl)-3-isoxazolol GABAA antagonists: synthesis, pharmacology, and structure-activity relationships [J]. J Med Chem, 2007, 50(8): 1988–1992. doi:10.1021/jm070038n |
| [41] | KRALL J, JENSEN C H, SØRENSEN T E, et al. Exploring the orthosteric binding site of the γ-aminobutyric acid type A receptor using 4-(piperidin-4-yl)-1-hydroxypyrazoles 3- or 5-imidazolyl substituted: design, synthesis, and pharmacological evaluation [J]. J Med Chem, 2013, 56(16): 6536–6540. doi:10.1021/jm4006466 |
 2017, Vol. 19
2017, Vol. 19


