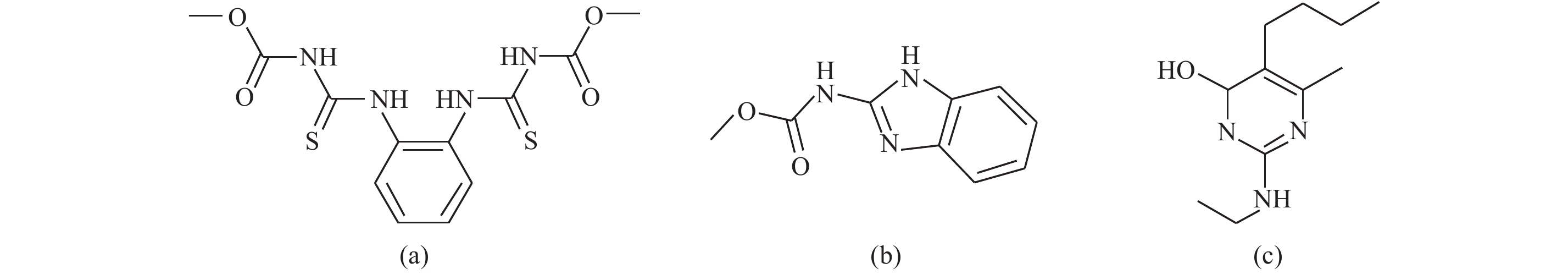
甲基硫菌灵 (图式 1) 是一种广谱性内吸杀菌剂,能防治多种作物病害[1],在草莓种植过程中应用广泛。多菌灵 (图式 1) 能有效抑制病原菌的繁殖、生长[2],同时也是甲基硫菌灵在环境中的转化产物,其残留期较长,容易在植物体内富集。乙嘧酚 (图式 1) 属于杂环类内吸性杀菌剂,对菌丝体有很强的杀灭效果,可有效抑制白粉病蔓延[3]。这些杀菌剂均常用于防治草莓上各种真菌病害[4-6],可能会在草莓中产生残留。根据GB2763—2014规定,多菌灵在草莓中的最大残留限量 (MRL值) 为0.5 mg/kg,甲基硫菌灵在苹果中的MRL值为3 mg/kg,在西瓜中的MRL值为2 mg/kg;乙嘧酚在黄瓜中的MRL值为1 mg/kg,但目前尚未制定甲基硫菌灵和乙嘧酚在草莓中的MRL值。
|
图式 1 甲基硫菌灵 (a)、多菌灵 (b) 及乙嘧酚 (c) 结构式 Scheme1 Structures of thiophanate-methy (a), carbendazim (b) and ethirimol (c) |
目前,关于草莓中的农药残留问题及相关检测方法主要有液相色谱法[7]、液相色谱-串联质谱法[8]、气相色谱法[9]、气相色谱-串联质谱法[10]等,在前处理过程中,常采用固相萃取柱[11]等方式进行净化,过程相对繁琐,且存在分析方法时间较长等问题[12–14]。QuEChERS方法具有简单、快速的优点,在农药残留检测中已得到广泛应用[15]。本研究采用QuEChERS方法对草莓样品进行处理,采用优化的溶剂提取、吸附剂净化后,利用超高效液相色谱-电喷雾串联质谱 (UPLC-MS/MS) 测定,建立了草莓中甲基硫菌灵、多菌灵及乙嘧酚残留同时检测的方法。
1 材料与方法 1.1 仪器ACQUITY超高效液相色谱仪 (美国Waters公司);3500三重四极杆质谱仪 (美国AB SCIEX公司);Milli-Q超纯水仪 (美国Millipore公司);Biofuge Stratos离心机 (美国Thermo Fisher Scientific公司);电子天平[感量0.000 1 g,梅特勒-托利多仪器 (上海) 有限公司];IKA VORTEX 3涡旋混合仪 (德国IKA公司);THZ-D台式恒温振荡器 (中国太仓市实验设备厂);JYL-A100料理机 (中国九阳股份有限公司)。
1.2 供试材料与试剂甲基硫菌灵 (thiophanate-methy, 99%)、多菌灵 (carbendazim, 98.8%) 和乙嘧酚 (ethirimol, 99%) 标准品 (德国Dr.Ehrenstorfer公司);乙腈 (色谱纯,德国Merck公司);硅胶吸附剂、石墨化碳黑吸附剂 (美国Agilent公司);甲酸 (色谱纯,美国Sigma-Aldrich公司);无水硫酸钠 (分析纯,中国国药集团化学试剂有限公司)。
草莓 Fragaria ananassa Duchesne 购自北京超市。
1.3 检测条件1.3.1 色谱条件 Agilent ZORBAX Eclipse XDB-C18色谱柱 (2.1 mm × 150 mm,3.5 μm);流动相:A为0.2%甲酸-水,B为乙腈;流速0.3 mL/min;柱温40 ℃;进样量3 μL。梯度洗脱程序列于 表1。
|
|
表 1 流动相梯度洗脱参数 Table 1 The gradient elution procedure of mobile phase |
1.3.2 质谱条件 电喷雾离子源,正离子扫描模式;离子喷雾电压5 500 V;离子源温度550 ℃。其他质谱信息见表2。
|
|
表 2 串联质谱多反应监测模式下甲基硫菌灵、多菌灵及乙嘧酚的分析参数 Table 2 LC-MS/MS parameters for the determination of thiophanate-methyl, carbendazim and ethirimol in the MRM mode |
1.4 样品前处理
将新鲜草莓样品去蒂后用料理机粉碎成浆状样品,准确称取10.0 g于50 mL具塞离心管中,加入10 mL 0.5%甲酸-乙腈,涡旋振荡1 min,加入3 g无水硫酸钠,涡旋1 min,置于摇床振荡提取15 min后,于8 000 r/min下离心5 min;取上清液1 mL,加入装有50 mg硅胶和5 mg石墨化碳黑吸附剂的1.5 mL Eppendorf管中,涡旋30 s,于10 000 r/min下离心3 min;取上清液,过0.22 μm滤膜,待测。
1.5 基质效应基质效应按公式 (1) 进行量化评估[15]:当|Mi| < 20%时,为弱基质效应,无需采取补偿措施,而中等程度基质效应20% ≤ | Mi| ≤ 50%或强基质效应|Mi| > 50%时,必须采取补偿措施。本研究中,分别使用乙腈和基质空白溶液将3种杀菌剂标准品稀释至0.2 mg/L 进行基质效应的量化评估。
|
${M_i} = \left( {\frac{\text{基质溶液中农药峰面积}}{\text{纯溶剂中农药峰面积}} - 1} \right) \times 100 {\%} $
|
(1) |
将甲基硫菌灵、多菌灵和乙嘧酚标准品分别用乙腈溶解,配成质量浓度为1 000 mg/L的标准储备液,再用乙腈稀释成10 mg/L的混合标准储备液,于 –18 ℃避光保存,有效期3个月。准确量取混合标准储备液适量,用乙腈稀释成20、50、200、500和1 000 μg/L系列混合标准溶液,现配现用。以各组分的质量浓度为横坐标,定量离子对响应的峰面积为纵坐标,绘制标准曲线。
1.7 添加回收试验向草莓空白样品中加入混合标准溶液,制备添加水平为50、200和500 μg/kg的添加回收样品,按所建立的方法进行测定。重复5次,计算添加平均回收率和相对标准偏差 (RSD)。
1.8 实际样品的检测采用本研究建立的方法,对某地区喷施甲基硫菌灵和乙嘧酚的草莓样品进行了甲基硫菌灵、多菌灵和乙嘧酚残留的测定。分别于施药后0、1、3、5、7、9及10 d采样,且每个间隔期的样品分别来自3个种植小区,以进行平行试验。于–80 ℃保存,待处理时缓慢解冻。
2 结果与讨论 2.1 提取溶剂的选择鉴于甲酸能提高目标物的离子化效率[16],本研究对比了乙腈[17]和0.5%甲酸-乙腈对甲基硫菌灵、多菌灵和乙嘧酚的提取效果。结果表明:在乙腈中加入体积分数为0.5%的甲酸,3种杀菌剂的回收率均有较大改善,平均回收率均超过85%。故选取0.5%甲酸-乙腈作为提取剂。其回收率见图1。

|
图 1 乙腈和0.5%甲酸-乙腈对甲基硫菌灵、多菌灵和乙嘧酚提取效果的影响 (添加水平:200 μg/kg) Fig. 1 The extraction efficiency by acetonitrile or 0.5% formic acid-acetonitrile (spiked level: 200 μg/kg) |
2.2 流动相的选择
选择乙腈-0.1%甲酸水、乙腈-0.2%甲酸水溶液作为流动相进行比较,发现后者对目标物峰型有一定改善,且目标物的响应值有一定的提高。因此,采用乙腈-0.2%甲酸水溶液作为流动相,典型色谱图见图2。

|
图 2 以乙腈-0.1%甲酸水 (A) 和乙腈-0.2%甲酸水 (B) 作为流动相的色谱图 (添加水平:500 μg/L) Fig. 2 The chromatogram with acetonitrile-0.1% formic acid or acetonitrile-0.2% formic acid as the mobile phase (spiked level: 500 μg/L) |
2.3 样品净化
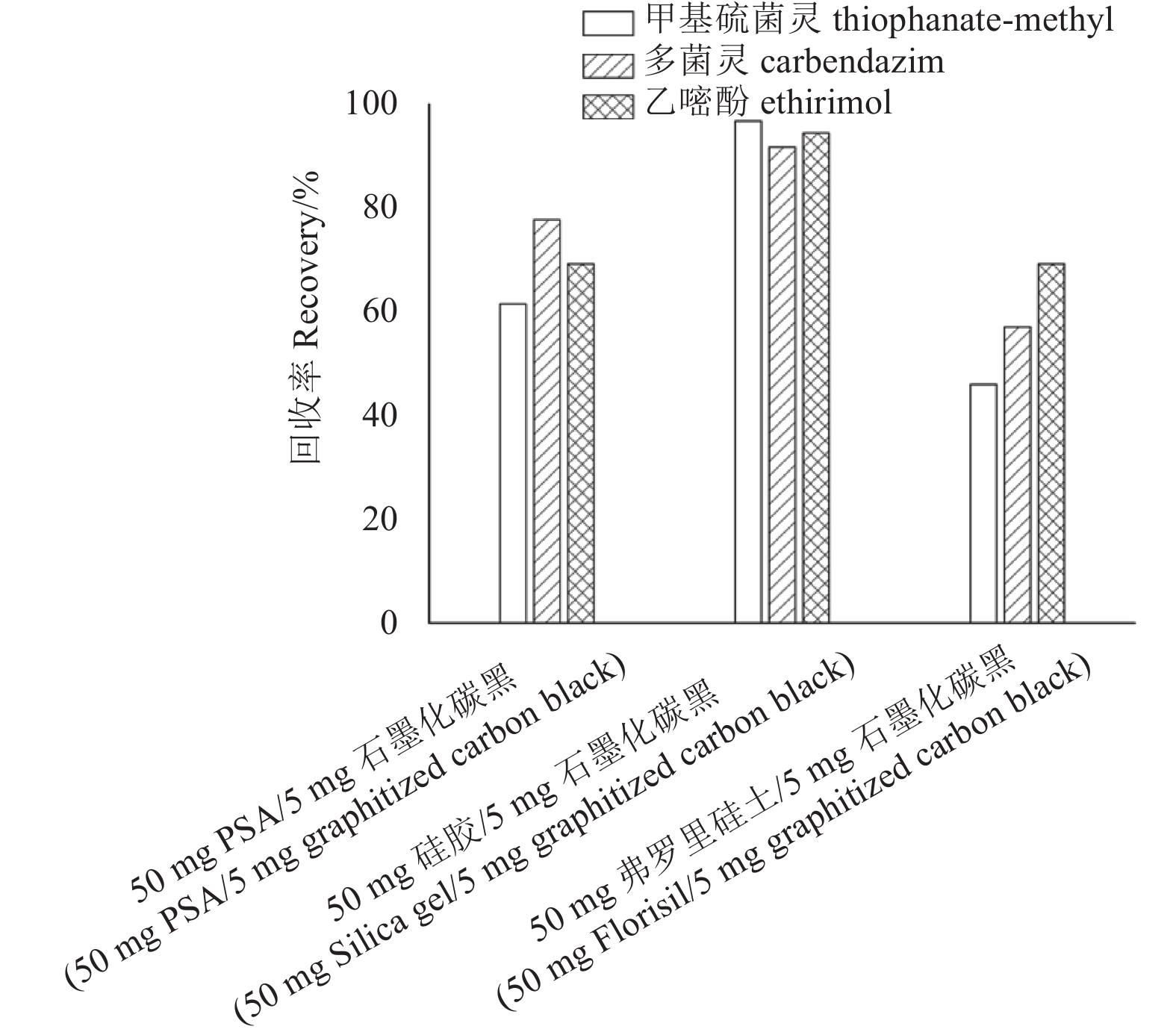
在200 μg/kg添加水平下,分别考察了50 mg PSA/5 mg石墨化碳黑[18]、50 mg弗罗里硅土/5 mg石墨化碳黑、50 mg硅胶/5 mg石墨化碳黑组合对样品净化效果的影响。结果 (图3) 表明:以硅胶/石墨化碳黑组合为净化剂时,回收率最高。因此,最终采用50 mg硅胶/5 mg石墨化碳黑组合进行样品净化处理。
|
图 3 不同吸附剂对3种杀菌剂净化效果的影响 (添加水平:200 μg/kg) Fig. 3 The purification effects on three targeted pesticides by three different adsorbents (spiked level: 200 μg/kg) |
2.4 基质效应的影响
结果表明:3种杀菌剂的Mi值分别为3.3%、8.1%和11.1%,均为弱基质效应,故本研究采取溶剂标准品进行定量分析。
2.5 方法的标准曲线、检出限及定量限结果表明:甲基硫菌灵、多菌灵及乙嘧酚的线性关系良好,相关系数 r > 0.997 8。其线性方程分别为:甲基硫菌灵 y=2 306.48x–63 144,r > 0.999 5;多菌灵 y=3 430.68x+205 313,r > 0.997 8;乙嘧酚 y=4 269.70x–16 235,r > 0.999 2。甲基硫菌灵、多菌灵及乙嘧酚的检出限分别为2.5、0.50和1.0 μg/kg,定量限均为50 μg/kg。
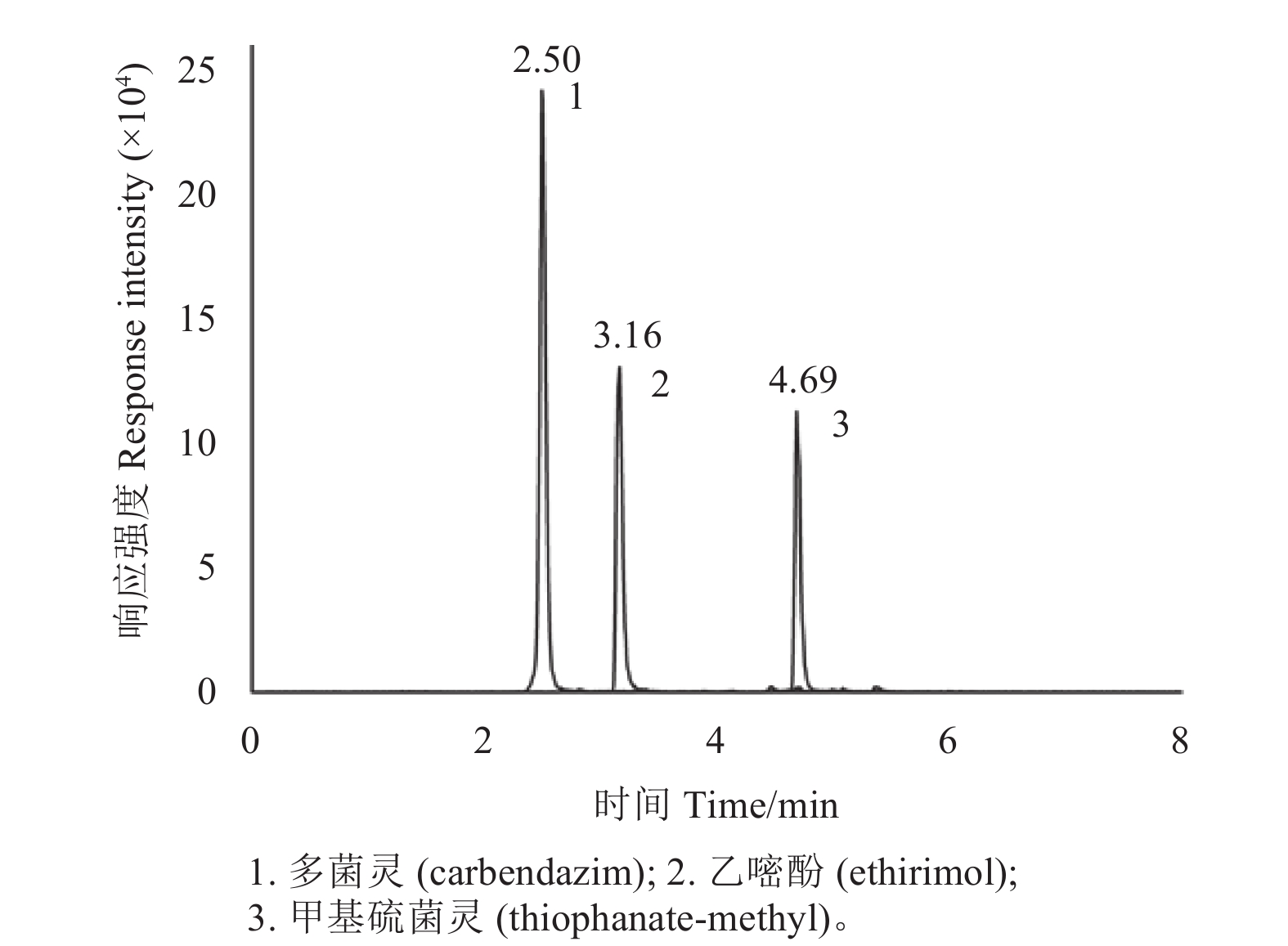
2.6 方法的准确度和精密度添加回收试验结果 (表3) 表明:在50、200和500 μg/kg添加水平下,甲基硫菌灵、多菌灵及乙嘧酚的平均回收率为86%~109%,相对标准偏差 (RSD) 在1.9%~13% (n=5) 之间,说明方法具有良好的准确度和精密度。其典型色谱图见图4。到多菌灵为甲基硫菌灵的代谢产物,故同时补充了只在草莓中添加甲基硫菌灵的添加回收试验来计算实际测得的多菌灵含量。结果表明:在50、200和500 μg/kg添加水平下,多菌灵含量仅在0.18%~1.04%之间,说明采用本方法进行样品处理及检测过程中甲基硫菌灵向多菌灵的转化率极低,因此在计算过程中分别按照实际添加水平计算回收率即可,不需进行相关折算。
|
|
表 3 甲基硫菌灵、多菌灵及乙嘧酚的添加回收率及相对标准偏差 Table 3 Recoveries and relative standard deviations of thiophanate-methyl, carbendazim and ethirimol |
|
图 4 草莓样品添加3种杀菌剂的典型色谱图 (添加水平:200 μg/kg) Fig. 4 The typical chromatogram of thiophanate-methyl, carbendazim and ethirimol in strawberry (spiked level: 200 μg/kg) |
2.7 实际样品检测
结果表明,未喷施甲基硫菌灵和乙嘧酚的样品均未检测到甲基硫菌灵、多菌灵及乙嘧酚;在喷施甲基硫菌灵和乙嘧酚的草莓样品中检测到甲基硫菌灵在1.01~3.57 μg/g之间,多菌灵在0.125~0.263μg/g之间,乙嘧酚在0.139~1.408 μg/g之间。值得注意的是,在未喷施多菌灵且对照样品不含多菌灵的情况下检测到多菌灵,说明其由甲基硫菌灵代谢产生。施药后,随着时间的延长均呈现出一定的降解趋势。
3 结论与讨论本研究采用0.5%甲酸-乙腈提取,QuEChERS方法净化,经UPLC-MS/MS测定,建立了同时检测草莓中甲基硫菌灵、多菌灵及乙嘧酚残留的方法。在20~1 000 μg/kg内,甲基硫菌灵、多菌灵及乙嘧酚线性关系良好,相关系数大于0.997 8,检出限分别为2.5、0.50和1.0 μg/kg,定量限均为50 μg/kg,可以满足定量分析的要求。3种杀菌剂的平均回收率为86%~109%,相对标准偏差在1.9%~13% (n=5) 之间,符合残留检测的要求。
与文献中报道的采用固相萃取小柱进行净化的方法[12-14]相比,本研究所采取的QuEChERS净化方法操作简便,检测成本低,在较短时间内即可实现对3种杀菌剂的有效提取、分离和检测。同时,该方法基质干扰小,总体方法可行,可为草莓中甲基硫菌灵、多菌灵及乙嘧酚残留的检测提供方法依据。
| [1] |
刘乾开, 朱国念. 新编农药使用手册[M]. 2版. 上海: 上海科学技术出版社, 1999: 243.
LIU Q K, ZHU G N. New handbook for pesticide use[M]. 2nd ed. Shanghai: Shanghai Scientific & Technical Publishers, 1999: 243. |
| [2] |
尹大川, 祁金玉, 邓玉侠, 等. 两种杀菌剂对立枯丝核菌(Rhizoctonia solani)生长的抑制作用机理
[J]. 沈阳农业大学学报, 2017, 48(1): 94–100.
YIN D C, QI J Y, DENG Y X, et al. Inhibiting mechanism of two fungicides on Rhizoctonia solani [J]. J Shenyang Agric Univ, 2017, 48(1): 94–100. |
| [3] |
宋双, 张鑫, 罗晶, 等. 不同杀菌剂对烟草白粉病菌的室内毒力及田间防效[J]. 西北农林科技大学学报 (自然科学版), 2014, 42(2): 131–135, 141.
SONG S, ZHANG X, LUO J, et al. Toxicity and field control efficiency of different fungicides against Erysiphe cichoracearum DC [J]. J Northwest A&F Univ (Nat Sci Ed), 2014, 42(2): 131–135, 141. |
| [4] |
寿林飞, 杨挺, 徐坚, 等. 液相色谱串联质谱法快速测定水果中5种苯并咪唑类杀菌剂[J]. 浙江农业科学, 2014(8): 1240–1243.
SHOU L F, YANG T, XU J, et al. Rapid determination of 5 kinds of benzimidazole fungicides by liquid chromatography-triple quadrupole tandem mass spectrometry in fruits[J]. J Zhejiang Agric Sci, 2014(8): 1240–1243. |
| [5] |
杨焕青, 王开运, 范昆, 等. 草莓枯萎病菌的生物学特性及7种杀菌剂对其抑制作用[J]. 植物保护学报, 2008, 35(2): 169–174.
YANG H Q, WANG K Y, FAN K, et al. Biological characteristics of strawberry Fusarium wilt and inhibitory effects of seven fungicides [J]. Acta Phytophylacica Sinica, 2008, 35(2): 169–174. |
| [6] |
于红梅, 赵密珍, 钱亚明, 等. 防治草莓枯萎病菌4种药剂的筛选试验[J]. 江苏农业科学, 2011, 39(6): 222–223.
YU H M, ZHAO M Z, QIAN Y M, et al. The screening test of 4 fungicides of strawberry blight[J]. Jiangsu Agric Sci, 2011, 39(6): 222–223. |
| [7] |
阮卓卿, 黎小鹏, 李拥军, 等. 高效液相色谱法测定草莓中7种氨基甲酸酯农药残留[J]. 现代农业科技, 2014(13): 141, 146.
RUAN Z Q, LI X P, LI Y J, et al. Determination of 7 carbamate pesticides residue in strawberry by high performance liquid chromatography[J]. Mod Agric Sci Technol, 2014(13): 141, 146. |
| [8] |
马琳, 黄兰淇, 陈建波, 等. 超高效液相色谱-串联质谱法测定草莓中19种农药残留量[J]. 分析测试学报, 2016, 35(6): 698–703.
MA L, HUANG L Q, CHEN J B, et al. Determination of 19 pesticides residues in strawberries by high performance liquid chromatography—tandem mass spectrometry[J]. J Instrum Anal, 2016, 35(6): 698–703. |
| [9] | KIN C M, HUAT T G. Headspace solid-phase microextraction for the evaluation of pesticide residue contents in cucumber and strawberry after washing treatment[J]. Food Chem, 2010, 123(2): 760–764. |
| [10] | YANG X, ZHANG H, LIU Y, et al. Multiresidue method for determination of 88 pesticides in berry fruits using solid-phase extraction and gas chromatography–mass spectrometry: determination of 88 pesticides in berries using SPE and GC-MS[J]. Food Chem, 2011, 127(2): 855–865. doi:10.1016/j.foodchem.2011.01.024 |
| [11] |
韩梅, 侯雪, 郭灵安. 气相色谱-串联质谱法测定葵花籽中28种农药残留[J]. 农药学学报, 2016, 18(1): 93–100.
HAN M, HOU X, GUO L A. Determination of 28 pesticide residues in sunflower seeds by gas chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2016, 18(1): 93–100. |
| [12] |
杨振华, 魏朝俊, 贾临芳, 等. SPE-GC法同时检测草莓中7种常用农药的残留[J]. 农业环境科学学报, 2012, 31(11): 2304–2308.
YANG Z H, WEI C J, JIA L F, et al. Simultaneous determination of the residue of seven commonly-used pesticides in strawberry with solid phase extraction and gas chromatography[J]. J Agro Environ Sci, 2012, 31(11): 2304–2308. |
| [13] |
翟硕莉, 张秀丰. 固相萃取-气相色谱法检测草莓中农药残留量[J]. 现代食品科技, 2013, 29(6): 1434–1436.
ZHAI S L, ZHANG X F. Determination of rganophosphorus pesticides in strawberry by GC-SPE[J]. Mod Food Sci Technol, 2013, 29(6): 1434–1436. |
| [14] |
刘谦, 颜红. 蔬菜、水果中的吡虫啉、多菌灵和5种氨基甲酸酯类农药残留测定[J]. 农药科学与管理, 2013, 34(2): 24–28.
LIU Q, YAN H. Determination of imidacloprid, carbendazim and 5 kinds of carbamate in fruits and vegetables by accelerated solvent extraction technology coupled with solid phase extraction and high performance liquid chromatography tandem mass spectrometry[J]. Pestic Sci Adm, 2013, 34(2): 24–28. |
| [15] |
汪传炳, 黄秀根, 樊晓青, 等. 微量叠加定量法校准蔬菜农药残留色谱分析中的基质效应[J]. 上海农业学报, 2013, 29(4): 36–41.
WANG C B, HUANG X G, FAN X Q, et al. Calibration of the matrix effects in vegetable pesticide residue gas chromatographic analysis by a quantitative micro addition method[J]. Acta Agric Shanghai, 2013, 29(4): 36–41. |
| [16] |
吴春梅, 程雪梅, 李亮, 等. QuEChERS-GPC-GC-MS快速测定蔬菜中24种农药残留[J]. 热带农业科学, 2012, 32(2): 52–56, 66.
WU C M, CHENG X M, LI L, et al. Quick determination of 24 pesticide residues in vegetables with QuEChERS-GPC-GC-MS[J]. Chin J Trop Agric, 2012, 32(2): 52–56, 66. |
| [17] |
彭芳, 雷美康, 徐佳文, 等. QuEChERS净化-超高效液相色谱-串联质谱法测定柑橘中7种保鲜剂的残留量[J]. 理化检验-化学分册, 2016, 52(9): 1007–1010.
PENG F, LEI M K, XU J W, et al. Determination of 7 preservatives in citrus by QuEChERS-UHPLC-MS/MS[J]. Phys Testing Chem Anal Part B (Chem Anal), 2016, 52(9): 1007–1010. doi:10.11973/lhjy-hx201609003 |
| [18] | FU Y, YANG T, ZHAO J, et al. Determination of eight pesticides in Lycium barbarum by LC-MS/MS and dietary risk assessment [J]. Food Chem, 2017, 218: 192–198. doi:10.1016/j.foodchem.2016.09.014 |
| [19] | FERREIRA J A, FERREIRA J M S, TALAMINI V, et al. Determination of pesticides in coconut (Cocos nucifera Linn.) water and pulp using modified QuEChERS and LC-MS/MS [J]. Food Chem, 2016, 213: 616–624. doi:10.1016/j.foodchem.2016.06.114 |
 2017, Vol. 19
2017, Vol. 19


