农业生产中常用植物生长调节剂以增强作物抗逆性,改善品质,增加产量[1-2]。矮壮素、氯吡脲、多效唑、烯效唑和丙环唑均具有控制植物徒长、抑制细胞伸长、促使植株矮化的效果[3-5]。调查发现,上述植物生长调节剂在蔬菜生产中具有明显改善叶菜品质的作用[6-8],在中国南方蔬菜特别是菜心、芥蓝等种植上应用普遍。
目前欧盟等国家对不同作物中的矮壮素、氯吡脲、多效唑、烯效唑和丙环唑残留量均做出了详细限定[9]。日本肯定列表中规定,矮壮素和丙环唑在菜心、芥蓝和小白菜上的最大允许残留限量 (MRL值) 均为0.05 mg/kg,氯吡脲、烯效唑和多效唑的MRL值分别为0.1、0.1和0.2 mg/kg[10]。而中国目前仅制定了这5种植物生长调节剂在部分作物上的MRL值[11],尚未制定其在叶类蔬菜中的MRL值。
目前,关于矮壮素、氯吡脲、多效唑、烯效唑和丙环唑的检测方法主要有液相色谱 (LC)[12-13]、液相色谱-质谱联用 (LC-MS)[14-15]和液相色谱-串联质谱 (LC-MS/MS)[16-26],但其在叶类蔬菜中残留的检测方法尚未见报道。由于叶类蔬菜的基质成分复杂,分离难度大,导致检测干扰大。UPLC-MS/MS法不仅可以减少基质干扰,分离度好,而且操作较简单,分析时间短,灵敏度高,定性定量准确,有利于提高检测效率,可用于大量样品的快速检测。鉴于此,本研究通过优化QuEChERS-UPLC-MS/MS法,建立了矮壮素、氯吡脲、多效唑、烯效唑和丙环唑5种植物调节剂在叶类蔬菜中残留的检测方法,以期为此类农药在叶类蔬菜中的规范使用及其质量安全监测提供分析方法方面的参考。
1 材料与方法 1.1 仪器与材料岛津8050三重四极杆质谱仪,配岛津LC-30AD超高效液相色谱仪 (日本SHMADZU公司),ESI电喷雾离子源;LabnetVX-200涡旋仪 (美国Labnet公司);高速离心机 (湖南湘仪实验室仪器开发有限公司);Milli Q超纯水系统 (美国Millipore公司)。
矮壮素 (chlormequat chloride)、氯吡脲 (forchlorfenuron)、多效唑 (paclobutrazol)、烯效唑 (uniconazole) 和丙环唑 (propiconazole),均为1 000 mg/L的标准品溶液 (农业部环境质量监督检验测试中心,天津),5种植物生长调节剂结构式见图式 1。
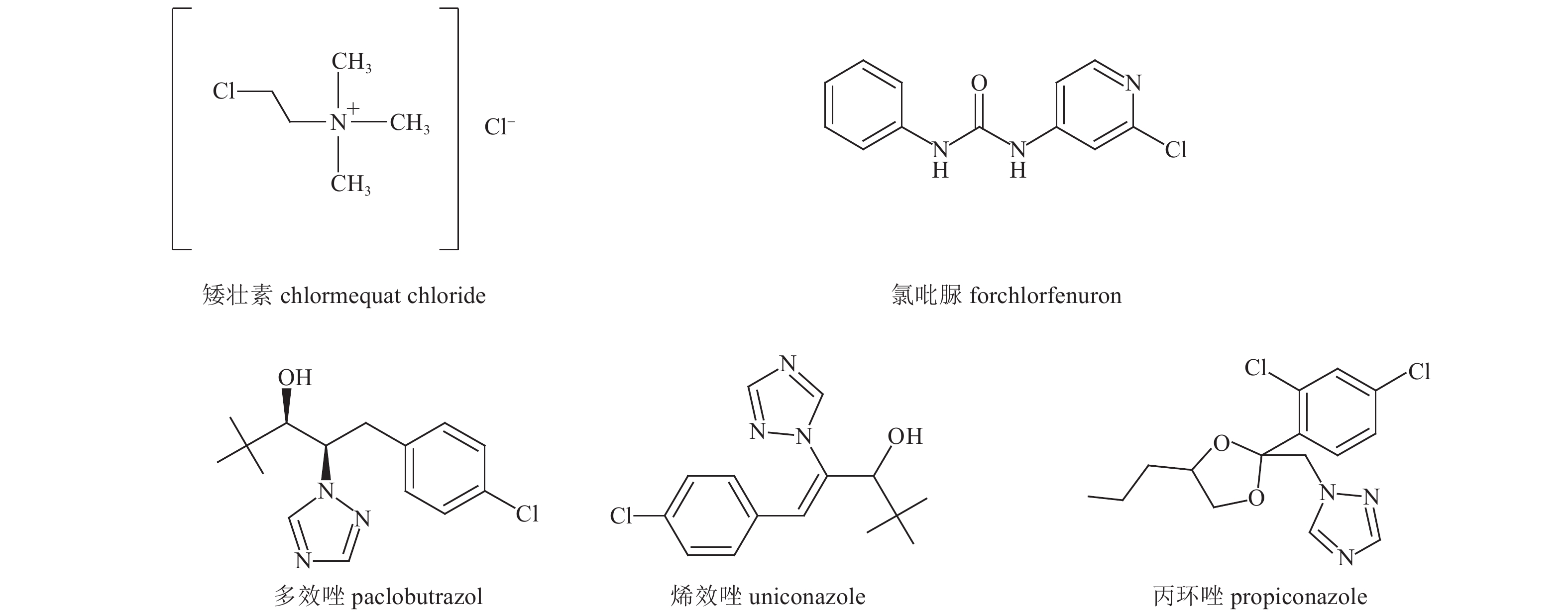
|
图式 1 5种植物生长调节剂的结构式 Scheme1 Structural formula of 5 plant growth regulators |
C18、Florisil净化剂、石墨化碳黑 (GCB)(天津博纳艾杰尔公司);N-丙基乙二胺 (PSA) 吸附剂 (美国Agilent公司);0.22 μm尼龙 66 微孔过滤膜 (天津津腾实验设备有限公司) ;乙腈、甲醇和甲酸均为色谱纯,乙酸、无水硫酸镁和无水醋酸钠均为分析纯。
供试菜心、芥蓝和普通白菜样品均为市场购买,去除枯黄叶片,经组织匀浆机匀浆,于 –20 ℃保存,备用。
1.2 样品前处理准确称取10 g (精确至0.01 g) 样品于50 mL离心管中,加入20 mL含体积分数为1%乙酸的乙腈溶液,加入4 g无水硫酸镁和1 g无水醋酸钠,涡旋振荡3 min,于4 500 r/min下离心5 min;取5 mL上清液于10 mL离心管 (内含100 mg PSA和50 mg GCB吸附剂) 中,涡旋混匀1 min,于4 500 r/min下离心5 min;取上清液,过0.22 μm滤膜,待测定。
1.3 UPLC-MS/MS检测条件色谱条件:Shim-pack XR-ODSⅢ C18色谱柱 (2.0 mm × 75 mm, 1.6 μm)。流动相A为超纯水,流动相B为乙腈;梯度洗脱程序:0~5 min,10%~95%B;5~7 min,95%B;7.1 min,10%B。流速0.4 mL/min。柱温40 ℃;进样量1 μL。
质谱条件:ESI离子源,正离子多反应监测模式 (MRM) 检测。雾化气流速3 L/min;加热气流速10 L/min;离子源接口温度300 ℃;脱溶剂温度250 ℃;加热块温度400 ℃;干燥气流速10 L/min。质谱参数见表1。
|
|
表 1 5种植物生长调节剂的质谱参数 Table 1 MS/MS parameters of 5 plant growth regulators |
1.4 标准溶液配制及标准曲线绘制
分别准确量取1mL氯吡脲、多效唑、烯效唑、丙环唑和矮壮素1 000 mg/L标准品溶液,用乙腈稀释,配制成100 mg/L的标准储备液,于–20 ℃保存。使用时根据试验需要,用乙腈稀释标准储备液,配成适当浓度的标准工作溶液。
将空白菜心、芥蓝、普通白菜按1.2节的方法处理,得到3种空白基质。用空白基质稀释标准储备液,配制成0.001、0.005、0.01、0.05、0.1、0.5和1.0 mg/L的系列基质匹配标准溶液,按1.3节的条件测定。以质量浓度为横坐标 (x),定量离子的峰面积为纵坐标 (y) 绘制标准曲线,并计算目标化合物的线性回归方程及决定系数 (R2)。
1.5 添加回收试验选用空白菜心、芥蓝和普通白菜样品进行添加回收试验,考察方法的准确度和精密度。5种植物生长调节剂的添加水平均为0.01、0.05和0.5 mg/kg,每个水平重复6次,采用1.2节的方法处理,按1.3节的条件测定,计算添加回收率和相对标准偏差。
2 结果与讨论 2.1 质谱条件优化矮壮素、氯吡脲、多效唑、烯效唑和丙环唑在进入一级质谱后,可产生稳定的[M+H]+离子,该离子即为5种待测物的母离子;在Product Scan模式下,对化合物母离子施加一定的碰撞能 (CE),母离子发生断裂或重排等反应产生不同的离子碎片,进入二级质谱;最后在MRM模式下,优化Q1、Q3电压及目标物离子碎片的碰撞能量。5种植物生长调节剂的二级离子质谱图见图1。

|
图 1 5种植物生长调剂的二级离子质谱图 Fig. 1 MS/MS spectra of 5 plant growth regulators |
2.2 色谱条件优化
试验对比了SHMADZU-GL Inertsil HILIC(2.1 mm × 150 mm, 3 μm)、Phenomenex HILIC(2.1 mm × 100 mm, 2.6 μm) 和Shim-pack XR-ODS III C18(2.0 mm × 75 mm, 1.6 μm) 色谱柱的分离效果。由于5种待测物的极性差异较大,极性相对较弱者在极性色谱柱上的保留较弱,其在SHMADZU-GL HILIC和Phenomenex HILIC柱上的保留时间均小于2 min,且 5种待测物在这两种柱上的重现性及峰形均较差。矮壮素虽然在Shim-pack XR-ODSⅢ C18色谱柱上保留时间小于1 min,但5种化合物在该柱上的重现性及峰形均可达到检测要求。因此最终选取Shim-pack XR-ODS IIIC18色谱柱分离待测物。
液相色谱-质谱分析中有机相通常使用乙腈和甲醇,水相通常使用甲酸水溶液和乙酸铵水溶液等[18]。通过试验对比发现,使用体积分数为0.1%的甲酸水溶液时,待测物的分离度及峰形均较好,因此选择流动相水相为体积分数为0.1%的甲酸水溶液,有机相为乙腈。
2.3 提取溶剂的选择根据待测5种生长调节剂的性质,以空白菜心为基质,对比了乙腈、含体积分数为1%乙酸的乙腈、体积分数为80%的乙腈水溶液、甲醇、含体积分数为1%乙酸的甲醇、体积分数为80%的甲醇水溶液的提取效果。结果 (图2) 显示:只有以含体积分数为1%乙酸的乙腈溶液为提取溶剂时,5种植物生长调节剂的回收率达到80%以上,满足农药定量分析要求[27]。
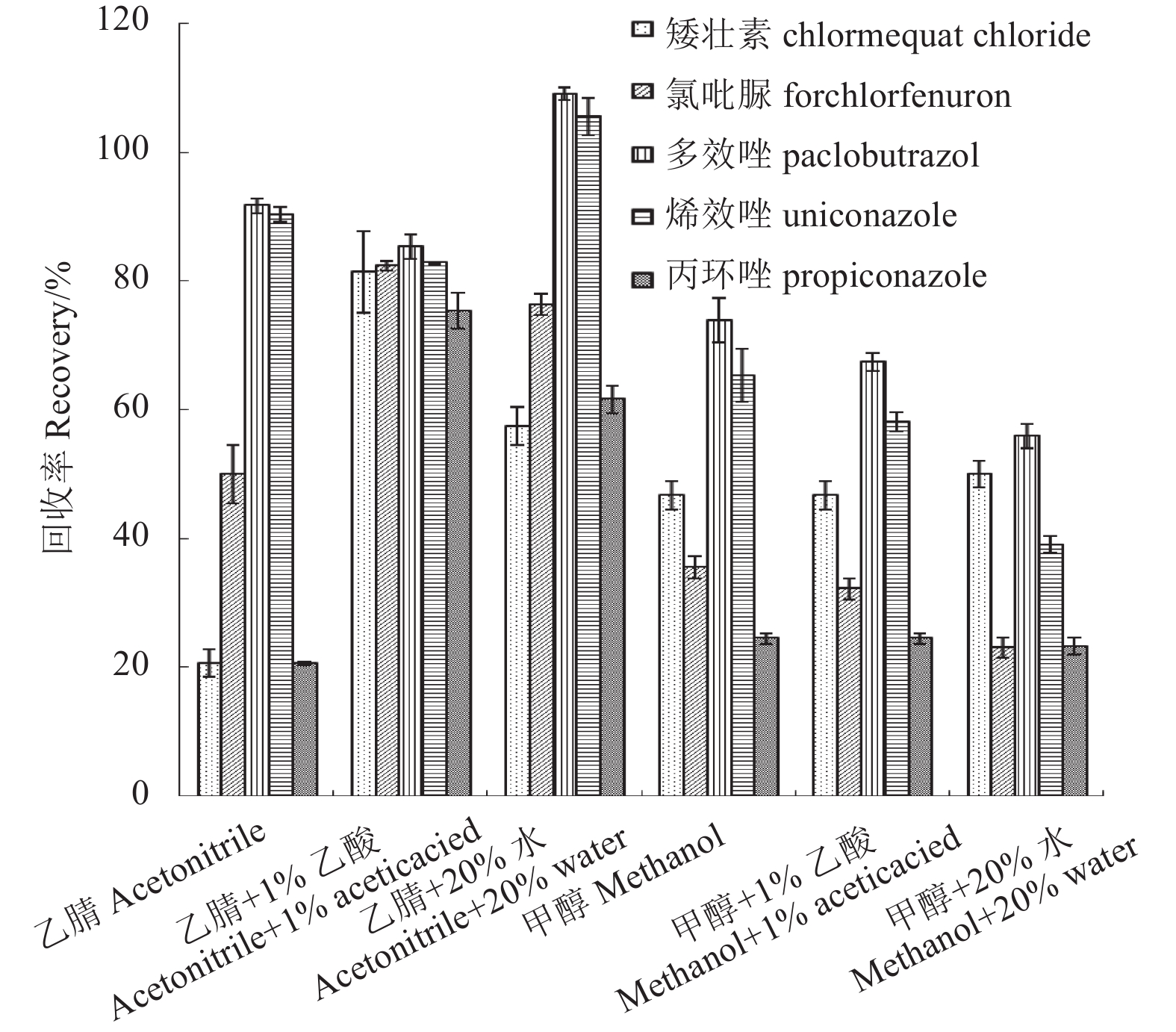
|
图 2 提取溶剂对5种植物生长调节剂回收率的影响 Fig. 2 Effect of extraction solvents on recoveries of 5 plant growth regulators |
2.4 吸附剂的优化
吸附剂的种类和组成是影响前处理效果的重要条件。以空白菜心为基质,对比了PSA、C18、GCB、Florisil和GCB+PSA的净化效果。结果 (图3) 显示:单一使用C18、PSA、GCB和Florisil吸附剂时,矮壮素的回收率均低于70%;使用GCB+PSA混合吸附剂时,5种植物生长调节剂的回收率均达到75%以上,满足农药定量分析的要求[27]。因此最终采用GCB+PSA混合吸附剂对样品进行净化处理。
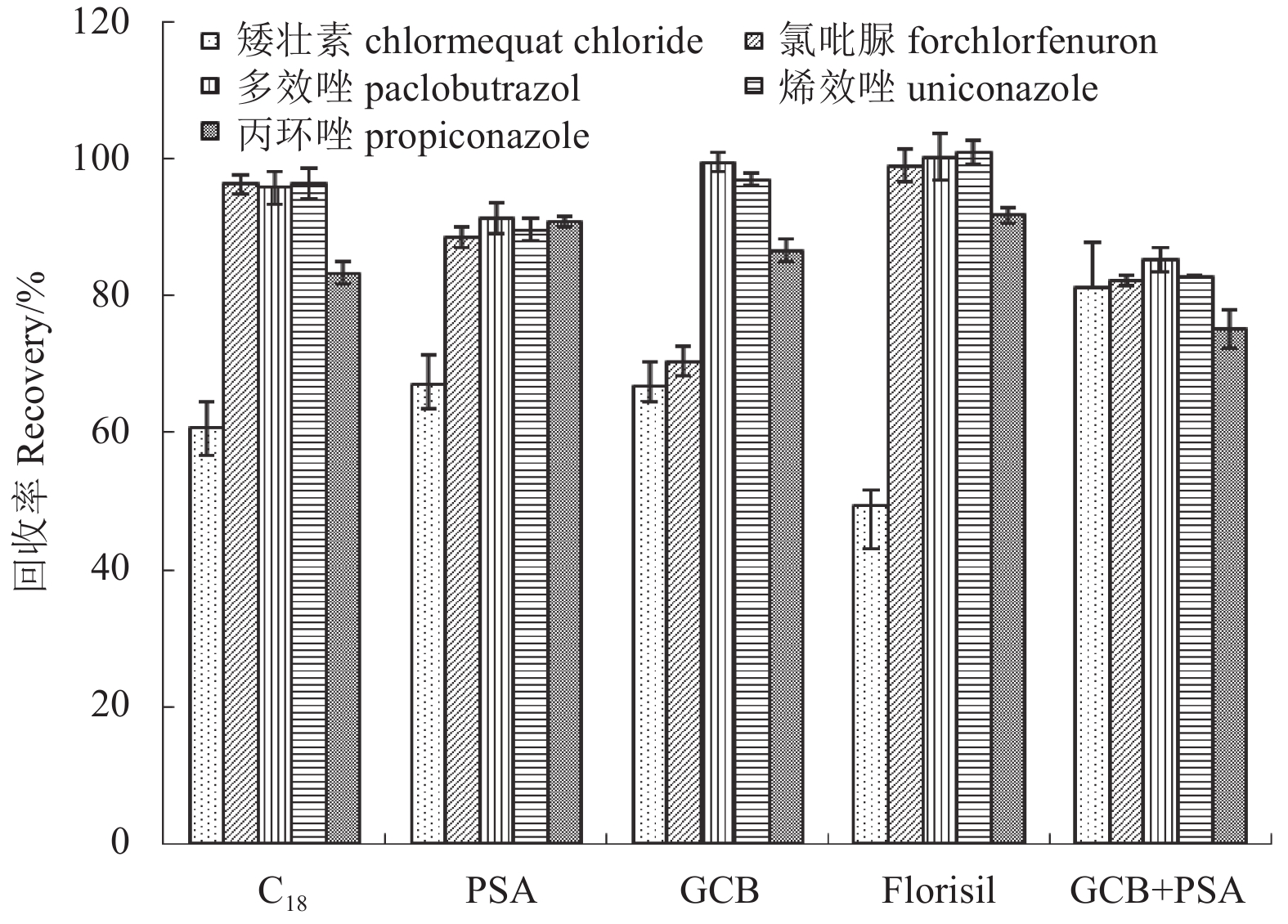
|
图 3 吸附剂对5种植物生长调节剂回收率的影响 Fig. 3 Effect of adsorbents on recoveries of 5 plant growth regulators |
2.5 方法的线性方程、检出限和定量限
结果 (表2) 表明:在1~1 000 μg/L范围内,供试5种植物生长调节剂在菜心、芥蓝和普通白菜3种基质中进样浓度与峰面积间线性关系良好,满足残留安全检测要求[27]。5种植物生长调节剂的定量限 (LOQ) 均为添加的最低浓度0.01 mg/kg。
|
|
表 2 5种植物生长调节剂的保留时间、线性方程和检出限 (n=6) Table 2 Retention time, linear relationships and LODs of 5 plant growth regulators (n=6) |
2.6 方法的准确度和精密度
结果 (表3) 表明:在0.01、0.1和0.5 mg/kg 添加水平下,供试5种植物生长调剂在菜心、芥蓝和普通白菜中的平均回收率为71%~93%,相对标准偏差 (RSD) 为0.2%~10%,方法准确度和精密度均符合残留分析要求[27]。典型色谱图见图4。
|
|
表 3 5种植物生长调节剂在3种叶类蔬菜中的添加回收率和相对标准偏差 (n=6) Table 3 Spiked recoveries and relative standard deviations (RSDs) of 5 plant growth regulators in 3 kinds of leafy vegetables (n=6) |
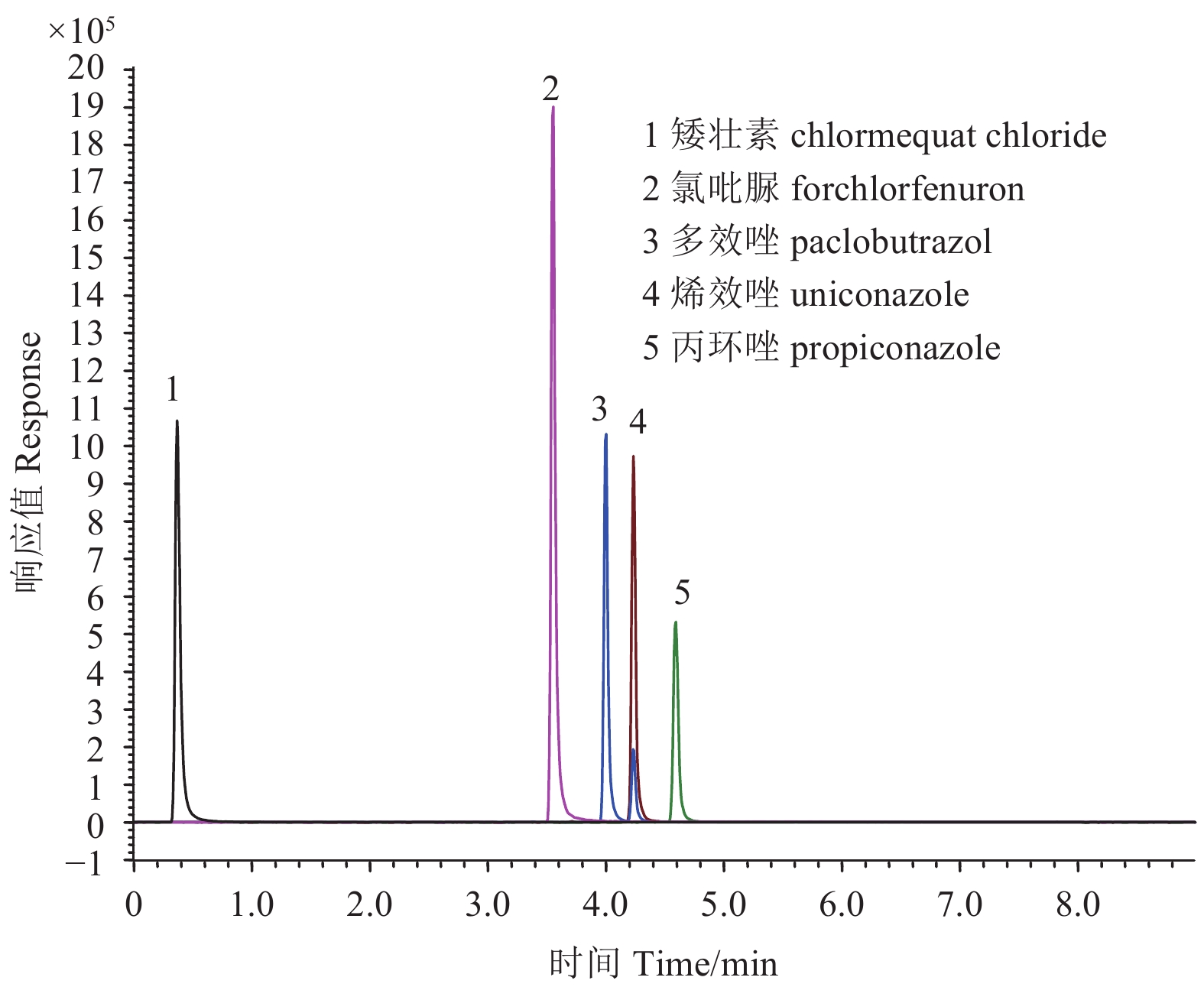
|
图 4 菜心中添加0.1 mg/kg 5种植物生长调节剂的谱图 Fig. 4 Chromatograms of 5 plant growth regulators in flowering chinese cabbage spiked with 0.1 mg/kg |
2.7 基质效应评价
本研究采用基质效应 = [(基质标准溶液响应 – 溶剂标准溶液响应值)/溶剂标准溶液响应值] × 100的方式评价了5种植物生长调节剂在供试叶类蔬菜中的基质效应,同时比较了按1.2节中的方法净化与提取液未经过净化直接检测的基质效应。结果 (表4) 表明:菜心、芥蓝和普通白菜3种叶类蔬菜提取液经过净化后,矮壮素、氯吡脲和丙环唑的基质效应降低较明显,为19%~84%,未净化时为31%~84%;多效唑和烯效唑经过净化后基质效应为1%~15%,未净化时为10%~20%,因此经过净化均可以消除部分基质效应的干扰。本研究中采用基质匹配标准溶液对数据进行校准,以消除基质效应的影响。
|
|
表 4 5种植物生长调节剂在3种叶类蔬菜中的基质效应 Table 4 Matrix effect of 5 plant growth regulators in 3 kinds of leafy vegetables |
3 小结
本研究通过优化色谱和质谱检测条件,优化样品提取和净化方法,建立了QuEChERS-UPLC-MS/MS同时测定叶类蔬菜中极性较强的矮壮素和极性较弱的氯吡脲、多效唑、烯效唑和丙环唑残留的方法。本方法解决了强极性化合物与极性相对较弱化合物同时检测时提取和净化中存在的问题,采用基质匹配标准溶液对数据进行校准,解决了叶类蔬菜检测时对串联质谱的基质效应。样品前处理较简单、灵敏度高,线性关系、准确度和精密度等均可满足残留检测要求,适用于叶类蔬菜中氯吡脲、多效唑、烯效唑、丙环唑和矮壮素等残留的同时检测分析,具备了较高的检测精度和检测通量。
| [1] |
林海丹, 谢守新, 吴思彦, 等. 广东地区果蔬中植物生长调节剂应用现状调查[J]. 广东农业科学, 2015, 42(12): 82–85.
LIN H D, XIE S X, WU S Y, et al. Investigation on application situation of plant growth regulators in fruits and vegetables in Guangdong[J]. Guangdong Agric Sci, 2015, 42(12): 82–85. doi:10.3969/j.issn.1004-874X.2015.12.017 |
| [2] |
仲伶俐, 胡莉, 郭灵安, 等. 固相萃取/超高效液相色谱-串联质谱测定水果中5种植物生长调节剂残留量[J]. 分析测试学报, 2016, 35(4): 466–470.
ZHONG L L, HU L, GUO L A, et al. Determination of 5 plant growth regulator residues in fruits by solid phase extraction and ultra high performance liquid chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2016, 35(4): 466–470. |
| [3] |
周艳明, 韩瑜, 田宏哲, 等. 高效液相色谱-质谱法对水果中矮壮素的检测[J]. 分析测试学报, 2009, 28(10): 1206–1209.
ZHOU Y M, HAN Y, TIAN H Z, et al. Determination of chlormequat residues in fruit by high performance liquid chromatography-mass spectrometry[J]. J Instrum Anal, 2009, 28(10): 1206–1209. doi:10.3969/j.issn.1004-4957.2009.10.021 |
| [4] |
陈锦永. 多效唑在桃中的残留与安全使用技术研究[D]. 北京: 中国农业科学院, 2012.
CHEN J Y. Research on residue of paclobutrazol in peach and its safe application[D]. Beijing: Chinese Academy of agricultural Sciences, 2012. |
| [5] |
闫震, 聂继云, 徐国峰, 等. 超高效液相色谱-串联质谱法检测水果中6种常用植物生长调节剂[J]. 园艺学报, 2016, 43(1): 175–182.
YAN Z, NIE J Y, XU G F, et al. Determination of six plant growth regulators in fruits by ultra performance liquid chromatograph–tandem mass spectromrtry[J]. Acta Horticulturae Sinica, 2016, 43(1): 175–182. |
| [6] |
杨锦华, 李进, 张雪峰, 等. 不同浓度矮壮素对夏季大白菜大苗栽培的影响[J]. 浙江农业科学, 2014, 1(4): 501–502.
YANG J H, LI J, ZHANG X F, et al. Different concentrations of CCC's impact on Chinese cabbage in summer[J]. J Zhejiang Agric Sci, 2014, 1(4): 501–502. |
| [7] |
王迪轩, 何咏梅. 矮壮素在蔬菜上的应用[J]. 蔬菜, 2001(2): 17.
WANG D X, HE Y M. Application of CCC in vegetables[J]. Vegetable, 2001(2): 17. |
| [8] |
项栋梁. 菜农用" 矮子药”只为迎合畸形择菜观[J]. 农村、农业、农民B, 2013(2): 36–37.
XIANG D L. Vegetable farm " dwarf medicine” to cater to the concept of deformity Zecai[J]. Country, Agriculture, Farmers B, 2013(2): 36–37. |
| [9] |
农药最大残留限量数据库[EB/OL]. [2017-08-01] http://202.127.42.84/tbt-sps/mrlsdb/mrlsdb.do.
The database of pesticide maximum residue limits[EB/OL]. [2017-08-01]. http://www.ffcr.or.jp/zaidan/FFCRHOME.nsf/pages/MRLs-p. |
| [10] | The Japanese Positive List System for Agricultural Chemical Residues in Foods. Maximum Residue Limits (MRLs) of Agricultural Chemicals in Foods[EB/OL]. [2016-08-18]. http://www.ffcr.or.jp/ zaidan/FFCRHOME.nsf/pages/MRLs-p. |
| [11] |
食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2016.
National food safety standard: Maximum residue limits for pesticides in food: GB 2763—2016[S]. Beijing: Standards Press of China, 2016. |
| [12] |
朱松, 袁晓晴, 戴军, 等. QuEChERS/HPLC/DAD法同时检测果蔬中多种植物激素残留[J]. 分析测试学报, 2017, 36(4): 513–518.
ZHU S, YUAN X Q, DAI J, et al. Simultaneous determination of different phytohormones residues in fruits and vegetables by QuEChERS/DAD/HPLC[J]. J Instrum Anal, 2017, 36(4): 513–518. |
| [13] |
仲伶俐, 雷绍荣, 郭灵安, 等. 固相萃取-高效液相色谱法同时测定水果中4种植物生长调节剂[J]. 分析试验室, 2016, 35(1): 51–55.
ZHONG L L, LEI S R, GUO L A, et al. Simultaneous determination of 4 plant growth regulators in fruits by high performance liquid chromatography with solid phase extraction[J]. Chin J Anal Lab, 2016, 35(1): 51–55. |
| [14] | GUO X L, JIA C H, ZHAO E C, et al. Dissipation and residues of chlormequat in wheat and soil[J]. Bull of Environ Contamin Toxicol, 2010, 84(2): 221–224. doi:10.1007/s00128-009-9920-4 |
| [15] | GUO X L, XU Y J, ZHANG F H, et al. Chlormequat residues and dissipation rates in cotton crops and soil[J]. Ecotoxicol Environ Safety, 2010, 73(4): 642–646. doi:10.1016/j.ecoenv.2009.12.024 |
| [16] | TIAN H Z. Uncertainty analysis of chlormequat residue in fruits by LC-MS-MS[J]. Chromatographia, 2011, 73(5-6): 457–462. doi:10.1007/s10337-011-1924-7 |
| [17] | MA L Y, ZHANG H Y, Xu W T, et al. Simultaneous determination of 15 plant growth regulators in bean sprout and tomato with liquid chromatography–triple quadrupole tandem mass spectrometry[J]. Food Anal Methods, 2013, 6(3): 941–951. doi:10.1007/s12161-012-9505-4 |
| [18] |
黄何何, 张缙, 徐敦明, 等. QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J]. 色谱, 2014, 32(7): 707–716.
HUANG H H, ZHANG J, XU D M, et al. Determination of 21 plant growth regulator residues in fruits by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Chromat, 2014, 32(7): 707–716. |
| [19] |
叶倩, 黄健祥, 骆冲, 等. QuEChERS-超高效液相色谱-串联质谱法快速测定3种叶菜中矮壮素和丙环唑残留[J]. 分析科学学报, 2017, 33(3): 342–346.
YE Q, HUANG J X, LUO C, et al. Fast Determination of chlormequat and propiconazole residues in three leafy vegetables by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J]. J Anal Sci, 2017, 33(3): 342–346. |
| [20] |
李娜, 郭藤, 刘学. 高效液相色谱-串联质谱法测定农产品中矮壮素残留量[J]. 理化检验 (化学分册), 2015, 51(3): 336–339.
LI N, GUO T, LIU X. HPLC-MS/MS determination of chlormequat in agricultural products[J]. Phys Test Chem Anal Part B: Chem Anal, 2015, 51(3): 336–339. |
| [21] | CARPINTEIRO I, RAMIL M, RODRÍGUEZ I, et al. Determination of fungicides in wine by mixed-mode solid phase extraction and liquid chromatography coupled to tandem mass spectrometry[J]. J Chromat A, 2010, 1217(48): 7484–7492. doi:10.1016/j.chroma.2010.09.080 |
| [22] | YANG A, ABD EL-ATY A M, PARK J H, et al. Analysis of 10 systemic pesticide residues in various baby foods using liquid chromatography–tandem mass spectrometry[J]. Biomed Chromat, 2014, 28(6): 735–741. doi:10.1002/bmc.3092 |
| [23] |
师君丽, 孔光辉, 逄涛, 等. 超高效液相色谱-电喷雾串联四极杆质谱法快速测定烟草中8种植物生长调节剂残留[J]. 分析科学学报, 2016, 32(4): 510–514.
SHI J L, KONG G H, PANG T, et al. Determination of plant growth regulator residues in tobacco by ultra performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. J Anal Sci, 2016, 32(4): 510–514. |
| [24] |
程盛华, 杨春亮, 曾绍东, 等. 分散固相萃取-超高效液相色谱-串质谱法测定豆芽中10种植物生长剂和杀菌剂[J]. 食品工业科技, 2016, 37(12): 53–59.
CHENG S H, YANG C L, ZENG S D, et al. Simultaneous determination of ten plant growth regulators and fungicides in bean sprouts using QuEChERS-UPLC-MS/MS[J]. Sci Technol Food Ind, 2016, 37(12): 53–59. |
| [25] |
张婧, 万慧慧, 张华. 基质分散固相萃取-高效液相色谱/串联质谱法检测红薯中氯吡脲[J]. 分析科学学报, 2017, 33(3): 387–390.
ZHANG J, WAN H H, ZHANG H. Detection of forchlorfenuron in batatas by matrix solid-phase dispersive extraction and high performance liquid chromatography-tandem mass spectrometry[J]. J Anal Sci, 2017, 33(3): 387–390. |
| [26] |
牟艳莉, 郭德华, 丁卓平, 等. 高效液相色谱-串联质谱法测定瓜果中11种植物生长调节剂的残留量[J]. 分析化学, 2013, 41(11): 1640–1646.
MOU Y L, GUO D H, DING Z P, et al. Determination of 11 kinds of plant growth regulator residues in fruits and melons by high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Anal Chem, 2013, 41(11): 1640–1646. |
| [27] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国标准出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
 2017, Vol. 19
2017, Vol. 19


