由禾谷丝核菌Rhizoctonia cerealis引起的小麦纹枯病是河南省小麦生产上的主要病害,发生面积在300万hm2以上,危害严重[1-2]。目前,河南省主要的小麦品种对纹枯病普遍抗性较差,大多数属于高感和感病品种,无免疫和高抗品种[3]。生产中对小麦纹枯病的防治主要是采用化学药剂通过秋季药剂拌种结合春季药剂喷雾来进行[4]。但由于同类杀菌剂的连续应用,病菌群体中已产生了对三唑酮、苯醚甲环唑、井冈霉素等常用杀菌剂敏感性下降的亚群体[5~7]。生产中需储备对小麦纹枯病菌抑制效果较好的杀菌剂。
咯菌腈 (fludioxonil) 是一种内吸活性较弱的苯基吡咯类杀菌剂,广泛应用于多种农作物种子包衣或拌种,以防治种子及土壤传播的真菌病害,现已被开发为种子处理剂、悬浮种衣剂等多种剂型[8]。咯菌腈不但对病菌具有较高的毒力,而且在田间连续施药及室内药剂驯化条件下均不易产生抗性,是植物病害防治的理想药剂[9-10]。咯菌腈对小麦纹枯病菌的菌丝生长也表现出良好的抑制活性,其EC50值为0.033 μg/mL[11]。咯菌腈拌种不仅对小麦纹枯病具有较高的防效,且能促进小麦增产,是理想的种子处理剂[12]。但上述研究结果选用的菌株较少,无法反映河南省小麦纹枯病菌群体对咯菌腈敏感性的情况,而河南省不同地市菌株对同一药剂的敏感性存在着很大的差异[13]。为了全面了解河南省不同地市菌株对药剂的敏感性水平,本研究采用菌丝生长速率法测定了2013年从河南省15个地市分离的98株病菌对咯菌腈的敏感性,建立了敏感性基线,分析了不同地区菌株对药剂的敏感性差异,以期根据各地菌株对药剂的敏感性水平指导生产中合理用药,为生产中小麦纹枯病的综合防治提供理论依据。
1 材料与方法 1.1 供试菌株从2013年分离自河南省15个地市的343株纹枯病菌中,每地市随机选取3~12株进行单菌丝顶端纯化,共98株用于试验。根据菌株培养性状及细胞核染色,鉴定所有菌株均为禾谷丝核菌Rhizoctonia cerealis[14]。
1.2 药剂及试剂97.9%咯菌腈 (fludioxonil) 原药和97%苯醚甲环唑 (difenoconazole) 原药由先正达 (中国) 投资有限公司生产;98%丙环唑 (propiconazole) 原药由江苏利民化工有限公司生产;97%戊唑醇 (tebuconazole) 原药由广西田园生化股份有限公司生产;62.5%井冈霉素 (jinggangmycin) 原药由浙江钱江生物化学股份有限公司生产。井冈霉素预溶于灭菌超纯水,其他杀菌剂预溶于丙酮或甲醇中,均配成104 μg/mL母液,于4 ℃冰箱中保存备用。蔗糖为分析纯,天津科密欧化学试剂有限公司;琼脂粉,生物技术级,合肥新恩源生物技术有限公司。
1.3 病原菌对咯菌腈的敏感性测定采用菌丝生长速率法[15]。将供试菌株在PSA平板上25 ℃培养3 d后,在菌落边缘打取直径5 mm的菌饼,参考咯菌腈抑制纹枯病菌菌丝生长的最低抑制浓度,将菌饼菌丝面朝下接入含0.01、0.02、0.03、0.05、0.1及0.3 μg/mL咯菌腈系列浓度的PSA平板上,每皿接种1个菌饼,每处理重复3次,以不含药剂的PSA平板为对照,25 ℃下培养5 d后,采用十字交叉法测量菌落直径 (mm),按照下式计算各浓度处理下药剂对菌丝生长的抑制率。
菌丝生长抑制率 = [(对照菌落直径平均值 – 处理菌落直径平均值)/(对照菌落直径平均值 – 菌饼直径) ]× 100%
利用Excel 2007和DPS 6.55软件插件中的“数量型数据机值分析”计算药剂抑制菌丝生长的毒力回归方程、相关系数和有效抑制中浓度 (EC50)。
1.4 敏感性分布图绘制及敏感性基线的确定参照文献[7]的方法进行。在小麦纹枯病菌对咯菌腈的敏感性范围内,以EC50值为依据,从最小值开始,以0.1 μg/mL为截距,将EC50值分为几个区间,统计每个区间的菌株数和频率,以每个区间的EC50中值为横坐标,菌株频率为纵坐标,制作小麦纹枯病菌对咯菌腈的敏感性频率分布图。根据敏感群体的EC50值分布建立小麦纹枯病菌对咯菌腈的敏感性基线。
1.5 不同地市菌株对咯菌腈敏感性差异的分析将咯菌腈对每个地级市菌株的EC50值分为一组,采用DPS 6.55软件插件中的最小显著差异法 (least significant difference, LSD) 对各地市菌株间的敏感性进行单因素差异显著性分析[6]。将98个菌株的平均EC50值设为1,各地区菌株均值与其比较,计算敏感性指数 (sensitive factor):如果指数小于1,则说明该地区菌株对咯菌腈的敏感性高于河南省平均水平;如果指数大于1,则说明该地区菌株对咯菌腈敏感性低于河南省平均水平。进一步从15个地市测定的菌株中,每地随机选择3株,共45株病菌,采用SPSS 20.0软件对咯菌腈抑制病菌菌丝生长的EC50值进行聚类分析[7]。
1.6 小麦纹枯病菌对咯菌腈的敏感性同其他杀菌剂敏感性相关性的比较选取对咯菌腈敏感性不同的10~30个菌株,在PSA平板上25 ℃培养3 d后,用打孔器在菌落边缘打取直径5 mm的菌饼,菌丝面朝下接入含系列浓度杀菌剂的PSA平板上。其中,苯醚甲环唑为0.025、0.05、0.1、0.5、2.5和5 μg/mL,戊唑醇为0.003、0.005、0.01、0.03、0.05和0.1 μg/mL,噻呋酰胺为0.031 25、0.062 5、0.125、0.25、0.5和1 μg/mL,丙环唑为0.025、0.05、0.1、0.5、2.5和5 μg/mL,井冈霉素为0.15、0.2、0.25、0.35、0.5和1 μg/mL。以不含药剂的平板为对照。试验及数据处理方法同1.4节。将咯菌腈对菌株的EC50值作为x轴,其他药剂对菌株的EC50值为y轴,进行线性回归分析,求出线性回归方程y = bx + a,根据决定系数 (R2)、b值及F检验的显著水平 (P值),分析咯菌腈与其他杀菌剂对纹枯病菌毒力之间的关系:P < 0.05,b值为正,且R2在0.8以上,说明两种药剂间存在正相关性;b值为负,且R2在0.8以上,说明两种药剂间存在负相关性。P > 0.05,说明两种药剂间无相关性[7]。
2 结果与分析 2.1 小麦纹枯病菌对咯菌腈的敏感性基线由供试98株小麦纹枯病菌对咯菌腈的敏感性频率分布图 (图1) 可以看出,98个菌株对咯菌腈的敏感性基本呈连续性分布,EC50值变化范围在0.009~0.079 μg/mL之间,最大值为最小值的8.78倍,平均EC50值为 (0.025 ± 0.012) μg/mL (表1)。且98个供试菌株的敏感性分布呈单峰曲线,田间没有发现敏感性下降的亚群体,因此将 (0.025 ± 0.012) μg/mL作为小麦纹枯病菌对咯菌腈的敏感性基线。
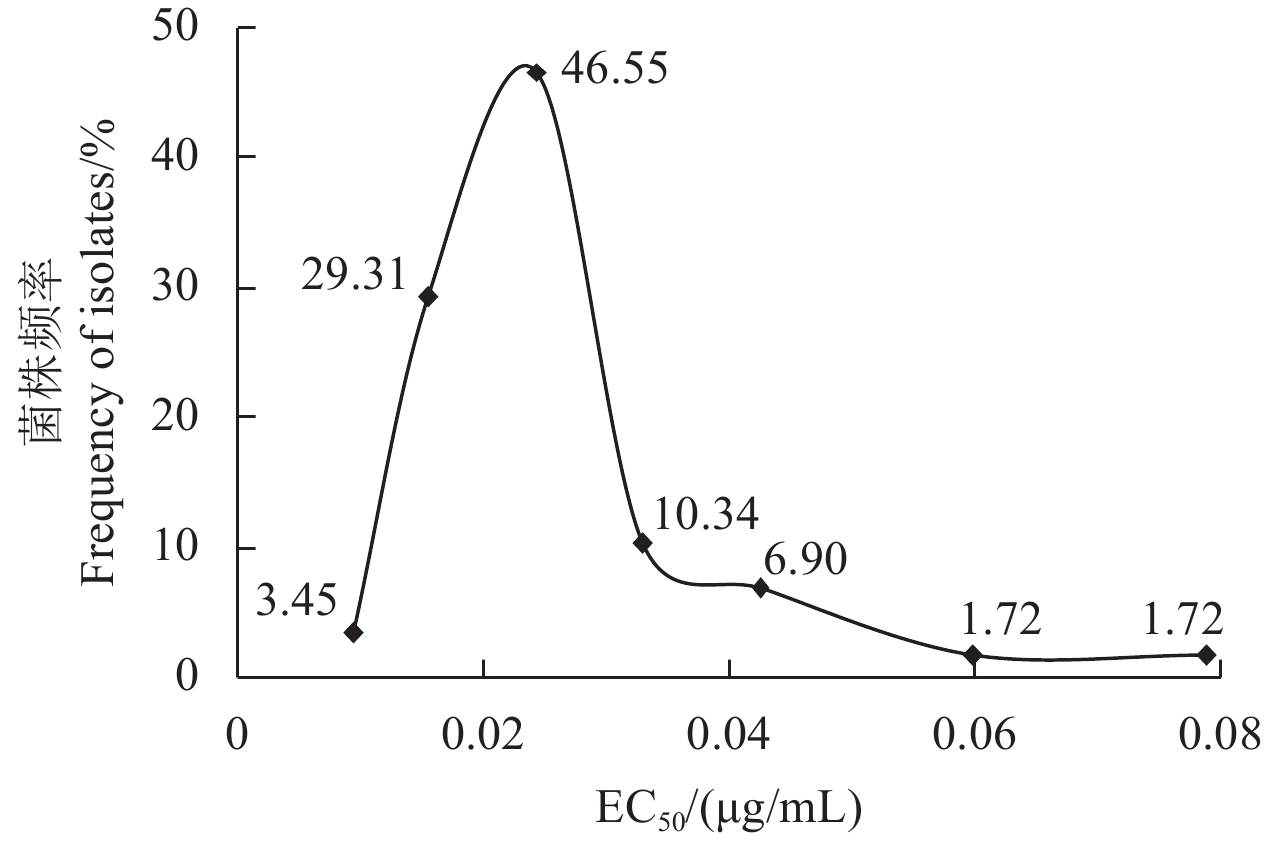
|
图 1 小麦纹枯病菌对咯菌腈的敏感性频率分布图 Fig. 1 Sensitive frequency distribution of EC50 values of Rhizoctonia cerealis populations to fludioxonil |
2.2 不同地区小麦纹枯病菌对咯菌腈的敏感性
由表1可以看出:同一地市内的菌株对咯菌腈的敏感性差异较大,最大的为平顶山菌株,EC50最大值和最小值比为4.1;驻马店和信阳菌株差异较小,EC50最大值和最小值之比不到1.1;其余大部分地区菌株比值在1.2~2.8之间。不同地区菌株间对咯菌腈敏感性差异不明显:咯菌腈EC50平均值变化范围在 (0.015 ± 0.004)~(0.060 ± 0.019) μg/mL之间,其中漯河菌株最敏感,许昌菌株最不敏感;其余地市菌株敏感性差异不显著。若以98个菌株的平均EC50值0.025 μg/mL对咯菌腈的敏感性指数设为1,各地区菌株均值与其比较,则漯河、郑州、濮阳、开封、鹤壁及洛阳6地菌株的敏感性指数低于河南省平均水平;而许昌、周口和信阳3地菌株高于河南省平均水平;其它6地菌株处于居中水平。
|
|
表 1 河南省不同地区小麦纹枯病菌对咯菌腈的敏感性比较 Table 1 Sensitivity (EC50 value) of Rhizoctonia cerealis to fludioxonil from different areas in Henan Province |
2.3 不同地市菌株对咯菌腈敏感性水平的系统聚类分析
采用SPSS软件聚类分析来源于不同地市的菌株EC50值。结果 (图2) 表明:咯菌腈对45个菌株的EC50值分在6个聚类组中;第一组有来源于11个县市的14个菌株,包括AY-14、ZX-10、KF-3、ZX-11、PH-5、SY-14、ZX-8、ND-1、XG-20、HB-7、XY-1、JZ-10、LL-2及XY-5;第二组有来源于4个县市的4个菌株,包括XC-14、ZK-13、ND-5、PB-15;第三组有来源于5个县市的5个菌株,包括AY-6、PB-4、ZK-11、JZ-14及SM-11;第四组有来源于5个县市的5个菌株,包括LL-1、PH-10、KF-2、PB-17、LH-15;第五组有来源于11个县市的15个菌株,包括KF-5、NS-8、LH-18、AY-10、YC-13、HB-3、ZK-4、JZ-12、HB-4、ZM-10、LH-20、ZM-3、SM-12、PH-12及ZM-2;第六组有来源于同一个县市的2个菌株,包括XC-8和XC-12。各地市的菌株均出现在不同的聚类组中,说明同一地市的菌株差异较大。第二、第三、第四及第六组包含的菌株数较少,而第一组与第五组包含的菌株数均在10个以上,涵盖了河南省的大部分区域。同一聚类组包含河南省大部分县市菌株,表明不同地区菌株对咯菌腈敏感性差异不明显,这与2.2节中LSD法的分析结果相对应,进一步说明了小麦纹枯病菌对咯菌腈的敏感性差异与菌株来源的地理位置无明显相关性。
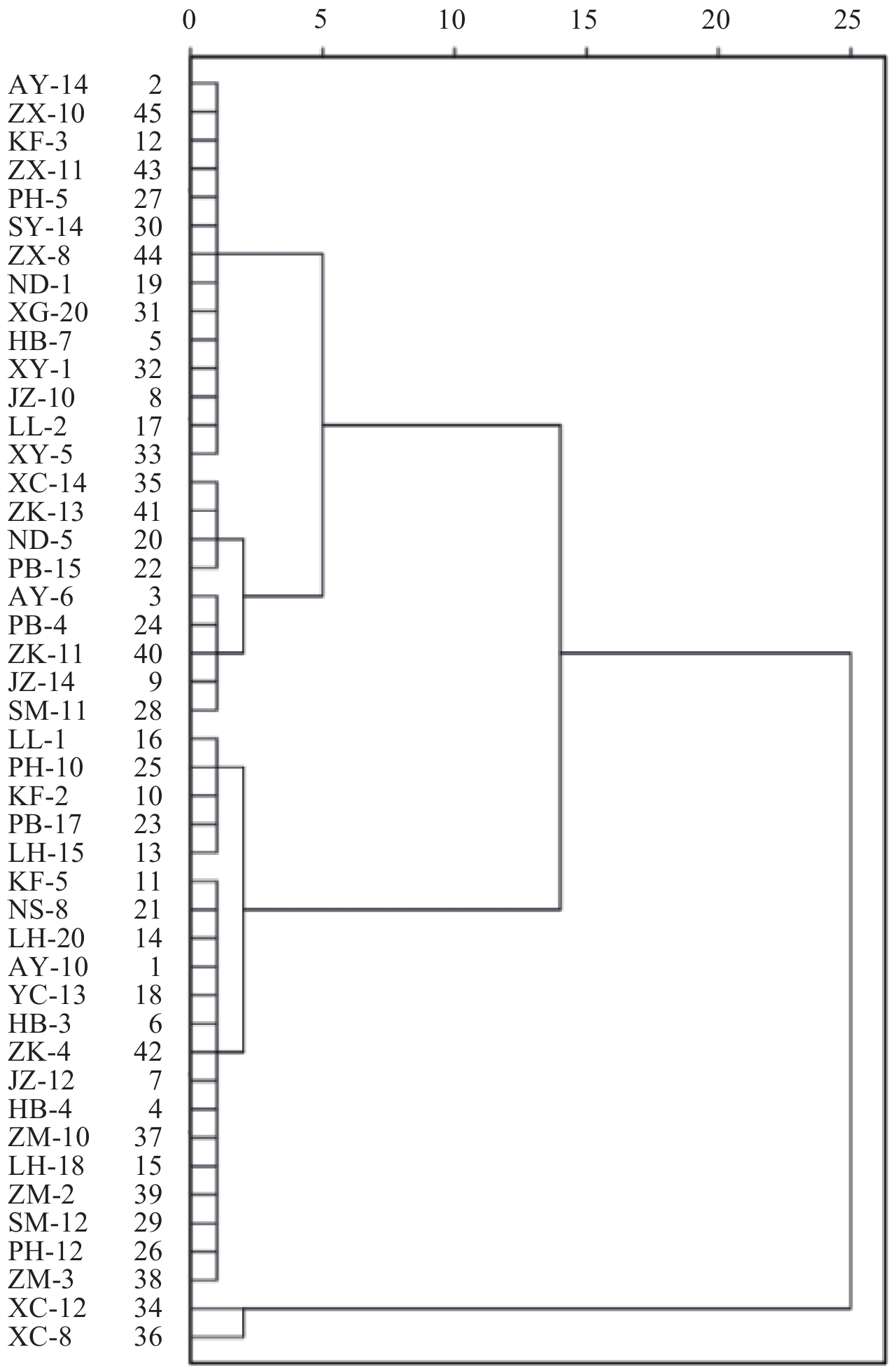
|
图 2 咯菌腈对小麦纹枯病菌EC50值的系统聚类分析 Fig. 2 Hierarchical cluster analysis on EC50 values of fludioxonil to Rhizoctonia cerealis |
2.4 小麦纹枯病菌对咯菌腈的敏感性与其他杀菌剂间的相关性
对EC50值进行的线性回归分析结果表明 (表2):病菌对咯菌腈与其对戊唑醇敏感性的F检验的显著水平 (P值) 大于0.05,说明小麦纹枯病菌对咯菌腈的敏感性与对戊唑醇间无相关性;尽管病菌对咯菌腈与其对苯醚甲环唑、噻呋酰胺、井冈霉素及丙环唑的敏感性F检验的显著水平 (P值) 均小于0.05,即在P = 0.05 水平上差异显著,且前3种药剂回归方程中b值为正,而丙环唑b值为负,但其决定系数 (R2) 均小于0.8,因此小麦纹枯病菌对咯菌腈的敏感性与以上5种药剂间也无明显相关性。
|
|
表 2 小麦纹枯病菌对咯菌腈与其他5种杀菌剂敏感性间的相关性 Table 2 Cross-resistance between fludioxonil and other five fungicides in Rhizoctonia cerealis |
3 小结与讨论
本研究采用菌丝生长速率法测定了2103年采自河南省15个地市98株小麦纹枯病菌对咯菌腈的敏感性。结果表明:咯菌腈对小麦纹枯病菌菌丝生长具有很高的抑制活性,敏感性基线为 (0.025 ± 0.012) μg/mL;同一地市内菌株对咯菌腈的敏感性存在一定差异,这可能同菌株本身的生理差异及群体组成多样性有关;除漯河及许昌两地菌株外,其余13个地市的菌株对咯菌腈差异均不太明显。由此说明:咯菌腈对河南省各地市小麦纹枯病菌均具有较高的毒力,且小麦纹枯病菌对咯菌腈与对其他5种药剂的敏感性间无明显的相关性,故可作为一种理想药剂应用于小麦纹枯病的化学防治。
祁之秋测定了1998、1999两年采自江苏省的50株小麦纹枯病菌对咯菌腈的敏感性,MIC值为0.060 μg/mL,敏感性基线为0.014 μg/mL[16]。Hamada等测定了2008、2009两年采自江苏、河南、安徽3省的89株小麦纹枯病菌对咯菌腈的敏感性,建立的敏感性基线为0.033 μg/mL[11]。孙炳剑等测定的咯菌腈对小麦纹枯病菌菌丝生长的EC50值为0.880 μg/mL[12]。王成凤测定了采自江苏省不同年份的20株小麦纹枯病菌对咯菌腈的敏感性,其EC50均值为0.022 μg/mL[17]。本研究结果同王成凤的相接近,大于祁之秋的结果,但却小于Hamada及孙炳剑等的结果。这可能是由于菌株地理来源、供试菌株数目、用药时间长短及用药剂型不同造成的:祁之秋测定的菌株距今已近20年,而且仅江苏一省;Hamada等所测菌株采集范围更广,包括了3个省份;而孙炳剑等仅测定了一个菌株,且用的是2.5%的咯菌腈悬浮种衣剂。
Hamada等在室内通过药剂驯化的方法试图诱导抗咯菌腈的禾谷丝核菌抗药性突变体,但未取得成功[11]。王成凤通过室内药剂驯化的方法获得了咯菌腈抗性突变体,这些诱变体与噻呋酰胺及戊唑醇均不存在交互抗性[17]。纪军建等在室内经紫外诱变获得了抗咯菌腈的番茄灰霉病菌菌株,抗药性突变体对氟啶胺、啶菌噁唑、啶酰菌胺及嘧霉胺均无交互抗性[18]。本研究结果则表明:小麦纹枯病菌对咯菌腈与其对噻呋酰胺、苯醚甲环唑、戊唑醇、丙环唑及井冈霉素5种药剂的敏感性间均无相关性。这些结果不但说明咯菌腈在田间应用时产生抗性的风险较低,而且为咯菌腈同其他药剂复配提供了理论依据。范子耀等将咯菌腈与苯醚甲环唑按质量比5 : 1进行复配,发现其具有明显的增效作用,增效系数达2.02,田间应用时不仅具有很高的防效,且具有增产作用 (显著高于同浓度单剂的防效及增产率)[19]。这为小麦纹枯病综合防控中咯菌腈与苯醚甲环唑等其他药剂的复配应用提供了参考。另外,为探索化学防治同生物防治相结合的方法。李山东等将枯草芽孢杆菌NJ-18同氟酰胺协同使用,在温室及大田条件下对小麦纹枯病的防效均显著高于二者相同剂量下单独使用的防效,且能显著提高小麦千粒重,同时对小麦生长安全[20]。该思路可借鉴用于咯菌腈对小麦纹枯病的综合防控中。
| [1] |
汪敏, 吕柏林, 邢小萍, 等. 河南省小麦纹枯病菌的群体组成及其致病力分化研究[J]. 植物病理学报, 2011, 41(5): 556–560.
WANG M, LV B L, XING X P, et al. Composition and virulence variation of the pathogen of wheat sharp eyespot from Henan Province[J]. Acta Phytopathologica Sinica, 2011, 41(5): 556–560. |
| [2] | HAMADA M S, YIN Y N, CHEN H G, et al. The escalating threat of Rhizoctonia cerealis, the causal agent of sharp eyespot in wheat [J]. Pest Manag Sci, 2011, 67(11): 1411–1419. doi:10.1002/ps.2236 |
| [3] |
李洪连, 袁红霞, 刁晓葛, 等. 河南小麦主要品种纹枯病抗性评价[J]. 河南农业大学学报, 1998, 32(2): 107–111.
LI H L, YUAN H X, DIAO X G, et al. Evaluation on the resistance of major wheat varieties in Henan Province to sharp eyespot[J]. Acta Agriculturae Universitatis Henanensis, 1998, 32(2): 107–111. |
| [4] | ZHOU M G, JIA X J. Wheat pathogens in China[M]//ISHII H, HOLLOMON D W. Fungicide resistance in plant pathogens: principles and a guide to practical management. Tokyo: Springer, 2015: 313-328. |
| [5] |
徐建强, 伍士郎, 赵建江, 等. 河南省小麦纹枯病菌对三唑酮的敏感性[J]. 植物病理学报, 2017, 47(1): 138–141.
XU J Q, WU S L, ZHAO J J, et al. Sensitivity of Rhizoctonia cerealis to triadimefon in Henan Province [J]. Acta Phytopathologica Sinica, 2017, 47(1): 138–141. |
| [6] |
徐建强, 刁兴旺, 李恒, 等. 中国河南省小麦纹枯病菌对苯醚甲环唑及戊唑醇的敏感性[J]. 农药学学报, 2016, 18(5): 582–588.
XU J Q, DIAO X W, LI H, et al. Sensitivity to difenoconazole and tebuconazole of Rhizoctonia cerealis in Henan Province in China [J]. Chin J Pestic Sci, 2016, 18(5): 582–588. |
| [7] |
徐建强, 平忠良, 党威, 等. 中国河南省小麦纹枯病菌对井冈霉素及甲基立枯磷的敏感性[J]. 农药学学报, 2017, 19(1): 25–31.
XU J Q, PING Z L, DANG W, et al. Sensitivity of Rhizoctonia cerealis to jinggangmycin and tolclofos-methyl in Henan Province in China [J]. Chin J Pestic Sci, 2017, 19(1): 25–31. |
| [8] |
中华人民共和国农业部农药检定所. 农药登记数据: 有效成分-咯菌腈[EB/OL]. 中国农药信息网[2017-05-16]. http://www.chinapesticide.gov.cn/hysj/index.jhtml.
Pesticide Examination Institute of the Ministry of Agriculture, the People’s Republic of China. Pesticide registration date, active ingredient, fludioxonil[EB/OL]. China Pesticide Information Network[2017-05-16]. http://www.chinapesticide.gov.cn/hysj/index.jhtml. |
| [9] |
刘颖超, 张金林, 庞民好, 等. 咯菌腈对草莓灰霉病Botrytis cinerea的毒力及防效研究初报
[J]. 农药学学报, 2002, 4(3): 94–96.
LIU Y C, ZHANG J L, PANG M H, et al. Effect of fludioxonil against Botrytis cinerea on strawberry [J]. Chin J Pestic Sci, 2002, 4(3): 94–96. |
| [10] |
纪军建, 王文桥, 张小风, 等. 连续施药及室内药剂驯化对番茄灰葡萄孢对咯菌腈敏感性的影响[J]. 农药学学报, 2012, 14(1): 35–41.
JI J J, WANG W Q, ZHANG X F, et al. Effect of continuous application and taming in vitro on sensitivity of Botrytis cinerea in tomato to fludioxonil [J]. Chin J Pestic Sci, 2012, 14(1): 35–41. |
| [11] | HAMADA M S, YIN Y N, MA Z H. Sensitivity to iprodione, difenoconazole and fludioxonil of Rhizoctonia cerealis isolates collected from wheat in China [J]. Crop Prot, 2011, 30(8): 1028–1033. doi:10.1016/j.cropro.2011.04.004 |
| [12] |
孙炳剑, 雷小天, 袁虹霞, 等. 小麦纹枯病化学防治药剂的筛选[J]. 麦类作物学报, 2007, 27(5): 914–918.
SUN B J, LEI X T, YUAN H X, et al. Screening of the fungicides for the chemical control of wheat sharp eyespot[J]. J Trit Crops, 2007, 27(5): 914–918. doi:10.7606/j.issn.1009-1041.2007.05.220 |
| [13] |
徐建强, 段晓欣, 赵一通, 等. 河南省小麦纹枯病菌及小麦全蚀病菌对丙环唑的敏感性[J]. 植物病理学报, 2017, 47(2): 278–281.
XU J Q, DUAN X X, ZAHO Y T, et al. Sensitivity of Rhizoctonia cerealis and Gaeumannomyces graminsis isolates from Henan Province to propiconazol [J]. Acta Phytopathologica Sinica, 2017, 47(2): 278–281. |
| [14] | BOEREMA G H, VERHOEVEN A A. Check-list for scientific names of common parasitic fungi. Series 2b: fungi on field crops: cereals and grasses[J]. Neth J Plant Pathol, 1977, 83(5): 165–204. doi:10.1007/BF01976647 |
| [15] |
慕立义. 植物化学保护研究方法[M].北京:中国农业出版社, 1994: 79-81.
MU L Y. Research methods of plant chemical protection[M]. Beijing: China Agriculture Press, 1994: 79-81. |
| [16] |
祁之秋. 小麦纹枯病菌对常用杀菌剂敏感性基线及化学防治原理研究[D]. 南京: 南京农业大学, 2001.
QI Z Q. Study on the sensitivity baseline of Rhizoctonia cerealis to modern fungicides and the principle of chemical control[D]. Nanjing: Nanjing Agricultural University, 2001. |
| [17] |
王成凤. 小麦纹枯病菌(Rhizoctonia cerealis)对噻呋酰胺和咯菌腈的抗性风险评估[D]. 南京: 南京农业大学, 2014.
WANG C F. Resistance and risk assessment of Rhizoctonia cerealis to thifluzamide and fludioxonil[D]. Nanjing: Nanjing Agricultural University, 2014. |
| [18] |
纪军建, 张小风, 王文桥. 番茄灰霉病菌对咯菌腈的抗性诱变及抗药突变体的生物学特性[J]. 农药学学报, 2012, 14(5): 497–502.
JI J J, ZHANG X F, WANG W Q. Induced mutation of Botrytis cinerea resistant to fludioxonil and biological characteristics of resistant mutants [J]. Chin J Pestic Sci, 2012, 14(5): 497–502. |
| [19] |
范子耀, 孟润杰, 马志强, 等. 咯菌腈与苯醚甲环唑等三种药剂复配对马铃薯早疫病菌(Alternaria solani)的联合毒力
[J]. 植物保护, 2012, 38(5): 184–188.
FAN Z Y, MENG R J, MA Z Q, et al. Joint toxicity of the mixtures of fludioxonil with coumoxystrobin, pyraclostrobin or difenoconazole against Alternaria solani [J]. Plant Protect, 2012, 38(5): 184–188. |
| [20] |
李山东, 于金凤, 彭迪, 等. 枯草芽孢杆菌NJ-18和氟酰胺联合拌种防治小麦纹枯病研究[J]. 农药学学报, 2013, 15(4): 427–433.
LI S D, YU J F, PENG D, et al. Co-utilization of Bacillus subtilis and flutolanil in controlling sharp eye spot of wheat by seed dressing [J]. Chin J Pestic Sci, 2013, 15(4): 427–433. |
 2017, Vol. 19
2017, Vol. 19


