桃蚜Myzus persicae (Sulzer)(Hemiptera: Aphididae) 属半翅目蚜科,主要为害油菜、甘蓝等十字花科蔬菜,桃、李等蔷薇科果树以及烟草等茄科作物,共可为害50科400多种植物[1],严重影响作物产量和质量。此外,其作为植物病毒传播的媒介,还可传播100多种植物病害[2]。目前对桃蚜仍主要以化学防治为主,并已发现其对有机磷类、氨基甲酸酯类及拟除虫菊酯类等多种杀虫剂产生了抗性[3-4]。因此,掌握桃蚜的抗性水平,对于合理选择杀虫剂进行有效防治具有重要的参考价值。
目前检测害虫对杀虫剂敏感性变化 (抗性水平) 的常用方法有生物测定、生化检测和分子检测等[5]。其中,传统的室内测定桃蚜对杀虫剂抗性水平的方法主要是浸叶法[6]。该方法虽然测定结果准确,但存在操作复杂、所需试虫数量大、费时费工等缺点,不适用于田间桃蚜抗性水平的快速检测。因此,为及时掌握田间桃蚜对杀虫剂的抗性水平,有必要开发简便的抗性水平快速检测方法。玻璃管药膜法是近年兴起的一种新型快速生物测定方法,适用于昆虫尤其是个体较小昆虫,如蚜虫、烟粉虱、绿盲蝽等以及二化螟的抗性水平检测[7-9],具有操作简便、快速等优点。此外,基于玻璃管药膜法建立的杀虫剂区分剂量,也可用于开发可快速测定昆虫对杀虫剂敏感性变化及抗性水平的选药试剂盒。
新烟碱类杀虫剂作为昆虫神经突触后膜上烟碱型乙酰胆碱受体的激动剂,是防治桃蚜、棉蚜、飞虱等害虫的主要药剂[10]。然而在长期的药剂选择压力下,一些地区的桃蚜田间种群已对该类杀虫剂产生了抗药性。1996年,Devine等比较了7个国家的桃蚜种群对新烟碱类杀虫剂的敏感性,发现桃蚜已对吡虫啉产生低水平抗性[11]。2011年,宫亚军等发现采自中国北京市门头沟、通州和延庆地区的3个桃蚜种群对吡虫啉已处于中等抗性水平[12]。2016年,Li等发现重庆市奉节和武隆地区桃蚜种群对吡虫啉已产生中等水平抗性[13];王利平等检测到山东省临沂地区桃蚜种群对吡虫啉处于中等抗性水平,而泰安、济南及烟台地区桃蚜种群处于低及以下抗性水平,同时泰安和临沂田间桃蚜种群对啶虫脒均处于中等抗性水平[14]。
氟啶虫胺腈 (sulfoxaflor) 是美国陶氏益农公司研制的砜亚胺类杀虫剂,作用于烟碱型乙酰胆碱受体 (nAChR) 内独特的结合位点,可有效防治蚜虫、烟粉虱及蝽类等刺吸式口器害虫[15-16]。王泽华等[17]的研究表明,亚致死浓度的氟啶虫胺腈可降低F0及F1代桃蚜成蚜的寿命和繁殖力;室内毒力测定及田间药效评价发现,22%氟啶虫胺腈悬浮剂 (SC) 可有效防治桃蚜[18]。随着氟啶虫胺腈的广泛应用,掌握桃蚜对其敏感性变化,对于桃蚜的科学防治十分有益。
为实现快速检测田间桃蚜种群对部分新烟碱类杀虫剂及氟啶虫胺腈的抗性水平,指导田间科学合理用药,笔者通过玻璃管药膜法,确立了桃蚜对5种新烟碱类药剂及氟啶虫胺腈的敏感性区分剂量,采用所确定的区分剂量,测定了桃蚜田间种群对6种杀虫剂的抗性水平,并与浸叶法测得的抗性水平进行了相关性分析,对采用区分剂量测定桃蚜抗性水平的准确性进行了验证,从而建立了基于区分剂量快速检测田间桃蚜种群对5种新烟碱类杀虫药剂及氟啶虫胺腈抗性水平的玻璃管药膜法。
1 材料与方法 1.1 供试昆虫室内敏感品系桃蚜 (SN):在不接触任何药剂的条件下,室内多代连续饲养多年。
河南驻马店田间桃蚜种群 (ZM):于2016年4月采于河南省驻马店地区白菜上;河北玉田甘蓝桃蚜种群 (GL) 及桃树桃蚜种群 (TS):于2016年6月分别采于河北省玉田县甘蓝和桃树上;江苏南京桃蚜种群 (NJ):于2015年6月采自江苏省南京市南京农业科学院附近油菜上。
试虫采用萝卜苗蛭石法[4]饲喂繁殖,并加以改进。养虫笼由0.15 mm孔径 (100目) 的尼龙网制成,将桃蚜接种至播种后4~5 d、株高约4 cm的萝卜苗上,在恒温气候室内饲养,饲养条件:(23+1) ℃,相对湿度60% + 5%,光照周期16 h : 8 h (L : D)。
1.2 供试药剂及试剂95.3%吡虫啉 (imidacloprid) 原药,德国拜耳公司;98.2%啶虫脒 (acetamiprid) 原药,江苏长隆化工有限公司;95%噻虫胺 (clothianidin) 原药,山东京蓬生物药业股份有限公司;98%噻虫嗪 (thiamethoxam) 原药,江苏绿叶农化有限公司;96.5%烯啶虫胺 (nitenpyram) 原药,江西天人生态工业有限公司;97.9%氟啶虫胺腈 (sulfoxaflor) 原药,美国陶氏益农公司。
曲拉通 (Triton X-100) 购自Sigma公司;丙酮购自国药集团公司。
1.3 杀虫剂对桃蚜的毒力测定1.3.1 叶片药膜法 采用Moores等[19]的方法,并加以改进。原药用丙酮配制成母液,再用含有体积分数为0.05% Triton X-100的蒸馏水稀释成系列梯度浓度,同时以仅含有0.05% Triton X-100的蒸馏水作为对照。取新鲜洁净的甘蓝叶片,打取直径2 cm的叶碟,在药液中浸渍15 s后置阴凉通风处晾干,置于底层铺有1 mL质量体积分数为 2%琼脂的12孔培养板中。小心接入无翅成蚜,每叶碟接20头,每浓度设3次重复。每种药剂至少测定5个有效浓度。用宣纸封住孔口,以防试虫逃逸。将培养板置于 (25 ± 1) ℃、光照良好的恒温室内,24 h后检查死亡虫数。以毛笔尖轻触桃蚜,5条足以上不动者视为死亡。
1.3.2 玻璃管药膜法 各供试原药先用丙酮配制成一定浓度的母液,再按等比或等差用丙酮稀释成所需浓度梯度。分别吸取250 μL药液加入到直径1.8 cm、高9 cm的玻璃管中,并使药液均匀覆盖玻璃管内壁,待丙酮挥发干后进行测定。每种药剂设6~7个浓度,每浓度3次重复,以丙酮为对照。每管接入20头健康一致的无翅成蚜,于室内正常条件下饲养,3 h后检查死亡率。以对照死亡率小于10%为有效测定,并用对照死亡率进行校正。
1.4 区分剂量的确定根据玻璃管药膜法测得的杀虫剂对室内敏感品系桃蚜的毒力回归方程,计算得LC90值,作为理论区分剂量。在此基础上,进一步测定室内敏感品系桃蚜在理论区分剂量下的实际死亡率,以验证室内敏感品系对区分剂量的敏感性。最后将可导致室内敏感品系死亡率在90%左右时的剂量作为杀虫剂的区分剂量。
1.5 区分剂量方法的准确性验证分别用区分剂量的6种杀虫剂处理桃蚜室内敏感品系以及采自河南驻马店、河北玉田甘蓝及桃树的3个田间桃蚜种群,考察不同种群试虫的死亡率,分析其对杀虫剂的抗性水平,并与浸叶法测得的抗性水平进行比较,分析两种方法测定结果的相关性,以验证用区分剂量测定桃蚜田间种群对6种杀虫剂抗性水平的准确性。
1.6 数据分析用Polo plus系统软件进行分析,得出LC50和LC90值、95%置信区间、卡方值 (χ2) 等。采用Excel软件 (Microsoft Co.) 分析区分剂量下死亡率与抗性水平的相关性,得到相关性方程及相关系数。
2 结果与分析 2.1 桃蚜对6种杀虫剂敏感性的区分剂量结果表明,吡虫啉、啶虫脒、噻虫嗪、噻虫胺、烯啶虫胺及氟啶虫胺腈6种药剂对桃蚜室内敏感品系的LC90值分别为150.01、1 170.81、54.19、951.34、245.98及133.60 ng/cm2 (表1)。采用上述LC90剂量的6种杀虫剂分别处理室内敏感品系桃蚜,发现试虫死亡率介于81%~96%之间 (表2),说明室内敏感品系桃蚜对LC90剂量的6种杀虫剂敏感性较高,因此,可将6种杀虫剂的LC90值作为区分剂量,用于考察田间桃蚜种群的敏感性变化。
|
|
表 1 玻璃管药膜法测定的6种杀虫剂对桃蚜室内敏感品系的毒力* Table 1 The toxicity of six insecticides to M. persicae susceptible strain (SN) tested by the method of residual film in glass tube* |
2.2 采用区分剂量快速测定的桃蚜田间种群抗性水平及方法的准确性
结果 (表2) 表明:用吡虫啉区分剂量150.01 ng/cm2分别处理河南驻马店、河北玉田甘蓝及桃树的桃蚜田间种群,3 h后,3个种群的死亡率分别是93%、58%及6%,表明不同种群桃蚜对吡虫啉的敏感性不同,其排序为:河南驻马店种群 > 河北玉田甘蓝种群 > 河北玉田桃树种群;而浸叶法测得吡虫啉对上述3个田间种群桃蚜的LC50值依次为156.1、321.5及998.7 mg/L;两种方法得到的3个种群对吡虫啉的敏感性变化趋势一致。因此,可采用区分剂量快速测定桃蚜田间种群对吡虫啉的敏感性变化。类似地,通过区分剂量和浸叶法测定的3个桃蚜田间种群对其他5种杀虫剂的敏感性变化趋势也一致 (表2),表明可通过考察区分剂量下桃蚜田间种群的死亡率,快速掌握桃蚜田间种群对杀虫剂的敏感性变化。
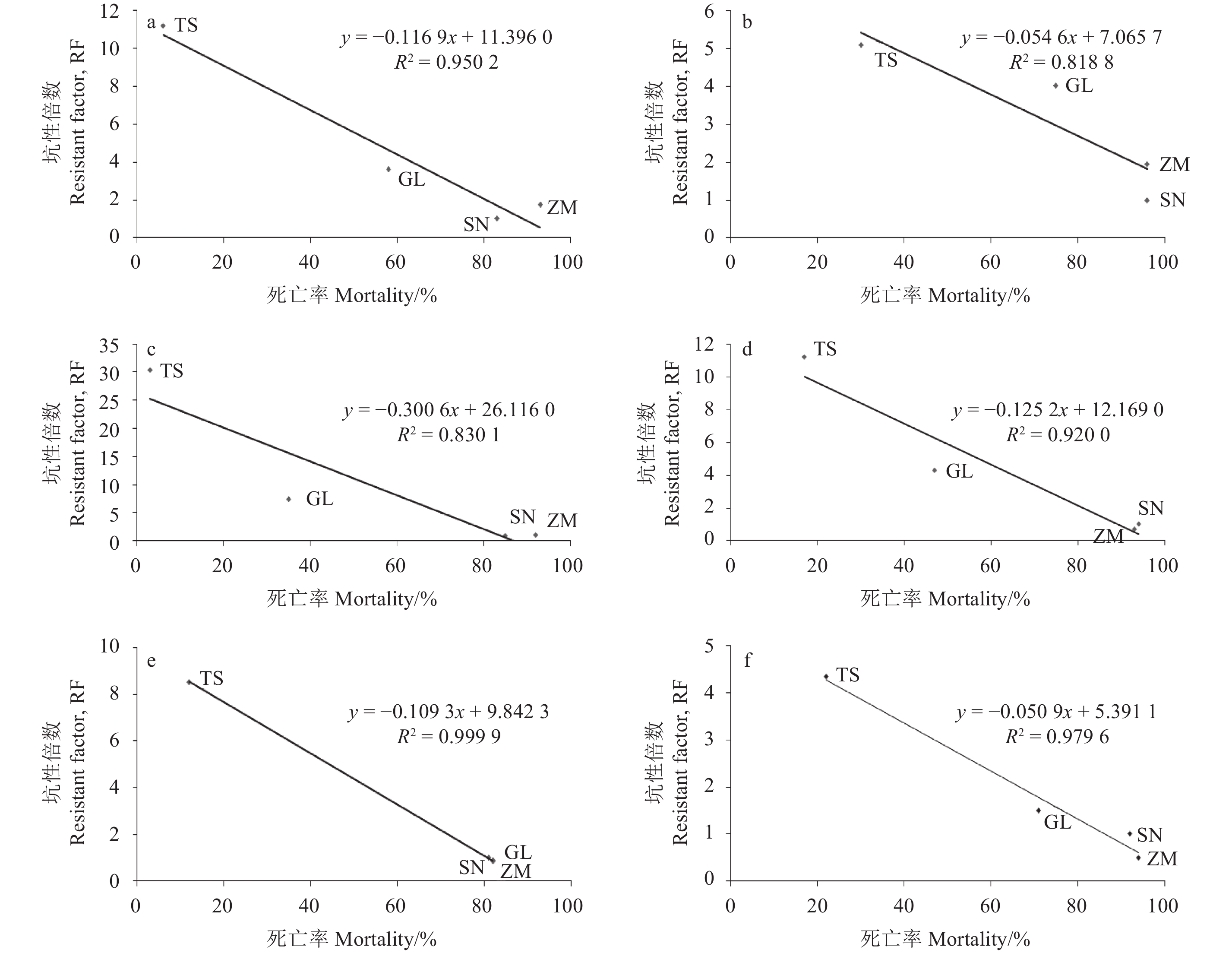
图1的相关性分析结果表明:采自河南驻马店、河北玉田甘蓝及桃树的3个田间种群桃蚜在区分剂量下的死亡率与3个种群对吡虫啉、噻虫胺、烯啶虫胺和氟啶虫胺腈的抗性水平的相关系数均超过0.92,验证了采用区分剂量测定桃蚜田间种群对4种杀虫剂抗性水平的准确性。虽然啶虫脒和噻虫嗪在两种方法下测定结果的相关系数分别为0.818 8和0.830 1,相关性相对较低,但从整体变化趋势看,其在区分剂量下测得的死亡率也可以在一定程度上体现出抗性水平的高低。
因此,利用玻璃管药膜法所得区分剂量,在相对较大幅度简化试验操作、提高检测速度的情况下,通过测定桃蚜田间种群的死亡率,可以有效表征桃蚜田间种群对杀虫剂的敏感性变化及抗性水平高低。
|
|
表 2 桃蚜田间种群在6种杀虫剂区分剂量下的死亡率 Table 2 The mortalities of three M. persicae field populations under the treatments of diagnose doses of six insecticides |
|
a. 吡虫啉 imidacloprid;b.啶虫脒 acetamiprid;c. 噻虫嗪 thiamethoxam;d. 噻虫胺 clothianidin;e. 烯啶虫胺 nitenpyram;f. 氟啶虫胺腈 sulfoxaflor注:SN 是室内敏感品系桃蚜,ZM 是河南省驻马店地区甘蓝桃蚜种群,GL 是河北省玉田地区甘蓝桃蚜种群,TS 是河北省玉田地区桃树桃蚜种群。 Note:SN is M. persicae susceptible strain from Lab, ZM is field population from cabbage in Zhumadian region of Henan Province, GL is field population from cabbage in Yutian region of Hebei Province, TS is field population from peach in Yutian region of Hebei Province. 图 1 在药剂区分剂量下桃蚜田间种群死亡率与抗性水平的相关性分析 Fig. 1 The correlation analysis between the mortality of M. persicae field populations under the diagnose doses of six insecticides with the resistance levels |
2.3 采用区分剂量测定田间桃蚜抗性水平准确性的进一步验证
在6种药剂的区分剂量下,江苏南京种群桃蚜的实测死亡率在59%~98%之间,根据桃蚜田间种群在区分剂量下的死亡率与抗性水平的相关性方程,计算得南京种群对除噻虫嗪以外的5种杀虫剂的抗性倍数理论值介于0.39~3.41之间,对噻虫嗪的理论抗性倍数为8.41 (表3);同时,采用浸叶法实测的该种群抗性倍数介于0.95~2.60之间 (表3)。可以看出,对于南京种群桃蚜而言,浸叶法实测的抗性倍数介于计算的理论抗性倍数变化范围之内,且实测的抗性倍数变化趋势与区分剂量下死亡率的变化趋势基本一致。结果中,南京田间种群桃蚜对噻虫嗪的理论抗性水平与实测抗性水平之间存在相对较大的差异,应与在噻虫嗪的区分剂量下,死亡率与抗性水平的相关系数仅为0.830 1,相关性较低有关。
上述结果表明,采用在杀虫剂区分剂量下测定的死亡率,建立死亡率与抗性水平之间的理论相关性方程,可以对田间桃蚜种群的抗性水平进行快速检测和评估。
|
|
表 3 采用区分剂量测定江苏南京种群桃蚜抗性水平的准确性验证 Table 3 Verification the accuracy of the tested resistance levels to six insecticides in NJ population under the diagnose doses |
3 结论与讨论
采用不同方法测定杀虫剂的毒力,不仅可以明确药剂的作用方式,还可以从多个方面表征杀虫剂对试虫的毒力,为建立客观的毒力评价方法提供必要的数据。于伟丽等[20]分别采用浸虫、浸叶和点滴法测定了甲氨基阿维菌素苯甲酸盐、茚虫威、溴虫腈、虫酰肼、灭多威5种杀虫剂对甜菜夜蛾3龄幼虫的室内毒力,结果表明,甲氨基阿维菌素苯甲酸盐以胃毒作用为主,其他4种药剂均兼有胃毒和触杀毒力。王冰等[21]通过饲喂法和浸虫法测定了球孢白僵菌对玉米螟幼虫的毒力,发现两种方法测定的校正死亡率差异不显著,表明两种方法均可用于测定球孢白僵菌对玉米螟幼虫的毒力。本研究分别通过浸叶法和玻璃管药膜法测定了吡虫啉、啶虫脒、噻虫嗪、噻虫胺、烯啶虫胺以及氟啶虫胺腈6种杀虫剂对桃蚜的毒力,结果表明,虽然浸叶法测定的是杀虫剂对桃蚜的胃毒及触杀毒力,而玻璃管药膜法测定的仅是触杀毒力,但两种方法下6种杀虫剂对桃蚜毒力强弱的变化趋势是基本一致的,表明与浸叶法类似,玻璃管药膜法也可用于测定桃蚜对杀虫剂的敏感性变化。
在确立杀虫剂的区分剂量时,虽然采用敏感基线所对应的LC90或者LC99值作为区分剂量测定田间种群敏感性变化,可以掌握田间种群与敏感基线种群对杀虫剂的敏感性差异,但是由于测定敏感基线的敏感种群难以得到,故本研究采用多年未接触杀虫剂的室内敏感品系桃蚜作为确定区分剂量的试虫。
有关杀虫剂区分剂量的确定标准,因昆虫种类和杀虫剂性质而有所差异。目前文献中分别有采用敏感种群LC90、LC99、2 × LC99及4 × LC99值作为区分剂量测定昆虫对杀虫剂敏感性的研究报道[6, 22-23],因此,区分剂量的建立可根据实际情况进行调整。本研究通过玻璃管药膜法,确立了以吡虫啉、氟啶虫胺腈等6种杀虫剂对桃蚜室内敏感品系的LC90值作为区分剂量,并成功用于桃蚜田间种群对6种杀虫剂敏感性变化的测定,较大幅度地简化了试验操作,提高了检测速度。桃蚜对吡虫啉及氟啶虫胺腈等6种杀虫剂抗性快速检测方法的建立,对于快速测定昆虫对杀虫剂的敏感性变化及进行选药试剂盒的研制,以及指导田间害虫防治中科学合理用药、延缓抗性发展均有十分重要的意义。
| [1] | WEBER G. Genetic variability in host plant adaptation of the green peach aphid, Myzus persicae [J]. Entomol Exp Appl, 1985, 38(1): 49–56. doi:10.1111/eea.1985.38.issue-1 |
| [2] | BLACKMAN R L, EASTOP V F. Aphids on the world's crops: an identification and information guide[M]. 2nd ed. New Jersey: John Wiley & Sons, Ltd, 2000: 2-3. |
| [3] |
高希武, 郑炳宗, 曹本钧. 桃蚜对有机磷和氨基甲酸酯抗性机制研究[J]. 植物保护学报, 1992, 19(4): 365–371.
GAO X W, ZHENG B Z, CAO B J. Resistance in Myzus persicae to organophosphorus and carbamate insecticides in China [J]. Acta Phytophy Sinica, 1992, 19(4): 365–371. |
| [4] |
汤秋玲. 我国桃蚜田间种群抗药性和遗传变异研究[D]. 北京: 中国农业大学, 2015: 38.
TANG Q L. Insecticide resistance and genetic variation of field populations of Myzus persicae (Sulzer), in China[D]. Beijing: China Agricultural University, 2015: 38. |
| [5] |
刘晓漫, 方勇, 贤振华. 农业害虫抗药性监测技术研究进展[J]. 广西农业科学, 2010, 41(9): 931–935.
LIU X M, FANG Y, XIAN Z H. Research advances in monitoring techniques of agricultural pests resistance[J]. Guangxi Agric Sci, 2010, 41(9): 931–935. |
| [6] |
陈年春. 农药生物测定技术[M]. 北京: 北京农业大学出版社, 1991: 30-40.
CHEN N C. Pesticide bioassay technology[M]. Beijing: Beijing Agricultural University Press, 1991: 30-40. |
| [7] |
高希武, 刘晓岚, 谭瑶, 等. 一种检测绿盲蝽抗药性的方法: CN 103675253A[P]. 2014-03-26.
GAO X W, LIU X L, TAN Y, et al. Method for detecting insecticide resistance of Apolygus lucorum: CN 103675253.A[P]. 2014-03-26. |
| [8] |
张宗磊. 二化螟和褐飞虱对几种杀虫剂的敏感性及选药试剂盒研究[D]. 武汉: 华中农业大学, 2013: 20-29.
ZHANG Z L. Study on the susceptibility of several insecticides and development of pesticides selection kit of Nilaparvata lugens and Chilo suppressalis[D]. Wuhan: Huazhong Agricultural University, 2013: 20-29. |
| [9] |
曹增, 张友军, 吴青君, 等. 联苯菊酯对烟粉虱毒力的快速测定技术优化和应用[J]. 应用昆虫学报, 2015, 52(1): 260–266.
CAO Z, ZHANG Y J, WU Q J, et al. Optimization and application of a rapid bioassay method of bifenthrin to Bemisia tabaci [J]. Chin J Appl Entomol, 2015, 52(1): 260–266. doi:10.7679/j.issn.20951353.2015.027 |
| [10] |
唐振华, 陶黎明, 李忠. 害虫对新烟碱类杀虫剂的抗药性及其治理策略[J]. 农药学学报, 2006, 8(3): 195–202.
TANG Z H, TAO L M, LI Z. Resistance of insect pests to neonicotinoid insecticides and management strategies[J]. Chin J Pestic Sci, 2006, 8(3): 195–202. |
| [11] | DEVINE G J, HARLING Z K, SCARR A W, et al. Lethal and sublethal effects of imidacloprid on nicotine-tolerant Myzus nicotianae and Myzus persicae [J]. Pest Manage Sci, 1996, 48(1): 57–62. doi:10.1002/(SICI)1096-9063(199609)48:1<>1.0.CO;2-Z |
| [12] |
宫亚军, 王泽华, 石宝才, 等. 北京地区不同桃蚜种群的抗药性研究[J]. 中国农业科学, 2011, 44(21): 4385–4394.
GONG Y J, WANG Z H, SHI B C, et al. Resistance status of Myzus persicae (Sulzer) (Hemiptera: Aphididae) populations to pesticide in Beijing [J]. Scientia Agricultura Sinica, 2011, 44(21): 4385–4394. |
| [13] | LI Y, XU Z F, SHI L, et al. Insecticide resistance monitoring and metabolic mechanism study of the green peach aphid, Myzus persicae (Sulzer) (Hemiptera: Aphididae), in Chongqing, China [J]. Pestic Biochem Physiol, 2016, 132: 21–28. doi:10.1016/j.pestbp.2015.11.008 |
| [14] |
王利平, 柳蕴芬, 张伟. 山东省桃蚜(Myzus persicae)对啶虫脒、吡虫啉的抗药性
[J]. 中国蔬菜, 2016, 1(2): 48–51.
WANG L P, LIU Y F, ZHANG W. Studies on Myzus persicae resistance to acetamiprid and imidacloprid in Shandong Province [J]. China Veg, 2016, 1(2): 48–51. |
| [15] | ZHU Y M, LOSO M R, WATSON G B, et al. Discovery and characterization of sulfoxaflor, a novel insecticide targeting sap-feeding pests[J]. J Agric Food Chem, 2011, 59(7): 2950–2957. doi:10.1021/jf102765x |
| [16] | LONGHURST C, BABCOCK J M, DENHOLM I, et al. Cross-resistance relationships of the sulfoximine insecticide sulfoxaflor with neonicotinoids and other insecticides in the whiteflies Bemisia tabaci and Trialeurodes vaporariorum [J]. Pest Manage Sci, 2013, 69(7): 809–813. doi:10.1002/ps.2013.69.issue-7 |
| [17] |
王泽华, 范佳敏, 陈金翠, 等. 氟啶虫胺腈亚致死浓度对桃蚜生长和繁殖的影响[J]. 中国农业科学, 2017, 50(3): 496–503.
WANG Z H, FAN J M, CHEN J C, et al. Sublethal effects of sulfoxaflor on the growth and reproduction of the green peach aphid Myzus persicae [J]. Scientia Agricultura Sinica, 2017, 50(3): 496–503. doi:10.3864/j.issn.0578-1752.2017.03.008 |
| [18] |
曲春鹤, 王彭. 氟啶虫胺腈对桃蚜的室内杀虫活性及田间防治效果[J]. 农药, 2017, 56(3): 216–218.
QU C H, WANG P. Laboratory bioassay and field efficacy of sulfoxaflor active against peach aphid (Myzus persicae) [J]. Agrochemicals, 2017, 56(3): 216–218. |
| [19] | MOORES G D, GAO X W, DENHOLM I, et al. Characterisation of insensitive acetylcholinesterase in insecticide-resistant cotton aphids, Aphis gossypii Glover (Homoptera: Aphididae) [J]. Pestic Biochem Physiol, 1996, 56(2): 102–110. doi:10.1006/pest.1996.0064 |
| [20] |
于伟丽, 张升国, 刘永强, 等. 5 种药剂不同生测方法对甜菜夜蛾幼虫毒力比较[J]. 长江蔬菜, 2010(18): 116–118.
YU W L, ZHANG S G, LIU Y Q, et al. Comparison of five insecticides by different bioassay methods to Spodoptera exigua toxicity [J]. J Changjiang Veg, 2010(18): 116–118. doi:10.3865/j.issn.1001-3547.2010.18.037 |
| [21] |
王冰, 关兵兵, 张军, 等. 球孢白僵菌对亚洲玉米螟毒力生测方法比较研究[J]. 玉米科学, 2014, 22(3): 142–147.
WANG B, GUANG B B, ZHANG J, et al. Comparative study on bioassay methods for Beauveria bassiana virulence against the Asian corn borer, Ostrinia fumacalis (Guenée) [J]. J Maize Sci, 2014, 22(3): 142–147. |
| [22] |
柳建伟. 石河子地区棉蚜敏感性测定及选药试剂盒的研制[D]. 石河子: 石河子大学, 2013: 24-31.
LIU J W. Determination of sensitivity of Aphis gossypii to insecticides in Shihezi and the develop of pesticides selected kits[D]. Shihezi: Shihezi University, 2013: 24-31. |
| [23] | EIDEN A L, KAUFMAN P E, ALLAN S A, et al. Establishing the discriminating concentration for permethrin and fipronil resistance in Rhipicephalus sanguineus (Latreille) (Acari: Ixodidae), the brown dog tick [J]. Pest Manage Sci, 2016, 72(7): 1390–1395. doi:10.1002/ps.2016.72.issue-7 |
 2017, Vol. 19
2017, Vol. 19


