苯并咪唑类化合物具有优良的杀菌活性[1-2],已商品化的代表品种有苯菌灵、噻菌灵和多菌灵[3]等。近年来,新型苯并咪唑类化合物的合成,尤其含杂环基团的苯并咪唑环衍生物的合成越来越受到重视[4-5]。1,3,4-噻二唑类化合物也表现出广泛的生物活性,如抑菌[6]、抗病毒[7]、除草[8]等,此类杂环化合物在农药研究领域倍受青睐;此外,酰胺基团作为药效基团存在于许多生物活性物质中,特别是在杀菌剂和除草剂中具有重要地位[9-10]。
本研究采用活性亚结构拼接法,将苯并咪唑环与1,3,4-噻二唑环通过酰胺基团连接组合于同一分子中,设计并合成了6个含苯并咪唑环的1,3,4-噻二唑乙酰胺类化合物,并初步测试了其抑菌活性。目标化合物的合成路线见图式 1。
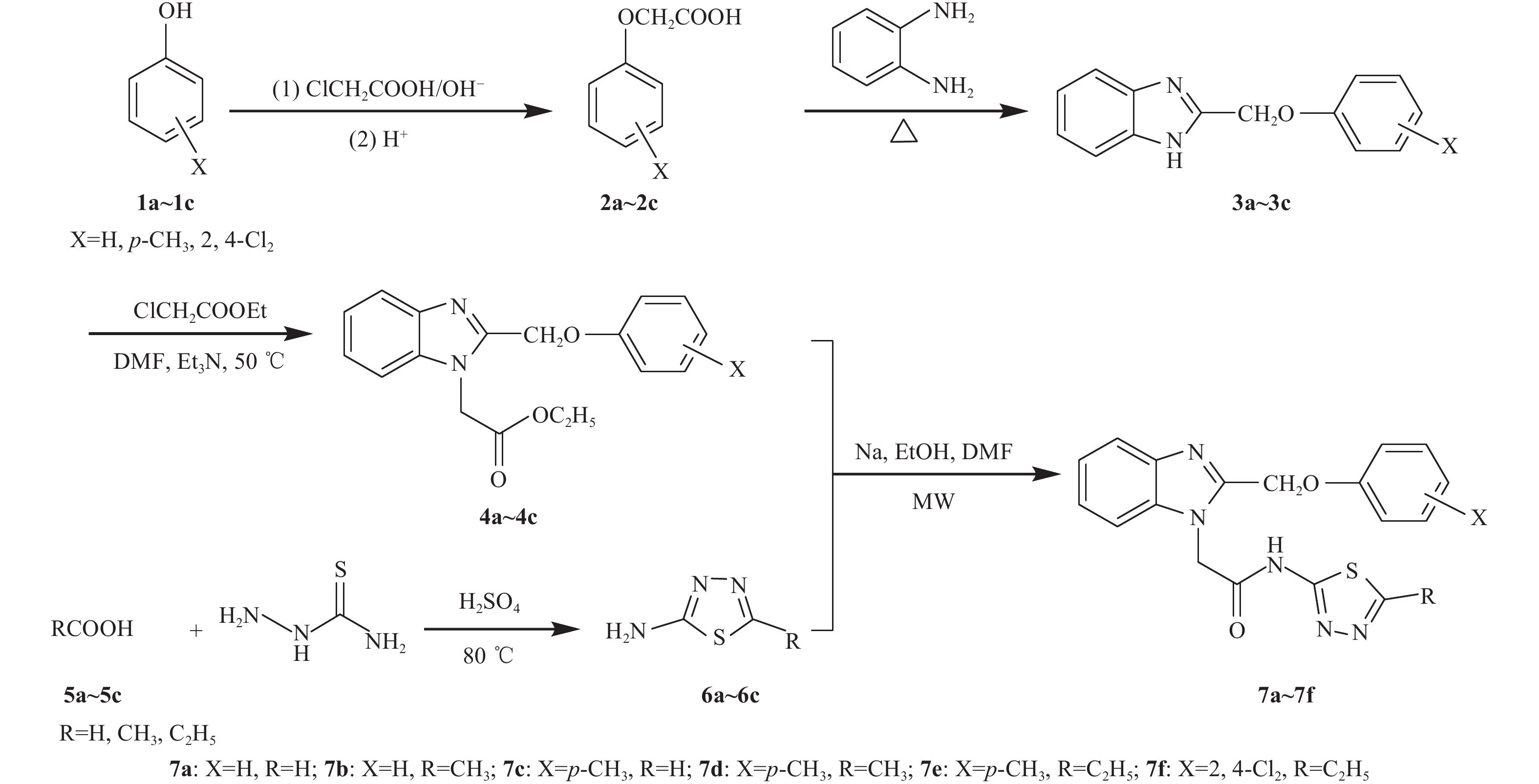
|
图式 1 目标化合物7a~7f的合成路线 Scheme1 The synthetic route of target compounds 7a-7f |
1 实验部分 1.1 仪器与供试材料
XH-200A微波固液相合成萃取仪 (北京祥鹄科技发展有限公司);SG-WRR目视熔点仪 (上海申光仪器有限公司);Spectrum 65型傅里叶红外光谱仪 (KBr压片法,美国Perkin Elmer公司);Bruker avance 600M核磁共振波谱仪 (TMS为内标,DMSO-d6 为溶剂)。多菌灵 (50%,可湿性粉剂,江苏健谷化工有限公司),其他试剂均为市售分析纯。5种植物病原菌均由广州爱菲科生物科技有限公司提供。
1.2 化合物的合成1.2.1 中间体2a~2c的合成 参考文献[11]的方法制备。2a:白色片状晶体,收率80%,m. p. 99~100 ℃ (文献值[11]:收率88%,m. p. 98~99 ℃)。2b:浅粉色针状晶体,收率88%,m. p. 135~136 ℃ (文献值[11]:收率92%,m. p. 136~137 ℃)。2c:白色针状晶体,收率83%,m. p. 138~140 ℃ (文献值[11]:收率86%,m. p. 139~140 ℃)。
1.2.2 中间体3a~3c的合成 参考文献[12]的方法制备。3a:灰白色粉状固体,收率90%,m. p. 160~162 ℃ (文献值[12]:收率56%,m. p. 162~164 ℃)。3b:浅粉色针状晶体,收率86%,m. p. 180~182 ℃ (文献值[12]:收率55%,m. p. 180~182 ℃)。3c:白色针状晶体,收率68%,m. p. 187~189 ℃ (文献值[12]:收率62%,m. p. 186~188 ℃)。
1.2.3 中间体4a~4c的合成 参考文献[13]的方法制备。4a:白色粉状固体,收率42%,m. p. 108~110 ℃ (文献值[13]:收率33%,m. p. 107~109 ℃)。4b:白色片状晶体,收率65%,m. p. 123~125 ℃ (文献值[13]:收率50%,m. p. 123~124 ℃)。4c:白色粉状固体,收率45%,m. p. 134~136 ℃ (文献值[13]:收率47%,m. p. 134~136 ℃)。
1.2.4 中间体6a~6c的合成 参考文献[14]的方法制备。6a:白色晶体,收率87%,m. p. 191~193 ℃ (文献值[14]:收率88%,m. p. 190~192 ℃);6b:白色针状结晶,收率75%,m. p. 202~204 ℃ (文献值[14]:收率74%,m. p. 202~204 ℃);6c:白色针状固体,收率78%,m. p. 197~199 ℃ (文献值[14]:收率73%,m. p. 196~198 ℃)。
1.2.5 目标化合物7a~7f的合成通法 以7a的合成为例:在 100 mL三口烧瓶中加入 15mL无水乙醇和 0.184 g (8 mmol) 金属钠,待金属钠溶解之后,加入 0.202 g (2 mmol) 中间体6a,搅拌 5 min,加入 0.324 g (1 mmol) 中间体4a和 1 mL DMF,置微波固液相合成萃取仪中以 500 W的功率间歇辐射回流反应 15 min。冷却,加入 60 mL蒸馏水,有大量灰白色固体析出,用浓盐酸调节pH=4~5,静置 1.0 h, 抽滤,水洗,烘干,得灰白色粉状固体0.212 g,收率56%,m. p. 230~232 ℃。采用同样的方法合成7b~7f。
1.3 抑菌活性测试以多菌灵为阳性对照,以丙酮为空白对照,采用菌丝生长速率法[15]测试目标化合物对5种供试病原菌的抑制作用。先将样品用丙酮溶解并配制成质量分数为50%的原液,再用无菌水稀释成500 mg/L 的待测样品。待测样品与培养基按体积比1 : 9的比例制成50 mg/L的含药PDA平板。将菌饼反接到平板中央,置 (25 ± 1) ℃的培养箱中培养72 h。每处理组设3次重复,用十字交叉法测量菌落直径 (mm),按公式 (1) 和 (2) 计算化合物在50 mg/L下的菌丝生长抑制率。
| ${\text{菌落扩展直径}}= {\text{菌落平均直径}} - 5$ | (1) |
| ${\text{抑制率}}/\text{%} ={\frac{{{\text{空白对照菌落扩展直径}} - {\text{处理组菌落扩展直径}}}}{{\text{空白对照菌落扩展直径}}}}\times 100$ | (2) |
目标化合物7a~7f的理化性质见表1,核磁共振氢谱及红外数据见表2。
|
|
表 1 目标化合物7a~7f的理化性质 Table 1 Properties of target compounds 7a-7f |
|
|
表 2 目标化合物7a~7f的核磁共振氢谱及红外光谱数据 Table 2 1H NMR and IR data of target compounds 7a-7f |
目标化合物的1H NMR图谱显示,6个化合物在 δ 12.8~13.3之间均具有一个积分为1的单峰,具有典型的酰胺基团特征峰。
由于酰胺基团的p-π 共轭效应大于氨基的吸电子诱导效应,此外,酰胺基上的-NH-和芳氧甲基上的-CH2O-空间位置接近,可形成分子内氢键。综合以上因素,目标化合物的羰基峰与相应的中间体酯 (4a~4c) 比较,位移向低波数方向移动,峰的强度也变弱。
以上数据说明,通过酯的氨解反应成功获得了目标化合物。
2.2 抑菌活性初步的抑菌活性数据 (表3) 表明,所合成的目标化合物对5种病原菌均表现出一定的抑菌活性,其中,化合物7c、7d、7e和7f的抑菌活性较强,50 mg/L下抑制率均达到80%以上,接近阳性对照多菌灵。初步构效关系表明,当苯并咪唑环2位取代基芳氧甲基的对位连接给电子基团时,有利于提高目标化合物的抑菌活性;而噻二唑基团5位取代基碳链的增长也有利于抑菌活性的提高。
|
|
表 3 化合物7a~7f的抑菌活性 Table 3 Fungicidal activities of compound 7a-7f |
| [1] |
甘新琪, 黄军海, 魏少鹏, 等. 1-异丙基-3-酰基-5-甲氧基苯并咪唑酮衍生物的合成及抑菌活性[J]. 农药学学报, 2013, 15(6): 629–634.
GAN X Q, HUANG J H, WEI S P, et al. Synthesis and antifungal activity of 1-isopropyl-3-acyl-5-methoxy-benzimidazolone derivatives[J]. Chin J Pestic Sci, 2013, 15(6): 629–634. |
| [2] |
李方方, 魏少鹏, 宗兆锋, 等. 1-酰基苯并咪唑酮酰胺衍生物的合成及其抗菌活性[J]. 农药学学报, 2012, 14(6): 597–601.
LI F F, WEI S P, ZONG Z F, et al. Synthesis and antimicrobial activity of 1-acyl benzimidazolone amide derivatives[J]. Chin J Pestic Sci, 2012, 14(6): 597–601. |
| [3] |
尤娟, 郭宏斌, 曾绍东, 等. 苯并咪唑类杀菌剂性质及检测技术[J]. 农药, 2016, 55(12): 859–863, 876.
YOU J, GUO H B, ZENG S D, et al. Properties and detection technologies of benzimidazole fungicide[J]. Agrochemicals, 2016, 55(12): 859–863, 876. |
| [4] |
陈岚, 魏宁宁, 高洁, 等. 2-取代苯并咪唑类化合物的合成及其抑菌活性[J]. 农药学学报, 2011, 13(5): 448–452.
CHEN L, WEI N N, GAO J, et al. Synthesis and antifungal activity of 2-heterocyclicbenzimidazole derivatives[J]. Chin J Pestic Sci, 2011, 13(5): 448–452. |
| [5] |
王陆瑶, 田敏, 胡文祥, 等. 微波催化新型杂环基苯并咪唑杀菌剂的合成、表征及活性测定[J]. 应用化学, 2007, 24(5): 507–511.
WANG L Y, TIAN M, HU W X, et al. Ferrocenesulfonyl benzimidazole derivatives synthesized under microwave irradiation and their crystal structure and antimicrobial activity[J]. Chin J Appl Chem, 2007, 24(5): 507–511. |
| [6] |
谢艳, 龚华玉, 王晓斌, 等. 含1,3,4-噻二唑硫醚的吡唑酰胺类化合物合成及生物活性[J]. 农药, 2016, 55(12): 872–876.
XIE Y, GONG H Y, WANG X B, et al. Synthesis and biological activity of novel pyrazole amide derivatives containing 1,3,4-thiadiazole thioether moiety[J]. Agrochemicals, 2016, 55(12): 872–876. |
| [7] |
魏学, 郑玉国, 薛伟, 等. 新型1,2,4-三唑并[3,4-b]-1,3,4-噻二唑类衍生物合成及其抗病毒活性[J]. 合成化学, 2010, 18(5): 595–598.
WEI X, ZHENG Y G, XUE W, et al. Synthesis of novel triazolo[3,4-b]-1,3,4-thiadiazole derivatives and their antivirus activity [J]. Chin J Synth Chem, 2010, 18(5): 595–598. |
| [8] |
胡燕红, 何海琴, 刘幸海, 等. 含1,3,4-噻二唑的吡啶联吡唑乙酰胺类化合物的合成及除草活性[J]. 农药学学报, 2017, 19(1): 114–118.
HU Y H, HE H Q, LIU X H, et al. Synthesis and herbicidal activity of substituted 2-(1-(3-chloropyridin-2-yl)-3,5-dimethyl-1H-pyrazol-4-yl) acetic acid derivatives containing 1,3,4-thiadiazole [J]. Chin J Pestic Sci, 2017, 19(1): 114–118. |
| [9] |
赵文泽, 李黔柱, 解旭东, 等. 杂环酰胺类化合物的杀菌活性研究进展[J]. 吉林农业科学, 2012, 37(5): 52–58.
ZHAO W Z, LI Q Z, XIE X D, et al. Advances in antifungal activity of heterocyclic amide compounds[J]. J Jilin Agric Sci, 2012, 37(5): 52–58. |
| [10] |
崔莹. 杂环酰胺类衍生物除草活性的研究进展[J]. 西安文理学院学报(自然科学版), 2014, 17(4): 17–20.
CUI Y. Recent researches in herbicidal activity of hetercyclic amide derivatives[J]. J Xi'an Univ(Nat Sci Ed), 2014, 17(4): 17–20. |
| [11] |
柴兰琴. 微波辐射下芳氧乙酸的合成[J]. 兰州交通大学学报(自然科学版), 2004, 23(3): 133–135.
CHAI L Q. Synthesis of aryloxycarboxylic acid under microwave irradiation[J]. J Lanzhou Jiaotong Univ (Nat Sci Ed), 2004, 23(3): 133–135. |
| [12] |
李英俊, 刘丽军, 靳焜, 等. 熔融法合成2-芳氧甲基苯并咪唑化合物[J]. 有机化学, 2009, 29(11): 1825–1828.
LI Y J, LIU L J, JIN K, et al. Melting synthesis of 2-aryloxymethylbenzimidazoles[J]. Chin J Organ Chem, 2009, 29(11): 1825–1828. |
| [13] |
邱文龙. 含苯并咪唑环的酰氨基硫脲、1,3,4-噻二唑/噁二唑化合物的合成及生物活性[D]. 大连: 辽宁师范大学, 2013.
QIU W L. Synthesis, characterization and biological activities of some novel acylthiosemicarbazides,1,3,4-thiadiazole/oxadiazole derivatives containing benzimidazole moiety[D]. Dalian: Liaoning Normal University, 2013. |
| [14] |
乐长高, 丁健桦, 杨思金. 5-烷基-2-氨基-1,3,4-噻二唑的合成及应用[J]. 化学世界, 2002, 43(7): 366–368.
LE Z G, DING J H, YANG S J. Synthesis and application of 5-alkyl-2-amino-1,3,4-thiodiazole[J]. Chem World, 2002, 43(7): 366–368. |
| [15] |
农药室内生物测定试验准则 杀菌剂 第2部分: 抑制病原真菌菌丝生长试验 平皿法: NY/T 1156.2—2006[S]. 北京: 中国农业出版社, 2006.
Pesticides guidelines for laboratory bioactivity tests Part 2: Petri plate test for determining fungicide inhibition of mycelial growth: NY/T 1156.2—2006[S]. Beijing: China Agriculture Press, 2006. |
 2017, Vol. 19
2017, Vol. 19


