2. 四川省农业科学院 分析测试中心/农业部农产品质量安全风险评估实验室(成都),成都 610066;
3. 中国科学院大学,北京 100049
2. Center of Analysis and Testing, Sichuan Academy of Agricultural Sciences/Laboratory of Quality and Safety Risk Assessment for Agro-products (Chengdu), Ministry of Agriculture, Chengdu 610066;
3. University of Chinese Academy of Sciences, Beijing 100049
植物生长调节剂根据其来源可分为天然植物激素和人工植物激素[1-3]。由于其能够促进植物生长、提高产量、改善品质等[4-6],使其在茶叶生产中的使用日益广泛,如:赤霉素可促进细胞分裂与伸长,提高茶叶产量及品质;吲哚乙酸可促进芽的生长以提高产量等[7]。此外,植物生长调节剂还可增强茶树的抗逆性[8]。但滥用或盲目使用,也会对人体产生一定的副作用[9],如造成人体免疫及造血系统紊乱、慢性肾病、消化及分泌系统失调、癌症等[10-12]。因此,很多国家对允许使用的调节剂种类和浓度有明确规定,如欧盟规定茶叶中的农药最大残留限量 (MRL) 标准达172项,且93%以检测方法的检测下限作为最高残留限量[13-14],其中规定2,4-滴在茶叶中的MRL值为0.1 mg/kg;日本规定茶叶中矮壮素的MRL值为1 mg/kg;但目前中国对茶叶中植物生长调节剂的限量值还未有明确规定[15-16]。
目前,关于植物生长调节剂的检测方法主要有气相色谱法、液相色谱法、气相色谱-质谱法和液相色谱-串联质谱法等[17-19]。采用单一的色谱法检测,基质干扰严重,仅以保留时间作为定性标准,易出现假阳性结果[20-21],而串联质谱法除了保留时间外,阳性结果还必须满足离子对及离子比率符合相关要求。高分辨质谱优越的扫描速率及分辨率,不仅能提供化合物的精确质量数,还能基于母离子触发子离子扫描,获得特定母离子的碎片信息,从而进一步提高了定性结果的准确性[22-23]。欧盟2002/657/EC指令[24]规定:农药残留的确证分析最少需要4个识别点,而高分辨质谱所获得的母离子为2点,其子离子为2.5点。按照此项规定,高分辨质谱的确证方法,至少包含两个母离子或者一个母离子及其对应的子离子。另一方面,欧盟SANTE/11945/2015[25]法规也规定,基于高分辨质谱的定性方法,至少要有包括碎片离子在内的2个诊断离子 (即:至少为1个母离子和1个碎片离子,或2个碎片离子),其质量偏差 < 5 × 10–6。
茶叶中含有茶碱、咖啡碱、嘌呤碱、可可碱、酚类、多种维生素,以及痕量元素和微量元素等300多种有效成分[26],其基质复杂,对分析结果干扰严重。为此,本研究拟建立绿茶中12种植物调节剂的超高效液相色谱-高分辨质谱分析方法,以期用于大量绿茶样品中植物调节剂的快速筛查。
1 材料与方法 1.1 仪器与试剂UltiMate3000 UPLC液相色谱仪和Thermo Q Exactive Focus高分辨质谱仪 (美国Thermo Fisher公司)。
12种植物生长调节剂标准品,纯度均 > 97%:赤霉酸 (gibbereuic acid, GA)、对硝基苯酚钠 (sodium para-nitrophenolate, SD2)、5-硝基邻甲氧基苯酚钠 (sodium 5-nitroguaiacolate, 5-NG)、吲哚丁酸 (4-indol-3-ylbutyric acid, IBA)、氯吡脲 (forchlorfenuron, CPPU)、2,4-滴 (2,4-dichlorophenoxyacetic acid, 2,4-D)、吲哚乙酸 (indol-3-ylacetic acid, IAA),购自Dr. Ehrenstorfer公司;胺鲜酯 (diethyl aminothyl hexanoate, DA6),购自Adamas公司;烯腺嘌呤 (isopentennyladenine, Z-IP)、羟烯腺嘌呤 (oxyenadenine, ZT)、苄氨基嘌呤 (6-benzylamino purine, 6-BAP),购自Sigma-Aldrich公司;对氯苯氧乙酸 (4-chlorophenoxyacetic, 4-CPA,) 购自AccuStandard公司。乙腈、甲醇、甲酸和乙酸铵均为色谱纯 (美国Fisher Scientific公司)。
绿茶样品 (毛峰) 采自四川省雅安市名山区。将300 g绿茶样品用混合研磨仪加工至粉末状,备用。
1.2 标准溶液配制分别准确称取12种植物生长调节剂标准品,用甲醇溶解,配成质量浓度为200 mg/L的标准储备液,于–18 ℃储存。再移取12种植物生长调节剂标准储备液各1 mL于50 mL容量瓶中,用甲醇定容,配制成4.0 mg/L的混合标准溶液。
1.3 样品前处理准确称取4 g绿茶样品于锥形瓶中,加入5 mL水和20 mL的V(甲酸) : V(乙腈)=1 : 99的混合溶液,振荡30 min后,过滤;取上清液,按体积比1 : 1的比例加水稀释后,过0.22 μm滤膜,待测。
1.4 检测条件色谱条件:CAPCELL PKA-C18色谱柱 (100 mm × 2.1 mm,2 μm);正离子模式:流动相A为体积分数为5%的甲醇水溶液 (含5 mmol/L乙酸铵和体积分数为0.1%甲酸),流动相B为含5 mmol/L乙酸铵和体积分数为0.1%甲酸的甲醇溶液;负离子模式:流动相A为体积分数为5%的甲醇水溶液,流动相B为甲醇。流速0.4 mL/min;进样量5 μL;柱温35 ℃。梯度洗脱程序见表1。
|
|
表 1 流动相梯度洗脱程序 Table 1 Mobile phase gradient |
质谱条件:电喷雾离子源 (ESI);毛细管温度320 ℃;喷雾电压正离子+3.2 kV,负离子–2.8 kV;辅助气温度350 ℃;辅助气流速10 L/h;鞘气流速40 L/h;分辨率R=70 000;m/z 150~2 000。
1.5 数据处理用空白样品基质溶液稀释标准储备液,按1.3节和1.4节的方法测定。采用TraceFinder软件进行数据处理,设定母离子精确质量分数允许偏差范围 < 5 × 10–6;碎片离子精确质量分数允许偏差范围 < 1 × 10–5;同位素分布匹配指数 > 80分。
2 结果与分析 2.1 色谱和质谱条件的选择及优化色谱柱及流动相的选择是目标物峰形及分离度的重要影响因素。液相色谱法分析,流动相一般采用乙腈或甲醇,同时也会添加一定量的酸和盐以减少峰拖尾、改善峰型并达到良好的分离效果。此外,加入乙酸铵也可增强某些化合物的离子化效果[27-28]。本研究在正离子模式下,采用体积分数为5%的甲醇水溶液 (含5 mmol/L的乙酸铵及体积分数为0.1%的甲酸) 为流动相;负离子模式下以体积分数为5%的甲醇水溶液为流动相。在此优化梯度洗脱程序下,在空白茶叶基质中添加12种植物生长调节剂的混合标准溶液,其出峰时间均在3 min以上,有效避免了前端水溶性物质对目标物的干扰 (图1)。
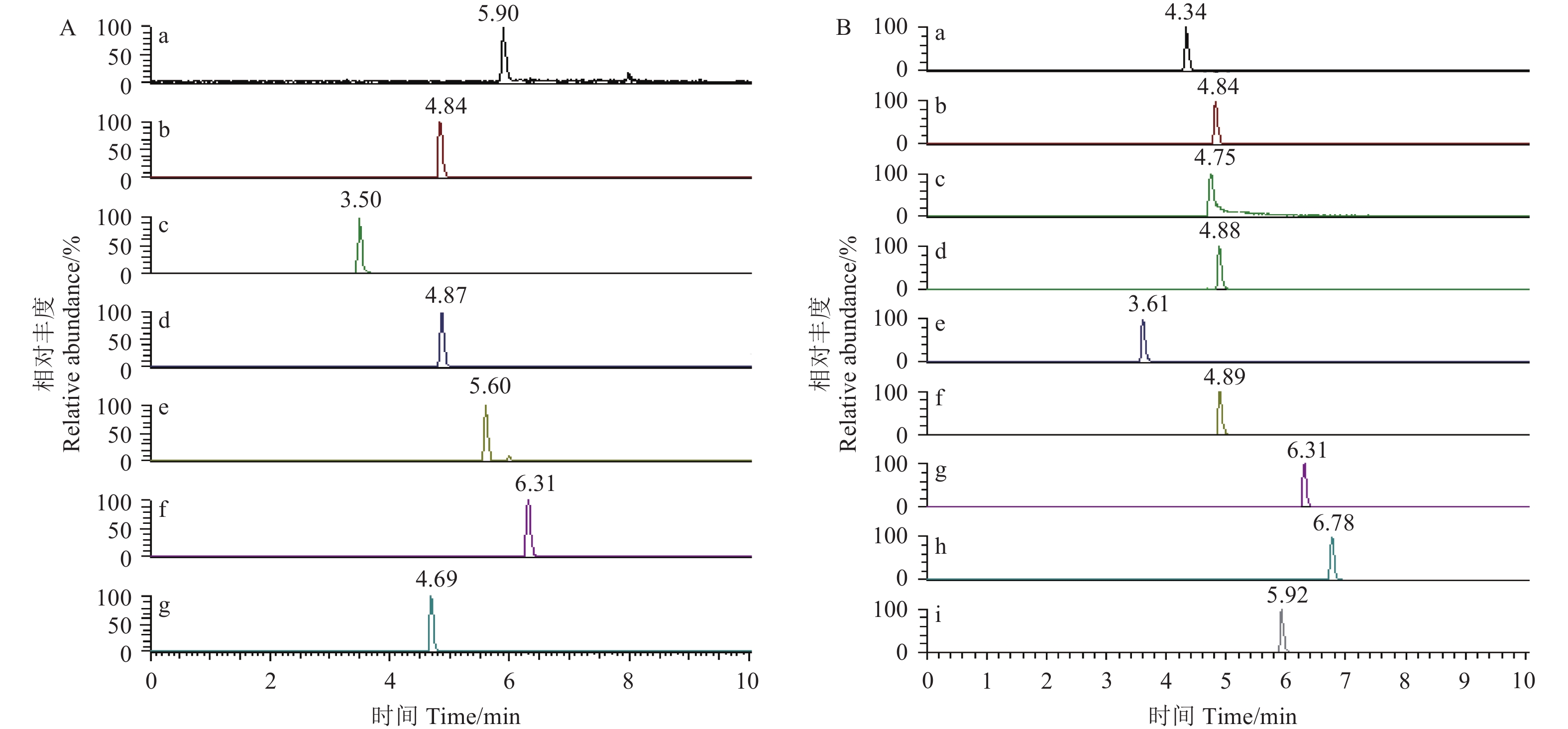
|
|
2.2 12种植物生长调节剂数据库的建立
在全扫描采集模式下,对比正、负离子模式下12种化合物的响应。结果表明:正离子模式下,可检测到DA6、Z-IP、ZT、6-BAP、IBA、CPPU和IAA的[M+H]+准分子离子峰,选定[M+H]+为DA6、Z-IP、ZT、6-BAP、IBA、CPPU和IAA在正离子模式下的母离子;负离子模式下,可检测到GA、SD2、5-NG、Z-IP、ZT、6-BAP、CPPU、2,4-D和4-CPA的[M-H]–准分子离子峰,选定[M-H]–为负离子模式下GA、SD2、5-NG、Z-IP、ZT、6-BAP、CPPU、2,4-D和4-CPA的母离子。
在Target MS/MS模式下,分别以[M+H]+和[M-H]–离子为母离子得到二级碎片离子的全扫描质谱图,选择丰度相对较高的特征碎片离子作为诊断离子,二级质谱图及结构信息见图2。由此建立12种植物生长调节剂的数据库,该数据库包含保留时间、母离子精确质量数、特征碎片离子精确质量数等信息 (表2)。
|
|
表 2 12种植物生长调节剂的相关质谱参数 Table 2 MS parameters of 12 plant growth regulators |

|
|
2.3 定量分析结果
12种植物生长调节剂中,赤霉酸、吲哚丁酸、吲哚乙酸属于内源性植物激素。因此,定量分析前需排除内源性植物激素的干扰。
准确称取绿茶样品500 g粉碎,按1.3节的方法步骤处理,按1.4节的条件测定。选定目标植物生长调节剂检出值低于0.01 mg/kg的样品作为空白样品 (图3),由此排除部分内源性激素对方法证实试验的干扰。
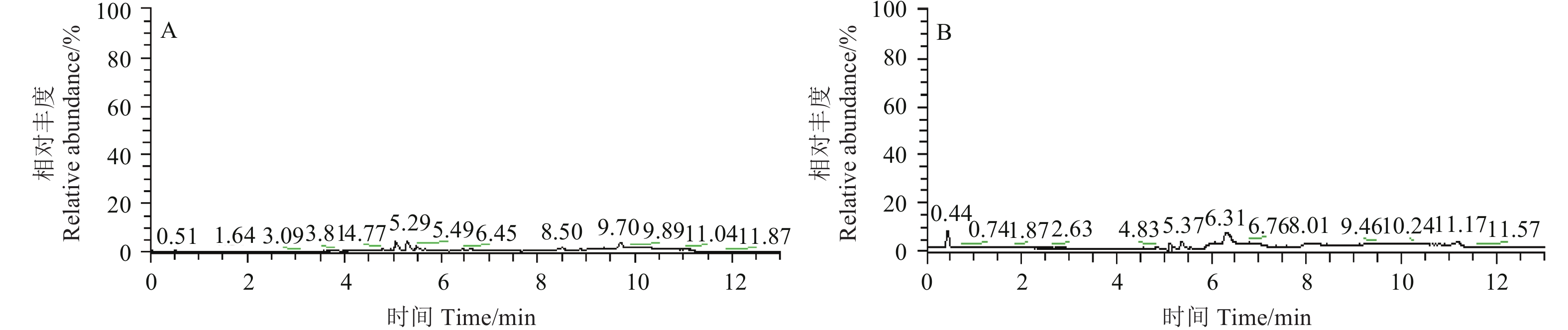
|
|
12种植物生长调节剂添加回收试验结果 (表3) 表明:在0.01、0.1和0.5 mg/kg(对应样品浓度分别为:0.001、0.01和0.05 mg/L)3个添加水平下,12种植物生长调节剂的回收率在61%~130%之间,RSDs位于1.8%~17 %之间。其中在0.01 mg/kg添加水平下,12 种植物生长调节剂均能实现准确定量分析,因此确定方法的报告限为0.01 mg/kg。
|
|
表 3 12种植物生长调节剂的添加回收率和相对标准偏差 (n=5) Table 3 Recoveries and RSDs of 12 plant growth regulators (n=5) |
2.4 筛查方法的实际应用
随机抽取四川省成都市市场的绿茶样品共计90个,采用本研究建立的方法进行筛查,筛查流程见图4。确证参数包括保留时间、母离子精确质量数、特征碎片离子精确质量数和同位素分布匹配指数,其中设定母离子精确质量数允许偏差范围 < 5×10-6;碎片离子精确质量数允许偏差范围 < 1×10-5;同位素分布匹配指数 > 80分。
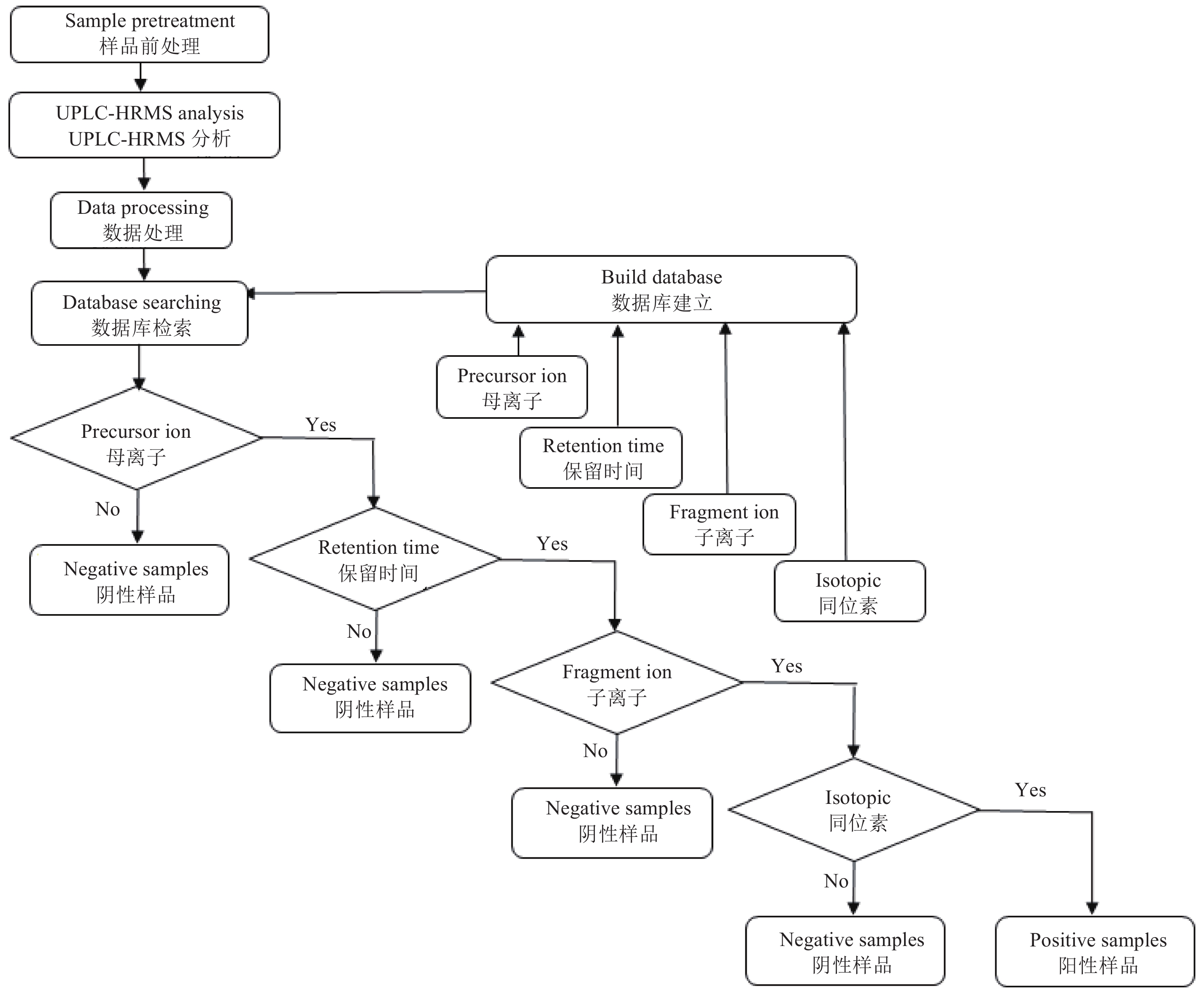
|
图 4 茶叶样品中12种植物生长调节剂筛查流程图 Fig. 4 Workflow of the screening of twelve plant growth regulators in tea |
基于数据库的筛查结果发现:(1) 90个茶叶样品中,第76号样品检出2,4-D,其母离子、子离子、保留时间和同位素分布匹配指数均满足要求,因此该样品最终筛查结论为2,4-D阳性结果;(2) 第48号样品检出SD2,母离子、子离子、保留时间均满足要求,但同位素分布匹配指数 < 80分,未能匹配,因此该样品最终筛查结论为对硝基苯酚钠阴性结果;(3) 第12号样品初步发现IAA,母离子、保留时间和同位素分布匹配指数均满足要求,但碎片离子未能匹配,因此该样品最终筛查结论为IAA阴性结果。汇总结果见表4。
|
|
表 4 筛查结果判定汇总表 Table 4 Summary table of screening results |
3 结论
本研究采用超高效液相色谱-高分辨质谱建立了绿茶中12种植物调节剂的快速筛查方法。首先根据12种植物生长调节剂标准品得到母离子、子离子的精确质量数、保留时间以及同位素分布匹配指数建立数据库,然后根据所建立的数据库对大量的茶叶样品进行快速筛查。该方法快速、简便、高效、准确,能够适用于绿茶中植物生长调节剂的筛查。
| [1] |
黄何何, 张缙, 徐敦明, 等. QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J]. 色谱, 2014, 32(7): 707–716.
HUANG H H, ZHANG J, XU D M, et al. Determination of 21 plant growth regulator residues in fruits by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2014, 32(7): 707–716. |
| [2] |
牟艳莉, 郭德华, 丁卓平, 等. 高效液相色谱-串联质谱法测定瓜果中11种植物生长调节剂的残留量[J]. 分析化学, 2013, 41(11): 1640–1646.
MOU Y L, GUO D H, DING Z P, et al. Determination of 11 kinds of plant growth regulator residues in fruits and melons by high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Anal Chem, 2013, 41(11): 1640–1646. |
| [3] |
陈卫军, 张耀海, 李云成, 等. 果蔬中常用植物生长调节剂分析方法研究进展[J]. 食品科学, 2012, 33(11): 283–289.
CHEN W J, ZHANG Y H, LI Y C, et al. Research advances in analytical methods of plant growth regulators for fruits and vegetables[J]. J Food Sci, 2012, 33(11): 283–289. |
| [4] |
张慧, 吴颖, 路勇, 等. 超高效液相色谱-串联质谱法测定苹果中的赤霉素、脱落酸、甲萘威、多效唑和烯效唑残的残留量[J]. 食品工业科技, 2010, 31(10): 383–385.
ZHANG H, WU Y, LU Y, et al. Determination of gibberellin, abscisic acid, carbaryl, paclobutrazol and uniconazole in apples by ultra performance liquid chromatography-tandem mass spectrometry[J]. Sci Technol Food Ind, 2010, 31(10): 383–385. |
| [5] | ZHANG W, HE L S, ZHANG R, et al. Development of a monoclonal antibody-based enzyme-linked immunosorbent assay for the analysis of 6-benzylaminopurine and its ribose adduct in bean sprouts[J]. Food Chem, 2016, 207: 233–238. doi:10.1016/j.foodchem.2016.03.103 |
| [6] | DANEZIS G P, ANAGNOSTOPOULOS C J, LIAPIS K, et al. Multi-residue analysis of pesticides, plant hormones, veterinary drugs and mycotoxins using HILIC chromatography-MS/MS in various food matrices[J]. Anal Chim Acta, 2016, 942: 121–138. doi:10.1016/j.aca.2016.09.011 |
| [7] |
王旭, 李维. 植物生长调节剂研究现状及其在茶树上的应用[J]. 湖南农业科学, 2012(13): 117–118, 122.
WANG X, LI W. Advances in plant growth regulators and it’s application on tea plants[J]. Hunan Agric Sci, 2012(13): 117–118, 122. doi:10.3969/j.issn.1006-060X.2012.13.039 |
| [8] |
陈娟. 生长调节剂在茶树抗性方面的研究及应用[J]. 贵州茶叶, 2013, 41(4): 12–14.
CHEN J. Research and application of growth regulators in terms of resistance to tea plant[J]. Guizhou Tea, 2013, 41(4): 12–14. |
| [9] | KIM K G, PARK D W, KANG G R, et al. Simultaneous determination of plant growth regulator and pesticides in bean sprouts by liquid chromatography-tandem mass spectrometry[J]. Food Chem, 2016, 208: 239–244. doi:10.1016/j.foodchem.2016.04.002 |
| [10] |
唐莉娟, 谭婷, 万益群. 超声波提取-高效液相色谱-电喷雾离子化质谱法测定白萝卜中植物生长调节剂[J]. 食品科学, 2012, 33(14): 136–141.
TANG L J, TAN T, WAN Y Q. Determination of plant growth regulators in radish by ultrasound-assisted extraction and liquid chromatography-electrospray ionization mass spectrometry[J]. Food Sci, 2012, 33(14): 136–141. |
| [11] | CAO S R, ZHOU X, XI C X, et al. Cleaning up vegetable samples using a modified " QuEChERS” procedure for the determination of 17 plant growth regulator residues by ultra high performance liquid chromatography-triple quadrupole linear ion trap mass spectrometry[J]. Food Anal Methods, 2016, 9(7): 2097–2104. doi:10.1007/s12161-015-0397-y |
| [12] | MAN Y R, SHU M, WANG D, et al. Determination of 6-benzylaminopurine in bean sprouts by capillary electrophoresis compared with HPLC[J]. Food Anal Methods, 2016, 9(11): 3025–3031. doi:10.1007/s12161-016-0496-4 |
| [13] |
冯洁. 茶叶中农药残留分析方法的应用研究[D]. 北京: 北京化工大学, 2014: 1-138.
FENG J. Application study on the analysis method of pesticide residues in tea[D]. Beijing: Beijing University of Chemical Technology, 2014: 1-138. |
| [14] |
吴雪原. 茶叶中农药的最大残留限量及风险评估研究[D]. 合肥: 安徽农业大学, 2007: 1-135.
WU X Y. Studies on maximum residue limits for pesticides in tea and relative risk assessment[D]. Hefei: Anhui Agricultural University, 2007: 1-135. |
| [15] |
诸力, 王晨, 陈红平, 等. 超高效液相色谱-串联质谱法同时测定茶叶中11种植物生长调节剂及吡虫啉、啶虫脒的残留[J]. 分析化学, 2017, 45(4): 529–536.
ZHU L, WANG C, CHEN H P, et al. Simultaneous determination of plant growth regulators and imidacloprid, acetamiprid in tea by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chin J Anal Chem, 2017, 45(4): 529–536. doi:10.11895/j.issn.0253-3820.160808 |
| [16] |
杨珺晖. 中日茶叶农药残留标准的贸易效应实证分析[J]. 兰州商学院学报, 2014, 30(5): 41–54.
YANG J H. The empirical study on the trading impacts of Sino-Japanese tea pesticide residue standard[J]. J Lanzhou Commer Coll, 2014, 30(5): 41–54. |
| [17] |
周纯洁, 赵博, 吴丹, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定蔬菜中6种植物生长调节剂[J]. 食品工业科技, 2016, 37(10): 94–98, 110.
ZHOU C J, ZHAO B, WU D, et al. Determination of six plant growth regulators in vegetables by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J]. Sci Technol Food Ind, 2016, 37(10): 94–98, 110. |
| [18] | WANG X F, MAO X J, YAN A P, et al. Simultaneous determination of nine plant growth regulators in navel oranges by liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Food Anal Methods, 2016, 9(12): 3268–3277. doi:10.1007/s12161-016-0512-8 |
| [19] |
郝杰, 冯楠, 姜洁, 等. 水果蔬菜中常见植物生长调节剂分析检测方法研究进展[J]. 食品科学, 2015, 36(21): 303–309.
HAO J, FENG N, JIANG J, et al. Recent advances in analytical techniques for the detection of plant growth regulators in common fruits and vegetables[J]. Food Sci, 2015, 36(21): 303–309. doi:10.7506/spkx1002-6630-201521056 |
| [20] |
侯雪, 易盛国, 韩梅, 等. 串联质谱法检测洋葱中36种例行监测农药及其基质效应的探讨[J]. 现代科学仪器, 2012(4): 115–118.
HOU X, YI S G, HAN M, et al. Study on detection and matrix effects of 36 routine monitoring pesticides in onion by gas chromatography-tandem mass spectrometry[J]. Mod Sci Instrum, 2012(4): 115–118. |
| [21] |
徐生坚, 曹慧, 陈小珍. 超高效液相色谱-串联质谱法测定粮谷中6种植物生长调节剂残留[J]. 食品科学, 2013, 34(18): 218–222.
XU S J, CAO H, CHEN X Z. Determination of plant growth regulator residues in grains by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Sci, 2013, 34(18): 218–222. doi:10.7506/spkx1002-6630-201318044 |
| [22] |
刘靖靖, 宫萍, 张晓梅, 等. 液相色谱-四极杆飞行时间质谱法快速测定草莓中6种植物生长调节剂的残留量[J]. 色谱, 2012, 30(10): 1012–1016.
LIU J J, GONG P, ZHANG X M, et al. Determination of six plant growth regulator residues in strawberry by liquid chromatography-quadrupole time of flight mass spectrometry[J]. Chin J Chromatogr, 2012, 30(10): 1012–1016. |
| [23] |
叶海英, 郑水庆, 梁晨, 等. LTQ-Orbitrap组合式高分辨质谱法快速筛查毛发中7种毒品及代谢物[J]. 分析化学, 2012, 40(11): 1674–1679.
YE H Y, ZHENG S Q, LIANG C, et al. Analysis of seven drugs in human hair by hybrid linear ion trap/orbitrap mass spectrometry[J]. Chin J Anal Chem, 2012, 40(11): 1674–1679. |
| [24] | European Commission. Implementing council directive 96/23/EC concerning the performance of analytical methods and the interpretation of results: 2002/657/EC[S]. European Commission, 2002. |
| [25] | European Commission. Guidance document on analytical quality control and method validation procedures for pesticides residues analysis in food and feed: SANTE/11945/2015[S]. European Commission, 2015. |
| [26] | WONG S K, YU K C, LAM C H. Isotope dilution gas chromatography/mass spectrometry method for determination of pyrethroids in apple juice[J]. Anal Bioanal Chem, 2010, 396(5): 1877–1884. doi:10.1007/s00216-009-3442-0 |
| [27] |
李海艳, 尚德军, 巩志国, 等. 高效液相色谱-串联质谱法检测葡萄干中五种植物生长调节剂的残留[J]. 保鲜与加工, 2014, 14(1): 27–32.
LI H Y, SHANG D J, GONG Z G, et al. Determination of the residues of the five kinds of plant growth regulators in raisins using high performance liquid chromatography-tandem mass spectrometry[J]. Storage Process, 2014, 14(1): 27–32. |
| [28] |
虞淼, 吴淑春. 高效液相色谱-串联质谱同时测定草莓、杨梅中20种植物生长调节剂残留[J]. 食品科学, 2015, 36(24): 246–252.
YU M, WU S C. Simultaneous determination of 20 plant growth regulator residues in strawberry and Chinese bayberry (Myrica rubra) by high performance liquid chromatography-tandem mass spectrometry [J]. Food Sci, 2015, 36(24): 246–252. doi:10.7506/spkx1002-6630-201524046 |
 2017, Vol. 19
2017, Vol. 19


