因化学农药的滥用而导致的残留、毒性和污染等问题日益突显,而耐药性问题更加剧了其滥用,形成恶性循环[1]。因此,环境友好的微生物菌剂受到了广泛的重视[2]。脂肽广泛存在于芽孢杆菌源微生物菌剂的生产过程 (发酵上清液) 中,具有显著的表面活性[3]、抗细菌[4-6]及抗真菌[4, 7-8]活性,在可持续农业领域具有很好的开发价值[9-10],可开发成农用抗生素[4, 11-13]、免疫诱导剂[14]及杀虫剂[15-16]等生物源农药[3]。
伊枯草菌素类脂肽bacillomycin D (杆菌霉素D,图1) 对包括灰葡萄孢 Botrytis cinerea 和尖孢镰刀菌 Fusarium oxysporum 等在内的多种植物病原真菌具有离体拮抗活性[17]。然而相关的验证试验目前仅限于以玉米、黄瓜子叶、大米或燕麦为对象进行的小规模生物测定试验[8, 17-18],与实际应用还相去甚远。类似情况在芽孢杆菌源胞外脂肽的开发中也普遍存在,其中一个重要的原因在于其表面活性和起泡活性严重制约了高纯度脂肽的规模化制备工艺[19],无法提供足够量且符合纯度要求 (>85%) 的样品,导致农药产品登记所要求的毒理学试验[20]难以开展,限制了脂肽类农用抗生素价值的进一步开发。相比之下,同为芽孢杆菌源的枯草芽孢杆菌 Bacillus subtilis 则已被美国食品药品监督管理局 (FDA) 界定为“GRAS”(generally recognized as safe) [8, 21],并实现了商品化开发,其在 2017 年的全球市场价值预计将达到 30~40 亿美元[22]。由此可见,芽孢杆菌源脂肽类抗生素的开发亟待建立高纯度样品的高效制备工艺,以满足农药登记所要求的相关试验项目。
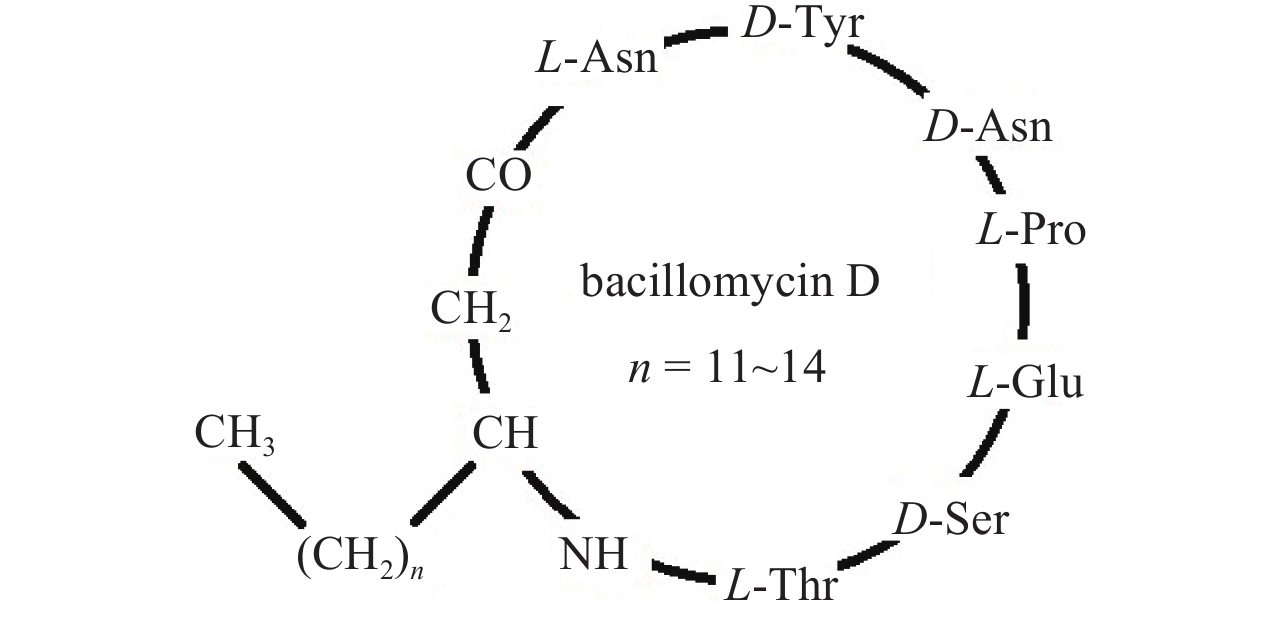
|
注:肽链的氨基端 (天冬酰胺) 与 β-氨基-脂肪酸的羧基缩合,而其羧基端 (苏氨酸) 与 β-氨基-脂肪酸的氨基缩合,形成了伊枯草菌素类脂肽抗生素的典型结构。 Note: The amino terminal (from Asn) and the carboxyl terminal (from Thr) of the peptide chain are linked to the carboxyl group and the amino group of β-amino fatty acid, respectively, which is a typical characteristic of iturin lipopeptide antibiotics. 图 1 Bacillomycin D 脂肽类抗生素的分子结构 Fig. 1 Molecular structure of bacillomycin D lipopeptide antibiotics |
因此,本研究从解淀粉芽孢杆菌 Bacillus amyloliquefaciens TYg 3-2 的发酵上清液中分离纯化得到活性物质,经鉴定为脂肽类抗生素bacillomycin D;通过对其发酵工艺的优化,建立了高产bacillomycin D 的发酵罐制备工艺;对已有的细菌源脂肽可放大纯化工艺[23]进行优化,最终达到了样品纯度 > 85% 的要求;采用优化后的工艺制备了足够量的高纯度bacillomycin D脂肽,并初步测定了其对植物病原真菌的抑菌活性。
1 材料与方法 1.1 供试材料1.1.1 菌株 生产菌株 Bacillus sp. TYg 3-2 由国家海洋局第一海洋研究所田黎教授课题组提供,GenBank登录号:HQ290101.1。经 16S rDNA鉴定确定其为解淀粉芽孢杆菌 B. amyloliquefaciens。德氏霉菌 Drechslera turcica、玉米弯孢霉 Curvularia lunata、稻绿核菌 Ustilaginoidea virens 与长柄链格孢 Alternaria longipes 等病原真菌均由华东理工大学海洋生化工程研究室提供。
1.1.2 主要仪器设备 高效液相色谱系统 (HPLC,由Waters 1525 高效液相色谱泵与Waters 2487 检测器组成,美国 Waters 科技有限公司);Cosmosil 5C18-MS-Ⅱ 制备型HPLC柱 (20 mm × 250 mm,5 μm,日本半井公司);RE-52C旋转蒸发仪 (规格 2 L,上海青浦沪西仪器厂) 及SHZ-Ⅲ 型循环水式真空泵 (上海亚荣生化仪器厂);5 L发酵罐及其主机等设备 (上海保兴生物设备有限公司);色谱层析柱 (主体由玻璃筒体、固定床层的砂芯及聚四氟乙烯旋塞构成,于华东理工大学定制)。
1.1.3 主要试剂、填料与对照药剂 发酵培养基包括酵母提取物 (BR级)、鱼粉蛋白胨 (BR级)、葡萄糖、硫酸铵及氯化钠等无机盐 (AR级);用于高效液相色谱制备工艺的乙腈 (HPLC级, 百灵威化学技术有限公司) 及三氟乙酸 (TFA,美国天地有限公司);可放大纯化工艺研究中所用的盐酸、甲醇、乙醇、氯仿 (AR级)、HZ806 大孔树脂 (粒径200~900 μm,上海华震科技有限公司) 与硅胶填料 (粒径50~74 μm,上海天莲化工科技有限公司);盆栽试验中的苯醚甲环唑 (difenoconazole,瑞士先正达作物保护有限公司)。
1.2 目标化合物的分离、纯化及鉴定采用葡萄糖-肉汤-人工海水培养基 (葡萄糖 5 g、酵母提取物 10 g、牛肉提取物 3 g、NaCl 30 g、MgCl2·6H2O 3.2 g、KCl 0.2 g及FePO4·4H2O 0.015 g,用水定容至 1.0 L,并用NaOH溶液将pH值调至 7.0~7.2)。将生产菌接种至摇瓶,于 25 ℃、150 r/min下培养 3~4 d。待积累至 25 L后,于 1 750 × g 离心 10 min,收集上清液,并用 6 mol/L的盐酸将其pH值调至 3.0,产生沉淀。离心收集沉淀物,经甲醇浸提、过滤和浓缩,获得样品浸膏。采用Sephadex LH-20 体积排阻层析,用 50% 甲醇洗脱,收集洗脱液,减压浓缩即得到初步纯化的样品。
通过HPLC系统与HPLC制备柱进行样品纯化。检测波长 210 nm,以V(乙腈) : V(水) = 40 :60 的混合溶剂 (含体积分数为 0.05% 的TFA) 为流动相进行洗脱,流速 7 mL/min,柱温 25 ℃。在 29~34 和 40~50 min期间分别收集 3 个目标化合物的洗脱液 (图2),并与 0.2 mol/L、pH 6.8~6.9 的磷酸盐缓冲液以体积比 10 : 1 的比例混合,浓缩后经HPLC制备柱吸附和脱盐,获得各目标单体化合物的纯品,并通过高分辨质谱 (HR-ESI-MS)、氨基酸分析以及核磁共振波谱 (1H NMR) 进行结构鉴定。

|
图 2 解淀粉芽孢杆菌 TYg 3-2 所产目标化合物的高效液相色谱纯化谱图 Fig. 2 HPLC spectrum of purification for target compounds secreted by B. amyloliquefaciens TYg 3-2 |
1.3 高纯度目标化合物样品制备工艺
1.3.1 发酵培养基的优化
1.3.1.1 无机盐组分对发酵水平的影响 由于葡萄糖-肉汤-人工海水培养基中的氯离子对多数金属发酵罐有腐蚀作用,因此需要探寻低盐度的培养基。此外,采用摇瓶法研究培养基优化时,需添加 30 mg/L的铁元素[24]104-106,以模拟金属发酵罐实罐灭菌或者连续灭菌后培养基中铁离子浓度升高的情况。已有文献报道二价金属离子可提升脂肽发酵水平[25-26],故对CaCl2、ZnSO4、CuSO4和MnSO4 进行了筛选和比较[24]104-106。
1.3.1.2 发酵培养基中碳源及氮源的响应面优化设计 为研究碳源及氮源对目标化合物发酵水平的影响,采用Design-Expert Version 8.0.6对葡萄糖 (速效碳源)、蛋白胨 (有机氮源)、酵母提取物 (有机氮源) 和 (NH4)2SO4 (速效无机氮源) 进行了 4 因素 3 水平的Box-Behnken响应面优化试验设计[24]114-118 (表1)。
|
|
表 1 响应面优化 (Box-Behnken 试验) 设计因素水平 Table 1 Experimental variables and levels for response surface method (Box-Behnken design) |
1.3.2 目标化合物可放大纯化工艺的建立 对酸化沉淀、甲醇浸提、溶剂沉淀、盐析、萃取、大孔树脂吸附和硅胶柱层析等可放大的常用单元工艺进一步进行整合、简化和优化,建立目标化合物的可放大纯化工艺。
1.4 目标化合物抑菌活性初步研究1.4.1 离体拮抗试验 采用平板扩散法[8]。将目标化合物配成质量浓度为 16.12~500 mg/L的甲醇溶液,并以甲醇为空白对照,分别测试了目标化合物对德氏霉菌、玉米弯孢霉、稻绿核菌和长柄链格孢的抑制活性。将各植物病原真菌的孢子悬浮液与 50 ℃、未凝固的PDA培养基以体积分数 2%~3%的比例混合后,制成厚 4 mm的琼脂平板,使用直径 6 mm的无菌打孔器在平板上形成彼此相距 3 cm的孔洞。向孔洞中注入 120 μL待测目标化合物药液,于 28 ℃培养箱中静置生长 2~4 d后,观察抑菌圈的形成情况。
1.4.2 群集运动试验 参照已有的群集运动考察方法[27-28]。用琼脂质量浓度为 3 g/L的半固体培养基溶解 1.3 节中制备的高纯度目标化合物 (药剂质量浓度为 0~500 mg/L),制成含药培养基平板。于平板中央接种TYg 3-2 菌株,25 ℃培养箱中静置生长,1 d后观察菌苔形成情况。
1.4.3 盆栽试验 委托上海南方农药研究中心进行黄瓜炭疽病防治盆栽试验。待黄瓜生长至 3~4 叶期时接种炭疽病菌 Colletotrichum orbiculare 菌液,按 750 L/hm2的剂量分别喷施目标化合物水溶液、目标化合物/TYg 3-2 菌体混合液、对照药剂 (苯醚甲环唑) 和空白对照 (水)。培养条件为:16 h/8 h光暗交替,24~28 ℃,相对湿度 80%~100%,2~4 d后进行防效考察。防效计算公式[29]见式 (1)。
| $ \begin{aligned}{\text{防治效果}}/{\text{%}} = &\left[ (\text{对照组病斑数} \,\text{-}\, \text{施药组病斑数})/ \right.\\& \left. \text{对照组病斑数}\right] \times 100\end{aligned}$ | (1) |
委托华东理工大学分析测试中心进行检测和鉴定。通过高分辨电喷雾质谱确定 1.2 节所制备 3 个目标化合物[M+H]+ 的m/z 值分别为 1 031.543 2、1 045.556 5 和 1 045.556 7,推断前者分子式为C48H74N10O15,后两者为C49H76N10O15;氨基酸分析显示,目标化合物的酸化水解物中含有天冬氨酸、酪氨酸、脯氨酸、谷氨酸、丝氨酸和苏氨酸,其物质的量之比为 2 : 1 : 1 : 1 : 1 : 1,与bacillomycin D的氨基酸组成相符;使用氘代吡啶溶解样品,经 1H NMR测定,并与文献[17, 30]进行比对,确定 3 个目标化合物分别为C14 bacillomycin D、n-C15 bacillomycin D和 i-C15 bacillomycin D。
2.2 Bacillomycin D 发酵工艺的建立2.2.1 无机盐对bacillomycin D发酵水平的影响 当NaCl和KCl的质量浓度分别降至 0.5 和 0.04 g/L时,bacillomycin D的发酵水平分别提升了 44.58% 和 32.53%,且铁元素的增加对bacillomycin D的发酵水平无明显影响,因此TYg 3-2 生产菌可利用低盐度培养基在常规的金属发酵罐中生产bacillomycin D。然而,本研究不仅未获得可提升bacillomycin D发酵水平的二价金属离子,反而出现了明显的抑制作用,该结果与文献报道[25-26]有所不同。
根据低盐度、高含铁量培养基的试验结果,对人工海水配方进行调整:NaCl 10 g、MgCl2·6H2O 0.09 g、KCl 0.04 g、FePO4·4H2O 0.015 g及FeSO4·7H2O 0.15 g,用水定容至 1.0 L。采用新调配的人工海水定容葡萄糖-肉汤-人工海水培养基后,bacillomycin D 的发酵水平达到 (118.96 ± 2.97) mg/L,较优化前的 83.01 mg/L提升了 43.31%。因此后续研究均采用该配方的人工海水。
2.2.2 Bacillomycin D发酵培养基中碳源及氮源的优化 采用Design-Expert进行 4 因素 3 水平的Box-Behnken响应面优化试验设计 (表1),并根据其设计方案进行了摇瓶试验 (表2)。对表2中的试验结果进行二次回归方程 (式 2) 拟合,其方差分析结果见表3。
|
|
表 2 Box-Behnken 试验设计及结果 Table 2 Experimental design and results of Box-Behnken design |
|
|
表 3 方差分析结果 Table 3 ANOVA (analysis of variance) of regression model |
二次回归方程为:
| $\begin{split}Y = & 557.39 + 18.72A + 56.74B - 19.89C - 27.50D - \\[3pt] & 82.48AB + 70.20AC - 29.83AD - 80.73BC -\\[3pt] & 17.55BD + 10.53CD + 55.93{A^2} -22.17{B^2} - \\[3pt] & 91.49{C^2} + 32.23{D^2}\end{split}$ | (2) |
其中,Y为响应值,即bacillomycin D的产量 (mg/L);A、B、C和D 分别为葡萄糖、蛋白胨、酵母提取物和 (NH4)2SO4的编码值。
本次响应面优化中,其回归模型的显著性不显著,失拟项显著,变异系数 (CV/%) 偏高,决定系数 (R2) 和校正决定系数 (adj R2) 不接近 1,表明该模型的拟合度欠佳。推测其原因可能是由于无机氮源硫酸铵的应用大幅提升了bacillomycin D脂肽的发酵水平,而脂肽降低表面张力的能力可显著增强其产生菌利用培养基中各种底物的能力,甚至包括难溶于水的烃类化合物[31],因此脂肽的高产显著减弱了培养基组分和比例对发酵水平的影响,从而导致了培养基优化后bacillomycin D发酵水平提升明显但模型的方差分析结果却欠佳的情况。
本次响应面优化结果为:当 A = –0.96、B = 0.93、C = –0.62及 D = –0.81 时,即按葡萄糖 10.40 g/L、蛋白胨 14.65 g/L、酵母提取物 6.9 g/L和 (NH4)2SO4 0.19 g/L的比例配制培养基,用新调配的人工海水定容后,预测bacillomycin D的发酵水平可达 801.05 mg/L。
2.2.3 响应面优化结果的验证 对 2.2.2 节的优化结果进行摇瓶验证试验,发酵水平达到 (730.57 ± 16.75) mg/L,略低于预计的 801.05 mg/L,但仍比优化前的 83.01 mg/L提升了 780.10%。
2.2.4 5 L罐发酵工艺的建立 通过 5 L发酵罐试验验证了培养基的优化效果。发酵罐配六平叶涡轮桨,液面以上部位安装耙式消泡桨,发酵培养基采用 2.2.2 节中的优化培养基 (添加 1 mL植物油消泡剂),装液系数 0.5。种子摇瓶配方同发酵培养基,种龄为 12 h,接种量 12.5%。发酵过程中,除 0~5.4 h快速生长期需要保证 0.3 m3/(m3·min) 的通气速率外,其余时间通气速率均降至 0.05 m3/(m3·min)。高搅拌转速-低通气速率组合在保证溶氧以满足发酵制备的同时,还可抑制泡沫的生成,使其无法淹没耙式消泡桨 (大中型发酵罐采用此法抑制泡沫时需注意电机功率)。
研究表明,发酵开始后 48 h放罐最为经济。此时bacillomycin D的发酵水平达到 990 mg/L,比生产速率达到 20.62 mg/(L·h),远高于目前文献报道的 10.23 mg/(L·h) [32],菌体浓度为 2.33 × 109 CFU/mL,镜检时芽孢率接近 100%,即在此条件下可同时获得最高产量的脂肽和大量易于储存的TYg 3-2 芽孢。
2.3 高纯度 bacillomycin D 样品制备工艺的建立采用 5 L发酵罐制备高品质原料,进一步简化脂肽的可放大纯化工艺[23]:发酵液经 9 000 × g 离心 10 min,实现菌液分离;用 6 mol/L的盐酸调节发酵上清液pH值至 3.0,使产生沉淀,于 1 750 × g 离心 10 min后收集沉淀,用甲醇浸提沉淀物;浓缩甲醇溶液,冷却后用 6 倍体积的乙醚快速冲洗并混匀,抽滤收集沉淀 (注意对乙醚的回收);采用HZ806 大孔树脂处理沉淀样品的水溶液,经 25% 乙醇去除杂质之后,采用 4 倍床层体积的 50% 乙醇溶液洗脱bacillomycin D;减压浓缩回收乙醇,室温条件 (20~25 ℃) 下向洗脱液中添加 243 g/L的硫酸铵进行盐析,bacillomycin D和残余的乙醇析出并于液面形成“油层”;添加正丁醇进行萃取,规避耗时耗能且易于起泡的脂肽水溶液的蒸发浓缩,并提取bacillomycin D;最终经硅胶柱层析,收集 40%~50% 甲醇-氯仿洗脱液,去除硫酸铵污染物,获得纯度高达 94.72% 的 bacillomycin D 样品,总收率 61.41%。结合 2.2 节的发酵水平与规模,新的可放大纯化工艺可从 5 L 罐生产的发酵液中制备得到每批次产量为 1.80 g 的高纯度 bacillomycin D 样品。
2.4 Bacillomycin D 的初步抑菌活性研究2.4.1 平板拮抗试验结果 平板拮抗试验表明,C15 bacillomycin D对德氏霉菌、玉米弯孢霉、稻绿核菌和长柄链格孢均具有离体抑制活性 (表4)。比较离体试验的最低抑菌浓度可知,bacillomycin D非极性端 β-NH2-脂肪酸链中碳原子数量越多 (≤ 17 时),则活性越高,这与Tanaka等[17]报道的结论相符。
|
|
表 4 Bacillomycin D对植物病原真菌的离体抑制活性 Table 4 Antagonism effects of bacillomycin D against plant pathogen fungi in vitro |
2.4.2 群集运动试验结果 研究表明,bacillomycin D的表面活性可促进同源TYg 3-2 菌体的群集运动。但与通常所预计的含有脂肽的平板上将形成更大的菌苔不同,在 6.25~500 mg/L bacillomycin D的促进作用下,TYg 3-2 菌体在萌发前已经扩散至整个平板,因此在萌发时直接形成了覆盖整个平板的菌苔;与之相反,苯醚甲环唑则未表现出此效果,其菌体被完全抑制,未见萌发 (图3)。
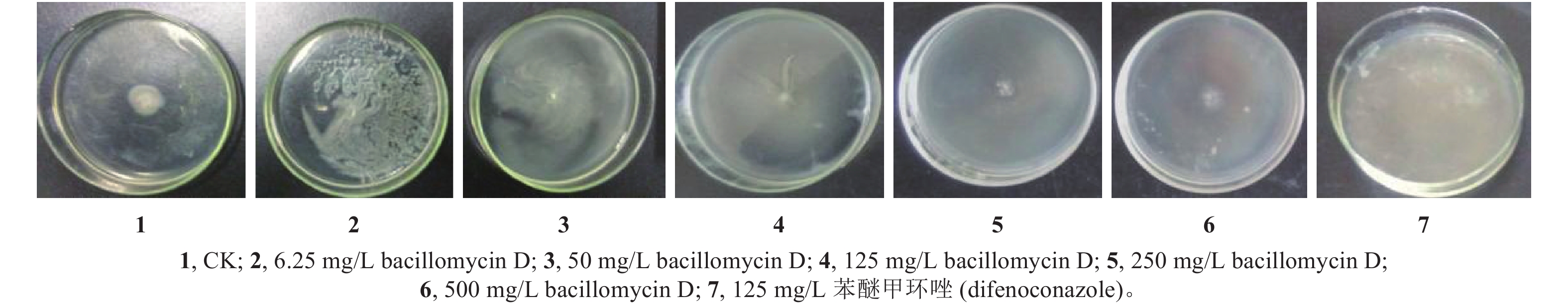
|
图 3 群集运动试验结果 Fig. 3 Swarming motility test |
2.4.3 盆栽试验结果 将 500 mg/L bacillomycin D与 4 × 106 CFU/mL的TYg 3-2 菌体混合施用,对黄瓜炭疽病的防效可达 95.3%,优于单独施用 500 mg/L bacillomycin D的 78.4%及单独施用 4 × 106 CFU/mL TYg 3-2 菌体的 0,但略逊于 125 mg/L苯醚甲环唑的 100%,表明bacillomycin D可显著提升同源TYg 3-2 菌体对黄瓜炭疽病的防效。
3 结论与讨论本研究依靠bacillomycin D规模纯化工艺所提供的充足高纯度样品,推动了对其抑菌活性的研究,获得了较好的结果:1) 首次报道了bacillomycin D在盆栽生测试验中对黄瓜炭疽病的防治作用,以及其对同源芽孢杆菌防治效果的提升作用;2) 拓展了bacillomycin D的抑菌谱。
Bacillomycin D等脂肽要开发成成熟的农用抗生素产品,需要经毒理学试验证明其安全性,但之前由于缺乏高纯度样品而难以开展相关研究[19, 33],而导致高纯度脂肽短缺的原因则在于其表面活性和起泡特性对发酵生产和下游分离纯化的干扰[19],因此需要结合中游发酵工艺优化和下游纯化工艺优化予以克服。
本研究建立的高产bacillomycin D的 5 L罐发酵工艺,其 20.62 mg/(L·h) 的比生产速率高于目前文献所报道的最高水平 [10.23 mg/(L·h)] [32]。其中培养基的选择避开了较粗糙的农副产品原料,转而选择了经加工后杂质相对较少的蛋白胨及酵母提取物,与组分明确的葡萄糖、硫酸铵组成复合培养基,并结合响应面优化,提升了发酵上清液溶质中脂肽的含量,从源头减少了样品中的杂质,有利于后续下游纯化工艺的简化,从而可有效克服絮凝-过滤法[19]、大孔树脂吸附法[34]和超滤法[35]等制备工艺中采用基本培养基因而不适合大规模发酵生产的问题[24]99-100。此外,TYg 3-2 菌体可在低盐度、高含铁量的培养基中高产bacillomycin D,这为之后更大规模的发酵生产打下了良好的基础。
本研究首次建立了bacillomycin D的可放大纯化工艺,最终样品的纯度可达 94.72%,制备规模达到克量级,可从 5 L 罐生产的发酵液中制备得到每批次产量为 1.80 g 的高纯度 bacillomycin D 样品,较原先HPLC的毫克量级[8, 17-18]有了显著提升。若在 50~500 L 规模发酵罐上进行 bacillomycin D 的中试规模发酵,其生产过程可根据 5 L 罐发酵工艺的参数与罐内结构的几何相似程度,相应调整通气速率和搅拌转速[36]68-72,并采用新建立的可放大纯化工艺对发酵液中的bacillomycin D 进行分离纯化,可获得百克量级的高纯度样品,足以满足与农药登记相关的毒理学试验要求 (样品纯度 > 85%) [20]。基于发酵原料和发酵工艺的优化,将已有的细菌源脂肽纯化工艺[23]的 10 个步骤精简至 6 个步骤,生产流程更为简单高效,并规避了脂肽表面活性干扰、水溶液浓缩困难和起泡等难题。
在脂肽的发酵罐生产过程中,起泡问题不容忽视。搅拌速率对于供氧系数 (KLa) 的影响大于通气速率对其的影响,而通气速率是泡沫积累最主要的外因之一[24, 36]178-180, 65-67。通过高搅拌转速-低通气速率相结合的办法,使起泡情况得到了明显的抑制,同时满足了发酵过程中的溶氧要求。然而,通气速率的改变将影响电机的轴功率 (搅拌功率) [36]54-58,如通气速率分别降低至原来的 10%~5%,则轴功率将上升至原先的 179%~213%,因此需注意对电机的保护,大中型发酵罐尤其需要注意。假如不能通过调频降低转速 (17%~21%),则可根据电机的额定功率决定通气速率的降低幅度,例如通气速率降至原来的 40%、30% 和 20% 时,电机功率将上升 35%、50% 和 79%,此时需考虑添加消泡剂,以应对可能的起泡,防止染菌、溢液等情况。
此外需要格外注意的是,菌液分离是脂肽开发的必经之路。若将 2.2 节中发酵罐生产 48 h的发酵液不经菌液分离直接喷雾干燥制成微生物菌剂,排除热降解和菌体死亡率的影响,在稀释 580 倍重新形成 4 × 106 CFU/mL菌体悬浮液之后,其中bacillomycin D的质量浓度仅为 1.71 mg/L,则群集运动的促进作用可能因为bacillomycin D的过度稀释而难以发挥效应。而以中国华东地区 6–7 月份平均气温 28 ℃、相对湿度 80% 的气象条件[36]234为例,如将菌液分离-喷雾干燥相结合,先将 1 t发酵液进行菌液分离,再采用 0.2 t水重新悬浮菌体和载体,并以进口温度为 120 ℃的热空气干燥,相比于 190 ℃热空气直接蒸发 1 t发酵液,能耗减少 83%,通气量 (工时) 也可减少 69%[36]159-160,而且由于条件更为温和,菌体的存活率也将有所上升[24, 36]121-122, 6-7,因此既有利于高含菌量生防菌剂的生产,也节约了与发酵生产等相关的固定成本。而菌液分离后获得的上清液可供高效提取脂肽类抗生素所用,为之后将两者混合施用提升防效创造了条件。
| [1] | CARVALHO F P. Agriculture, pesticides, food security and food safety[J]. Environ Sci Policy, 2006, 9(7-8): 685–692. doi:10.1016/j.envsci.2006.08.002 |
| [2] | SHODA M. Bacterial control of plant diseases[J]. J Biosci Bioeng, 2000, 89(6): 515–521. doi:10.1016/S1389-1723(00)80049-3 |
| [3] | DELEU M, PAQUOT M. From renewable vegetables resources to microorganisms: new trends in surfactants[J]. C R Chimie, 2004, 7(6-7): 641–646. doi:10.1016/j.crci.2004.04.002 |
| [4] | DONIO M B S, RONICA S F A, THANGA VIJI V, et al. Isolation and characterization of halophilic Bacillus sp. BS3 able to produce pharmacologically important biosurfactants [J]. Asian Pac J Trop Med, 2013, 6(11): 876–883. doi:10.1016/S1995-7645(13)60156-X |
| [5] | SARAVANAKUMARI P, MANI K. Structural characterization of a novel xylolipid biosurfactant from Lactococcus lactis and analysis of antibacterial activity against multi-drug resistant pathogens [J]. Bioresour Technol, 2010, 101(22): 8851–8854. doi:10.1016/j.biortech.2010.06.104 |
| [6] | PABEL C T, VATER J, WILDE C, et al. Antimicrobial activities and matrix-assisted laser desorption/ionization mass spectrometry of Bacillus isolates from the marine sponge Aplysina aerophoba [J]. Mar Biotechnol, 2003, 5(5): 424–434. doi:10.1007/s10126-002-0088-8 |
| [7] | GANDHIMATHI R, SEGHAL KIRAN G S, HEMA T A, et al. Production and characterization of lipopeptide biosurfactant by a sponge-associated marine actinomycetes Nocardiopsis alba MSA10 [J]. Bioprocess Biosyst Eng, 2009, 32(6): 825–835. doi:10.1007/s00449-009-0309-x |
| [8] | GONG Q W, ZHANG C, LU F X, et al. Identification of bacillomycin D from Bacillus subtilis fmbJ and its inhibition effects against Aspergillus flavus [J]. Food Control, 2014, 36(1): 8–14. doi:10.1016/j.foodcont.2013.07.034 |
| [9] | INÈS M, DHOUHA G. Lipopeptide surfactants: production, recovery and pore forming capacity[J]. Peptides, 2015, 71: 100–112. doi:10.1016/j.peptides.2015.07.006 |
| [10] | ONGENA M, JACQUES P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol [J]. Trends Microbiol, 2008, 16(3): 115–125. doi:10.1016/j.tim.2007.12.009 |
| [11] | WANG B B, YUAN J, ZHANG J, et al. Effects of novel bioorganic fertilizer produced by Bacillus amyloliquefaciens W19 on antagonism of Fusarium wilt of banana [J]. Biol Fertil Soils, 2013, 49(4): 435–446. doi:10.1007/s00374-012-0739-5 |
| [12] | CAO Y, XU Z H, LING N, et al. Isolation and identification of lipopeptides produced by B. subtilis SQR 9 for suppressing Fusarium wilt of cucumber [J]. Sci Hortic, 2012, 135: 32–39. doi:10.1016/j.scienta.2011.12.002 |
| [13] | YE Y F, LI Q Q, FU G, et al. Identification of antifungal substance (iturin A2) produced by Bacillus subtilis B47 and its effect on southern corn leaf blight [J]. J Integr Agric, 2012, 11(1): 90–99. doi:10.1016/S1671-2927(12)60786-X |
| [14] | ONGENA M, JOURDAN E, ADAM A, et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants [J]. Environ Microbiol, 2007, 9(4): 1084–1090. doi:10.1111/emi.2007.9.issue-4 |
| [15] | GEETHA I, MANONMANI A M, PAILY K P. Identification and characterization of a mosquito pupicidal metabolite of a Bacillus subtilis subsp. subtilis strain [J]. Appl Microbiol Biotechnol, 2010, 86(6): 1737–1744. doi:10.1007/s00253-010-2449-y |
| [16] | MNIF I, ELLEUCH M, CHAABOUNI S E, et al. Bacillus subtilis SPB1 biosurfactant: production optimization and insecticidal activity against the carob moth Ectomyelois ceratoniae [J]. Crop Prot, 2013, 50: 66–72. doi:10.1016/j.cropro.2013.03.005 |
| [17] | TANAKA K, ISHIHARA A, NAKAJIMA H. Isolation of anteiso-C17, iso-C17, iso-C16, and iso-C15 bacillomycin D from Bacillus amyloliquefaciens SD-32 and their antifungal activities against plant pathogens [J]. J Agric Food Chem, 2014, 62(7): 1469–1476. doi:10.1021/jf404531t |
| [18] | QIAN S Q, LU H D, SUN J, et al. Antifungal activity mode of Aspergillus ochraceus by bacillomycin D and its inhibition of ochratoxin A (OTA) production in food samples [J]. Food Control, 2016, 60: 281–288. doi:10.1016/j.foodcont.2015.08.006 |
| [19] | ZHANG D L, WANG Y F, LU Y J, et al. An efficient method for separation of surfactin from Bacillus amyloliquefaciens fmb50 broth by flocculation [J]. Process Biochem, 2014, 49(7): 1182–1188. doi:10.1016/j.procbio.2014.03.021 |
| [20] |
农药登记毒理学试验方法: GB/T 15670—1995[S]. 北京: 中国标准出版社, 1996.
Toxicological test methods of pesticides for registration: GB/T 15670—1995[S]. Beijing: Standards Press of China, 1996. |
| [21] | CHEON J, KIM S B, PARK S W, et al. Characterization of L-arabinose isomerase in Bacillus subtilis, a GRAS host, for the production of edible tagatose [J]. Food Biotechnol, 2009, 23(1): 8–16. doi:10.1080/08905430802671873 |
| [22] | VELIVELLI S L S, DE VOS P, KROMANN P, et al. Biological control agents: from field to market, problems, and challenges[J]. Trends Biotechnol, 2014, 32(10): 493–496. doi:10.1016/j.tibtech.2014.07.002 |
| [23] |
顾康博, 管成, 许家慧, 等. 中试规模纯化海洋芽孢杆菌源脂肽类化合物[J]. 生物工程学报, 2016, 32(11): 1549–1563.
GU K B, GUAN C, XU J H, et al. Pilot-scale purification of lipopeptide from marine-derived Bacillus marinus [J]. Chin J Biotech, 2016, 32(11): 1549–1563. |
| [24] |
俞俊棠, 唐孝宣, 邬行彦, 等. 新编生物工艺学(上册)[M]. 北京: 化学工业出版社, 2003.
YU J T, TANG X X, WU X Y, et al. New biotechnology (Vol.1)[M]. Beijing: Chemical Industry Press, 2003. |
| [25] | ABDEL-MAWGOUD A M, ABOULWAFA M M, HASSOUNA N A H. Optimization of surfactin production by Bacillus subtilis isolate BS5 [J]. Appl Biochem Biotechnol, 2008, 150(3): 305–325. doi:10.1007/s12010-008-8155-x |
| [26] | WEI Y H, WANG L F, CHANG J S. Optimizing iron supplement strategies for enhanced surfactin production with Bacillus subtilis [J]. Biotechnol Prog, 2004, 20(3): 979–983. doi:10.1021/bp030051a |
| [27] | KEARNS D B, LOSICK R. Swarming motility in undomesticated Bacillus subtilis [J]. Mol Microbiol, 2003, 49(3): 581–590. |
| [28] | DANIELS R, VANDERLEYDEN J, MICHIELS J. Quorum sensing and swarming migration in bacteria[J]. FEMS Microbiol Rev, 2004, 28(3): 261–289. doi:10.1016/j.femsre.2003.09.004 |
| [29] |
陈义娟, 贾福丽, 陈佳, 等. 植物提取物对黄瓜炭疽病的抑制作用及其苗期防治效果[J]. 上海交通大学学报(农业科学版), 2011, 29(4): 67–71.
CHEN Y J, JIA F L, CHEN J, et al. Inhibition of plant extracts against Colletotrichum lagenarium and control effect at the seedling stage [J]. J Shanghai Jiaotong Univ (Agric Sci), 2011, 29(4): 67–71. |
| [30] |
闫大壮, 肖明, 薛春佳, 等. 杆菌霉素 D (Bacillomycin D) 的分离纯化及结构鉴定[J]. 中国医药工业杂志, 2015, 46(3): 240–244.
YAN D Z, XIAO M, XUE C J, et al. Isolation, purification and structural identification of bacillomycin D[J]. Chin J Pharm, 2015, 46(3): 240–244. |
| [31] | MUKHERJEE A K, DAS K. Correlation between diverse cyclic lipopeptides production and regulation of growth and substrate utilization by Bacillus subtilis strains in a particular habitat [J]. FEMS Microbiol Ecol, 2005, 54(3): 479–489. doi:10.1016/j.femsec.2005.06.003 |
| [32] | QIAN S Q, LU H D, MENG P P, et al. Effect of inulin on efficient production and regulatory biosynthesis of bacillomycin D in Bacillus subtilis fmbJ [J]. Bioresour Technol, 2015, 179: 260–267. doi:10.1016/j.biortech.2014.11.086 |
| [33] | VIJAYAKUMAR S, SARAVANAN V. Biosurfactants-types, sources and applications[J]. Res J Microbiol, 2015, 10(5): 181–192. doi:10.3923/jm.2015.181.192 |
| [34] | DHANARAJAN G, RANGARAJAN V, SEN R. Dual gradient macroporous resin column chromatography for concurrent separation and purification of three families of marine bacterial lipopeptides from cell free broth[J]. Sep Purif Technol, 2015, 143: 72–79. doi:10.1016/j.seppur.2015.01.025 |
| [35] | CHEN H L, CHEN Y S, JUANG R S. Separation of surfactin from fermentation broths by acid precipitation and two-stage dead-end ultrafiltration processes[J]. J Membr Sci, 2007, 299(1-2): 114–121. doi:10.1016/j.memsci.2007.04.031 |
| [36] |
陈国豪, 俞俊棠. 生物工程设备[M]. 北京: 化学工业出版社, 2007.
CHEN G H, YU J T. Bioengineering equipment[M]. Beijing: Chemical Industry Press, 2007. |
 2017, Vol. 19
2017, Vol. 19


