2. 西北农林科技大学 陕西省植物源农药研究与开发重点实验室,陕西 杨凌 712100
2. Shaanxi Province Key Laboratory Research & Development on Botanical Pesticides, Northwest A&F University, Yangling 712100, Shaanxi Province, China
从植物内生菌次生代谢物中筛选抗菌、杀虫和除草活性农用抗生素,是新型生物农药研发的一个重要途径[1-2]。前期研究中,笔者所在课题组从冬青卫矛中分离鉴定出一株内生真菌Cylindrocarpon olidum W1,发现其代谢产物对多种植物病原细菌和真菌均有明显的抗菌活性[3]。Cylindrocarpon (柱孢属) 真菌是人参和西洋参锈腐病的重要病原菌,其主要代谢产物为具有抗癌活性的酚醛倍半萜类化合物[4]。为了明确C. olidum W1活性代谢物的结构,在抑菌活性追踪指导下,笔者从其代谢产物中分离鉴定出8个具有抑菌活性化合物,经高分辨质谱、核磁共振波谱等技术将其鉴定为壳二孢氯素 (ascochlorin) 及其类似物。现将部分结果报道如下。
1 材料与方法 1.1 供试材料1.1.1 菌株 Cylindrocarpon olidum W1,保存于西北农林科技大学农药研究所。
1.1.2 培养基 PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1 000 mL,pH 7.0,用于C. olidum W1菌株斜面、平板培养及病原真菌培养;
马铃薯葡萄糖液体培养基:土豆200 g,蛋白胨0.5 g,葡萄糖10 g,乙酸钠1.66 g,蔗糖10 g,MgSO4·7H2O 1.02 g,蒸馏水1 000 mL,pH 7.0,用于C. olidum W1菌株摇瓶发酵;
牛肉膏蛋白胨琼脂培养基:牛肉膏3.0 g、蛋白胨10 g、氯化钠5.0 g、琼脂15 g、蒸馏水1 000 mL,pH 7.0~7.2及Mueller-Hinton肉汤培养基 (杭州大和微生物试剂有限公司) 用于病原细菌培养。
所有培养基在121 ℃、1 × 105 Pa下灭菌30 min,备用。
1.1.3 供试病原细菌 白菜软腐病菌Erwinia carotovora、猕猴桃溃疡病菌Pseudomonas syringae和水稻白叶枯病菌Xanthomonas oryzae pv. oryzae由西北农林科技大学植物病理研究室提供;烟草青枯病菌Ralstonia solanacearum由西南大学植物保护学院提供。将病原细菌接种于牛肉膏蛋白胨琼脂培养基,于37 ℃下培养1 d。
1.1.4 供试病原真菌 番茄灰霉病菌Botrytis cinerea、小麦赤霉病菌Fusarium graminearum、苹果炭疽病菌Colletotrichum gloeosporioides、玉米弯孢病菌Curvularia lunata、烟草赤星病菌Alternaria alternate、茄子黄萎病菌Verticillium dahlia、油菜菌核病菌Sclerotinia sclerotiorum和苹果树腐烂病菌Valsa mali由西北农林科技大学农药研究所提供;棉花枯萎病菌Fusarium oxysporum f. sp. vasinfectum由西北农林科技大学植物病理研究室提供。将病原真菌接种于PDA培养基,于25 ℃下培养3~7 d。
1.1.5 主要仪器及试剂 分析型HPLC系统:Shimadzu LC-6AD高效液相色谱仪,具二极管阵列检测器,日本岛津公司;制备型HPLC系统:LC3000高效液相色谱仪,配紫外检测器,北京创新通恒科技有限公司;Bruker APEX Ⅱ质谱仪和Bruker RPX 500 MHz核磁共振仪,德国布鲁克公司;WPR熔点仪,上海精科仪器有限公司;Synergy超纯水系统,美国密理博公司。
甲醇 (HPLC级)(美国Tedia公司);200~300目 (粒径54~74 μm) 硅胶 (青岛海洋化工厂);氨苄青霉素 (USP级)(上海国药集团化学试剂有限公司);嘧菌酯 (azoxystrobin),(百灵威科技有限公司);石油醚、乙酸乙酯均为市售分析纯。
1.2 试验方法1.2.1 种子液制备 将斜面保存的W1菌株接种于PDA平板培养基上,于25 ℃恒温培养7 d,无菌条件下,将活化好的平板制成3 cm × 3 cm菌饼接种于100 mL马铃薯葡萄糖液体培养基中,于180 r/min、25 ℃振荡培养16 h。
1.2.2 发酵液制备 将制备好的种子液以体积分数为20%的量接种于100 mL马铃薯葡萄糖液体培养基中,于180 r/min、25 ℃振荡培养12 d。
1.2.3 活性成分的分离及鉴定 将50 L发酵液用多层纱布过滤后收集菌体,置于 –70 ℃冰箱中冷冻24 h,转移至冻干机中冻干。冻干后的菌丝体以甲醇为溶剂超声提取2次,每次1 h;合并有机相,减压浓缩,浓缩液用少量硅胶拌匀晾干后进行硅胶柱层析,依次用V (石油醚):V (乙酸乙酯)=9:1~1:1、乙酸乙酯、V (乙酸乙酯):V (甲醇)=9:1~1:1及甲醇梯度洗脱。每200 mL收集1份,经薄层层析 (TLC) 检测后合并相同组分,共得6个馏分Fr01-Fr06,其中Fr02为一纯化合物W1-6 (10.5 g)。以烟草青枯病菌R. solanacearum 为活性指示菌,采用滤纸片法进行抑菌活性追踪测试,将活性组分Fr01 (2.34 g) 和Fr03 (1.21 g) 采用反相高效液相色谱进行制备纯化,分别得化合物W1-1~W1-5 (214、389、154、261和94 mg)、W1-7 (394 mg) 和W1-8 (287 mg)。采用1 H NMR、13 C NMR和ESI-MS等技术对其进行结构鉴定。
1.2.4 抑菌活性测定
1.2.4.1 对病原细菌的抑制作用 采用微量稀释法[5]。从琼脂培养基中挑取4~5个相同形态的供试菌菌落,接入1.0 mL灭菌的Mueller-Hinton肉汤中,于35 ℃培养至轻度混浊后转入0.9%生理盐水中,调整到麦氏浊度为0.5,再用Mueller-Hinton肉汤稀释200倍,其接种量相当于7.5 × 105 cfu/mL。将稀释好的接种液转入96孔板中,每孔100 μL,再分别加入100 μL不同质量浓度的药液,使最终浓度分别为100、50、25、12.5、6.25、3.13、1.56、0.78和0.39 μg/mL,每板另设不加药剂的空白对照、氨苄青霉素 (Ampicillin) 阳性对照和加药不接菌阴性对照。每处理重复3次。于35 ℃培养20 h,记录药剂对供试细菌的最低抑菌浓度 (MIC)。
1.2.4.2 对病原真菌的抑制作用 采用菌丝生长速率法[6]。准确称取10 mg待测化合物,先用500 μL二甲基亚砜 (DMSO) 溶解后,用无菌水配制成质量浓度为10 mg/mL的母液。用无菌水将供试药液母液进行梯度稀释,得到系列浓度药液。将1.0 mL药液与9.0 mL融化的PDA培养基混匀,倒入无菌培养皿中制成带药培养基平板。待培养基凝固后,在每个培养基平面接入1个供试真菌菌饼 (直径为4 mm),使带菌丝的一面贴在培养基表面。每处理3次重复。于25 ℃恒温箱中培养72~96 h,用十字交叉法测量菌落生长直径,按 (1) 式计算菌丝生长抑制率。
| ${\text{菌丝生长抑制率}}/{\text{%}} =\frac{\text{对照菌落直径} - \text{处理菌落直径}}{\text{对照菌落直径} - \text{菌饼直径}} \times 100$ | (1) |
所得数据用SPSS软件求出毒力回归方程及抑制中浓度 (EC50值) 及相关性分析。
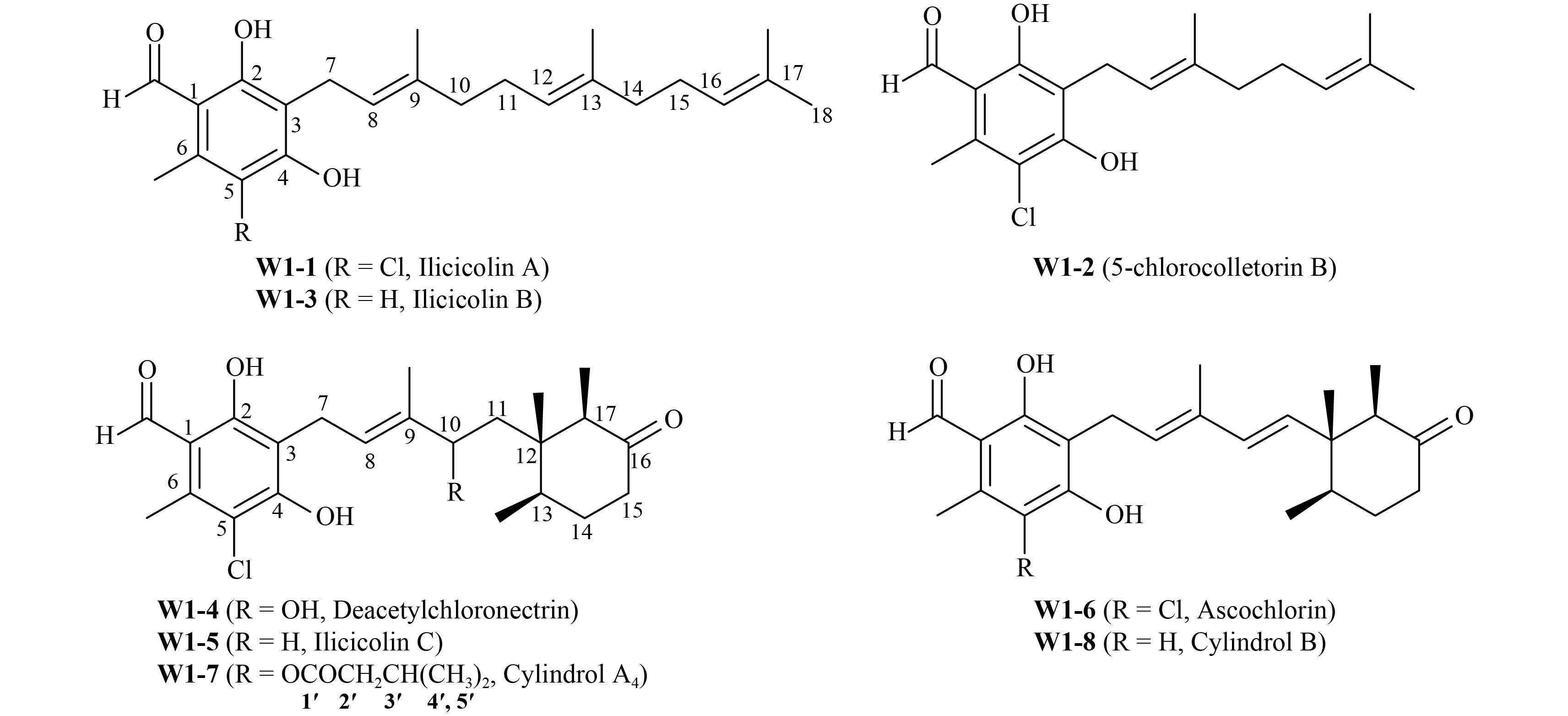
2 结果与分析 2.1 活性成分分离及结构鉴定以抑菌活性追踪为指导,经大孔吸附树脂吸附,甲醇解析,硅胶柱层析等方法从菌株C. olidum W1发酵产物中分离出8个活性化合物W1-1~W1-8,经高分辨质谱、核磁共振波谱等技术将其鉴定为壳二孢氯素及其类似物,其结构见图式1,相关核磁共振氢谱和碳谱数据见表1和表2。
|
图式 1 Ascochlorin及其类似物的结构 Scheme1 Structure of Ascochlorin and its analogues |
|
|
表 1 化合物W1-1~W1-8的核磁共振氢谱数据 Table 1 1H NMR data of W1-1–W1-8 in CDCl3 |
|
|
表 2 化合物W1-1~W1-8的核磁共振碳谱数据 Table 2 13C NMR data of W1-1–W1-8 |
W1-1,淡黄色晶体,C23H31ClO3,熔点:71~72 ℃ (文献值[7]:72~72.5 ℃);UV (λMeOH):202,229,293,368 nm;HRMS:[M–H]–,m/z 389.187 9 (计算值:389.188 3),相对分子质量为390。1H、13C NMR数据与Hosono等[8]报道的Ilicicolin A基本一致,故将化合物W1-1鉴定为Ilicicolin A。
W1-2,淡黄色粉末,C18H23ClO3,熔点:88.1~88.4 ℃ (文献值[9]:88 ℃);UV(λMeOH):204,228,293 nm;HRMS:[M–H]–,m/z 321.126 1 (计算值:321.125 7),相对分子质量为322。1H、13C NMR数据与Singh等[4]报道的5-chlorocolletorin B基本一致,故将化合物W1-2鉴定为5-chlorocolletorin B。
W1-3,淡黄色粉末,C23H31O3,熔点:97~98 ℃ (文献值[7]:97~98.5 ℃);UV(λMeOH):206,298 nm;HRMS:[M–H]–,m/z 354.219 9 (计算值:354.219 5),相对分子质量为355。1H、13C NMR数据与Guo等[10]报道的Ilicicolin B基本一致,故将化合物W1-3鉴定为Ilicicolin B。
W1-4,无色晶体,C23H31ClO5,熔点:136.5~138.1 ℃ (文献值[11]:138 ℃);UV(λMeOH):206,228,293,337 nm;HRMS:[M–H]–,m/z 421.177 9 (计算值:421.178 2),相对分子质量为422。1H、13C NMR数据与Seephonkai等[12]报道的Deacetylchloronectrin基本一致,故将化合物W1-4鉴定为Deacetylchloronectrin。
W1-5,淡黄色晶体,C23H31ClO4,熔点:135.1~136.5 ℃ (文献值[7]:134~136 ℃);UV(λMeOH):206,228,294 nm;HRMS:[M–H]–,m/z 405.183 0 (计算值:405.183 3),相对分子质量为406。1H、13C NMR数据与Gutiérrez等[13]报道的Ilicicolin C基本一致,故将化合物W1-5鉴定为Ilicicolin C。
W1-6,C23H29ClO4,淡黄色晶体,熔点:151~153 ℃ (文献值[7]:153~154 ℃);UV (λMeOH):206,222,298 nm;HRMS:[M–H]–,m/z 406.167 9 (计算值:403.167 6),相对分子质量为404。1H、13C NMR数据与Takamatsu等[14]报道的Ascochlorin基本一致,故将化合物W1-6鉴定为Ascochlorin。
W1-7,无色油状,C28H39ClO6,UV(λMeOH):209,225,291 nm;HRMS:[M–H]–,m/z 505.235 5 (计算值:505.235 7),相对分子质量为506。1H、13C NMR数据与Singh等[4]报道的Cylindrol A4基本一致,故将化合物W1-7鉴定为Cylindrol A4。
W1-8,无色油状,C23H30O4,UV(λMeOH):205,222,298 nm;HRMS:[M–H]–,m/z 369.207 0 (计算值:369.206 6),相对分子质量为370。1H、13C NMR数据与Singh等[4]报道的Cylindrol B基本一致,故将化合物W1-8鉴定为Cylindrol B。
2.2 化合物的抑菌活性2.2.1 对病原细菌的抑制作用 由表3可以看出,W1-1~W1-8对供试4种农业病原细菌的抑菌活性差异较大,其中,对烟草青枯病菌的抑制活性较为明显,其MIC值分别为6.25、3.13、> 100、3.13、6.25、12.5、25 和25 μg/mL,对白菜软腐病菌抑菌活性较差,其MIC值均 ≥ 50 μg/mL。化合物W1-2、W1-4和W1-5的抑菌活性优于其余化合物。
|
|
表 3 目标化合物对4种农业病原细菌的MIC值 Table 3 MIC values of target compounds against four strains of agricultural bacteria |
2.2.2 对植物病原真菌的抑制作用 由表4可以看出,目标化合物对供试的9种植物病原真菌菌丝生长均有不同程度的抑制作用,其中对番茄灰霉病菌和油菜菌核病菌菌丝生长的抑制作用尤为明显。与抗细菌活性类似,化合物W1-2、W1-4和W1-5的抗真菌活性亦明显高于其余化合物。进一步毒力测定结果表明 (表5),化合物W1-2、W1-4及W1-5对番茄灰霉病菌的IC50值分别为36.45、21.60和26.69 μg/mL;对油菜菌核病菌的IC50值分别为20.21、16.79 和12.11 μg/mL。
|
|
表 4 目标化合物对9种供试病原真菌菌丝生长的抑制作用 (100 μg/mL) Table 4 Inhibition effect of target compounds against the mycelial growth of nine tested fungi (100 μg/mL) |
|
|
表 5 目标化合物对供试植物病原真菌的毒力 Table 5 Toxicity of target compounds against tested fungi |
3 讨论
壳二孢氯素属于异戊烯酚类抗生素,研究发现,该类抗生素具有多种生物学活性,如抗真菌、杀灭疟原虫和杰氏肺囊虫、抑制肿瘤细胞增殖等[15]。壳二孢氯素最初由日本学者Tamura[16]于1968年从丝孢纲壳二孢属真菌蚕豆壳二孢的代谢产物中分离得到。1994年,Takamatsu[14]又于日本静冈土壤真菌Verticillium sp. FO-2787的菌丝体中分离得到该化合物。壳二孢氯素作用于真菌线粒体,通过抑制微生物的呼吸作用破坏其能量代谢,与目前大多数呼吸电子链抑制剂仅选择性地作用于Q0或Qi位点不同,壳二孢氯素同时可结合于Q0和Qi两个作用位点[17]。作用靶标单一的杀菌剂面临的重要问题就是抗性问题,如甲氧基丙烯酸酯类杀菌剂。从作用机理上来看,壳二孢氯素属于多靶点杀菌剂,与大多数呼吸抑制剂相比更不容易产生抗药性。本研究从冬青卫矛内生真菌C. olidum W1中分离鉴定出壳二孢氯素及多个类似物,首次系统评价了其对多种农业致病细菌和致病真菌的抑菌活性,丰富了壳二孢氯素及其类似物的农用生物活性。结果表明,该类化合物的抑菌活性与其侧链异戊烯基的长短有关 (如化合物W1-2抑菌活性明显高于W1-1),同时受侧链C11-C12化学键类型影响较大,C11-C12为不饱和碳碳双键时活性较差,为饱和碳碳单键时抑菌活性明显提高 (W1-4和W1-5抑菌活性明显高于W1-6)。这一结果为新型微生物农药的开发提供了素材和理论依据。
| [1] |
曹艳, 魏少鹏, 姬志勤. 冬青卫矛内生放线菌Streptomyces flavofuscus G1发酵液中抑菌活性成分研究
[J]. 农药学学报, 2015, 17(5): 616–621.
CAO Y, WEI S P, JI Z Q. Investigation on antimicrobial compounds from fermentation broth of Streptomyces flavofuscus G1, an endophyte isolated from Euonymus japonicas [J]. Chin J Pestic Sci, 2015, 17(5): 616–621. |
| [2] |
俞晓平, 陈列忠, 申屠旭萍. 植物内生菌及其代谢物在生物农药创制中的应用[J]. 浙江农业学报, 2006, 18(5): 289–293.
YU X P, CHEN L Z, SHENTU X P. Review on plant endophyte and its secondary metabolites in the application of producing bio-pesticides[J]. Acta Agric Zhejiangensis, 2006, 18(5): 289–293. |
| [3] |
曹艳. 冬青卫矛内生菌的分离及其活性代谢物研究[D]. 杨凌: 西北农林科技大学, 2016.
CAO Y. Investigation on endophytes of Euonymus japonicas and its bioactive metabolites[D]. Yangling: Northwest A&F University, 2016. |
| [4] | SINGH S B, BALL R G, BILLS G F, et al. Chemistry and biology of cylindrols: novel inhibitors of ras farnesyl-protein transferase from Cylindrocarpon lucidum [J]. J Org Chem, 1996, 61(22): 7727–7737. doi:10.1021/jo961074p |
| [5] | Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for Bacteria that grow aerobically; approved standard[S]. 8th ed. Wayne, PA, USA: Clinical and Laboratory Standards Institute, 2009. |
| [6] |
吴文君. 植物化学保护实验技术导论[M]. 西安: 陕西科学与技术出版社, 1988.
WU W J. Introduction to experimental techniques of plant chemical protection[M]. Xi’an: Shanxi Scientific & Technical Press, 1988. |
| [7] | HAYAKAWA S, MINATO H, KATAGIRI K. The ilicicolins, antibiotics from Cylindrocladium ilicicola [J]. J Antibiot, 1971, 24(9): 653–654. doi:10.7164/antibiotics.24.653 |
| [8] | HOSONO K, OGIHARA J, OHDAKE T, et al. LL-Z1272α epoxide, a precursor of ascochlorin produced by a mutant of Ascochyta viciae [J]. J Antibiot, 2009, 62(10): 571–574. doi:10.1038/ja.2009.80 |
| [9] | HUSSAIN H, DROGIES K HHeinz, AL-HARRASI A, et al. Antimicrobial constituents from endophytic fungus Fusarium sp. [J]. Asian Pac J Trop Dis, 2015, 5(3): 186–189. doi:10.1016/S2222-1808(14)60650-2 |
| [10] | GUO R H, ZHANG Y T, DUAN D, et al. Fibrinolytic evaluation of compounds isolated from a marine fungus Stachybotrys longispora FG216 [J]. Chin J Chem, 2016, 34(11): 1194–1198. doi:10.1002/cjoc.v34.11 |
| [11] | SASAKI H, HOSOKAWA T, NAWATA Y, et al. Isolation and structure of ascochlorin and its analogs[J]. Agric Biol Chem, 1974, 38(8): 1463–1466. doi:10.1080/00021369.1974.10861351 |
| [12] | SEEPHONKAI P, ISAKA M, KITTAKOOP P, et al. A Novel ascochlorin glycoside from the insect pathogenic fungus Verticillium hemipterigenum BCC 2370 [J]. J Antibiot, 2004, 57(1): 10–16. doi:10.7164/antibiotics.57.10 |
| [13] | GUTIEÁRREZ M, THEODULOZ C, RODRIÁGUEZ J, et al. Bioactive metabolites from the fungus Nectria galligena, the main apple canker agent in Chile [J]. J Agric Food Chem, 2005, 53(20): 7701–7708. doi:10.1021/jf051021l |
| [14] | TAKAMATSU S, RHO M C, MASUMA R, et al. A novel testosterone 5α-reductase inhibitor, 8′, 9′-dehydroascochlorin produced by Verticillium sp. FO-2787 [J]. Chem Pharm Bull, 1994, 42(4): 953–956. doi:10.1248/cpb.42.953 |
| [15] |
刘小宇. 两株真菌的次生代谢产物结构鉴定及生物学活性研究[D]. 上海: 第二军医大学, 2016.
LIU X Y. Researches on structure elucidation and biological activities investigation of secondary metabolites of two polar fungi[D]. Shanghai: The Second Military Medical University, 2016. |
| [16] | TAMURA G, SUZUKI S, TAKATSUKI A, et al. Ascochlorin, a new antibiotic, found by paper-disc agar-diffusion method. I: isolation, biological and chemical properties of ascochlorin (studies on antiviral and antitumor antibiotics. I)[J]. J Antibiot, 1968, 21(9): 539–544. doi:10.7164/antibiotics.21.539 |
| [17] | BERRY E A, HUANG L S, LEE D W, et al. Ascochlorin is a novel, specific inhibitor of the mitochondrial cytochrome bc1 complex [J]. Biochim Biophys Acta, 2010, 1797(3): 360–370. doi:10.1016/j.bbabio.2009.12.003 |
 2017, Vol. 19
2017, Vol. 19


