2. 陕西省生物农药工程技术研究中心,陕西 杨凌 712100;
3. 陕西上格之路生物科学有限公司,陕西 周至 710400
2. Biopesticide Technology & Engineering Center of Shaanxi Province, Yangling 712100, Shaanxi Province, China;
3. Shaanxi Sunger Road Bio-Science Co., LTD, Zhouzhi 710400, Shaanxi Province, China
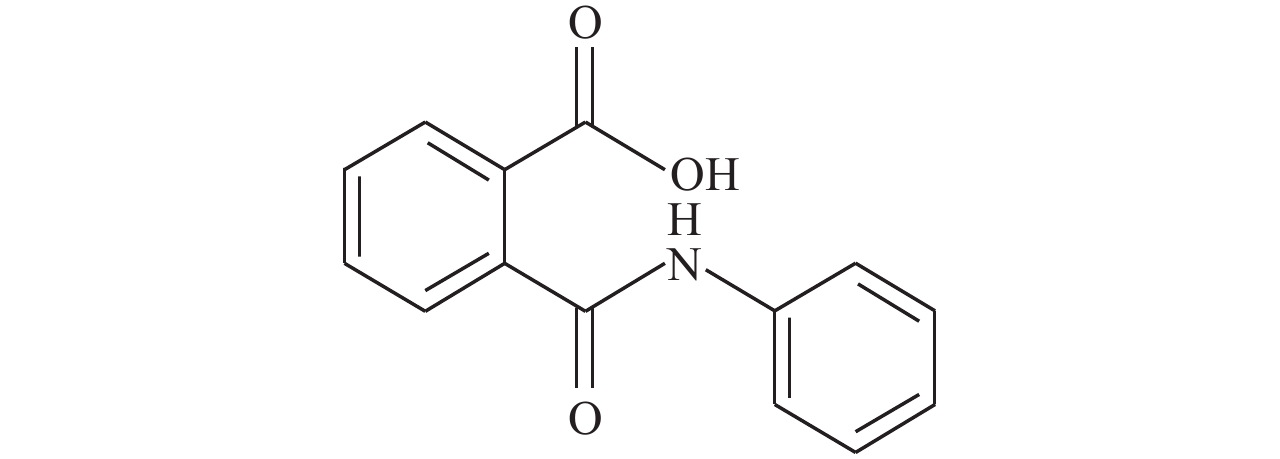
苯肽胺酸 (phthalamic acid, 以下简称PPA,结构式见图式 1) 是1982年由匈牙利Neviki化学工业研究所开发的植物生长调节剂,于1993年商业化生产并投入使用。其具有保花保果、提高抗逆性、改善果实品质、提高产量等功效,在枣、杏、李、荔枝、葡萄、芒果、猕猴桃、苹果等果树上使用均有良好表现[1]。在田间试验中,笔者所在课题组多次观察到应用苯肽胺酸后,辣椒、苹果、豇豆等多种作物均表现出叶色浓绿、抗性提高、产量增加等效应。然而,迄今为止,未见与上述功效相关的研究型报道,其作用机理也不清楚。
|
图式 1 苯肽胺酸化学结构 Scheme1 Phthalamic acid chemical structure |
逆境 (旱涝、低温、盐碱及病虫害等) 是影响植物生长发育及产量与品质的重要因素,植物生长调节剂往往具有诱导作物提高抗逆性、提高作物产量的功效[2-3]。因此,从提高植株抗逆性及果实产量角度探究苯肽胺酸对作物的影响,可为进一步探求该药剂的作用机理及其田间推广应用提供依据,具有重要的理论及实践指导意义。鉴于此,本研究以辣椒为供试对象,在田间小区试验条件下于辣椒的不同生长发育期,以不同剂量的苯肽胺酸处理,评价其对辣椒抗逆生理指标及前期产量的影响,现将结果报道如下。
1 材料与方法 1.1 供试材料辣椒Capsicum annuum L.,供试品种为世纪红,由西北农林科技大学园艺学院提供;20%苯肽胺酸可溶性液剂 (phthalanilic acid SL),陕西上格之路生物科学有限公司;0.007 5%芸苔素内酯水剂 (brassinolides AS),成都新朝阳作物科学有限公司;史丹利复合肥,史丹利化肥当阳有限公司;沃夫特水溶性肥,临沂沃夫特复合肥有限公司;80%代森锰锌可湿性粉剂 (mancozeb WP),成都好景年农资发展有限公司;70%甲基硫菌灵可湿性粉剂 (thiophanate-Methyl WP),西安美邦药业有限公司;75%百菌清可湿性粉剂 (chlorothalonil WP),霍州市绿洲农药有限公司。
1.2 试验设计苯肽胺酸对辣椒生理特性及前期产量的测定采用田间小区试验。试验在西北农林科技大学北校区试验田进行。供试土壤为关中塿土,土壤肥力中等,耕层10~20 cm,含有机质10.2 g/kg、全氮1.20 g/kg、全磷 (P2O5) 0.18 g/kg、有效磷 (P) 5.37 mg/kg、速效钾140 mg/kg,长期以种植小麦和玉米为主。辣椒于2016 年 4 月 29 日 (6~7片真叶期) 单株定植,株行距30 cm × 60 cm,垄带沟110 cm。试验设20%苯肽胺酸可溶性液剂266.7、200.0和133.3 mg/L 3个质量浓度处理,以0.007 5%芸苔素内酯水剂1 000倍稀释液 (质量浓度为0.075 mg/L) 为药剂对照,清水处理为空白对照,共计5个处理;每处理均设3个重复,共计15个小区,小区面积为14 m2,随机区组排列。采用背负杠杆式手动喷雾器于辣椒叶片正反两面进行常量喷雾,使雾滴在受药表面均匀分布,且不超过流失点。分别于5月11日 (苗期)、6月8日 (显蕾期) 和6月27日 (初花期) 喷施3次,喷液量依次为300、600和600 kg/hm2。于不同的调查期在每小区随机取样,测定植株相关生理指标和果实产量。试验期间的田间管理措施为:定植前撒施史丹利复合肥作为基肥 (用量为750 kg/hm2),门椒期追施沃夫特水溶性肥 (用量75 kg/hm2);分别于5月6日 (移栽后7 d)、6月20日 (门椒期) 和7月2日 (果期) 浇水3次;分别于7月1日和7月30日采用背负杠杆式手动喷雾器常量喷施80%代森锰锌可湿性粉剂、70%甲基托布津可湿性粉剂和75%百菌清可湿性粉剂防治辣椒果实炭疽病 (稀释1 000倍)。
1.3 测定方法1.3.1 植株相关生理指标的测定 分别于苗期 (6月8日)、蕾期 (6月19日)、花期 (7月4日)、初果期 (7月11日) 和盛果期 (7月18日) 在每小区随机取样10株,用打孔器在每株辣椒苗相同功能叶 (倒五叶) 部位打取叶圆片,进行植株抗逆性测定。抗氧化酶系活性测定参照Zhang et al. 的方法[4];丙二醛的测定参照Zhao et al. 的方法[5];游离脯氨酸的测定参照Bates et al. 的方法[6];类黄酮、总酚的测定参照Mirecki & Teramura的方法[7]。
1.3.2 植株果实产量的测定 每小区随机选取10株,分别在各处理区果实色泽深绿时统计第1、2、3批果实产量和平均单果重[8],比较不同处理对辣椒植株产量的影响。
1.4 数据分析试验数据均采用SPSS 22.0软件进行处理,结果以3次重复的平均值 ± SD表示。采用Duncan’s新复极差法 (P0.05) 进行差异显著性检验。
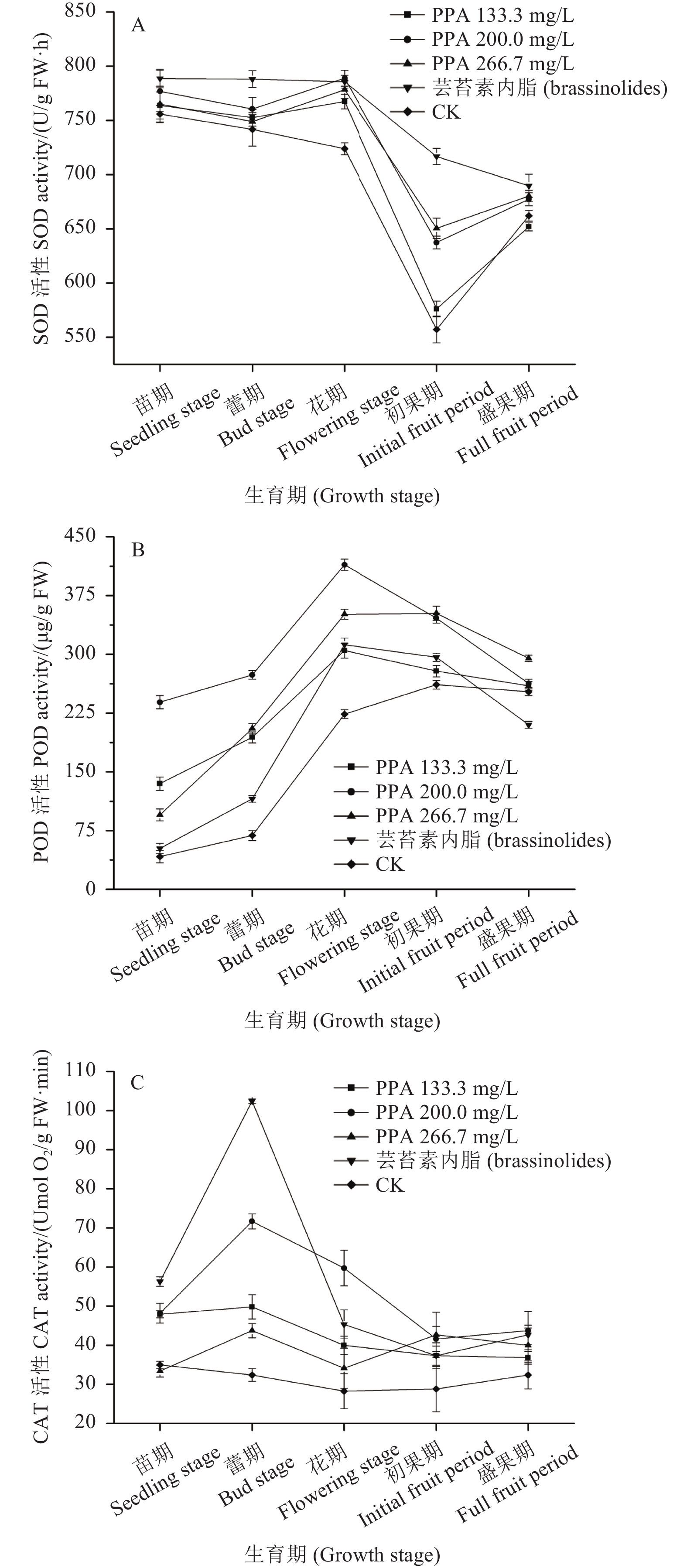
2 结果与分析 2.1 苯肽胺酸对辣椒不同生育期抗逆生理指标的影响2.1.1 对辣椒抗氧化酶系的影响 在辣椒不同生长发育期苯肽胺酸不同剂量处理对辣椒抗氧化酶系的影响结果见图1。
|
图 1 苯肽胺酸对辣椒叶片抗氧化酶系的影响 Fig. 1 Effect of phthalanilic acid on antioxidant enzymes in pepper leaves |
由图1-A可以看出,不同剂量的苯肽胺酸处理在一定程度上可以提高辣椒叶片超氧化物歧化酶 (SOD) 活性。其中,在苗期、蕾期和盛果期,不同剂量的苯肽胺酸处理后SOD活性与空白对照无显著差异;在花期,不同剂量的苯肽胺酸处理之间差异不显著,但均显著高于空白对照,其中,以200.0 mg/L的处理影响最为显著,SOD活性高于同期空白对照9.01%;在初果期,以200.0和266.7 mg/L的处理影响最为显著,SOD活性较空白对照分别提高了14.39%和16.74%。芸苔素内酯处理也可以提高辣椒叶片SOD活性,其中,苗期和盛果期与空白对照无显著差异;蕾期、花期和初果期的SOD活性分别高于空白对照6.25%、8.54%和28.64%;苗期、花期和盛果期SOD活性与不同剂量的苯肽胺酸处理之间差异不显著;蕾期和初果期SOD活性均高于不同剂量的苯肽胺酸处理,其中初果期SOD活性较266.7 mg/L苯肽胺酸处理提高了10.19%。
由图1-B可以看出,用不同剂量的苯肽胺酸处理后辣椒叶片过氧化物酶 (POD) 活性较空白对照存在显著差异。其中,苗期、蕾期和花期,以200.0 mg/L苯肽胺酸处理影响最为显著,较空白对照分别提高471.72%、298.15%和85.18%;初果期和盛果期,以266.7 mg/L苯肽胺酸处理影响最为显著,较空白对照分别提高34.84%和16.94%。芸苔素内酯处理也可以提高辣椒叶片POD活性,其中,苗期、蕾期、花期和初果期POD活性分别高于空白对照25.02%、68.09%、39.61%和13.34%;在盛果期,POD活性低于空白对照20.05%;在苗期、蕾期和花期,较200.0 mg/L苯肽胺酸处理分别降低357.31%、57.78%和32.64%;在初果期和盛果期较266.7 mg/L苯肽胺酸处理降低了13.98%和40.38%。
由图1-C可以看出,不同剂量的苯肽胺酸处理后在一定程度上可以提高辣椒叶片过氧化氢酶 (CAT) 活性。其中,以200.0 mg/L苯肽胺酸处理影响最为显著,苗期、蕾期、花期、初果期和盛果期,辣椒叶片CAT活性同期较空白对照分别提高了37.71%、121.19%、111.32%、44.44%和34.98%。芸苔素内酯也具有类似效应,辣椒叶片CAT活性在上述各生育期较空白对照分别提高了60.76%、216.05%、60.37%、29.63%和31.69%。不同生育期,芸苔素内酯和苯肽胺酸对CAT活性影响略有差异,其中:在苗期和蕾期,芸苔素内酯处理较苯肽胺酸处理 (200.0 mg/L) 分别提高了16.74%和42.88%;而在花期,芸苔素内酯处理较苯肽胺酸处理 (200.0 mg/L) 降低了31.76%;在初果期和盛果期,芸苔素内酯处理对CAT的影响略低于苯肽胺酸处理 (200.0 mg/L),但差异不显著。
2.1.2 对辣椒叶片丙二醛含量的影响 测定结果 (表1) 表明:经不同剂量的苯肽胺酸处理后,辣椒叶片丙二醛 (MDA) 含量较空白对照显著降低,其中以200.0 mg/L苯肽胺处理影响最为显著,丙二醛含量在苗期、蕾期、花期、初果期和盛果期较空白对照分别降低了25.29%、30.19%、34.55%、24.27%和25.73%。经芸苔素内酯处理后,丙二醛含量在上述各生育期较空白对照分别降低了53.75%、55.10%、96.48%、35.40%和38.15%;初果期和盛果期丙二醛含量与200.0 mg/L苯肽胺酸处理无显著差异,但显著低于133.3和266.7 mg/L苯肽胺酸处理;苗期、蕾期和花期丙二醛含量较200.0 mg/L苯肽胺酸处理分别降低了15.01%、8.22%和28.52%。
|
|
表 1 苯肽胺酸对辣椒叶片丙二醛含量的影响 Table 1 Effect of phthalanilic acid on the content of MDA in pepper leaves |
2.1.3 对辣椒叶片游离脯氨酸含量的影响 结果 (表2) 表明:经不同剂量的苯肽胺酸处理后,辣椒叶片中游离脯氨酸含量呈先升高后降低的趋势。在苗期和蕾期,不同剂量的苯肽胺酸处理之间游离脯氨酸含量差异显著且均显著高于空白对照。其中,经133.3、200.0和266.7 mg/L的苯肽胺酸处理后,游离脯氨酸含量在苗期较空白对照分别提高了181.53%、241.31%和103.76%,在蕾期分别提高了25.18%、121.26%和51.48%。在花期,经133.3、200.0和266.7 mg/L的苯肽胺酸处理后,游离脯氨酸含量较空白对照分别显著提高了44.49%、50.43%和32.40%;在初果期,经200.0 mg/L苯肽胺酸处理后,游离脯氨酸含量较空白对照显著提高了10.99%;在盛果期,以266.7 mg/L苯肽胺酸处理后,游离脯氨酸含量较空白对照显著提高了20.13%。经芸苔素内酯处理后,辣椒叶片游离脯氨酸含量均显著高于空白对照,在苗期、蕾期、花期、初果期和盛果期较空白对照分别提高了148.54%、106.07%、91.90%、25.21%和22.09%;苗期和蕾期,经芸苔素内酯处理后辣椒叶片的游离脯氨酸含量较200.0 mg/L苯肽胺酸处理分别降低了37.32%和7.37%,而在花期和初果期,较200.0 mg/L苯肽胺酸处理却分别提高了27.57%和12.81%;在盛果期,芸苔素内酯处理与266.7 mg/L的苯肽胺酸处理无显著差异。
|
|
表 2 苯肽胺酸对辣椒叶片游离脯氨酸含量的影响 Table 2 Effect of phthalanilic acid on free proline content in pepper leaves |
2.1.4 对辣椒叶片类黄酮含量的影响 结果 (表3) 表明,经不同剂量的苯肽胺酸处理后,辣椒叶片中类黄酮含量较空白对照均有一定程度的提高。苗期,以133.3 mg/L苯肽胺酸处理影响最为显著,类黄酮含量较空白对照提高了18.92%;在蕾期、花期、初果期和盛果期,以200.0 mg/L苯肽胺酸处理影响最为显著,类黄酮含量较空白对照分别提高了10.10%、14.61%、21.28%和19.57%。经芸苔素内酯处理后,辣椒叶片类黄酮含量在苗期、蕾期、花期、初果期和盛果期较空白对照分别提高了39.19%、26.26%、17.98%、15.96%和19.57%,在苗期和蕾期,其诱导效果均优于苯肽胺酸各处理,但在花期、初果期和盛果期,与200.0 mg/L的苯肽胺酸处理无显著差异。
|
|
表 3 苯肽胺酸对辣椒叶片类黄酮含量的影响 Table 3 Effect of phthalanilic acid on the content of flavonoids in pepper leaves |
2.1.5 对辣椒叶片总酚含量的影响 结果 (表4) 表明,与空白对照相比,经不同剂量的苯肽胺酸处理对辣椒叶片的类黄酮含量有一定的影响。其中,以200.0 mg/L苯肽胺酸处理影响最为显著,各生育期辣椒叶片的总酚含量较空白对照分别提高了14.44%、16.35%、13.04%、13.46%和7.41%。芸苔素内酯可显著提高辣椒叶片的总酚含量,上述各生育期较空白对照分别提高了28.57%、25.96%、16.30%、17.31%和9.26%;苗期和蕾期较200.0 mg/L苯肽胺酸处理分别提高了10%和8.26%;而花期、初果期和盛果期却与200.0 mg/L的苯肽胺酸处理无显著差异。
|
|
表 4 苯肽胺酸对辣椒叶片总酚含量的影响 Table 4 Effect of phthalanilic acid on the content of total phenols in pepper leaves |
2.2 苯肽胺酸对辣椒前期产量的影响
结果 (表5) 表明,不同剂量的苯肽胺酸处理后,辣椒各批果实产量及总产量均发生一定的变化。其中,经200.0 mg/L苯肽胺酸处理后,第1、2批辣椒果实产量与空白对照无显著差异;而第3批产量却显著高于空白对照,增加了23.97%;3个批次总产量增加了13.91%,显著高于空白对照;而经133.3和266.7 mg/L的苯肽胺酸处理后,各批次产量及总产量均与空白对照相当。经芸苔素内酯处理后,第1~3批果实产量及总产量较空白对照分别提高了34.97%、4.85%、11.30%和16.41%;但总产量与200.0 mg/L的苯肽胺酸处理无显著差异。同时苯肽胺酸处理后辣椒果实平均单果重也有变化,但各处理间差异不显著。
|
|
表 5 苯肽胺酸对辣椒产量及单果重的影响 Table 5 Effect of phthalanilic acid on the early yield and single fruit weight of pepper |
3 讨论 3.1 苯肽胺酸能诱导辣椒植株抗逆性增强
植物处于逆境时可产生大量的氧自由基,通过氧化作用破坏细胞膜等膜结构和功能,从而导致膜透性增大,并产生丙二醛等氧化产物,最终使得植物生长受到抑制[9-10]。本研究结果表明,经苯肽胺酸处理后,辣椒叶片中的抗氧化酶系统 (SOD、POD、CAT) 活性及非酶系统 (类黄酮、总酚) 含量较空白对照均有所提高,且与膜脂过氧化产物丙二醛含量的下降及细胞渗透调节物质游离脯氨酸含量的上升相符。说明苯肽胺酸能够激活植物在逆境胁迫下的应答机制[11-12]。其可能的原因为:一方面,经苯肽胺酸处理后辣椒抗氧化酶系统的启动可提高植物体内清除活性氧自由基的能力,使自由基保持在较低水平[13];另一方面,苯肽胺酸处理后可提高具备防御功能的多酚类次生物质类黄酮和总酚[14-15]及细胞渗透调节物质游离脯氨酸等非酶系统含量,从而稳定蛋白质、DNA和膜的结构与功能[16-17]。已有研究表明,多酚类次生物质可通过氢键结合到膜磷脂的极性头部,阻止有害分子进入膜磷脂双分子的疏水区,维持细胞膜的完整性,同时提高对氧自由基的捕捉能力,与氧化反应产生的脂质自由基结合[18-19];而脯氨酸在植物体内大量积累,可降低细胞的渗透势、增大渗透调节能力[20-21],同时作为一种有效的活性氧螯合剂,可以激发体内过氧化氢酶、超氧化物酶及多酚氧化酶的活性,鳌合单线态氧,高效地清除羟基自由基。综上,苯肽胺酸既可启动植株的抗氧化酶系统直接清除植株体内的活性氧,又可提高非酶系统的含量,从结构上维持膜结构的完整性,从而诱导辣椒抗逆性增强。
3.2 苯肽胺酸与芸苔素内酯对植株生理特性的影响具有相似性芸苔素内酯是一种十分重要的甾醇类激素,可参与调控植物多方面的生长发育过程,包括促进植物茎和根中的细胞伸长和细胞分裂、生殖发育、植物的光形态建成,叶片衰老和植物抗逆性[22]等。外源施用芸苔素内酯能诱导植株在应对异常温度、干旱、盐渍、重金属胁迫及病原菌侵袭过程中提高抗逆性[23],激活抗氧化酶和非酶系统[24]。本研究发现,芸苔素内酯对辣椒的诱导抗性与已有报道相一致[25]。同时,经对比试验发现,苯肽胺酸与芸苔素内酯对辣椒生理特性的影响极其类似,其不同主要反映在CAT活性与游离脯氨酸含量上。在苗期和蕾期,以200.0 mg/L苯肽胺酸处理后游离脯氨酸含量显著高于芸苔素内酯处理;而在蕾期,芸苔素内酯处理后CAT活性极显著地高于200.0 mg/L苯肽胺酸处理。推测苯肽胺酸与芸苔素内酯在诱导植株应对干旱、盐渍、温度和重金属胁迫时存在一定差异,但具体机制尚不清楚,需进一步研究。
3.3 苯肽胺酸具有良好的增产效应植物生长调节剂往往具有提高作物产量的功效,如叶面喷施α-萘乙酸钠可显著提高辣椒生育后期的单果重及辣椒不同生育阶段单株的产量[8],叶面喷施烯效唑,可显著增加大豆的单株荚数和单株粒数,提高大豆产量[26]。本研究表明,叶面喷施200.0 mg/L的苯肽胺酸,辣椒的平均单果重与空白对照和芸苔素内酯处理无显著差异,但果实产量与芸苔素内酯处理相当,且显著高于空白对照,增产达13.91%。植物生长调节剂的增产机理较为复杂,苯肽胺酸对辣椒的增产效应,可能与其诱导作物提高抗逆性有关,也可能是其对作物的生长发育具有调控作用,但具体机理尚需进一步探讨。
苯肽胺酸能够激活辣椒植株的酶促和非酶促抗氧化系统,在辣椒的各生育期均可提高抗逆性,并具有较好的增产效应,作为一类广谱、高效的植物生长调节剂,具有较好的推广应用价值。
| [1] |
雷曼. 植物生长调节剂宝赢及其在苹果上的应用[J]. 西北园艺(果树), 2014(3): 51.
LEI M. Plant growth regulator BAOYING and its application on apple[J]. Northwest Horticult (Fruit Tree), 2014(3): 51. |
| [2] | BARI R, JONES J D G. Role of plant hormones in plant defence responses[J]. Plant Mol Biol, 2009, 69(4): 473–488. doi:10.1007/s11103-008-9435-0 |
| [3] | GIANNAKOULA A E, ILIAS L F, MAKSIMOVIĆ J J D, et al. The effects of plant growth regulators on growth, yield, and phenolic profile of lentil plants[J]. J Food Composit Anal, 2012, 28(1): 46–53. doi:10.1016/j.jfca.2012.06.005 |
| [4] | ZHANG Y J, ZHANG X, CHEN C J, et al. Effects of fungicides JS399-19, azoxystrobin, tebuconazloe, and carbendazim on the physiological and biochemical indices and grain yield of winter wheat[J]. Pestic Biochem Physiol, 2010, 98(2): 151–157. doi:10.1016/j.pestbp.2010.04.007 |
| [5] | ZHAO H, DAI T B, JING Q, et al. Leaf senescence and grain filling affected by post-anthesis high temperatures in two different wheat cultivars[J]. Plant Growth Regul, 2007, 51(2): 149–158. doi:10.1007/s10725-006-9157-8 |
| [6] | BATES L S, WALDREN R P, TEARE I D. Rapid determination of free proline for water-stress studies[J]. Plant Soil, 1973, 39(1): 205–207. doi:10.1007/BF00018060 |
| [7] | MIRECKI R M, TERAMURA A H. Effects of ultraviolet-B irradiance on soybean: V. The dependence of plant sensitivity on the photosynthetic photon flux density during and after leaf expansion[J]. Plant Physiol, 1984, 74(3): 475–480. doi:10.1104/pp.74.3.475 |
| [8] |
张红菊, 赵怀勇, 郁继华. α-萘乙酸钠对温室辣椒产量和内源激素水平的影响[J]. 中国沙漠, 2013, 33(5): 1390–1399.
ZHANG H J, ZHAO H Y, YU J H. Effects of α-naphthalene acetic acid on yield and endogenous hormones of greenhouse grown pepper in desert area[J]. J Desert Res, 2013, 33(5): 1390–1399. doi:10.7522/j.issn.1000-694X.2013.00204 |
| [9] |
刘方春, 邢尚军, 马海林, 等. 干旱对侧柏容器苗和裸根苗生长、营养及生理特性的影响[J]. 北京林业大学学报, 2014, 36(5): 68–73.
LIU F C, XING S J, MA H L, et al. Effects of drought stress on growth, nutrition and physiological characteristics of Platycladus orientalis container and bareroot seedlings [J]. J Beijing For Univ, 2014, 36(5): 68–73. |
| [10] |
张海艳. 低温对鲜食玉米种子萌发及幼苗生长的影响[J]. 植物生理学报, 2013, 49(4): 347–350.
ZHANG H Y. Effects of low temperature on seed germination and seedling growth of fresh corn[J]. Plant Physiol J, 2013, 49(4): 347–350. |
| [11] | ALMESELMANI M, DESHMUKH P S, SAIRAM R K, et al. Protective role of antioxidant enzymes under high temperature stress[J]. Plant Sci, 2006, 171(3): 382–388. doi:10.1016/j.plantsci.2006.04.009 |
| [12] | LIU P, GUO W S, PU H C, et al. Effects of high temperature on antioxidant enzymes and lipid peroxidation in flag leaves of wheat during grain filling period[J]. Agric Sci China, 2006, 5(6): 425–430. doi:10.1016/S1671-2927(06)60071-0 |
| [13] | SCHÜTZENDÜBEL A, POLLE A. Plant responses to abiotic stresses: heavy metal-induced oxidative stress and protection by mycorrhization[J]. J Exp Bot, 2002, 53(372): 1351–1365. |
| [14] | SAKIHAMA Y, YAMASAKI H. Lipid peroxidation induced by phenolics in conjunction with aluminum ions[J]. Biol Plant, 2002, 45(2): 249–254. doi:10.1023/A:1015152908241 |
| [15] | RUIZ J M, RIVERO R M. Role of Ca2+ in the metabolism of phenolic compounds in tobacco leaves (Nicotiana tabacum L.) [J]. Plant Growth Regul, 2003, 41(2): 173–177. doi:10.1023/A:1027358423187 |
| [16] | CHEN C B, DICKMAN M B. Proline suppresses apoptosis in the fungal pathogen Colletotrichum trifolii [J]. Proc Natl Acad Sci USA, 2005, 102(9): 3459–3464. doi:10.1073/pnas.0407960102 |
| [17] | XIONG X, YAO M, FU L L, et al. The botanical pesticide derived from Sophora flavescens for controlling insect pests can also improve growth and development of tomato plants [J]. Ind Crops Prod, 2016, 92: 13–18. doi:10.1016/j.indcrop.2016.07.043 |
| [18] | MICHALAK A. Phenolic compounds and their antioxidant activity in plants growing under heavy metal stress[J]. Polish J Environ Stud, 2006, 15(4): 523–530. |
| [19] |
宋立江, 狄莹, 石碧. 植物多酚研究与利用的意义及发展趋势[J]. 化学进展, 2000, 12(2): 161–170.
SONG L J, DI Y, SHI B. The significance and development trend in research of plant polyphenols[J]. Prog Chem, 2000, 12(2): 161–170. |
| [20] | ANJUM F, RISHI V, AHMAD F. Compatibility of osmolytes with Gibbs energy of stabilization of proteins[J]. Biochim Biophys Acta, 2000, 1476(1): 75–84. doi:10.1016/S0167-4838(99)00215-0 |
| [21] | HARE P D, CRESS W A. Metabolic implications of stress-induced proline accumulation in plants[J]. Plant Growth Regul, 1997, 21(2): 79–102. doi:10.1023/A:1005703923347 |
| [22] | CHOUDHARY S P, YU J Q, YAMAGUCHI-SHINOZAKI K, et al. Benefits of brassinosteroid crosstalk[J]. Trends Plant Sci, 2012, 17(10): 594–605. doi:10.1016/j.tplants.2012.05.012 |
| [23] | KRISHNA P. Brassinosteroid-mediated stress responses[J]. J Plant Growth Regul, 2003, 22(4): 289–297. doi:10.1007/s00344-003-0058-z |
| [24] |
闫慧萍, 彭云玲, 赵小强, 等. 外源24-表油菜素内酯对逆境胁迫下玉米种子萌发和幼苗生长的影响[J]. 核农学报, 2016, 30(5): 988–996.
YAN H P, PENG Y L, ZHAO X Q, et al. Effects of exogenous 24- epibrassinolide on seed germination and seedling growth of maize under different stress[J]. J Nucl Agric Sci, 2016, 30(5): 988–996. doi:10.11869/j.issn.100-8551.2016.05.0988 |
| [25] | LI J, YANG P, GAN Y T, et al. Brassinosteroid alleviates chilling-induced oxidative stress in pepper by enhancing antioxidation systems and maintenance of photosystem II[J]. Acta Physiol Plant, 2015, 37(11): 222. doi:10.1007/s11738-015-1966-9 |
| [26] |
刘春娟, 冯乃杰, 郑殿峰, 等. 植物生长调节剂S3307和DTA-6对大豆源库碳水化合物代谢及产量的影响[J]. 中国农业科学, 2016, 49(4): 657–666.
LIU C J, FENG N J, ZHENG D F, et al. Effects of plant growth regulators S3307 and DTA-6 on carbohydrate content and yield in soybean[J]. Scientia Agricultura Sinica, 2016, 49(4): 657–666. doi:10.3864/j.issn.0578-1752.2016.04.005 |
 2017, Vol. 19
2017, Vol. 19


