为保障农产品的高产增收,生产中存在多种农药联合施用以及不合理使用等问题,导致农药残留超标事件频频发生,已引起社会的广泛关注。而常规的农药残留仪器分析方法不能满足在较短时间内完成大量样品现场筛查的需求,为此,迫切需要开发一种能在现场或实验室内进行大批量筛查的快捷、灵敏的农药残留速测方法。相对目前常用的酶抑制法及生物传感器法等检测方法,免疫层析技术是一种更适用于大批量样本快捷、准确检测的方法。
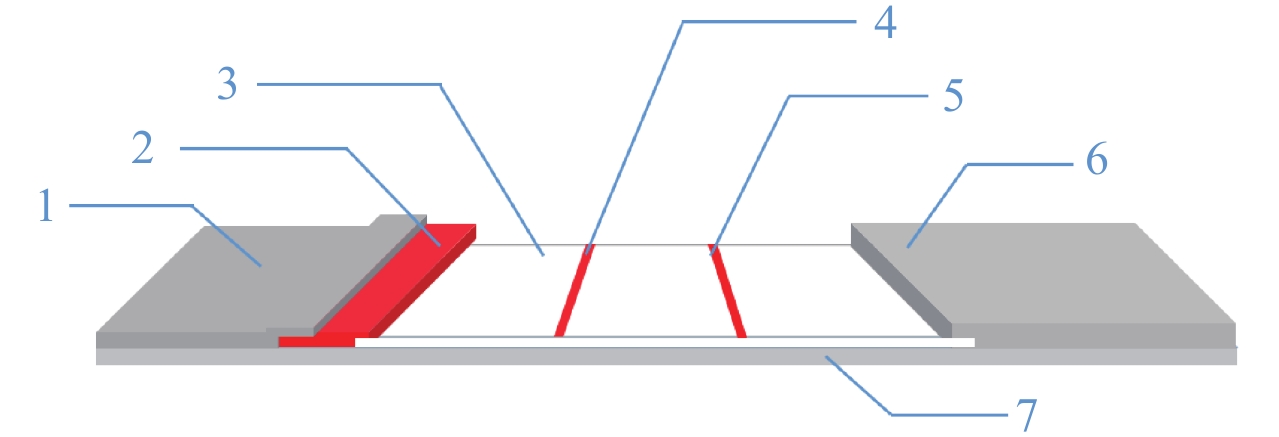
免疫层析技术是从20世纪末开始发展起来的一种将免疫技术和色谱层析技术相结合的检测分析方法[1],主要由样品垫、结合垫、硝酸纤维素膜 (NC膜)、检测线 (T线)、质控线 (C线)、吸水垫、聚氯乙烯 (PVC) 底板等部分组成,其原理是利用毛细管作用使待测物与捕获线上的免疫试剂结合,通过酶促显色反应或直接使用着色标记物,可在短时间内获得测试结果 (图1)[2]。
免疫层析技术目前主要分为夹心法和竞争法两种模式。大分子物质的检测基本采用夹心法,即用单抗标记的探针分别包被T线和C线,当样本中含有待测物时,T线和C线处将出现2条条带,反之则仅在C线位置出现1条条带[3];小分子物质的检测则一般采用竞争法,先用特异性抗原包被T线,将标记物与生物抗体标记的复合物喷涂在结合垫上,再采用第二抗体包被C线,与夹心模式不同的是,当样本中含有待测物时,仅在C线位置显示1条条带,反之,则在T线和C线处共出现2条条带。
|
1. 样品垫;2. 结合垫;3. 硝酸纤维素膜;4. 检测线 (T线);5. 质控线 (C线);6. 吸水垫;7. 聚氯乙烯 (PVC) 底板。 1. Sample pad; 2. Conjugate pad; 3. Nitrocellulose membrane; 4. Test line (T); 5. Control line (C); 6. Absorbent pad; 7. PVC backboard. 图 1 免疫层析试纸示意图 Fig. 1 Schematic diagram of immunochromatographic strip |
随着现代纳米科技的不断发展,除最初的胶体金外,已相继出现多种其他纳米标记物,检测结果也已从定性发展到半定量或定量,从而使得免疫层析技术拥有了更广阔的应用前景,而农药残留免疫层析技术也日趋成为了具有良好应用价值和发展潜力的农药痕量分析技术之一。
免疫层析技术的核心是纳米材料标记免疫探针的制备。通常有两种途径:1) 非共价作用标记,优点是制备方便,但稳定性欠佳;2) 共价作用标记,虽然其制备工艺要求高,但稳定性也高。本文将分别针对不同标记类型免疫层析技术在农药残留检测中的应用研究展开综述。
1 非共价作用标记型免疫层析技术胶体金及纳米碳等通常可通过非共价作用力与生物抗体或抗原结合而形成标记复合物,用于免疫层析技术中。
1.1 胶体金免疫层析技术1.1.1 胶体金 胶体金是由氯金酸 (chloroauric acid, HAuCl4·4H2O) 在还原剂柠檬酸三钠 (trisodium citrate) 等的作用下聚合成为特定大小的金颗粒,并通过静电作用而形成的一种稳定的胶体状态。胶体金免疫层析技术是以胶体金作为免疫标记探针,应用于抗原抗体反应的一种新型免疫检测技术,可通过肉眼观察或仪器检测判断待测物的有无:若样品中含有待测物,则待测物会与胶体金标记物反应形成复合物,被试纸条上的检测线截获,显色呈现肉眼可见的红色条带;若样品中不含待测物,则不会出现红色条带;且无论是否含有待测物,标记物都会越过检测线到达质控线而显色,当质控线不显色时则检测无效。
1.1.2 胶体金免疫层析技术在农药残留检测中的应用
1.1.2.1 在杀虫剂检测领域的应用 现有农药产品中,杀虫剂品种多、用量大,对环境、生态和人类健康存在较大影响。目前,胶体金免疫层析试纸主要应用于新烟碱类、有机磷类、拟除虫菊酯类及氨基甲酸酯类等杀虫剂的残留检测 (表1)。
|
|
表 1 胶体金免疫层析试纸在杀虫剂检测中的应用 Table 1 Application of colloidal gold immunochromatographic test for detection of insecticides |
1.1.2.2 在除草剂检测领域的应用 除草剂在农药产品中所占的比例已越来越高。目前,胶体金免疫层析试纸主要应用于三嗪类、有机杂环类及苯腈类等除草剂的残留检测 (表2)。
|
|
表 2 胶体金免疫层析试纸在除草剂检测中的应用 Table 2 Application of colloidal gold immunochromatographic test for the detection of herbicides |
1.1.2.3 在杀菌剂检测领域的应用 目前,胶体金免疫层析试纸主要应用于酰胺类、氨基甲酸酯类及取代苯类等杀菌剂的残留检测 (表3)。
|
|
表 3 胶体金免疫层析试纸在杀菌剂检测中的应用 Table 3 Application of colloidal gold immunochromatographic test for the detection of fungicides |
1.1.3 胶体金免疫层析技术应用展望 胶体金免疫层析技术具有耗时短、操作简捷、携带方便、检测前无需复杂的样品前处理、检测结果肉眼可见且可以保存一段时间等明显优势,但其缺点也不容忽视。首先,其检测灵敏度对于满足农药的最大允许残留限量 (maximum residue limit, MRL) 检测监管要求仍有较大距离。这主要是由于胶体金本身属于吸收光谱型物质,需大量聚集达到一定浓度才能产生可视信号,且其信号易受光学干扰,因而使得该方法的检测灵敏度和实际应用受到限制[27];其次,目前采用胶体金免疫层析技术只能实现对待测物的定性或半定量检测,还需结合其他检测技术 (如色谱法等) 才能得到精确的定量结果。总体而言,胶体金免疫层析技术以其低成本、可视化及方便快捷等优点,在农药残留快速筛查中发挥了重要的实用价值。
1.2 纳米碳免疫层析技术1.2.1 纳米碳 纳米碳的粒径通常在10~100 nm之间,具有信噪比高、稳定性好、易制备、无毒、不需要活化、灵敏度高及价格低廉等优点。纳米碳免疫层析技术原理与胶体金免疫层析技术相似。
1.2.2 纳米碳免疫层析技术在农药残留检测中的应用 Suárez-Pantaleón等[37]利用纳米碳标记二抗后再结合氯吡脲 (forchlorfenuron) 单抗,开发了检测氯吡脲的两步法试纸,其检出限为 (45 ± 9) ng/L,在猕猴桃和葡萄样品中的最低检出浓度为33.4 μg/kg。
Mičková-Holubová 课题组利用纳米碳构建了一系列免疫层析试纸。于2009年开发了特异性检测灭虫威 (mesurol) 的免疫层析试纸[38],检出限为 0.5 ng/mL,灵敏度与ELISA法相当;2010年,他们基于竞争免疫法又研制了可检测噻菌灵 (thiabendazole) 的免疫试纸[39],在10 min内检测出标准分析物的下限值可达 (0.08 ± 0.03) ng/mL[40]。
1.2.3 纳米碳免疫层析技术应用展望 纳米碳具有优良的稳定性以及原材料价格低廉、易于制备等优点,尤为重要的是,其黑色信号与白色背景层析膜可形成强烈对比,因而具有较高的灵敏度,远比常用的胶体金灵敏,其检测下限甚至可达到 10–12 mol/L 级别[41],从而使其成为了眼下炙手可热的纳米探针。但其检测水平仍然只能达到定性或半定量级别,因此还需进一步开发可准确定量的其他配套检测手段[42]。
2 共价作用标记型免疫层析技术共价作用型标记通常是利用纳米颗粒表面存在的、或经修饰产生的一些功能性基团,使其和生物抗体表面游离的基团通过共价作用相结合而获得标记复合物。量子点、上转换发光纳米粒子、磁性纳米颗粒、时间分辨荧光微球及荧光乳胶颗粒等材料通常可与抗体进行共价偶联。
2.1 量子点免疫层析技术2.1.1 量子点 量子点 (quantum dots, QDs) 是由元素周期表中II~VI族或III~V族元素构成的半导体材料,粒径一般介于1~10 nm之间[43]。由于量子点具有表面效应,且其表面原子活性极不稳定,易出现团聚现象[44],所以在用其偶联抗体之前,需要先对量子点表面进行修饰,以提高其荧光特性和量子产率。
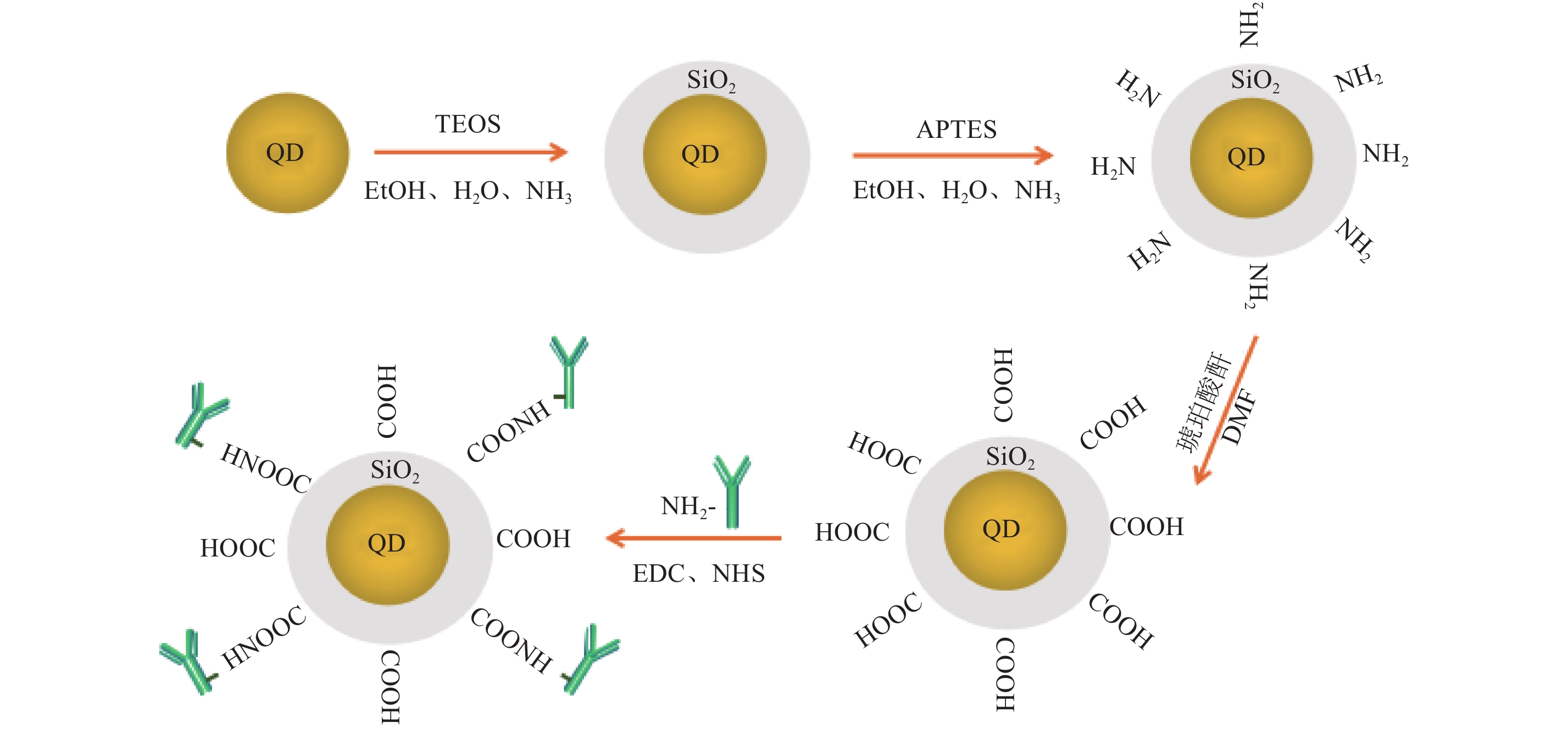
目前对量子点表面进行修饰的方法主要有两种:一种是将功能化基团 (如硅烷化基团、巯基等) 修饰至量子点表面;另一种是采用核壳结构钝化量子点表面。以硅烷化量子点 (图2) 为例,在碱性条件下,先通过与正硅酸四乙酯 (TEOS) 反应在量子点表面形成硅壳,再与氨丙基三乙氧基硅烷 (APTES) 反应,在硅壳外连接氨基 (-NH2),进一步氧化成羧基 (-COOH),最后通过活化酯法[碳二亚胺 (EDC) 及 N-羟基琥珀酰亚胺 (NHS)]连接氨基化的抗体。此方法可提高量子点的水溶性,阻止纳米粒子团聚,从而易与生物分子偶联[45]。
|
图 2 量子点表面修饰及偶联抗体示意图 Fig. 2 QDs’ surface modification and coupling with antibody |
2.1.2 量子点免疫层析技术在农药残留检测中的应用 迄今为止,已报道的量子点层析试纸主要应用在大分子物质如沙门氏菌[46]以及兽药如氯霉素[47]等的检测中,有关农药免疫层析试纸方面的研究还处于起步阶段。
Zou等[48]基于量子点标记抗原的方法,成功开发了一种可检测血浆中毒死蜱代谢产物三氯吡啶 (trichloropyridinol) 的免疫试纸,待测物的检出限为1 ng/mL。Zhang等[49]同时利用量子点和二氧化锆制备了一种夹心型免疫试纸,成功用于对氧磷 (paraoxon) 的检测,检出限为 4 × 10–12 mol/L,并且对人类血浆样品有很好的适用性。
2.1.3 量子点免疫层析技术应用展望 量子点材料在免疫层析技术中的优势在于其荧光强度高、寿命长、稳定性好,可接受多次激发及具有较好的生物相容性,并且在标记生物分子后不会影响其原有的特性,尤为重要的是,量子点的激发波长很宽且不对称,被激发后能产生窄而对称的发射光谱,从而解决了寻找合适波长光源的难题。此外,通过与读数仪器联用,量子点免疫层析技术可以实现定量检测。但其缺点是量子点本身不溶于水,需通过修饰成亲水性的物质后才能用于标记生物分子[50];对于一些残留量很低的待测物,灵敏度还达不到检测要求;另外,在实际样品检测中其结果易受到基质和背景荧光的干扰[51]。
2.2 上转换发光免疫层析技术2.2.1 上转换发光纳米粒子 上转换发光纳米粒子 (上转发光颗粒) 是一种由主基质 (氟化物等)、吸收子 (Er、Yb、Sm等稀土离子) 及发射子 (Tm、Ho、Tb等稀土离子) 组成的荧光物质,具有斯托克斯位移大、发射峰窄、低毒及光稳定性好等优点[52]。上转换发光是利用稀土离子丰富的电子能级结构,通过连续吸收多个光子的能量而将低能量光辐射转换成高能量光辐射的过程[53]。
2.2.2 上转换免疫层析技术在农药残留检测中的应用 基于上转发光颗粒标记的免疫层析技术已开始在细菌、病毒等大分子物质检测领域展现了巨大的应用潜力[54],但其在农药小分子物质检测方面的研究尚处于起步阶段。
目前,已报道的有关上转发光颗粒在农药残留检测方面的应用主要是利用其发光共振能量转移技术原理。例如,结合适配体检测啶虫脒 (acetamiprid)[55]和氯噻啉 (imidaclothiz)[56]等的含量;Mei等[57]利用上转发光颗粒,结合纸传感器和智能手机成像技术,检测了福美双 (thiram) 的残留量,其主要特点是检测结果可视。但有关基于上转发光颗粒的农药免疫层析试纸尚未见公开报道。
2.2.3 上转换发光免疫层析技术的应用展望 上转换发光材料的优点在于其特殊的发光信号不易受检测环境影响,故样品本底值低时检测灵敏度也比较高,因而非常适合复杂样品基质中目标化合物的痕量分析,且发光稳定,可长期存放[58],故其在各类生物材料分析领域具有很好的应用前景。但上转换发光免疫层析技术研究开发的难度在于合理制备尺寸均匀、单分散性好、不易团聚的上转发光颗粒标记免疫探针;此外,与其配套的测试仪器也需根据上转发光颗粒的发光特性相应进行设计与研发。
2.3 基于其他标记材料的共价作用标记型免疫层析技术除量子点和上转发光颗粒外,磁性纳米颗粒、时间分辨荧光微球及荧光乳胶颗粒等纳米材料也可通过共价作用与生物抗体分子结合而形成标记复合物,用于免疫层析技术。
2.3.1 磁性纳米颗粒 指尺寸为纳米级的磁性材料 (以Fe3O4为代表),具有良好的磁导向性和生物相容性,易于制备,可与抗体耦合形成免疫磁珠[59],广泛应用于免疫层析试纸中 [如心脏肌钙蛋白[60]和人绒毛膜促性腺激素 (human chorionic gonadotropin, HCG)[61]检测试纸]。目前磁性纳米颗粒免疫层析技术在农药残留检测上已有所应用。Liu等[62]研制了可快速半定量检测对氧磷残留的磁性纳米颗粒免疫层析试纸,其检测限为1.7 ng/mL。
2.3.2 时间分辨荧光微球 指添加了具有荧光特性物质 (以镧系元素为代表) 的纳米微粒。时间分辨荧光免疫层析技术 (TRFIA) 是以三价稀土元素离子Eu (Ⅲ) 等作为标记物,通过仪器测定荧光强度而对化合物进行定量的[63]。该方法因其荧光衰变时间长,从而可以消除自然荧光的干扰,提高检测灵敏度。近年来,李培武课题组系统研究了多种真菌毒素的时间分辨荧光免疫层析技术:Zhang等[64]以铕离子为标记物,检测了水稻及玉米中T-2毒素的残留量;Wang等[65]成功检测了大豆酱中黄曲霉毒素B1的含量。虽然有关农药残留检测的时间分辨荧光免疫层析试纸目前仍鲜有报道,但其发展前景已然可以预见。
2.3.3 荧光乳胶颗粒 荧光乳胶颗粒以其分散性好、色彩鲜艳、粒径分布窄等特点,也在免疫层析技术中得到了有效的应用。崔浩等[66]建立了针对莱克多巴胺的荧光乳胶颗粒免疫层析快速检测技术,用于猪肉组织中莱克多巴胺残留量的检测,检出限为0.5 μg/mL。但有关荧光乳胶颗粒在农药残留免疫层析试纸中的应用研究尚未见公开报道。
3 总结与展望免疫层析技术因其操作简便、测定快速及可批量处理样品等优势而得到了广泛的应用,将各种基于纳米材料的免疫层析试纸应用于农产品质量安全筛查,对于快速、灵敏、准确地判断农药残留超标问题具有重要的现实意义,但该技术目前在农药残留检测领域的研究应用尚处于起步阶段,仍需深入研究与开发。
首先,伴随着上转换发光纳米颗粒、时间分辨荧光微球等具有特殊光学性能新型材料的出现,使得免疫层析试纸在一些基质干扰明显的样品中也得到了很好的应用,由于其能够有效降低背景的干扰,检测灵敏度已明显提高,但如何长期保持其高灵敏度依然是需研究实现的目标;其次,新型纳米标记材料的应用,使得该技术已能够达到定量检测的要求,突破了过去只能简单定性或半定量检测的局限;此外,为实现对多种目标分析物的同时检测,混合模式或多通道检测模式也已经被采用,可以同时对多个样品或多个分析物进行检测。但是,无论是对共价还是非共价作用标记型免疫层析技术而言,拥有稳定性好、易标记、发光性能高的纳米标记复合物都是获得满意检测结果的基础,所以如何制备出尺寸均匀、分散性优异、信号强的标记型免疫探针尤为重要,也是其重点研究的方向。
此外,免疫层析快速检测技术能方便、高效地应用于农药残留检测中,还要归功于免疫方法的高特异性和高灵敏度,以及层析过程有利于样品中杂质的分离,因此通常无需复杂、繁琐、耗时的常规前处理步骤,一般采用直接提取-稀释法[8, 24]及QuEChERS法[2]等即可。但是,也有些复杂基质样品中的共提物会干扰免疫层析过程中抗原、抗体的结合,或者影响标记材料本身显色信号的强度,从而降低分析方法的灵敏度和可靠性,虽然加大对基质的稀释可以减少干扰,但同时也会降低样品检测方法的最终灵敏度。因此,针对待测样品具体类型和不同的纳米材料标记物,需要建立相应合适的快速前处理方法,从而最终研发出适用于各类农产品和食品中农药残留快速筛查的免疫层析速测产品。
| [1] |
李阳, 王云龙. 免疫层析技术的研究进展[J]. 中国卫生检验杂志, 2015, 25(22): 3978–3980.
LI Y, WANG Y L. The research progress of immunechromatography technology[J]. Chin J Health Lab Technol, 2015, 25(22): 3978–3980. |
| [2] |
谢艳君, 杨英, 孔维军, 等. 基于不同纳米材料的侧流免疫层析技术在真菌毒素检测中的应用[J]. 分析化学, 2015, 43(4): 618–628.
XIE Y J, YANG Y, KONG W J, et al. Application of nanoparticle probe-based lateral flow immunochromatography technology in mycotoxins detection[J]. Chin J Anal Chem, 2015, 43(4): 618–628. doi:10.11895/j.issn.0253-3820.141035 |
| [3] |
樊淑华, 王永立. 胶体金免疫层析技术应用研究进展[J]. 动物医学进展, 2014, 35(10): 99–103.
FAN S H, WANG Y L. Progress on colloidal gold immunochromatographic assay[J]. Progr Veter Med, 2014, 35(10): 99–103. doi:10.3969/j.issn.1007-5038.2014.10.022 |
| [4] |
刘培辰. 烯啶虫胺胶体金免疫层析试纸条的研究[D]. 天津: 天津科技大学, 2013: 36-46.
LIU P C. Study on the colloidal gold immunochromatographic assay for the determination of nitenpyram[D]. Tianjin: Tianjin University of Science and Technology, 2013: 36-46. |
| [5] |
肖琛, 李培武, 唐章林, 等. 氰戊菊酯残留胶体金免疫层析试纸条研制[J]. 化学试剂, 2011, 33(8): 675–679.
XIAO C, LI P W, TANG Z L, et al. Development of gold immunochromatography strip for fenvalerate residue[J]. Chem Reagents, 2011, 33(8): 675–679. |
| [6] |
赵颖, 杨斌, 柳颖, 等. 啶虫脒金标免疫速测试纸条研制及其在茶叶中的应用[J]. 农药学学报, 2016, 18(3): 337–343.
ZHAO Y, YANG B, LIU Y, et al. Development and application of gold immunostrip for the detection of acetamiprid residue in tea samples[J]. Chin J Pestic Sci, 2016, 18(3): 337–343. |
| [7] | LEE E H, KIM Y A, LEE Y T, et al. Competitive immunochromatographic assay for the detection of the organophosphorus pesticide EPN[J]. Food Agric Immunol, 2013, 24(2): 129–138. doi:10.1080/09540105.2012.661703 |
| [8] | GUI W J, WANG S T, GUO Y R, et al. Development of a one-step strip for the detection of triazophos residues in environmental samples[J]. Anal Biochem, 2008, 377(2): 202–208. doi:10.1016/j.ab.2008.03.013 |
| [9] | KIM Y A, LEE E H, KIM K O, et al. Competitive immunochromatographic assay for the detection of the organophosphorus pesticide chlorpyrifos[J]. Anal Chim Acta, 2011, 693(1-2): 106–113. doi:10.1016/j.aca.2011.03.011 |
| [10] | HUA X D, QIAN G L, YANG J F, et al. Development of an immunochromatographic assay for the rapid detection of chlorpyrifos-methyl in water samples[J]. Biosens Bioelectron, 2010, 26(1): 189–194. doi:10.1016/j.bios.2010.06.005 |
| [11] | LIU Y H, XIE R, GUO Y R, et al. Comparison of homologous and heterologous formats in nanocolloidal gold-based immunoassays for parathion residue determination[J]. J Environ Sci Health, 2012, 47(5): 475–483. doi:10.1080/03601234.2012.663613 |
| [12] | SHI C G, ZHAO S Q, ZHANG K, et al. Preparation of colloidal gold immunochromatography strip for detection of methamidophos residue[J]. J Environ Sci, 2008, 20(11): 1392–1397. doi:10.1016/S1001-0742(08)62238-X |
| [13] | CHEN X J, LIU L Q, KUANG H, et al. A strip-based immunoassay for rapid determination of fenpropathrin[J]. Anal Methods, 2013, 5(21): 6234–6239. doi:10.1039/c3ay41030g |
| [14] | ZHOU P, LU Y T, ZHU J, et al. Nanocolloidal gold-based immunoassay for the detection of the N-methylcarbamate pesticide carbofuran [J]. J Agric Food chem, 2004, 52(14): 4355–4359. doi:10.1021/jf0499121 |
| [15] | WANG S, ZHANG C, WANG J P, et al. Development of colloidal gold-based flow-through and lateral-flow immunoassays for the rapid detection of the insecticide carbaryl[J]. Anal Chim Acta, 2005, 546(2): 161–166. doi:10.1016/j.aca.2005.04.088 |
| [16] | LI M, HUA X D, MA M, et al. Detecting clothianidin residues in environmental and agricultural samples using rapid, sensitive enzyme-linked immunosorbent assay and gold immunochromatographic assay[J]. Sci Total Environ, 2014, 499: 1–6. doi:10.1016/j.scitotenv.2014.08.029 |
| [17] | LEE J Y, KIM Y A, KIM M Y, et al. Importance of membrane selection in the development of immunochromatographic assays for low-molecular weight compounds[J]. Anal Chim Acta, 2012, 757: 69–74. doi:10.1016/j.aca.2012.10.052 |
| [18] | FANG Q K, WANG L M, CHENG Q, et al. A bare-eye based one-step signal amplified semiquantitative immunochromatographic assay for the detection of imidacloprid in Chinese cabbage samples[J]. Anal Chim Acta, 2015, 881: 82–89. doi:10.1016/j.aca.2015.04.047 |
| [19] | LE T, YAN P F, XU J, et al. A novel colloidal gold-based lateral flow immunoassay for rapid simultaneous detection of cyromazine and melamine in foods of animal origin[J]. Food Chem, 2013, 138(2-3): 1610–1615. doi:10.1016/j.foodchem.2012.11.077 |
| [20] | LISA M, CHOUHAN R S, VINAYAKA A C, et al. Gold nanoparticles based dipstick immunoassay for the rapid detection of dichlorodiphenyltrichloroethane: an organochlorine pesticide[J]. Biosens Bioelectron, 2009, 25(1): 224–227. doi:10.1016/j.bios.2009.05.006 |
| [21] | WANG L M, CAI J, WANG Y L, et al. A bare-eye-based lateral flow immunoassay based on the use of gold nanoparticles for simultaneous detection of three pesticides[J]. Microchimica Acta, 2014, 181(13-14): 1565–1572. doi:10.1007/s00604-014-1247-0 |
| [22] | GUO Y R, LIU S Y, GUI W J, et al. Gold immunochromatographic assay for simultaneous detection of carbofuran and triazophos in water samples[J]. Anal Biochem, 2009, 389(1): 32–39. doi:10.1016/j.ab.2009.03.020 |
| [23] | KRANTHI K R, DAVIS M, MAYEE C D, et al. Development of a colloidal-gold based lateral-flow immunoassay kit for ‘quality-control’ assessment of pyrethroid and endosulfan formulations in a novel single strip format[J]. Crop Prot, 2009, 28(5): 428–434. doi:10.1016/j.cropro.2009.01.003 |
| [24] | XU T, GONG X Q, LI H, et al. Strip-based immunoassay for the simultaneous detection of the neonicotinoid insecticides imidacloprid and thiamethoxam in agricultural products[J]. Talanta, 2012, 101: 85–90. doi:10.1016/j.talanta.2012.08.047 |
| [25] | HUA X D, YANG J F, WANG L M, et al. Development of an enzyme linked immunosorbent assay and an immunochromatographic assay for detection of organophosphorus pesticides in different agricultural products[J]. PLoS One, 2012, 7(12): e53099. doi:10.1371/journal.pone.0053099 |
| [26] |
胡静, 郭逸蓉, 梁晓, 等. 菊酯类农药广谱型免疫层析试纸条的研究及应用[J]. 分析化学, 2016, 44(12): 1900–1906.
HU J, GUO Y R, LIANG X, et al. Lateral flow immunoassay for simultaneous determination of four kinds of pyrethroid pesticides in vegetables and fruits[J]. Chin J Anal Chem, 2016, 44(12): 1900–1906. |
| [27] | BYZOVA N A, ZHERDEV A V, ZVEREVA E A, et al. Immunochromatographic assay with photometric detection for rapid determination of the herbicide atrazine and other triazines in foodstuffs[J]. J AOAC Int, 2010, 93(1): 36–43. |
| [28] | KAUR J, SINGH K V, BORO R, et al. Immunochromatographic dipstick assay format using gold nanoparticles labeled protein-hapten conjugate for the detection of atrazine[J]. Environ Sci Technol, 2007, 41(14): 5028–5036. doi:10.1021/es070194j |
| [29] | LYUBAVINA I A, ZINCHENKO A A, SALOMATINA I S, et al. An immunochromatographic assay of 2,4-dichlorophenoxyacetic acid and simazine using monoclonal antibodies labeled with colloidal gold[J]. Russ J Bioorg Chem, 2004, 30(2): 178–183. doi:10.1023/B:RUBI.0000023105.53131.39 |
| [30] | ZHU J, CHEN W C, LU Y T, et al. Development of an immunochromatographic assay for the rapid detection of bromoxynil in water[J]. Environ Pollut, 2008, 156(1): 136–142. doi:10.1016/j.envpol.2007.12.020 |
| [31] |
李伶伶, 张琳, 那宇, 等. 除草剂扑草净胶体金免疫层析检测试纸条的研制[J]. 现代食品科技, 2012, 28(4): 424–426.
LI L L, ZHANG L, NA Y, et al. Development of a colloidal gold immunochromatographic strip for rapid detection of herbicide prometryn[J]. Mod Food Sci Technol, 2012, 28(4): 424–426. |
| [32] |
孙秀兰, 杨婷婷, 张银志. 粮食中百草枯残留的金标免疫层析检测方法研究[J]. 分析测试学报, 2010, 29(5): 507–510.
SUN X L, YANG T T, ZHANG Y Z. Study on gold labeled strip for detection of paraquat residues in food by immune chromatography[J]. J Instrum Anal, 2010, 29(5): 507–510. |
| [33] |
袁宝凤, 亢欢虎, 王丽, 等. 甲霜灵、吡虫啉胶体金免疫层析试纸与色谱仪检测蔬菜农药残留比对试验分析[J]. 陕西农业科学, 2013, 59(5): 69–72.
YUAN B F, KANG H H, WANG L, et al. The comparison analysis between colloidal gold immune chromatography test paper and chromatograph detection of metalaxyl and than imidacloprid in vegetable pesticide residues[J]. Shaanxi J Agric Sci, 2013, 59(5): 69–72. |
| [34] |
唐晓宾, 许泓, 万志全, 等. 检测霜霉威的两种方法的比较[J]. 中国食品卫生杂志, 2009, 21(1): 36–38.
TANG X B, XU H, WAN Z Q, et al. Comparison on two methods for detection of propamocarb[J]. Chin J Food Hygiene, 2009, 21(1): 36–38. |
| [35] | XING C R, LIU L Q, SONG S S, et al. Ultrasensitive immunochromatographic assay for the simultaneous detection of five chemicals in drinking water[J]. Biosens Bioelectron, 2015, 66: 445–453. doi:10.1016/j.bios.2014.12.004 |
| [36] |
袁玉龙. 苯噻菌酯残留免疫分析方法研究[D]. 南京: 南京农业大学, 2014: 57-70.
YUAN Y L. Development of immunoassay for the detection of benzothiostrobin[D]. Nanjing: Nanjing Agricultural University, 2014: 57-70. |
| [37] | SUÁREZ-PANTALEÓN C, WICHERS J, ABAD-SOMOVILLA A, et al. Development of an immunochromatographic assay based on carbon nanoparticles for the determination of the phytoregulator for chlorfenuron[J]. Biosens Bioelectron, 2013, 42(8): 170–176. |
| [38] | BLAŽKOVÁ M, MIČKOVÁ-HOLUBOVÁ B, RAUCH P, et al. Immunochromatographic colloidal carbon-based assay for detection of methiocarb in surface water[J]. Biosens Bioelectron, 2009, 25(4): 753–758. doi:10.1016/j.bios.2009.08.023 |
| [39] | BLAŽKOVÁ M, RAUCH P, FUKAL L. Strip-based immunoassay for rapid detection of thiabendazole[J]. Biosens Bioelectron, 2010, 25(9): 2122–2128. doi:10.1016/j.bios.2010.02.011 |
| [40] | ŠMÍDOVÁZ, BLAŽKOVÁM, FUKALL. Pesticides in food-immunochromatographic detection of thiabendazole and methiocarb[J]. Czech J Food Sci, 2009, 27(Special issue): 414–416. |
| [41] | GORDON J, MICHEL G. Analytical sensitivity limits for lateral flow immunoassays[J]. Clin Chem, 2008, 54(7): 1250–1251. doi:10.1373/clinchem.2007.102491 |
| [42] | NOGUERA P S, PSTHUMA-TRUMPIE G A, VAN TUIL M, et al. Carbon nanoparticles as detection labels in antibody microarrays. Detection of genes encoding virulence factors in Shiga toxin-producing Escherichia coli [J]. Anal Chem, 2011, 83(22): 8531–8636. doi:10.1021/ac201823v |
| [43] | STANISAVLJEVIC M, KRIZKOVA S, VACULOVICOVA M, et al. Quantum dots-fluorescence resonance energy transfer-based nanosensors and their application[J]. Biosen Bioelectron, 2015, 74: 562–574. doi:10.1016/j.bios.2015.06.076 |
| [44] | SHEN Y Y, LI L L, LU Q, et al. Microwave-assisted synthesis of highly luminescent CdSeTe@ZnS-SiO2 quantum dots and their application in the detection of Cu(II) [J]. Chem Commun, 2012, 48(16): 2222–2224. doi:10.1039/c2cc16329b |
| [45] | GORYACHEVA I Y, SPERANSKAYA E S, GOFTMAN V V, et al. Synthesis and bioanalytical applications of nanostructures multiloaded with quantum dots[J]. Trends Anal Chem, 2015, 66: 53–62. doi:10.1016/j.trac.2014.11.008 |
| [46] | BRUNO J G. Application of DNA aptamers and quantum dots to lateral flow test strips for detection of foodborne pathogens with improved sensitivity versus colloidal gold [J]. Pathogens, 2014, 3(2): 341–355. doi:10.3390/pathogens3020341 |
| [47] | BERLINA A N, TARANOVA N A, ZHERDEV A V, et al. Quantum dot-based lateral flow immunoassay for detection of chloramphenicol in milk[J]. Anal Bioanal Chem, 2013, 405(14): 4997–5000. doi:10.1007/s00216-013-6876-3 |
| [48] | ZOU Z X, DU D, WANG J, et al. Quantum dot-based immunochromatographic fluorescent biosensor for biomonitoring trichloropyridinol, a biomarker of exposure to chlorpyrifos[J]. Anal Chem, 2010, 82(12): 5125–5133. doi:10.1021/ac100260m |
| [49] | ZHANG W Y, GE X X, TANG Y, et al. Nanoparticle-based immunochromatographic test strip with fluorescent detector for quantification of phosphorylated acetylcholinesterase: an exposure biomarker of organophosphorus agents[J]. Analyst, 2013, 138(18): 5431–5436. doi:10.1039/c3an00621b |
| [50] | ESTEVE-TURRILLAS F A, ABAD-FUENTES A. Applications of quantum dots as probes in immunosensing of small-sized analytes[J]. Biosens Bioelectron, 2013, 41: 12–29. doi:10.1016/j.bios.2012.09.025 |
| [51] | LIU C H, WANG Z, JIA H X, et al. Efficient fluorescence resonance energy transfer between upconversion nanophosphors and graphene oxide: a highly sensitive biosensing platform[J]. Chem Commun, 2011, 47(16): 4661–4663. doi:10.1039/c1cc10597c |
| [52] | WU S J, DUAN N, ZHU C Q, et al. Magnetic nanobead-based immunoassay for the simultaneous detection of aflatoxin B1 and ochratoxin A using upconversion nanoparticles as multicolor labels [J]. Biosens Bioelectron, 2011, 30(1): 35–42. doi:10.1016/j.bios.2011.08.023 |
| [53] | AUZEL F. Upconversion and anti-stokes processes with f and d ions in solids[J]. Chem Rev, 2004, 104(1): 139–174. doi:10.1021/cr020357g |
| [54] | TJON KON FAT E M, ABRAMS W R, NIEDBALA R S, et al. Chapter 11-lateral flow sandwich assay utilizing upconverting phosphor (UCP) reporters[J]. Methods Cell Biol, 2012, 112: 203–234. doi:10.1016/B978-0-12-405914-6.00011-1 |
| [55] | HU W W, CHEN Q S, LI H H, et al. Fabricating a novel label-free aptasensor for acetamiprid by fluorescence resonance energy transfer between NH2-NaYF4: Yb, Ho@SiO2 and Au nanoparticles [J]. Biosens Bioelectron, 2016, 80: 398–404. doi:10.1016/j.bios.2016.02.001 |
| [56] | YOU H J, HUA X D, FENG L, et al. Competitive immunoassay for imidaclothiz using upconversion nanoparticles and gold nanoparticles as labels[J]. Microchim Acta, 2017, 184(4): 1085–1092. doi:10.1007/s00604-017-2097-3 |
| [57] | MEI Q S, JING H R, LI Y, et al. Smartphone based visual and quantitative assay on upconversional paper sensor[J]. Biosens Bioelectron, 2016, 75: 427–432. doi:10.1016/j.bios.2015.08.054 |
| [58] |
任志奇, 吴英松, 刘天才. 新型免疫层析技术的研究进展[J]. 广东医学, 2013, 34(2): 312–314.
REN Z Q, WU Y S, LIU T C. The research progress of new immune chromatography technology[J]. Guangdong Med J, 2013, 34(2): 312–314. |
| [59] |
李建武, 宋春美, 刘芳, 等. 免疫层析试纸技术及其在食品安全检测中的应用[J]. 食品科学, 2014, 35(8): 36–41.
LI J W, SONG C M, LIU F, et al. Immunochromatographic strip technology and its application in food safety detection[J]. Food Sci, 2014, 35(8): 36–41. doi:10.7506/spkx1002-6630-201408007 |
| [60] | RYU Y, JIN Z W, KANG M S, et al. Increase in the detection sensitivity of a lateral flow assay for a cardiac marker by oriented immobilization of antibody[J]. Biochip J, 2011, 5(3): 193–198. doi:10.1007/s13206-011-5301-2 |
| [61] |
孙建斌, 雷小英, 包晗, 等. 纳米磁性颗粒标记的免疫层析法定量检测人绒毛膜促性腺激素[J]. 现代生物医学进展, 2011, 24(11): 5001–5004.
SUN J B, LEI X Y, BAO H, et al. Application of magnetic nanoparticles in rapid quantitative immunochromatography detection of human chorionic gonadotrophin[J]. Progr Mod Biomed, 2011, 24(11): 5001–5004. |
| [62] | LIU C Y, JIA Q J, YANG C H, et al. Lateral flow immunochromatographic assay for sensitive pesticide detection by using Fe3O4 nanoparticle aggregates as color reagents [J]. Anal Chem, 2011, 83(17): 6778–6784. doi:10.1021/ac201462d |
| [63] |
武学成, 何林, 周克元. 时间分辨荧光免疫分析技术及临床应用[J]. 医学综述, 2006, 12(7): 434–436.
WU X C, HE L, ZHOU K Y. The research and clinical application of time-resolved fluoroimmunoassay[J]. Med Recapit, 2006, 12(7): 434–436. |
| [64] | ZHANG Z W, WANG D, LI J, et al. Monoclonal antibody-europium conjugate-based lateral flow time-resolved fluoroimmunoassay for quantitative determination of T-2 toxin in cereals and feed[J]. Anal Methods, 2015, 7(6): 2822–2829. doi:10.1039/C5AY00100E |
| [65] | WANG D, ZHANG Z W, LI P W, et al. Time-resolved fluorescent immunochromatography of aflatoxin B1 in soybean sauce: a rapid and sensitive quantitative analysis[J]. Sensors, 2016, 16(7): 1094. doi:10.3390/s16071094 |
| [66] |
崔浩, 陈耀强, 唐勇, 等. 莱克多巴胺荧光胶乳颗粒免疫层析检测法的建立[J]. 分析测试学报, 2011, 30(7): 764–768.
CUI H, CHEN Y Q, TANG Y, et al. Development of an immunochromatography assay with fluorescent latex particles for the rapid detection of ractopamine[J]. J Instrum Anal, 2011, 30(7): 764–768. |
 2017, Vol. 19
2017, Vol. 19


