西瓜蔓枯病致病菌为 Didymella bryoniae,是危害西瓜生产的重要病害之一,可造成减产 15%~30%,重病田块可减产 80% 以上,同时还会明显影响果实品质,严重威胁西瓜生产[1]。中国有关瓜类蔓枯病的研究起步较晚,且主要集中在甜瓜蔓枯病方面[2-7],而针对西瓜、黄瓜等的研究相对较少[8-13]。适时施用多菌灵、百菌清、甲基托布津及代森锰锌等药剂是目前防治西瓜蔓枯病最直接有效的方法之一,但杀菌剂的长期大量使用将不可避免地诱导田间抗性的产生,在生产上常常引起药剂防效下降或失效等问题[14-16]。
啶酰菌胺 (boscalid, Scheme 1) 是由巴斯夫公司于 1992 年开发的琥珀酸脱氢酶抑制剂类 (SDHIs) 杀菌剂,作用机制主要是抑制病原菌琥珀酸脱氢酶的活性,从而干扰其呼吸作用[17]。植物病原菌对 SDHIs 杀菌剂的抗性在 Sdh B、Sdh C 和 Sdh D 亚基上均有发生[18-22],现有的报道中,无论是田间抗性菌株还是室内诱导获得的抗药性突变体,突变位点均主要发生在 Sdh B 亚基上第 220 位至第 290 位氨基酸之间[19, 23-24]。2007 年,Stammler 等[23]的研究表明,灰葡萄孢 Botrytis cinerea 对啶酰菌胺的抗性是由于其 Sdh B 亚基第 225 位和 272 位上的氨基酸突变所致;而百合灰霉病菌 Botrytis elliptica 在 Sdh B 亚基 272 位上的氨基酸由组氨酸突变为酪氨酸或精氨酸,使得其对啶酰菌胺产生了抗性。2008 年,Avenot 等[22]监测到了对啶酰菌胺具有极高水平抗性的马铃早疫病菌 Alternaria solani,并发现其对啶酰菌胺和萎锈灵之间存在交互抗性,通过比对抗性和敏感菌株的 Sdh B 亚基全序列,发现存在 2 种抗性突变型,分别为 277 位上的组氨酸 (His) 转变为酪氨酸 (Tyr) 或精氨酸 (Arg)。同年,Ishii 等[19, 24]在日本的田间检测到了抗啶酰菌胺的黄瓜褐斑病菌 Corynespora cassiicola,并发现所有极高抗性菌株均是由于 Sdh B 亚基 278 位上的氨基酸由组氨酸 (His) 突变为酪氨酸 (Tyr) 所致。
目前已有关于啶酰菌胺用于西瓜蔓枯病防治的报道[8, 12],但尚未见有关该病原菌对啶酰菌胺抗药性的分子机理及生物学特性方面的研究报道。因此,研究西瓜蔓枯病菌对啶酰菌胺的抗性风险,探究其可能的抗性机制,为啶酰菌胺在西瓜蔓枯病防治上的应用、延缓其抗性的产生及延长药剂使用寿命均具有重要的指导意义。
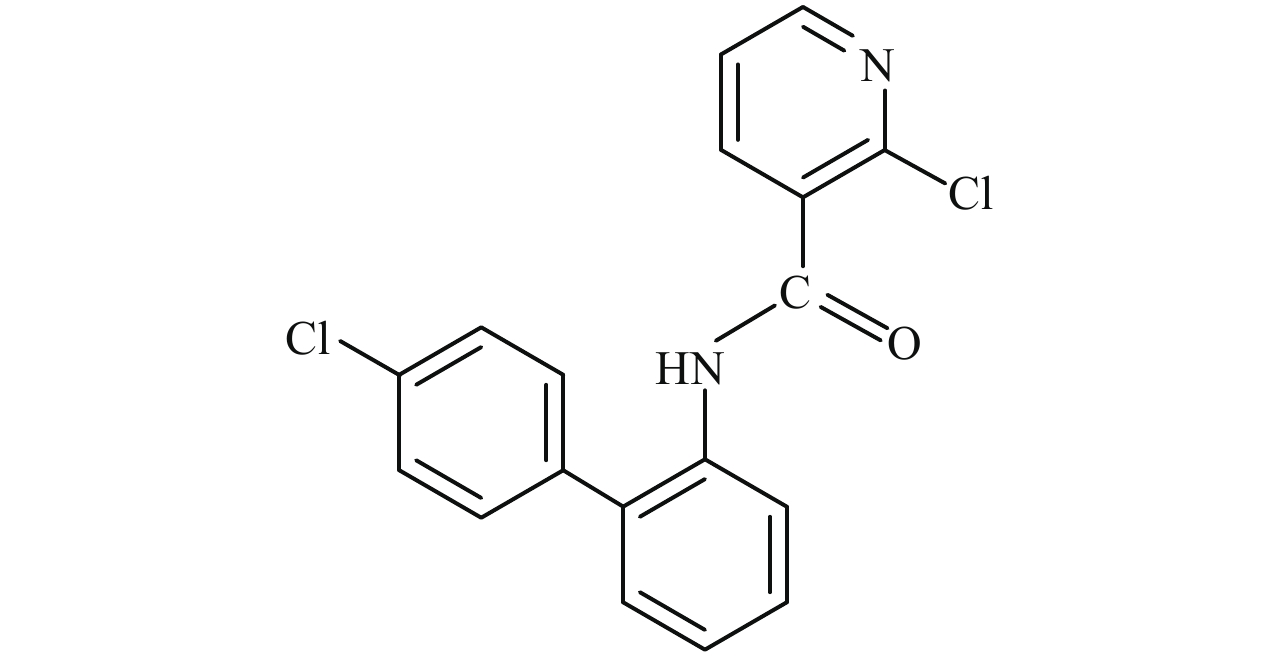
|
Scheme1 |
1 材料与方法 1.1 供试材料
菌株:西瓜蔓枯病菌 Didymella bryoniae 野生菌株 XF21 和 YC60 分别分离自贵州省息烽市和重庆市永川区。田间采集感病叶片,在实验室根据蔓枯病菌的形态特征进行多次分离纯化[7, 9]获得。
原药:98% 啶酰菌胺 (boscalid)、98% 萎锈灵 (carboxin)、97% 噻呋酰胺 (thifluzamide)、97% 戊唑醇 (tebuconazole)、97% 醚菌酯 (kresoxim-methyl) 及 95% 乙霉威 (diethofencarb),均购于湖北康宝泰精细化工有限公司,用丙酮溶解配制成 1 × 104 μg/mL 的母液,于 4 ℃ 保存,备用。
马铃薯葡萄糖琼脂培养基 (PDA):马铃薯 200 g、葡萄糖 20 g、琼脂粉 20 g,加水定容至 1 L,用于菌株的培养及保存;马铃薯磷酸二氢铵培养基:马铃薯 200 g、葡萄糖 20 g、琼脂粉 20 g、磷酸二氢铵 2 g,加水定容至 1 L,用于菌株产孢培养。
1.2 药剂驯化参考陈杰[25]的方法进行药剂驯化获得抗性突变菌株。随机选取一定数量的敏感菌株,于 PDA 平板上活化 4 d 后,接种于含有 EC50 浓度[26]啶酰菌胺的平板上,25 ℃ 条件下培养,待菌落长满平板 2/3 大小时,于边缘打取菌碟,转接至下一浓度继续驯化培养。初始几代转接浓度成倍递增,待后续生长速度加快时可适量增大转接浓度。以出现扇形突变或在较高药剂浓度下依然可快速生长的菌株为疑似抗性突变体,测定其 EC50 值,按 (1) 式计算抗性倍数 (RR),保存备用。此过程耗时约 8 个月。
| $\begin{split}\text{抗性倍数} & =\\ & \!\!\!\!\!\!\!\!\!\!\text{抗性突变体 }{\rm{E}}{{\rm{C}}_{50}}\text{ 值} / \text{亲本菌株 }{\rm{E}}{{\rm{C}}_{50}}\text{ 值}\end{split}$ | (1) |
根据抗性倍数确定其抗性水平。抗性划分标准[27]:RR ≤ 5 为敏感菌株;5 < RR ≤ 10 为低抗菌株;10 < RR ≤ 100 为中抗菌株;RR > 100 为高抗菌株。
1.3 抗性突变体生物学特性研究1.3.1 抗性遗传稳定性测定 将抗性突变体在无药 PDA 平板上连续转接 8 代,采用菌丝生长速率法[28]分别测定第 2、4、6、8 代对啶酰菌胺的敏感性。根据抗性倍数变化情况确定病原菌抗药性状的遗传稳定性。
1.3.2 抗性突变体生长速率测定 采用菌丝生长速率法[28]。于活化后的抗性突变体及其亲本菌株菌落边缘打取直径 7 mm 的菌碟,接种于无药 PDA 培养基上,25 ℃下培养。分别于 24、48、72 及 96 h 后用十字交叉法测量菌落直径 (mm)。每菌株 3 次重复。以时间为横坐标、平均菌落直径为纵坐标绘制生长曲线。
1.3.3 温度对抗性突变体生长的影响 于活化后的抗性突变体及亲本菌株菌落边缘打取直径 7 mm 的菌碟,接种于无药 PDA 培养基上,分别于 5、10、15、20、25、30 和 35 ℃培养箱中培养,4 d 后采用十字交叉法测量菌落直径 (mm)。每菌株 3 次重复。以温度为横坐标、平均菌落直径为纵坐标绘制生长曲线。
1.3.4 抗性突变体对渗透压的敏感性测定
1.3.4.1 抗性突变体在高盐条件下的生长 于活化后的抗性突变体及其亲本菌株菌落边缘打取直径 7 mm 的菌碟,分别接种至含有 3、6、12、24、48 和 96 g/L 氯化钠的无药 PDA 培养基上,以空白 PDA 培养基为对照,25 ℃ 下培养 4 d 后,用十字交叉法测量菌落直径 (mm),按 (2) 式计算菌丝生长抑制率。每菌株 3 次重复。以氯化钠质量浓度为横坐标、菌丝生长抑制率为纵坐标绘制生长曲线。
| $\begin{split}{\text{菌丝生长抑制率}}/\text{\%} \! =\! \left[ {1\! -\!\!{\text{(药剂处理菌落直径} \!-\! 7\;{\rm{mm}}}\text{)} /}\right.\\ \!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\left.{ {\text{(对照菌落直径} - 7\;{\rm{mm}}} } \text{)} \right] \times 100 \; \; \; \; \;\;(2)\end{split}$ |
1.3.4.2 抗性突变体在高糖条件下的生长 于活化后的抗性突变体及其亲本菌株菌落边缘打取直径 7 mm 的菌碟,分别接种至含有 0、10、20、40、80、160、240 和 320 g/L 葡萄糖的无药 PDA 培养基上,以葡萄糖质量浓度为 20 g/L 的 PDA 培养基为对照,25 ℃ 下培养 4 d 后,用十字交叉法测量各菌落直径 (mm)。每菌株 3 次重复。以葡萄糖质量浓度为横坐标、菌丝生长抑制率为纵坐标绘制生长曲线。
1.3.5 抗性突变体产孢量测定 于活化后的抗性突变体及其亲本菌株菌落边缘打取直径 7 mm 的菌碟,分别接种至马铃薯磷酸二氢铵琼脂培养基上,25 ℃ 下培养 7 d 后,刮掉所有气生菌丝并用灭菌纱布封口培养皿,保湿培养,培养过程中于 15 W 黑光灯下进行 12 h 光暗交替,诱导产孢。4 d 后用等量蒸馏水洗脱所有孢子,并用蒸馏水将孢子悬浮液定容至 40 mL,通过血球计数板计算孢子数。每处理 3 次重复。
1.3.6 抗性突变体致病性测定 选取大小一致的西瓜叶片若干。用打孔器打取菌龄一致、直径 4 mm 的抗性突变体及亲本敏感菌株菌饼,菌丝面朝下接种至离体西瓜叶片上,每菌株 3 次重复,以接种空白 PDA 的处理作为对照。于 25 ℃ 培养箱中保湿培养 48 h 后,用十字交叉法测量病斑直径。
1.3.7 抗性突变体对其他药剂的交互抗性测定 参照预试验结果,采用菌丝生长速率法[28]分别测定敏感菌株及抗性突变体对同类型琥珀酸脱氢酶抑制剂类杀菌剂萎锈灵 (敏感菌株处理浓度为:0.050、0.299、1.047、4.785、21.867 和 100.000 μg/mL,抗性突变体为:0.100、0.457、2.088、9.542、43.607 和 199.284 μg/mL)、噻呋酰胺 (敏感:0.003、0.030、0.300、3.000、30.000 和 300.000 μg/mL,抗性:0.003、0.038、0.483、6.145、78.183 和 994.722 μg/mL),甲氧基丙烯酸酯类杀菌剂醚菌酯 (0.007、0.045、0.292、1.892、12.260 和 79.445 μg/mL),三唑类杀菌剂戊唑醇 (0.003、0.015、0.076、0.385、1.950 和 9.880 μg/mL) 以及氨基甲酸酯类杀菌剂乙霉威 (0.100、0.209、0.437、0.914、1.911 和 3.996 μg/mL) 的敏感性,分析其交互抗性关系。
1.4 抗性分子机理分析按照杨艳秋等[29]的方法提取西瓜蔓枯病菌的 DNA,参照 Avenot 等[30]设计引物对 WSQ1/WSQ2 (5′-CTTGTCCCTGACATGACACTT-3′/5′-TCCTTGAGCAGTTGAGAATGG-3′),用 TaKaRa LA Taq 酶对 Sdh B 亚基进行 PCR 扩增 (扩增条件:95 ℃ 4 min;95 ℃ 1 min,55 ℃ 30 s,72 ℃ 21 s,25 个循环;72 ℃ 10 min)。所得 PCR 产物经电泳分离并切胶纯化回收后,用 pMDTM19-T 克隆载体试剂盒连接,采用热激法转化连接产物至感受态细胞 DH5-α。分别选取 3~5 个成功的阳性克隆菌液进行 DNA 测序,测序结果用 DNAMAN 软件进行序列比对分析。
2 结果与分析 2.1 室内抗药性突变菌株的获得经过药剂驯化,共获得 2 株抗性突变体 XF21-3 和 YC60-1,其中 XF21-3 由 XF21 在啶酰菌胺终浓度为 800 μg/mL 的 PDA 平板上汰选获得,YC60-1 由 YC60 在啶酰菌胺终浓度为 12 μg/mL 的 PDA 平板上发生扇形突变获得,经测定其 EC50 值分别为 108.073 和 124.650 μg/mL,抗性倍数分别为 1 007 和 1 347,均为高抗菌株 (表 1)。
|
|
表 1 啶酰菌胺抗性突变体及其亲本菌株的 EC50 值及抗性倍数 Table 1 EC50 value of D. bryoniae boscalid-resistant strains and their parent strains and the resistance ratio of resistant strains |
2.2 抗性突变体的生物学特性
2.2.1 抗性遗传稳定性 经过 8 次连续转代后,抗性突变体 XF21-3 和 YC60-1 的 EC50 值分别为 73.0 和 91.9 μg/mL,抗性倍数分别为 680 和 994 (表 2)。连续转代后,XF21-3 的抗性倍数较 F1 代而言虽然有所下降,但仍保持极高的抗性水平,而 YC60-1 的抗性倍数与其 F1 代相比不仅未随转接代数下降反而有所升高。由此推断,一旦西瓜蔓枯病菌对啶酰菌胺产生了抗性,即便是长期脱离药剂选择压,其抗药性也能稳定遗传,不易恢复到敏感水平。
|
|
表 2 啶酰菌胺抗性突变体连续转接培养后 EC50 值和抗性倍数的变化 Table 2 The changes of EC50 value and resistance ratio of boscalid-resistant strains after continuous transference |
2.2.2 抗性突变体与敏感菌株菌丝生长速率比较 从菌丝生长曲线 (图 1) 可看出:抗性突变体 YC60-1 生长速率最快,敏感菌株 XF21 生长速率最慢。同时,抗性突变体 XF21-3 的生长速率快于其亲本菌株 XF21,两者差异显著 (P<0.05);而抗性突变体 YC60-1 的生长速率与其亲本菌株 YC60 相近,未达到差异显著水平。
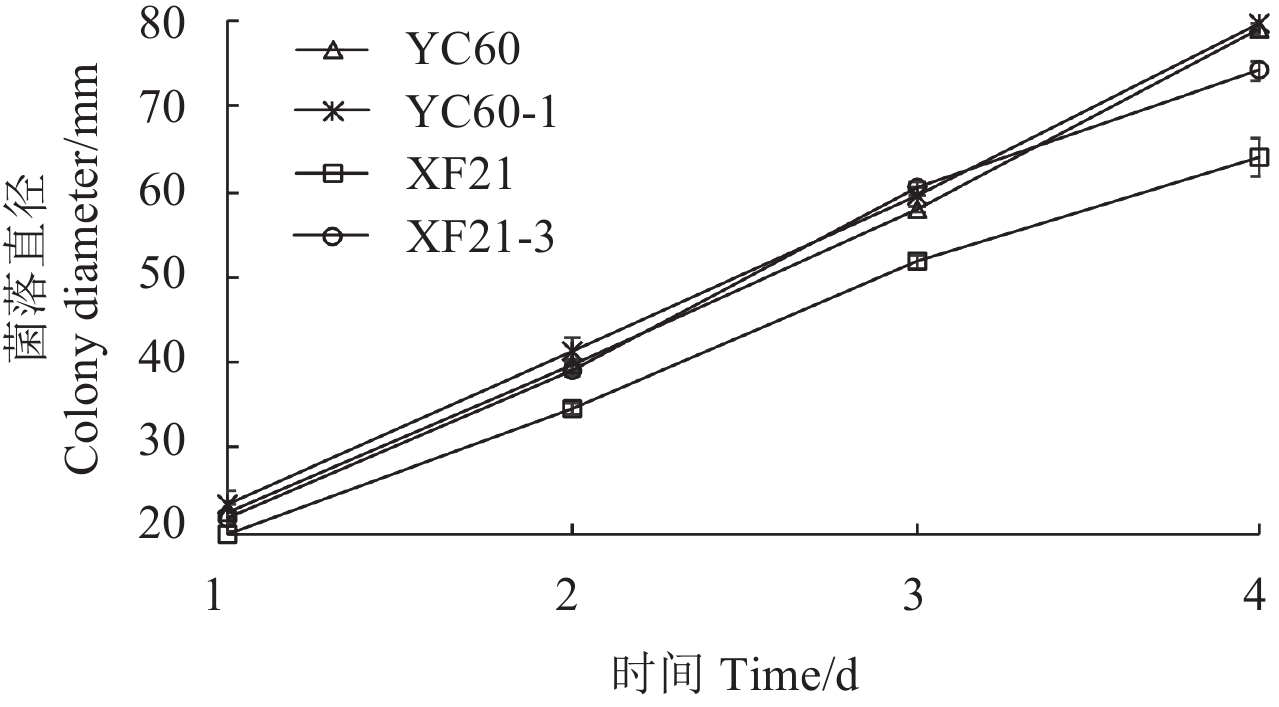
|
图 1 抗性突变体及其亲本菌株菌丝生长曲线 Fig. 1 Growth curve of boscalid-resistance strains and their parental strains |
2.2.3 温度对抗性突变体生长的影响 图 2 表明:两株抗性突变体及其亲本菌株的最适宜生长温度有所差异,其中 XF21 和 XF21-3 的最适宜生长温度在 20~25 ℃ 之间,YC60 和 YC60-1 在 25~30 ℃ 之间;但供试所有菌株最适宜的生长温度仍为 25 ℃,未发生明显变化;在低于 15 ℃ 及高于 30 ℃ 条件下,所有菌株的生长都十分缓慢,菌丝生长速率急剧下降。
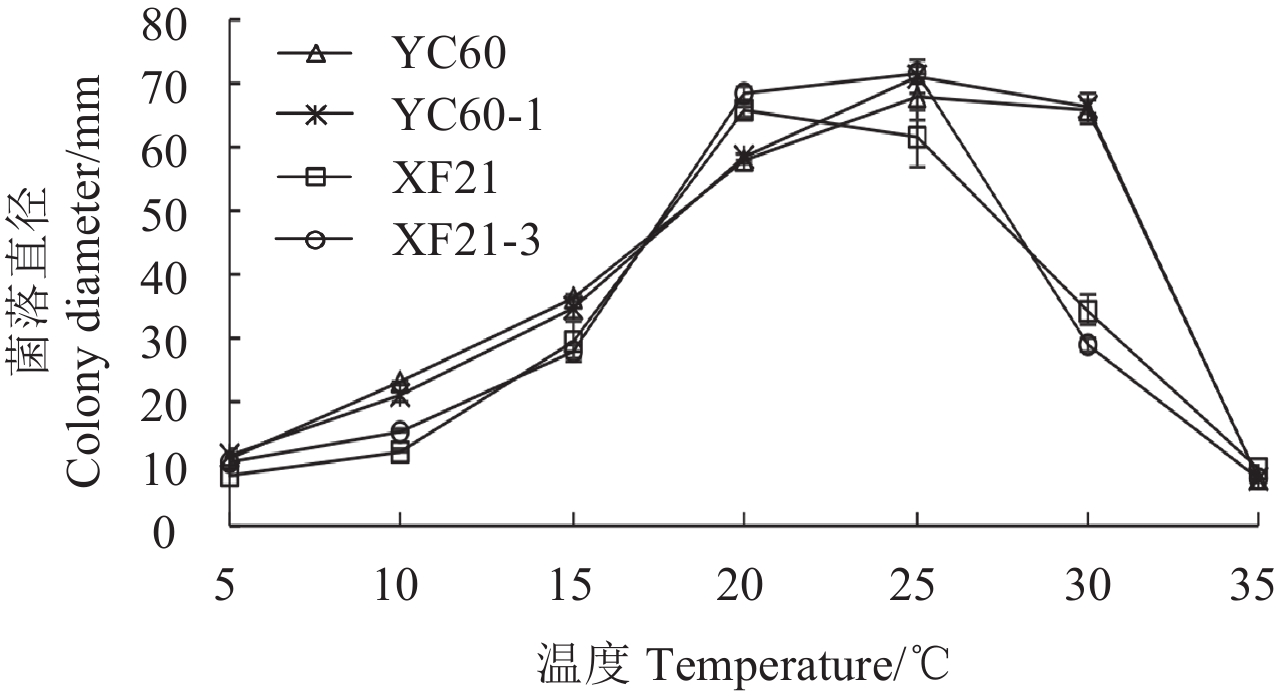
|
图 2 温度对啶酰菌胺抗性突变体及敏感菌株生长速率的影响 Fig. 2 Colony diameter of boscalid-resistance and sensitive strains in different temperature |
2.2.4 抗性突变体对渗透压的敏感性
2.2.4.1 抗性突变体在高盐条件下的生长状况 图 3 表明:低浓度氯化钠处理除对抗性突变体 YC60-1 的生长表现为抑制作用外,对其余 3 个菌株均表现为促进作用;但当 PDA 培养基中氯化钠质量浓度升至高于 25 g/L 时,对所有菌株均表现为抑制作用,并且随氯化钠浓度进一步升高,其对敏感菌株生长的抑制作用大于对抗性突变体。表明抗性突变体对氯化钠浓度的敏感性低于敏感菌株。
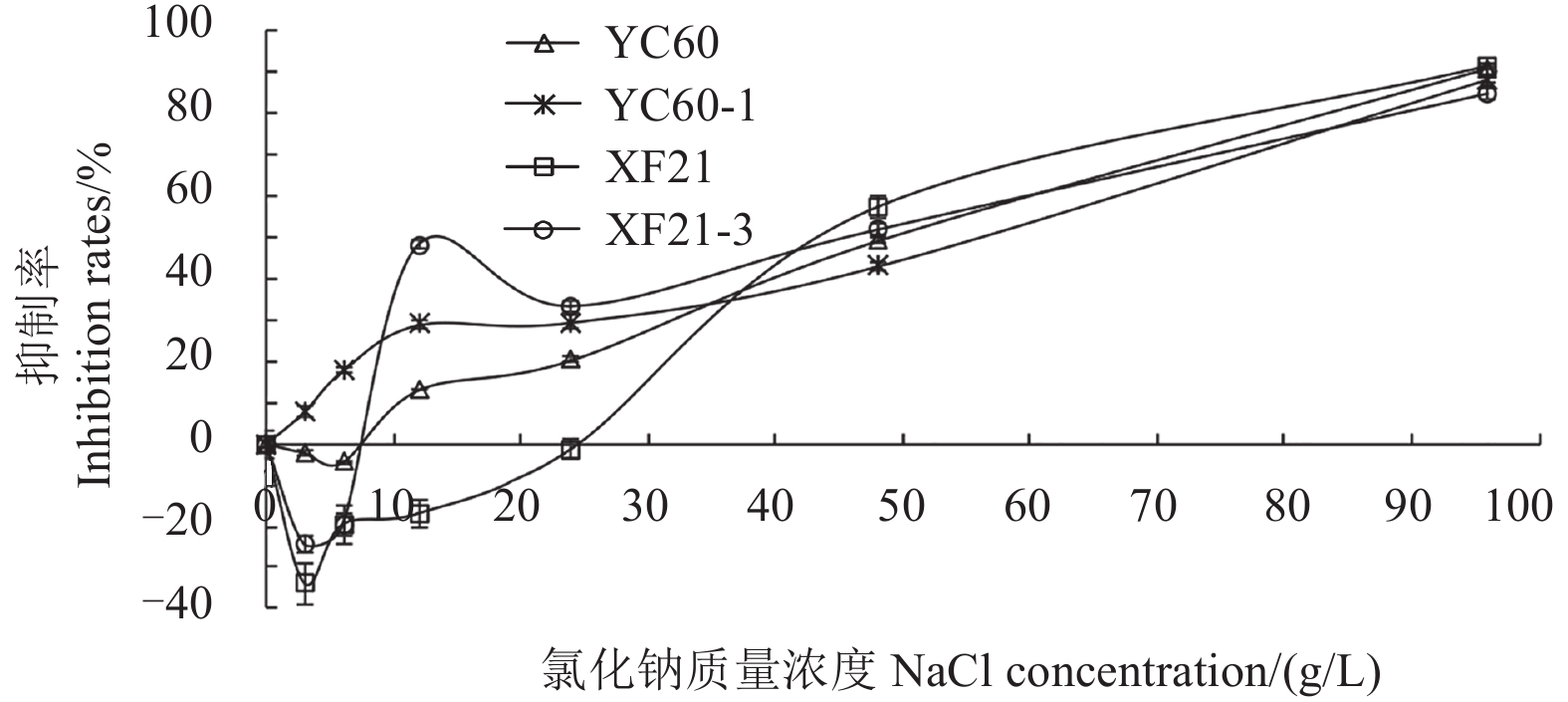
|
图 3 不同氯化钠浓度下供试菌株菌丝生长状况 Fig. 3 Inhibition rates of boscalid-resistance strains and sensitive strains on different salt concentrations |
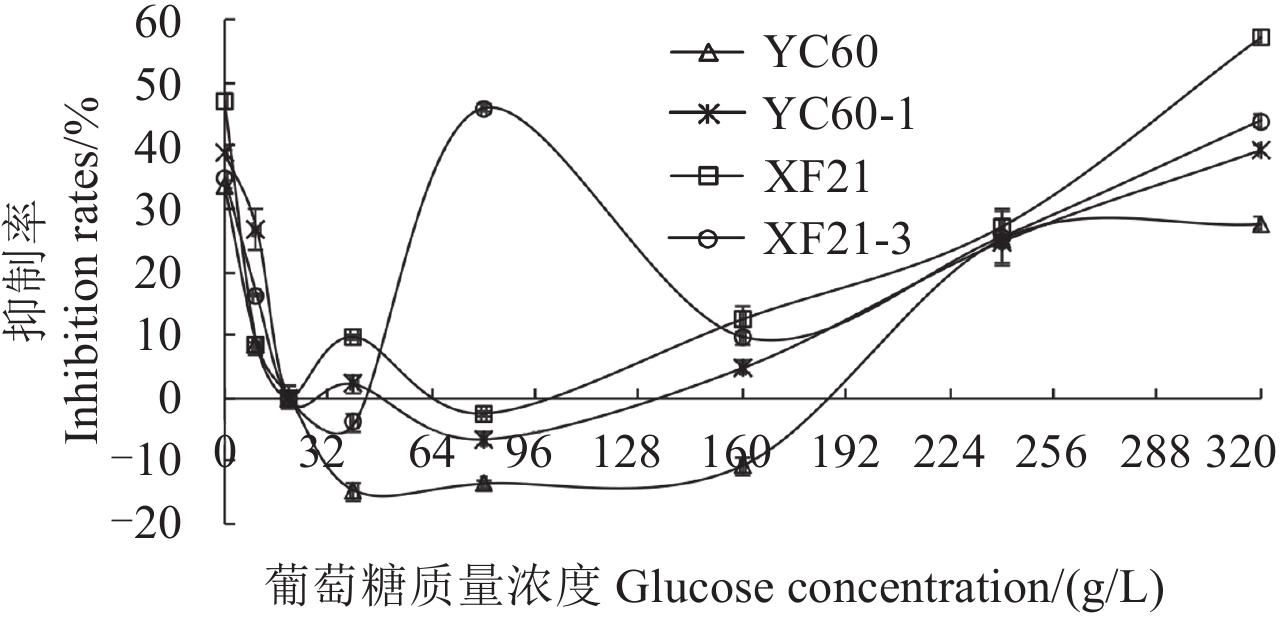
2.2.4.2 抗性突变体在高糖条件下的生长状况 图 4 表明:当 PDA 培养基中葡萄糖质量浓度为 40 g/L 时,对抗性突变体 XF21-3 和敏感菌株 YC60 菌丝生长的促进作用最为明显,当葡萄糖质量浓度为 80 g/L 时,对抗性突变体 YC60-1 和敏感菌株 XF21 生长的促进作用最明显。而当葡萄糖质量浓度小于 20 g/L 和大于 160 g/L 时,则对除亲本菌株 YC60 外所有菌株的菌丝生长均表现为抑制作用,且抑制率最大时的浓度各不相同。因此推测,菌株对于葡萄糖浓度的敏感性与抗性的产生无关而与菌株的特异性有关。
|
图 4 不同葡萄糖浓度下供试菌株菌丝生长状况 Fig. 4 Inhibition rates of boscalid-resistance strains and sensitive strains on different glucose concentrations |
2.2.5 抗性突变体的产孢能力 结果 (表 3) 表明,抗性突变体的产孢量均大于敏感菌株,其中,XF21-3 的产孢量远高于其亲本菌株 XF21,差异显著 (P<0.05)。由此推断,随着抗性的产生,菌株的繁殖力有所增强。
|
|
表 3 抗性突变体与亲本菌株的产孢量比较 Table 3 Spore production between boscalid-resistance strains and sensitive strains of D. bryoniae |
2.2.6 抗性突变体的致病性 接种 48 h 后,抗性突变体 XF21-3 及 YC60-1 处理组病斑面积与各自的亲本菌株之间均无显著性差异,但在不同菌株之间则差异显著 (表 4)。由此推断,西瓜蔓枯病菌对啶酰菌胺的致病力与抗性的产生无关,而与菌株之间的特异性差异有关。
|
|
表 4 抗性突变体与亲本菌株的致病力比较 Table 4 Ability of pathogenicity between boscalid-resistance strains and sensitive strains of D. bryoniae |
2.2.7 抗性突变体对其他药剂的交互抗性 啶酰菌胺与其他 5 种杀菌剂之间的交互抗性测定结果见表 5。其中,抗性突变体 XF21-3、YC60-1 及其亲本敏感菌株对萎锈灵、乙霉威、戊唑醇和醚菌酯均表现为敏感,表明啶酰菌胺与这 4 种药剂之间不存在交互抗性;XF21-3 和 YC60-1 对噻呋酰胺的抗性倍数分别为 1 233 和 57,说明啶酰菌胺与噻呋酰胺之间存在正交互抗性。
|
|
表 5 啶酰菌胺抗性突变体对不同药剂的 EC50 值 Table 5 EC50 value of D. bryoniae boscalid-resistance strains to different fungicides |
2.3 突变体的抗性分子机理
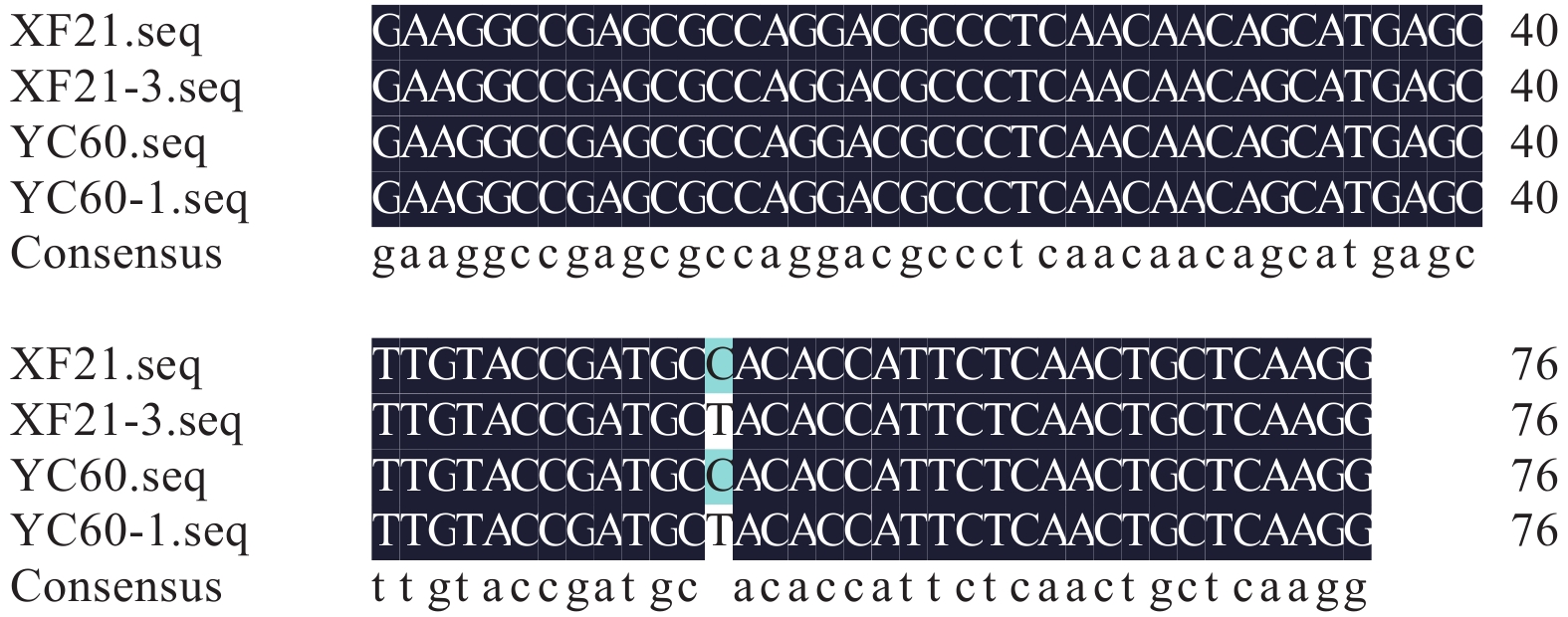
利用引物对 WSQ1/2 对抗性突变体 XF21-3、YC60-1 及其亲本菌株 XF21、YC60 的 Sdh B 亚基基因进行 PCR 扩增,均得到了 337 bp 的 DNA 片段,其中第 220 位氨基酸至第 291 位氨基酸所对应的碱基序列比对如图 5 所示。从中可以看出,277 位氨基酸残基所对应的碱基序列由 CAC 突变为 TAC,即由组氨酸 (His) 突变为酪氨酸 (Tyr),其他氨基酸位点未发生变异,因此认为这两株西瓜蔓枯病菌株对啶酰菌胺的抗性可能是由 Sdh B 亚基上 277 位点的氨基酸突变而导致的。
|
图 5 抗性突变体 Sdh B 亚基突变位点 Fig. 5 The Sdh B subunits sequence alignment of boscalid-resistance strains |
3 结论与讨论
抗药性的产生通常会伴随着生物学特性的改变,因此生物学特性研究结果是抗药性风险评价的重要指标之一[31]。多数研究者认为,病原菌产生抗药性后,其自然适合度会降低,竞争力减弱,无药条件下抗性菌株的相关生物学指标明显低于敏感菌株[32-34]。而在实际生产自然环境条件下,抗性菌株能否发展为优势群体即与其竞争力有关,如果抗性群体的生命力较弱,不能在与敏感群体的竞争中占优,将不能在田间形成优势群体,抗性问题也就不易出现,反之则存在比较严重的抗性风险[35-36]。
本研究结果表明:西瓜蔓枯病菌对啶酰菌胺产生抗性后,其抗性能稳定遗传并保持较高水平。在无药剂胁迫的环境下,突变体的菌丝生长随抗性水平增高而有所增加,且不同菌株间增加幅度存在差异;抗性突变体的产孢量均大于敏感菌株,其中 XF21-3 的产孢量与亲本菌株 XF21 相比达到差异显著水平;抗性及敏感菌株在致病性方面无显著差异。因此可推断,田间西瓜蔓枯病菌一旦对啶酰菌胺产生抗性后,抗性菌株存活的概率较大,利于形成优势群体。此外,虽然抗性突变体的最适生长温度未发生变化,但其在最适温度下的生长速率却有所增加,最适温度范围也更宽,表明在适宜生长的温度条件下,抗性突变体的生存竞争力比敏感菌株强,具备形成优势群体的竞争优势。
在高渗透压环境胁迫下,微生物通常可以合成或从环境中吸收一些低分子质量的物质,以调节内外渗透压的平衡[37]。Ellis 等[38]认为,菌体在高渗透压环境中需要不断合成甘油以维持细胞膨压,消耗大量能量而使得生长受到抑制甚至不能生长,故渗透压变化和抗药性突变可能是同源的。本研究中,敏感菌株对氯化钠浓度的敏感性高于抗性突变体,对葡萄糖浓度的敏感性则与抗性的产生无关。分析可能是由于抗性突变体对渗透压的敏感性下降,导致细胞膜透性降低,使药物分子难以穿过细胞膜进入菌丝体内,从而表现出一定的抗药性,同时也使得抗性突变体对外界渗透压的变化具有相对较强的适应能力。该结论与 Ellis 等[38]的结论一致。
实验室药剂驯化结果表明,西瓜蔓枯病菌对啶酰菌胺较易产生抗药性。交互抗性研究发现,啶酰菌胺与呋噻酰胺之间存在交互抗性,但与萎锈灵、戊唑醇、乙霉威和醚菌酯之间无交互抗性。这是首次发现啶酰菌胺与噻呋酰胺之间存在交互抗性。此外,本研究结果与 Avenot 等[22]关于对啶酰菌胺具极高水平抗性的 A. alternaria 菌株对萎锈灵存在交互抗性的报道不同。在与啶酰菌胺无交互抗性的药剂中,戊唑醇的 EC50 值最低,因此戊唑醇可作为治理啶酰菌胺抗性的候选药剂。
目前关于啶酰菌胺抗性分子机理的研究较多,且多集中于 Sdh 基因突变上。Stevenson 等[39]在田间检测到了因 Sdh B 亚基上氨基酸由组氨酸突变为酪氨酸而引起的西瓜蔓枯病菌对啶酰菌胺的抗性菌株。Avenot 等[40]也发现,Sdh B 亚基上的氨基酸由组氨酸突变为酪氨酸可引起田间西瓜蔓枯病菌对啶酰菌胺的极高抗性菌株,突变为精氨酸则可产生高抗菌株。本研究发现,抗性突变体 Sdh B 亚基 277 位氨基酸由组氨酸 (His) 突变为酪氨酸 (Tyr),其他位点未发生变异,与上述报道一致。同时,也有报道表明,除 Sdh B 基因位点的突变外,Sdh C 和 Sdh D 的基因突变也与啶酰菌胺抗性的产生有一定关系。如开心果上抗啶酰菌胺的链格孢 A. alternata 菌株即分别在 B 亚基上存在 2 个单一位点突变 (H227Y 和 H227R),在 C 亚基上存在 1 个单一位点突变 (H134R),在 D 亚基上存在 2 个单一位点突变 (HD3R 和 D123E) [18]。Mallik 等[41]发现,马铃薯早疫病菌 Alternaria solani 田间抗啶酰菌胺菌株 Sdh B 亚基的第 278 位组氨酸被酪氨酸或精氨酸替代 (H278Y/R),且对啶酰菌胺的抗性主要体现在 Sdh B 亚基的突变;而 Sdh C 的突变 (H134R) 普遍出现在敏感、中抗、高抗和极高抗性菌株中,Sdh D 突变 (H133R) 则在中抗和高抗菌株中出现,另外还检测到了 1 株只存在 Sdh D 突变 (D123E) 的抗性菌株。但关于西瓜蔓枯病菌抗啶酰菌胺菌株是否也在 Sdh C 和 Sdh D 位点上发生了突变还需进一步验证。
笔者对采自中国西南地区 7 个区、县的共 615 株西瓜蔓枯病菌进行了抗性监测,并未发现啶酰菌胺的田间抗性菌株[27],因此尚无法测定田间抗性菌株的生物学特性及其抗性分子机理。而田间抗性监测是一个长期持续的过程,因此还需后续持续跟进,以便及时掌握抗性的发生发展规律,制定合理的用药策略。同时,应对田间检测到的抗性菌株进行生物学特性测定及抗性分子机理研究,以便对啶酰菌胺的应用进行综合评估。
| [1] |
刘书林, 顾兴芳, 石延霞, 等. 瓜类蔬菜蔓枯病研究概况[J]. 中国蔬菜, 2013, 1(18): 1–10.
LIU S L, GU X F, SHI Y X, et al. General research situation on gummy stem blight of cucurbitacae vegetables[J]. China Veget, 2013, 1(18): 1–10. doi:10.3969/j.issn.1000-6346.2013.18.001 |
| [2] |
张永兵. 甜瓜细胞遗传学、单倍体创制及抗蔓枯病分子标记[D]. 南京: 南京农业大学, 2007: 6-19.
ZHANG Y B. Cytogenetics, haploid breeding and molecular markers linked to genes for resistance to gummy stem blight in melon[D]. Nanjing: Nanjing Agricultural University, 2007: 6-19. |
| [3] |
任海英, 方丽, 茹水江, 等. 抗蔓枯病甜瓜突变体 edr2 抗病现象的初步研究[J]. 中国农业科学, 2009, 42(9): 3131–3138.
REN H Y, FANG L, RU S J, et al. A preliminary investigation of a mutant melon plant edr2 on resistance to gummy stem blight[J]. Scientia Agricultura Sinica, 2009, 42(9): 3131–3138. doi:10.3864/j.issn.0578-1752.2009.09.014 |
| [4] |
王红英, 钱春桃, 娄丽娜, 等. 甜瓜抗蔓枯病基因 Gsb-4 的分子标记
[J]. 园艺学报, 2012, 39(3): 574–580.
WANG H Y, QIAN C T, LOU L N, et al. A SSR marker linked to Gsb-4 loci resistance to gummy stem blight in melon [J]. Acta Horticulturae Sinica, 2012, 39(3): 574–580. |
| [5] |
张学军, 张永兵, 张龑, 等. 甜瓜抗蔓枯病基因 Gsb-3 的 ISSR 分子标记
[J]. 西北植物学报, 2013, 33(2): 261–265.
ZHANG X J, ZHANG Y B, ZHANG L, et al. ISSR markers linked to Gsb-3 resistance of gummy stem blight (Didymella bryoniae) in melon [J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(2): 261–265. |
| [6] |
徐兵划. 甜瓜抗蔓枯病基因聚合的研究[D]. 南京: 南京农业大学, 2014: 1-4.
XU B H. Research of pyramiding two gummy stem blight resistance genes into melon (Cucumis melo L.)[D]. Nanjing: Nanjing Agricultural University, 2014: 1-4. |
| [7] |
毕研飞, 徐兵划, 钱春桃, 等. 分子标记辅助甜瓜抗蔓枯病基因的聚合及品种改良[J]. 中国农业科学, 2015, 48(3): 523–533.
BI Y F, XU B H, QIAN C T, et al. Pyramiding disease resistance genes and variety improvement by molecular marker-assisted selection in melon (Cucumis melon L.) [J]. Scientia Agricultura Sinica, 2015, 48(3): 523–533. doi:10.3864/j.issn.0578-1752.2015.03.12 |
| [8] |
陆佩, 顾振芳, 代光辉, 等. 黄瓜蔓枯病菌生物学特性及室内药剂筛选[J]. 上海交通大学学报(农业科学版), 2003, 21(3): 226–231.
LU P, GU Z F, DAI G H, et al. Biological characteristics and screening for fungicides of Mycosphaerella melonis [J]. J Shanghai Jiaotong Univ (Agric Sci), 2003, 21(3): 226–231. |
| [9] |
李英. 瓜类蔓枯病菌的生物学特性和黄瓜抗病资源的筛选[D]. 南京: 南京农业大学, 2007: 10-13.
LI Y. Study on biology characteristics of Didymella bryoniae and screening of resistance germplasm of cucumber[D]. Nanjing: Nanjing Agricultural University, 2007: 10-13. |
| [10] |
管炜, 李淑菊, 王惠哲, 等. 几种杀菌剂对黄瓜蔓枯病菌的室内毒力测定[J]. 天津农业科学, 2010, 6(3): 82–83.
GUAN W, LI S J, WANG H Z, et al. Toxicity of some fungicides to Mycosphaerlla melonis [J]. Tianjin Agric Sci, 2010, 6(3): 82–83. |
| [11] |
刘书林. 黄瓜蔓枯病抗性遗传分析与 QTL 定位[D]. 北京: 中国农业科学院, 2014: 1.
LIU S L. Genetic analysis and QTL mapping of gummy stem blight resistance in cucumber[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014: 1. |
| [12] |
李雨, 王少秋, 谭蕊, 等. 西瓜蔓枯病有效药剂筛选及药效评价[J]. 农药, 2016, 55(6): 460–462.
LI Y, WANG S Q, TAN R, et al. Evaluation of fungicides for control of gummy stem blight caused by Didymella bryoniae [J]. Agrochemicals, 2016, 55(6): 460–462. |
| [13] |
郑雪松, 茹李军, 张智能, 等. 烯肟菌胺与苯醚甲环唑对西瓜蔓枯病菌的联合毒力及防效[J]. 农学学报, 2016, 6(5): 28–32.
ZHEN X S, RU L J, ZHANG Z N, et al. Co-toxicity and effect of mixtures of fenaminstrobin and difenoconazole against Mycosphaerlla melonis of watermelon [J]. J Agric, 2016, 6(5): 28–32. doi:10.11923/j.issn.2095-4050.cjas15090006 |
| [14] |
王建新, 周明国. 小麦赤霉病菌对多菌灵抗药性监测技术研究[J]. 植物保护学报, 2001, 29(1): 73–77.
WANG J X, ZHOU M G. Methods for monitoring resistance of Gibberella zeae to carbendazim [J]. Acta Phytophylacica Sinica, 2001, 29(1): 73–77. |
| [15] |
何秀玲, 张一宾. 甲氧基丙烯酸酯类和酰胺类杀菌剂品种市场和抗性发展情况[J]. 世界农药, 2013, 35(3): 14–19.
HE X L, ZHANG Y B. Market and resistance of strobilurin and carboxamide fungicides[J]. World Pestic, 2013, 35(3): 14–19. |
| [16] |
叶滔, 马志强, 毕秋艳, 等. 植物病原真菌对甾醇生物合成抑制剂类(SBIs)杀菌剂的抗药性研究进展[J]. 农药学学报, 2012, 14(1): 1–16.
YE T, MA Z Q, BI Q Y, et al. Research advances on the resistance of plant pathogenic fungi to SBIs fungicides[J]. Chin J Pestic Sci, 2012, 14(1): 1–16. |
| [17] | RUSSELLPE. Fungicide resistance action committee (FRAC): a resistance activity update[J]. Outlooks Pest Manage, 2009, 20(3): 122–125. doi:10.1564/20jun08 |
| [18] | AVENOT H F, SELLAM A, MICHAILIDES T J. Characterization of mutations in the membrane-anchored subunits AaSDHC and AaSDHD of succinate dehydrogenase from Alternaria alternata isolates conferring field resistance to the fungicide boscalid [J]. Plant Pathol, 2009, 58(6): 1134–1143. doi:10.1111/ppa.2009.58.issue-6 |
| [19] | MIYAMOTO T, ISHII H, STAMMLER G, et al. Distribution and molecular characterization of Corynespora cassiicola isolates resistant to boscalid [J]. Plant Pathol, 2010, 59(5): 873–881. doi:10.1111/ppa.2010.59.issue-5 |
| [20] | MALLIK I, ARABIAT S, PASCHE J S, et al. Molecular characterization and detection of mutations associated with resistance to succinate dehydrogenase-inhibiting fungicides in Alternaria solani [J]. Phytopathology, 2014, 104(1): 40–49. doi:10.1094/PHYTO-02-13-0041-R |
| [21] | FRANK M, GLAETTLI A, SCHLEHUBER S, et al. Mutations in the target protein of succinate-dehydrogenase inhibitors (SDHI) conferring changes in fungicide sensitivity[J]. Phytopathology, 2010, 100(6): 37. |
| [22] | AVENOT H F, SELLAM A, KARAOGLANIDIS G, et al. Characterization of mutations in the iron-sulphur subunit of succinate dehydrogenase correlating with boscalid resistance in Alternaria alternata from California pistachio [J]. Phytopathology, 2008, 98(6): 736–742. doi:10.1094/PHYTO-98-6-0736 |
| [23] | STAMMLER G, BRIX H D, GLÄTTLI A. Biological properties of the carboxamide boscalid including recent studies on its mode of action[C]//Proceedings XVI international plant protection congress glasgow. Alton: British Crop Protection Council, 2007: 40-45. |
| [24] | ISHII H, FOUNTAINE J, MIYAMOTO T, et al. Occurrence of a mutation in the succinate dehydrogenase gene found in some isolates of cucumber corynespora leaf spot fungus resistant to boscalid[J]. Jpn J Phytopathol, 2008, 74: 38–39. |
| [25] |
陈杰. 西南地区稻瘟病菌对稻瘟灵和吡唑醚菌酯的抗性监测及抗性机理[D]. 重庆: 西南大学, 2015: 19.
CHEN J. Monitoring and mechanisms of resistance to isoprothiolane and pyraclostrobin by Magnaporthe grisea in Southwest China[D]. Chongqing: Southwest University, 2015: 19. |
| [26] |
王少秋, 李雨, 谭蕊, 等. 西瓜蔓枯病菌对啶酰菌胺敏感基线的建立及抗性监测[M]//周明国. 中国植物病害化学防治研究. 北京: 中国农业科学技术出版社, 2016: 174-177.
WANG S Q, LI Y, TAN R, et al. Sensitivity baseline and resistance monitoring of D. bryoniae to boscalid[M]//ZHOU M G. Study on chemical control of plant diseases in China. Beijing: China Agricultural Science and Technology Press, 2016: 174-177. |
| [27] | FAO. Recommended methods for the detection and measurement of resistance of agricultural pests to pesticides[J]. FAO Plant Prot Bull, 1982, 30(2): 30–36. |
| [28] | BECHER R, HETTWER U, KARLOVSKY P, et al. Adaptation of Fusarium graminearum to tebuconazole yielded descendants diverging for levels of fitness, fungicide resistance, virulence, and mycotoxin production [J]. Phytopathology, 2010, 100(5): 444–453. doi:10.1094/PHYTO-100-5-0444 |
| [29] |
杨艳秋, 王丽, 贺丹, 等. 病原真菌 DNA 提取方法及简单重复序列聚合酶链反应体系的优化[J]. 中国组织工程研究与临床康复, 2009, 13(50): 9925–9927.
YANG Y Q, WANG L, HE D, et al. DNA extraction method of pathogenic fungi and the optimization of simple repetitive repeat PCR system[J]. J Clin Rehabilit Tissue Eng Res, 2009, 13(50): 9925–9927. |
| [30] | AVENOT H F, THOMAS A, GITAITIS R D, et al. Molecular characterization of boscalid-and penthiopyrad-resistant isolates of Didymella bryoniae and assessment of their sensitivity to fluopyram [J]. Soc Chem Ind, 2012, 68(4): 645–651. |
| [31] | ZIOGAS B N, MARKOGLOU A N, MALANDRAKIS A A. Studies on the inherent resistance risk to fenhexamid in Botrytis cinerea [J]. Eur J Plant Pathol, 2003, 109(4): 311–317. doi:10.1023/A:1023522213675 |
| [32] | HISADA Y. Fitness of procymidone-resistant Botrytis cinerea strains developed in vitro [J]. Netherlands J Plant Pathol, 1981, 87(3): 243–244. |
| [33] | MORGAN W M. The effect of night temperature and glasshouse ventilation on the incidence of Botrytis cinerea in a late-planted tomato crop [J]. Crop Prot, 1984, 3(2): 243–251. doi:10.1016/0261-2194(84)90058-9 |
| [34] |
刘波, 苗蓉, 刘经芬, 等. 灰霉病菌对二甲酰亚胺类药剂的田间抗药性检测[J]. 莱阳农学院学报, 1977, 14(1): 47–51.
LIU B, MIAO R, LIU J F, et al. Surver of botrytis resistance to dicarboximide in the field[J]. J Laiyang Agric College, 1977, 14(1): 47–51. |
| [35] | KATAN T, ELAD Y, YUNIS H. Resistance to diethofencarb (NPC) in benomyl-resistant field isolates of Botrytis cinerea [J]. Plant Pathol, 1989, 38(1): 86–92. doi:10.1111/ppa.1989.38.issue-1 |
| [36] |
王美琴, 刘慧平, 张智广, 等. 番茄叶霉病菌对多菌灵抗药性的诱导及抗性菌株特性研究[J]. 植物保护, 2004, 30(5): 55–59.
WANG M Q, LIU H P, ZHANG Z G, et al. Resistance induction of Fulvia fulva (Cooke) Ciferri to carbendazim and bionomics of resistant-mutants [J]. Plant Prot, 2004, 30(5): 55–59. |
| [37] |
张小青, 曹军卫, 翟超, 等. 枯草芽孢杆菌渗透压调节基因 proB 的克隆和表达[J]. 微生物学报, 2002, 42(2): 163–168.
ZHANG X Q, CAO J W, ZHAI C, et al. Cloning and expression of a osmoregulatory gene proB from halotolerant Bacillus subtilis [J]. Acta Microbiologica Sinica, 2002, 42(2): 163–168. |
| [38] | ELLIS S W, GRINDLE M. Effect of osmotic stress on yield and polyolcontent of dicarboximide-sensitive and resistant strains of Neurospora crassa [J]. Mycol Res, 1991, 95(4): 457–464. doi:10.1016/S0953-7562(09)80846-0 |
| [39] | STEVENSON K L, LANGSTON D B, SANDERS F. Baseline sensitivity and evidence of resistance to boscalid in Didymella bryoniae [J]. Phytopathology, 2007, 98: S151. |
| [40] | AVENOT H F, MICHAILIDES T J. Resistance to boscalid fungicide in Alternaria alternata isolates from pistachio in California [J]. Plant Dis, 2007, 91(10): 1345–1350. doi:10.1094/PDIS-91-10-1345 |
| [41] | MALLIK I, ARABIAT S, PASCHE J S, et al. Molecular characterization and detection of mutations associated with resistance to succinate dehydrogenase-inhibiting fungicides in Alternaria solani [J]. Phytopathology, 2008, 104(1): 38–39. |
 2017, Vol. 19
2017, Vol. 19


