蓝莓作为具有较高经济价值和保健功能的小浆果,在中国发展迅速,2015 年全国栽培面积达 31 210 hm2[1]。然而随着种植面积的不断扩大,病害的发生成为限制生产的主要原因,尤其是枝枯病。田间调查发现,蓝莓枝枯病呈扩展加重趋势,且病原种类复杂多样。目前中国报道的主要蓝莓枝枯致病菌有乌饭树拟茎点霉 Phomopsis vaccinii[2]、棒状拟盘多毛孢 Pestalotiopsis clavispora[3]、葡萄座腔菌 Botryosphaeria dothidea[4]及小新壳梭孢 Neofusicoccum parvum[5]。近年,在山东省青岛市胶南蓝莓基地的病害调查中发现一种新的枝枯病病原菌——假可可毛色二胞 Lasiodiplodia pseudotheobromae,该病菌侵染迅速,已对蓝莓生产构成了威胁[6]。目前,对于蓝莓枝枯病主要采用化学药剂防治,而长期使用化学药剂将导致食品安全、病原菌抗药性及生态环境破坏等问题,从而驱使人们寻找更安全、高效的解决措施[7]。
生物防治作为一种环境友好型的病害控制措施已成为国内外的研究热点,利用生防细菌防治植物病害是生物防治的主要手段之一[8-9]。目前尚未见有利用拮抗细菌防治蓝莓枝枯病的研究报道。本研究从蓝莓种植园根际土壤中分离筛选到一株对多种蓝莓枝枯病菌具有较好防效的拮抗菌株 HMQAU140045,通过形态观察、生理生化特性以及 gyrB 序列分析,对该菌株进行了鉴定,并初步测定了其抑菌活性。
1 材料与方法 1.1 供试材料1.1.1 供试病原菌 蓝莓枝枯病菌:假可可毛色二胞 Lasiodiplodia pseudotheobromae,棒状拟盘多毛孢 Pestalotiopsis clavispora,葡萄座腔菌 Botryosphaeria dothidea,乌饭树拟茎点霉 Phomopsis vaccinii;苹果树腐烂病菌:黑腐皮壳 Valsa mali;苹果斑点落叶病菌:链格孢苹果专化型 Alternaria alternata f.sp. mali;苹果炭疽病菌无性态:胶孢炭疽菌 Colletotrichum gloeosporioides,苹果炭疽叶枯病菌有性态:围小丛壳 Glomerella cingulata;苹果霉心病菌:粉红单端孢 Trichothecium roseum;草莓灰霉病菌:灰葡萄孢 Botrytis cinerea;番茄枯萎病菌:尖镰孢番茄专化型 Fusarium oxysporum f.sp. lycopersici;黄瓜褐斑病菌:山扁豆生棒孢 Corynespora cassiicola;烟草赤星病菌:链格孢 Alternaria alternata;小麦根腐叶斑病菌:麦根腐平脐蠕孢 Bipolaris sorokiniana;小麦赤霉病菌:禾谷镰孢 Fusarium graminearum。以上病原菌均保存于青岛农业大学真菌室。
1.1.2 主要培养基 LB 固体培养基、LB 液体培养基和发酵培养基 (玉米粉 20.0 g,胰蛋白胨 10.0 g,酵母提取物 10.0 g,磷酸氢二钾 0.5 g,用蒸馏水定容至 1 000 mL,pH 为 7.2~7.4) 分别用于细菌的分离纯化和筛选以及拮抗菌株的液体发酵;马铃薯葡萄糖琼脂 (PDA) 培养基用于植物病原真菌的培养和抑菌活性检测。
1.1.3 供试药剂 70% 甲基硫菌灵可湿性粉剂 (thiophanate-methyl WP),江苏蓝丰生物化工股份有限公司。
1.2 拮抗细菌的分离与筛选1.2.1 细菌的分离与纯化 2014 年夏季从山东省青岛市黄岛区青岛沃林蓝莓果业有限公司的蓝莓种植园采集蓝莓植株的根际土,采用稀释平板法[10]分离细菌菌株,待长出菌落后,挑取细菌单菌落于 LB 固体平板划线纯化并保存于青岛农业大学真菌学研究室。
1.2.2 拮抗细菌的筛选 以假可可毛色二胞为供试靶标菌,采用对峙平板法[10],在 PDA 平板中轴划线接种细菌,距细菌中央两侧 2.5 cm 处接种靶标菌菌饼,于 25 ℃ 恒温培养,对照只接种靶标菌菌饼。每处理设 3 个重复,待对照长满 3/4 培养皿时,测量抑菌带宽度,筛选出对靶标菌有明显拮抗作用的细菌菌株进行复筛。
用初筛得到的细菌菌株制备种子液,取 1 mL 种子液接种于 50 mL LB 液体培养基中,于 130 r/min、30 ℃ 恒温振荡培养 48 h,发酵液于 4 ℃、8 000 r/min 离心 15 min,上清液用 0.22 μm 微孔滤膜过滤,制备拮抗细菌发酵滤液。采用菌丝生长速率法[11],将发酵滤液与融化的 PDA 培养基 (45~50 ℃) 混匀,倒平板,以加入等体积无菌 LB 培养液的 PDA 培养基作为对照,于平板中央接种直径为 5 mm 的靶标菌菌饼。每处理设 3 个重复,待对照长满 3/4 培养皿时,采用十字交叉法测量对照及处理组菌落直径,计算抑菌率,筛选出对靶标菌拮抗效果最优的细菌菌株。
抑制率/% = [(对照菌落直径 – 处理菌落直径)/对照菌落直径] × 100
1.3 拮抗菌株 HMQAU140045 发酵滤液对蓝莓毛色二胞枝枯病菌的抑制作用1.3.1 对病菌孢子萌发的抑制作用 将拮抗菌株 HMQAU140045 接种于优化后的发酵培养基,于 28 ℃、180 r/min 摇培 84 h 后进行无菌过滤,得到其发酵滤液。采用凹玻片法[12]观察发酵滤液对假可可毛色二胞分生孢子萌发的影响。挑取蓝莓枝干溢出的假可可毛色二胞分生孢子角,用无菌水制备浓度为 106 个/mL 的孢子悬浮液。将 HMQAU140045 发酵滤液按 50、100、150 和 200 倍的稀释比例分别与孢子悬浮液等体积混匀,以无菌水和孢子悬浮液等体积混匀为对照。各处理取 40 μL 滴加在凹玻片上,置于培养皿中于 25 ℃ 下恒温保湿培养 4 h 后,在显微镜下观察孢子萌发情况,计算孢子萌发抑制率,并进行显微拍照。每处理设 3 个重复,试验重复 3 次。
1.3.2 对病菌菌丝生长的抑制作用 采用菌丝生长速率法[11]测定发酵滤液对假可可毛色二胞的抑制作用。将发酵滤液与 PDA 培养基混合,使滤液分别稀释 50、100、150 和 200 倍,以加入等体积无菌培养液的 PDA 培养基为对照,每处理设 5 个重复,于 25 ℃ 恒温培养 60 h 后,计算菌丝生长抑制率。之后挑取处理组及对照病原菌菌丝,在光学显微镜下观察发酵滤液对菌丝形态的影响,并进行显微拍照。
1.4 菌株 HMQAU140045 对离体蓝莓枝条毛色二胞枝枯病的防治作用从蓝莓种植基地采集当年生的健康蓝莓枝条 (品种:杜克),剪成长短粗细一致的枝段,用 75% 乙醇表面消毒后用无菌水冲洗晾干,待用。试验设 12 种处理,分别为 3 种喷施时间 (a. 施药 24 h 后接种病原菌菌饼;b. 施药后待药液稍干燥立即接种病原菌菌饼;c. 接种病原菌菌饼 24 h 后施药) 和 4 种喷施药剂 (HMQAU140045:A. 菌悬液;B. 发酵滤液; C. 发酵液; D. 70% 甲基硫菌灵 1 500 倍稀释液) 的组合。
采用针刺法[13]接种,每个枝条接种 1 个点,每处理重复 5 个枝条。接种病原菌菌饼后用保鲜膜缠绕固定并保湿 24 h,之后去掉保鲜膜并开始观察记录发病情况。以接种无菌水和发酵培养基分别作为 A, D 和 B, C 的对照,培养条件为 25 ℃ ,12 h 光暗交替。试验重复 3 次。7 d 后测量病斑大小,按照椭圆面积公式计算病斑面积和防治效果。
防治效果/% = [(对照病斑面积 – 处理病斑面积)/对照病斑面积] × 100
1.5 拮抗菌株 HMQAU140045 发酵滤液抑菌谱的测定采用菌丝生长速率法测定拮抗菌株 HMQAU140045 的抑菌谱。将发酵滤液与 PDA 混合稀释 100 倍后测定其对 15 种供试病原真菌的抑制作用,计算抑制率。以加入等体积发酵培养基的 PDA 作为对照,每处理设 5 个重复。
1.6 菌株 HMQAU140045 的鉴定1.6.1 菌株 HMQAU140045 的形态及生理生化特征鉴定 通过革兰氏染色和芽孢染色进行形态观察。生理生化试验鉴定方法参照文献[14-15]进行。
1.6.2 菌株 HMQAU140045 的分子鉴定 菌株基因组 DNA 的提取参考夏涵等的 chelex100 法[16]。以 gyrB 引物 UP1 (5′-GAAGTCATCATGACCG TTCTGCAYGCNGGNGGNAARTTYGA-3′) 和UP2r (5′-AGCAGGGTACGGATGTGCGAGC CRTCNACRTCNGCRTCNGTCAT-3′) [17]对菌株的基因组进行扩增。反应体系:10 × Buffer 2.5 μL,5 mmol/L dNTP 2 μL,10 μmol/L 引物 UP1 和引物 UP2r 各 1 μL,PremixTaq (5 U/μL) 0.5 μL,模板 DNA 2.5 μL,补水至 25 μL。反应条件:95 ℃ 预变性 5 min;98 ℃ 变性 10 s,65 ℃ 退火 1 min,72 ℃ 延伸 2 min,30 个循环;最后 72 ℃ 延伸 8 min。扩增产物取 5 μL 在 1% 琼脂糖凝胶电泳检查扩增效果,其余扩增产物采用凝胶回收试剂盒回收。利用 pMD18-T 载体对回收的扩增产物进行 T-A 克隆和转化,菌液 PCR 检测后送双向测序。测序结果经 Sequencher5.0 软件自动装配后导出重叠群 (Contig),并在 NCBI (http://www.ncbi.nlm.gov) 数据库中进行 BLAST 分析,提交给 GenBank。再从 GenBank 中选取合适的序列,经 CLUSTALW 2.0 软件进行序列对比,并用 MEGA 5.05 软件采用邻接法 (neighbor-joining analysis,NJ) 构建系统发育树,其中 Bootstrap 检验的重复次数为 1 000 次。
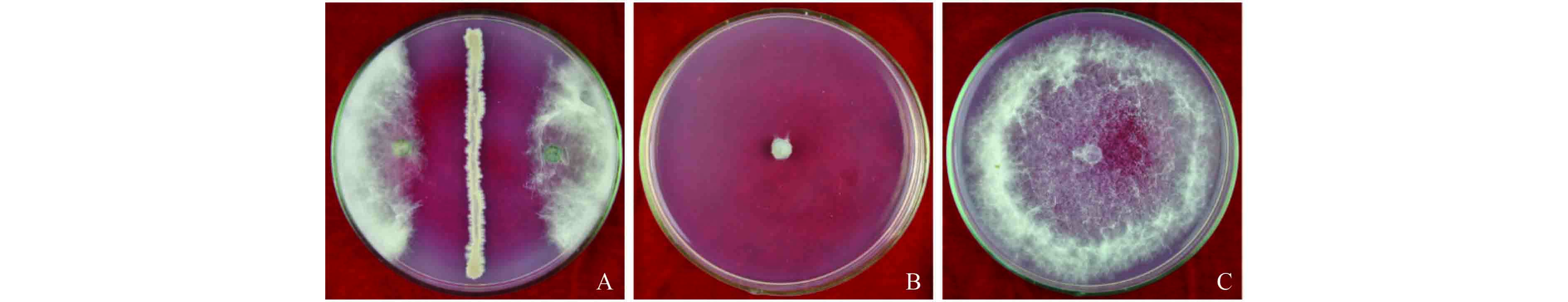
2 结果与分析 2.1 拮抗细菌的分离及其拮抗效果采用稀释平板法,从健康蓝莓植株的根际土壤中分离得到 20 株细菌,采用对峙平板法筛选出 7 株对假可可毛色二胞有明显抑制效果的拮抗菌株,占所分离菌株的 35%,其中菌株 HMQAU140045 拮抗效果最好,抑菌带宽度达到 14.50 mm (图 1-A)。选取该菌株的 LB 发酵滤液于 PDA 中稀释 10 倍后进行菌丝生长速率法试验,结果表明,其对假可可毛色二胞菌丝生长的抑制率达 100%(图 1-B)。此外,菌株 HMQAU140045 对葡萄座腔菌、乌饭树拟茎点霉及棒状拟盘多毛孢的抑菌带宽度分别为 12.63、18.3 及 8.75 mm。该菌株稀释 10 倍的 LB 发酵滤液对葡萄座腔菌、乌饭树拟茎点霉及棒状拟盘多毛孢的抑制率分别为 100%、89.67% 及 76.74%。说明菌株 HMQAU140045 对多种蓝莓枝枯病病原菌具有较好的抑菌效果。
|
A: 菌株 HMQAU140045 与假可可毛二胞的平板对峙;B: 菌株 HMQAU140045 的 LB 发酵滤液稀释 10 倍对假可可毛色二胞菌丝生长的抑制;C: 对照 A: Plate confrontation of strain HMQAU140045 and L. pseudotheobromae; B: Inhibition of 10 times diluted LB fermentation filtrate of strain HMQAU140045 on mycelial growth of L. pseudotheobromae; C: CK 图 1 菌株 HMQAU140045 对蓝莓毛色二胞枝枯病菌的拮抗效果 Fig. 1 Antagonistic effect of strain HMQAU140045 on Blueberry Lasiodiplodia twig blight pathogen |
2.2 拮抗菌株 HMQAU140045 对蓝莓毛色二胞枝枯病菌的抑制作用
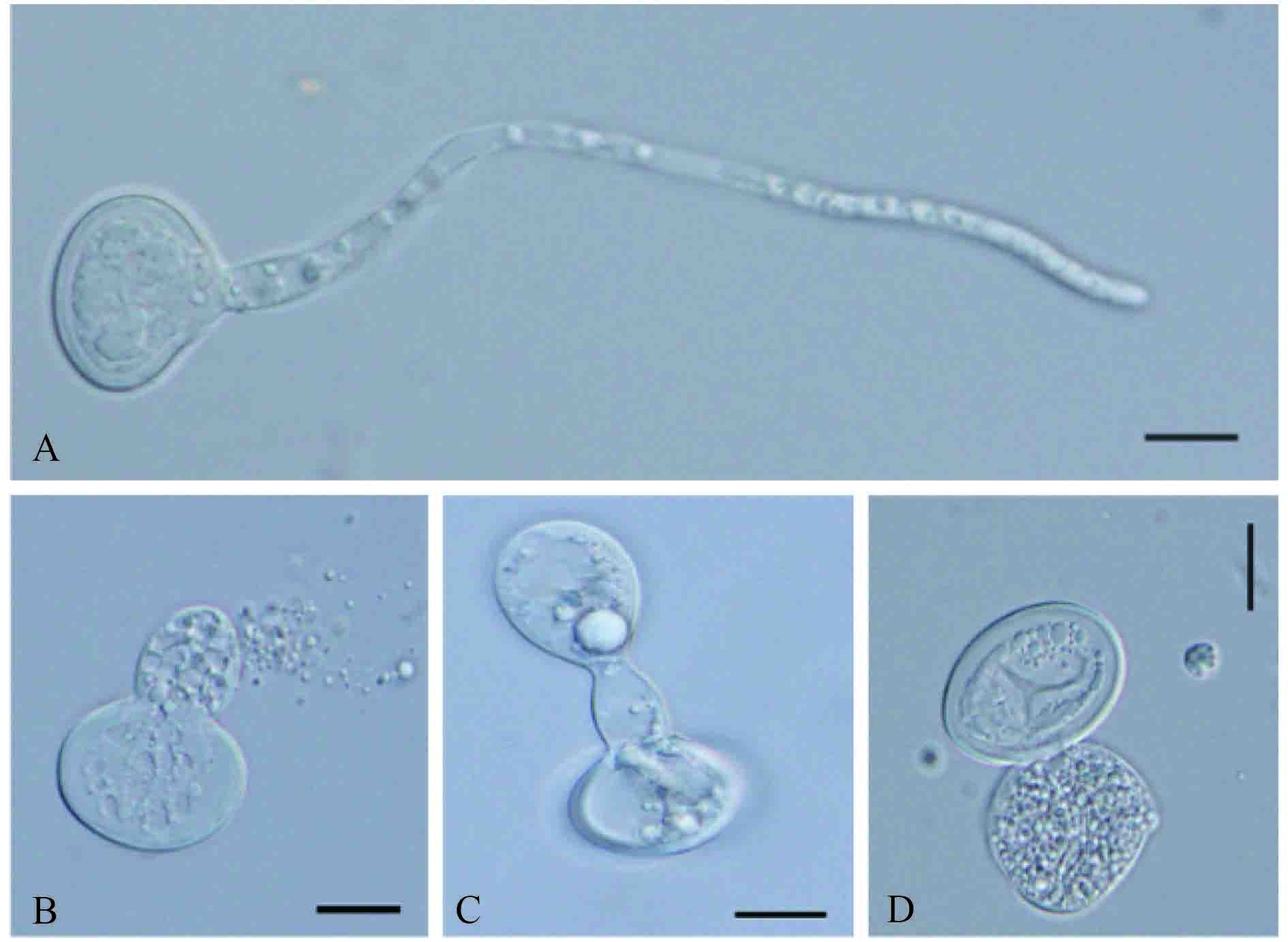
2.2.1 对孢子萌发的抑制作用 菌株 HMQAU140045 不同稀释倍数的发酵滤液对假可可毛色二胞的孢子萌发具有不同程度的抑制作用,发酵滤液稀释 50 倍可完全抑制孢子萌发,抑制率达 100%;稀释 100 倍仍能达到 85% 以上;随着发酵滤液稀释倍数的增加,抑制率逐渐下降 (表 1)。显微观察发现,对照的孢子萌发较好,芽管较长,粗细均匀 (图 2-A);处理组内除了稀释 50 倍外,其余 3 个处理的部分孢子虽然能萌发,但芽管畸形,芽管顶端或中间膨大,部分孢子内容物外泄 (图 2-BCD)。
|
|
|
|
表 1 菌株 HMQAU140045 发酵滤液对蓝莓毛色二胞枝枯病菌孢子萌发及菌丝生长的抑制效果 Table 1 Inhibitory effect of strain HMQAU140045 fermentation filtrate on spore germination and mycelial growth of blueberry Lasiodiplodia twig blight pathogen |
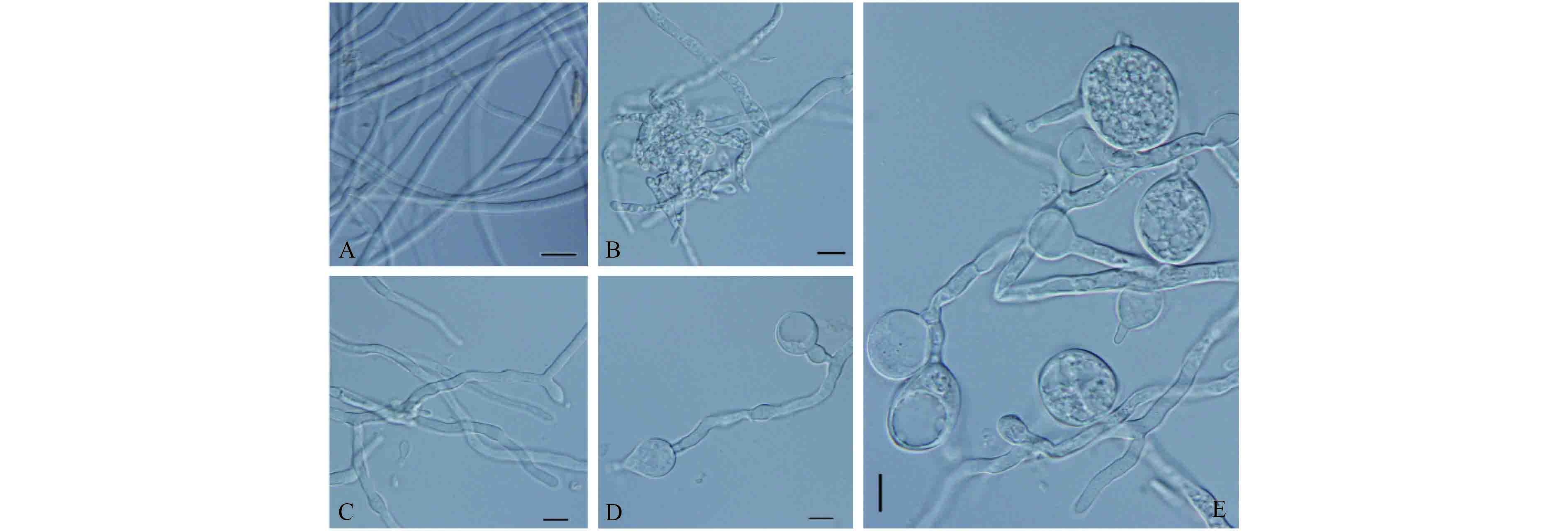
2.2.2 对菌丝生长的抑制作用 菌株 HMQAU140045 发酵滤液对假可可毛色二胞菌丝生长具有明显的抑制作用,发酵滤液稀释 50 倍可完全抑制菌丝生长,稀释 100 倍抑制率仍接近 90%。随着发酵滤液稀释倍数的增加,抑制率逐渐下降,但稀释 150 倍和 200 倍对菌丝生长的抑制率仍能分别达到 71.25% 和 57.49% (表 1)。显微观察发现,对照的菌丝粗细一致、分支较少、原生质分布均匀 (图 3-A);处理组内除了稀释 50 倍外,其余 3 个处理的菌丝虽然能生长,但菌丝体膨大变粗、畸形、分支增多,菌丝聚集成瘤状,有些菌丝内原生质流出形成空壳 (图 3-BCDE)。
|
|
2.3 菌株 HMQAU140045 对离体蓝莓枝条毛色二胞枝枯病的抑制作用
菌株 HMQAU140045 的离体蓝莓枝条试验结果 (表 2) 显示:施药 24 h 后接种病原菌的 4 个处理中,A (菌悬液)、C (发酵液) 和 D (甲基硫菌灵) 的防效之间无显著差异,抑制率均在 96% 以上;B (发酵滤液) 的防效虽低于其余 3 个处理的防效,但仍能达到 93% 以上。施药后同时接种病原菌,发现 B (发酵滤液)、C (发酵液) 和 D (甲基硫菌灵) 的防效之间无显著性差异,A (菌悬液) 防效明显低于其他 3 个处理,为 82.56%。接种病原菌 24 h 后施药,发现 C (发酵液) 与 D (甲基硫菌灵) 的防效之间无显著性差异,D 效果最佳,其次是 B (发酵滤液),A (菌悬液) 效果最差。可见,施用发酵液 (菌悬液与发酵滤液的组合) 效果要优于单独施用发酵滤液与菌悬液,先施药后接种病原菌效果优于先接种病原菌后施药。
|
|
表 2 拮抗菌株 HMQAU140045 对离体蓝莓枝条毛色二胞枝枯病的防治效果 Table 2 Control efficiency of antagonistic strain HMQAU140045 on detached blueberry twig inoculated with Lasiodiplodia pseudotheobromae |
2.4 拮抗菌株 HMQAU140045 发酵滤液的抑菌谱
测定结果表明:菌株 HMQAU140045 发酵滤液稀释 100 倍后对 15 种供试植物病原真菌具有不同的抑菌活性 (表 3)。其中对苹果腐烂病的抑制效果最好,抑制率达 100%;其次是对蓝莓葡萄座腔菌枝枯病菌、蓝莓毛色二胞枝枯病菌、小麦根腐病菌、蓝莓拟茎点枝枯病菌及小麦赤霉病菌,抑制率均为 76% 以上;对其他 7 种病原菌的抑制率也在 53.36%~70.73% 之间;对番茄枯萎病菌和苹果霉心病菌的抑制率相对较差。表明菌株 HMQAU1140045 抗菌谱较广,抗菌效果较好,具有较高的生防潜力。
|
|
表 3 菌株 HMQAU140045 发酵滤液对 15 种病原菌菌丝生长的抑制作用 Table 3 The inhibition effects of strain HMQAU140045 fermentation filtrate on the mycelial growth of fifteen pathogens |
2.5 菌株 HMQAU140045 的鉴定
2.5.1 菌株 HMQAU140045 的形态及生理生化特征鉴定 菌株 HMQAU140045 在 LB 固体培养基上 30 ℃ 培养 2 d,菌落直径 0.5~2.5 mm,菌落凸起呈乳白色、不透明、圆形、边缘不规则、表面有褶皱,在菌落边缘有晶体状物质。菌体革兰氏染色呈阳性,杆状,(0.65 ± 0.15) μm × (2.31 ± 0.37) μm,单个或成对排列,产芽孢。生理生化测定结果显示,该菌株除厌氧反应、吲哚试验、65 ℃ 生长为阴性外,其余反应为阳性。此外,该菌株与枯草芽孢杆菌相比水解淀粉能力强。因此通过形态学及生理生化鉴定该菌株为解淀粉芽孢杆菌 Bacillus amyloliquefaciens。
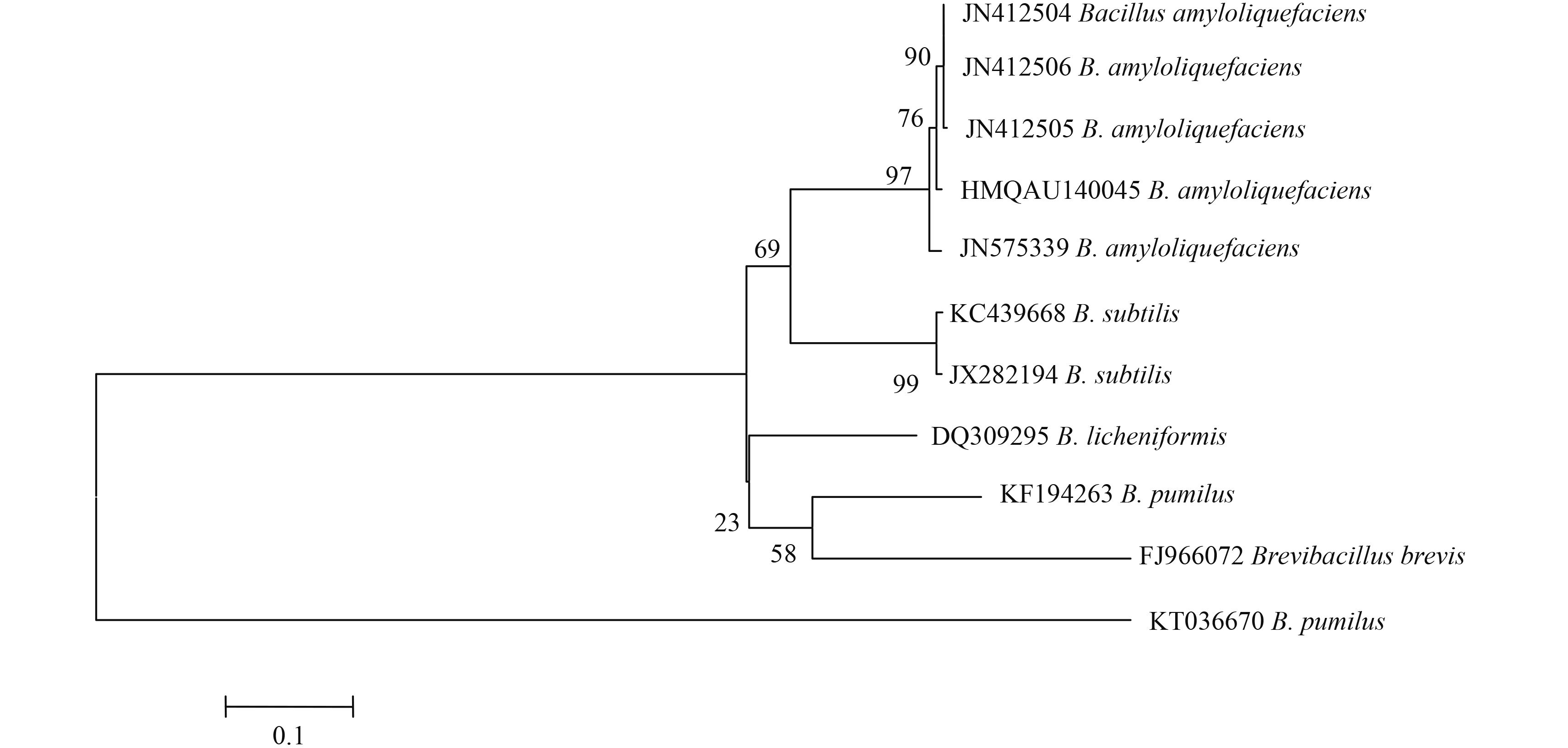
2.5.2 菌株 HMQAU140045 的分子鉴定 利用细菌通用引物 UP1/UP2r 对菌株 HMQAU140045 的 gyrB 片段进行扩增,经测序分析,确定该片段全长 1 259 bp。将该序列与 GenBank 中 BLAST 数据库中的核酸序列进行同源性比较,发现该菌株与来自银杏的解淀粉芽孢杆菌Bacillus amyloliquefaciens (GenBank 登录号为 JN412506) 的同源性达到 99%。系统发育分析结果表明,该菌株与 4 株解淀粉芽孢杆菌菌株的序列位于系统发育树的同一分支 (图 4)。同源性比对数据和系统发育树位置进一步证明了菌株 HMQAU140045 为 Bacillus amyloliquefaciens。
|
注:分支处的数值为 Bootstrap 法重复 1 000 次评估得到的各节点支持率;标尺 0.01 为进化距离。 Note: Numbers at nodes indicating bootstrap values for each node out of 1 000 bootstrap replications; Scale 0.01 meaning evolutionary distance. 图 4 基于 gyrB 基因序列构建的拮抗细菌 HMQAU140045 和相关细菌的邻接法系统发育树 Fig. 4 NJ phylogenetic tree based on gyrB gene sequences of antagonistic bacterium HMQAU140045 and related bacteria |
3 讨论
本研究从蓝莓根际土壤中分离筛选出 1 株对多种蓝莓枝枯病菌具有较强拮抗活性的菌株 HMQAU140045,经菌体形态、培养特征、生理生化鉴定以及 gyrB 的序列分析,确定该菌株为解淀粉芽孢杆菌 Bacillus amyloliquefaciens。国外已有多种生物杀菌剂产品,如 Serenade (B. subtilis),Sonata (B. pumilis),Actinovate (Streptomyces lydicus) 以及 Pre-stop (Gliocladium catenulatum) 注册用于蓝莓病害的防治,但主要应用于花期[18-19],对于利用解淀粉芽孢杆菌防治蓝莓枝干病害,尚未见相关报道。本研究发现,菌株 HMQAU140045 的菌体本身、发酵滤液以及发酵液在离体蓝莓枝干上均表现出了较好的防效,同时该菌株对其他 14 种植物病原菌也有较好的防效,尤其是苹果腐烂病菌,因此将来可进一步将活体菌株或其发酵后的代谢产物制成生物制剂,应用于田间防效试验,这也为生防菌剂的研制提供了新的应用材料。
本研究发现,菌株 HMQAU140045 发酵滤液的 50 倍稀释液可抑制孢子萌发和菌丝生长,其余 3 个稀释倍数 (100 倍、150 倍及 200 倍) 可导致孢子萌发后的芽管畸形,芽管顶端或中间膨大,部分孢子内容物外泄以及菌丝生长畸形,原生质体凝集渗漏,形成囊泡,表明该菌株在发酵过程中产生了抑菌活性物质,后续试验发现该菌株能分泌蛋白酶及纤维素酶等细胞壁降解酶成分,但有关其抑菌活性的具体成分及结构有待进一步分析确定。
| [1] |
李亚东. 中国蓝莓产业数据报告[EB/OL]. (2015-11-03)[2016-01-19]. http://www.blueberrysci.com/show_news.php?classid=30&id=636.
LI Y D. Chinese blueberry industry data report[EB/OL]. (2015-11-03)[2016-01-19]. http://www.blueberrysci.com/show_news.php? classid=30&id=636 |
| [2] |
岳清华, 赵洪海, 梁晨, 等. 蓝莓拟茎点枝枯病的病原[J]. 菌物学报, 2013, 32(6): 959–966.
YUE Q H, ZHAO H H, LIANG C, et al. The pathogen causing Phomopsis twig blight of blueberry [J]. Mycosystema, 2013, 32(6): 959–966. |
| [3] |
赵洪海, 岳清华, 梁晨. 蓝莓拟盘多毛孢枝枯病的病原菌[J]. 菌物学报, 2014, 33(3): 577–583.
ZHAO H H, YUE Q H, LIANG C. The pathogen causing Pestalotiopsis twig dieback of blueberry [J]. Mycosystema, 2014, 33(3): 577–583. |
| [4] |
徐成楠, 周宗山, 迟福梅, 等. 越橘葡萄座腔菌枝枯病的病原菌鉴定[J]. 园艺学报, 2013, 40(2): 231–236.
XU C N, ZHOU Z S, CHI F M, et al. Research on the pathogen causing Botryosphaeria stem blight on blueberry [J]. Acta Horticult Sinica, 2013, 40(2): 231–236. |
| [5] |
. 蓝莓枝枯病病原菌鉴定[J]. 植物病理学报, 2013, 43(4): 421–425.
YU L, ZHAO J R, RARISARA I, et al. Identification of the pathogen causing twigs and stem dieback in blueberry[J]. Acta Phytopathol Sinica, 2013, 43(4): 421–425. |
| [6] |
王佳宁, 赵洪海, 尉莹莹, 等. 蓝莓毛色二胞枝枯病的病原菌[J]. 菌物学报, 2016, 35(6): 657–665.
WANG J N, ZHAO H H, YU Y Y, et al. The pathogen causing Lasiodiplodia twig blight of blueberry [J]. Mycosystema, 2016, 35(6): 657–665. |
| [7] | SCHERM H, KREWER G. Disease management in organic rabbiteye blueberries[J]. Int J Fruit Sci, 2008, 8(1-2): 69–80. doi:10.1080/15538360802367661 |
| [8] | GÁLVEZ A, ABRIOUEL H, BENOMAR N, et al. Microbial antagonists to food-borne pathogens and biocontrol[J]. Curr Opin Biotechnol, 2010, 21(2): 142–148. doi:10.1016/j.copbio.2010.01.005 |
| [9] |
王光华, RAAIJMAKERSJ M. 生防细菌产生的拮抗物质及其在生物防治中的作用[J]. 应用生态学报, 2004, 15(6): 1100–1104.
WANG G H, RAAIJMAKERS J M. Antibiotics production by bacterial agents and its role in biological control[J]. Chin J Appl Ecol, 2004, 15(6): 1100–1104. |
| [10] |
黄云. 植物病害生物防治学[M]. 北京: 科学出版社, 2010: 296-408.
HUANG Y. Biological control of plant diseases[M]. Beijing: Science Press, 2010: 296-408. |
| [11] |
陈年春. 农药生物测定技术[M]. 北京: 北京农业大学出版社, 1991: 1-270.
CHEN N C. Pesticide bioassay technology[M]. Beijing: Beijing Agricultural University Press, 1991: 1-270. |
| [12] |
方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 146-155.
FANG Z D. Methodology on plant pathology research[M]. 3rd ed. Beijing: China Agriculture Press, 1998: 146-155. |
| [13] |
林月莉, 黄丽丽, 索朗拉姆, 等. 苹果轮纹病室内快速评价体系的建立[J]. 植物保护学报, 2011, 38(1): 37–41.
LIN Y L, HUANG L L, SUOLANG L, et al. A rapid laboratory evaluation system for apple ring rot[J]. Acta Phytophyl Sinica, 2011, 38(1): 37–41. |
| [14] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
DONG X Z, CAI M Y. Systematic identification manual of common bacteria[M]. Beijing: Science Press, 2001. |
| [15] | WELKER N E, CAMPBELL L L. Unrelatedness of Bacillus amyloliquefaciens and Bacillus subtilis [J]. J Bacteriol, 1967, 94(4): 1124–1130. |
| [16] |
夏涵, 府伟灵, 陈鸣, 等. 快速提取细菌DNA方法的研究[J]. 现代预防医学, 2005, 32(5): 571–573.
XIA H, FU W L, CHEN M, et al. The research of rapid DNA extraction from bacteria[J]. Mod Prev Med, 2005, 32(5): 571–573. |
| [17] | YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains [J]. Appl Environ Microbiol, 1995, 61(3): 1104–1109. |
| [18] | SCHERM H, NGUGI H K, SAVELLE A T, et al. Biological control of infection of blueberry flowers caused by Monilinia vaccinii-corymbosi [J]. Biol Control, 2004, 29(2): 199–206. doi:10.1016/S1049-9644(03)00154-3 |
| [19] | LANGDON D H, TRAQUAIR J A, HILDEBRAND P D, et al. Screening commercial biocontrol agents for inhibition of Monilinia blight (mummy berry) on lowbush blueberry [J]. Can J Plant Pathol, 2006, 28(2): 355–365. |
 2017, Vol. 19
2017, Vol. 19


