拟除虫菊酯类杀虫剂 (SPs) 具有生物活性优异、环境相容性好等优点[1],根据其化学结构特点可分为 Ⅰ 型和 Ⅱ 型两大类。其中高效氯氰菊酯 (beta-cypermethrin) 为两对外消旋体的混合物[2],由于其具有高效、广谱和对人畜低毒等特点,已成为 Ⅱ 型中应用较为广泛的杀虫剂[3-5]。
高效氯氰菊酯属于神经毒剂类,主要作用于昆虫钠离子通道,使其神经传导受阻,进而破坏昆虫神经系统,其作用方式一般为触杀和胃毒[6]。但目前关于高效氯氰菊酯对昆虫离体细胞毒性作用的详细机制尚未见系统性报道。
细胞死亡方式一般可分为坏死和程序性死亡两种,而细胞的程序性死亡主要包括凋亡与自噬[7]。细胞自噬在正常生理状态下有利于其保持自身稳态,但在受到过度刺激时,细胞自噬率的上升将对个体的生存产生危害。草地贪夜蛾 Sf9 细胞常被用作为细胞水平机制研究的模式细胞[8-10]。笔者针对高效氯氰菊酯,利用草地贪夜蛾 Sf9 细胞开展了一系列体外生物测试,旨在探明其潜在的杀虫机理,为进一步探讨高效氯氰菊酯的作用机制提供参考。
1 材料和方法 1.1 主要试剂、抗体及仪器设备高效氯氰菊酯 (beta-cypermethrin) 原药 (纯度 > 98%),上海市农药研究所有限公司产品;噻唑蓝 (MTT)、苯甲基磺酰氟 (PMSF)、RIPA 裂解液和单丹磺酰戊二胺 (MDC) 均购自美国 Sigma 公司;无血清昆虫细胞培养基 (SFX-Ⅰnsert)、青霉素-链霉素溶液和胎牛血清购自美国 HyClone 公司;二甲基亚砜 (DMSO) 购自美国 Biosharp 公司;胰蛋白酶购自美国 Gibco 公司;BCA 蛋白检测试剂盒购自美国 Thermo 公司;SDS-PAGE 蛋白上样缓冲液 (2X) 购自上海碧云天生物技术有限公司;LC3A/B、Beclin 1 和 P62 等抗体购自美国 CST 公司;辣根过氧化物酶标记山羊抗兔 IgG 二抗、辣根过氧化物酶标记山羊抗小鼠 IgG 二抗购自上海生工生物工程有限公司。
Synergy H1 酶标仪,美国 Bio-Teck 公司;ImageJ 软件,由 National Institutes of Health 开发。
称取 50 mg 高效氯氰菊酯粉末,用 DMSO 溶解并配制成质量浓度为 10 mg/mL 的母液,于 4 ℃ 棕色瓶中保存备用。
1.2 供试细胞株Sf9 细胞购自美国模式培养物集存库 (American type culture collection, ATCC CRL-1711),采用 SFX 培养基 (添加 10% 的胎牛血清和 1% 的青霉素-链霉素),于 28 ℃ 恒温培养箱中培养。
1.3 细胞活力测定采用噻唑蓝 (MTT) 染色法[11]测定高效氯氰菊酯对 Sf9 细胞活力的影响。将 Sf9 细胞悬液调整至密度为 5 × 10 3 cell/孔,接种至 2 块 96 孔板中,孵育过夜后分别加入质量浓度为 5、10、20、40 和 80 μg/mL 的高效氯氰菊酯。分别于药物处理 24 和 48 h 后向每个孔中加入 20 μL (5 mg/mL) MTT 溶液,孵育 4 h 以上,至光学显微镜下可看见紫色沉淀晶体后,加入 150 μL DMSO 以溶解晶体。采用酶标仪分别测定 492 和 630 nm 处的吸光度值。通过公式 (1) 计算细胞存活率 (%)。
| $\begin{aligned}{\text{细胞存活率}}/\text{\%} = & \left[ {\text{试验组}\left( {\rm {OD}}_{492}-{\rm {OD}}_{630} \right)/} \right.\\&\left. {\text{对照组}\left( {{\rm {OD}}_{492}-{\rm {OD}}_{630}} \right)} \right] \times 100\end{aligned}$ | (1) |
通过显微镜观察高效氯氰菊酯处理后 Sf9 细胞形态的变化。将 Sf9 细胞悬液接种于 24 孔板中,孵育至密度为 4 × 10 4 cell/mL 后,分别加入 5、10、20、40 和 80 μg/mL 的高效氯氰菊酯。6 h 后对细胞进行检查和拍摄。
1.5 透射电子显微分析通过透射电子显微镜 (TEM) 观察经高效氯氰菊酯处理后 Sf9 细胞自噬形态学[12]。将 Sf9 细胞悬液接种于 6 孔板中,孵育过夜后分别加入 5、10、20、40 和 80 μg/mL 的高效氯氰菊酯,6 h 后收集细胞并用 0.01 mol/L、pH 7.4 的 PBS 缓冲液洗涤 3 次。加入预冷的、质量分数为 2.5% 的戊二醛磷酸缓冲液,于 4 ℃ 下固定 2 h 后,再用上述 PBS 缓冲液洗涤 3 次。加入质量分数为 1% 的锇酸 (OsO 4),于 4 ℃ 下固定 1 h,采用系列梯度 (体积分数 30%、50%、70%、80% 和 90%) 的丙酮进行逐级脱水,每浓度处理 30 min。用树脂包埋后切半薄片,分别经过 30 min 1% 醋酸铀和 10 min 柠檬酸铅双重染色后,固定于铜网上用电镜检查,选取代表性薄片区域再用透射电镜进行观察。
1.6 采用单丹磺酰戊二胺检测酸性液泡将浓度为 5 × 10 5 cell/孔的 Sf9 细胞悬液接种于 6 孔板中,孵育过夜后分别加入 5、10、20、40 和 80 μg/mL 的高效氯氰菊酯。处理 6 h 后收集细胞,用 0.01 mol/L、pH 7.4 的 PBS 缓冲液洗涤 3 次,加入 20 μmol/L 的单丹磺酰戊二胺 (MDC),黑暗中孵育 15 min 后,用上述 PBS 缓冲液洗涤 3 次,立即用荧光显微镜进行检测[13]。数据通过 ImageJ 软件进行分析。
1.7 蛋白免疫印迹分析采用蛋白免疫印迹 (WB) 技术对特定蛋白进行分析[14]。将浓度为 1 × 10 6 cell/孔的 Sf9 细胞悬液接种于 6 孔板中,孵育过夜后分别加入 5、10、20、40 和 80 μg/mL 的高效氯氰菊酯。6 h 后,用 0.01 mol/L、pH 7.4 的 PBS 缓冲液洗涤 3 次,收集细胞。加入预冷的、1 mmol/L 的 PMSF,混合均匀,4 ℃ 下静置 30 min 后,于 10 000 ×g 离心 5 min。通过 BCA 蛋白检测试剂盒检测蛋白浓度。向 10% SDS-聚丙酰胺凝胶电泳 (SDS-PAGE) 缓冲液中加入总蛋白量相等的上样液,80 V 电泳 30 min 后转 120 V 再电泳 45 min,采用聚偏二氟乙烯膜 (PVDF) 转膜 45 min,用 5% 脱脂牛奶封闭 2 h 后加入抗体,4 ℃ 下孵育过夜。经 TBST 缓冲液洗涤 3 次后,用辣根过氧化物酶 (HRP) 孵育 2 h,化学发光法 (ECL) [15]显色。对目的蛋白条带进行扫描,通过 ImageJ 软件进行灰度分析,目的条带与 β-actin 的灰度比值即为该蛋白的相对表达量。
上述试验均重复 3 次,以加入体积分数 0.1% DMSO 的处理作为阴性对照。
1.8 数据统计分析数据均为平均值 ± 标准差 (SD),进行单因素方差分析 (ANOVA)。所有统计结果均采用 SPSS 17.0 软件进行分析,其中 P ≤ 0.05 表示差异显著,P ≤ 0.01 表示差异极显著。
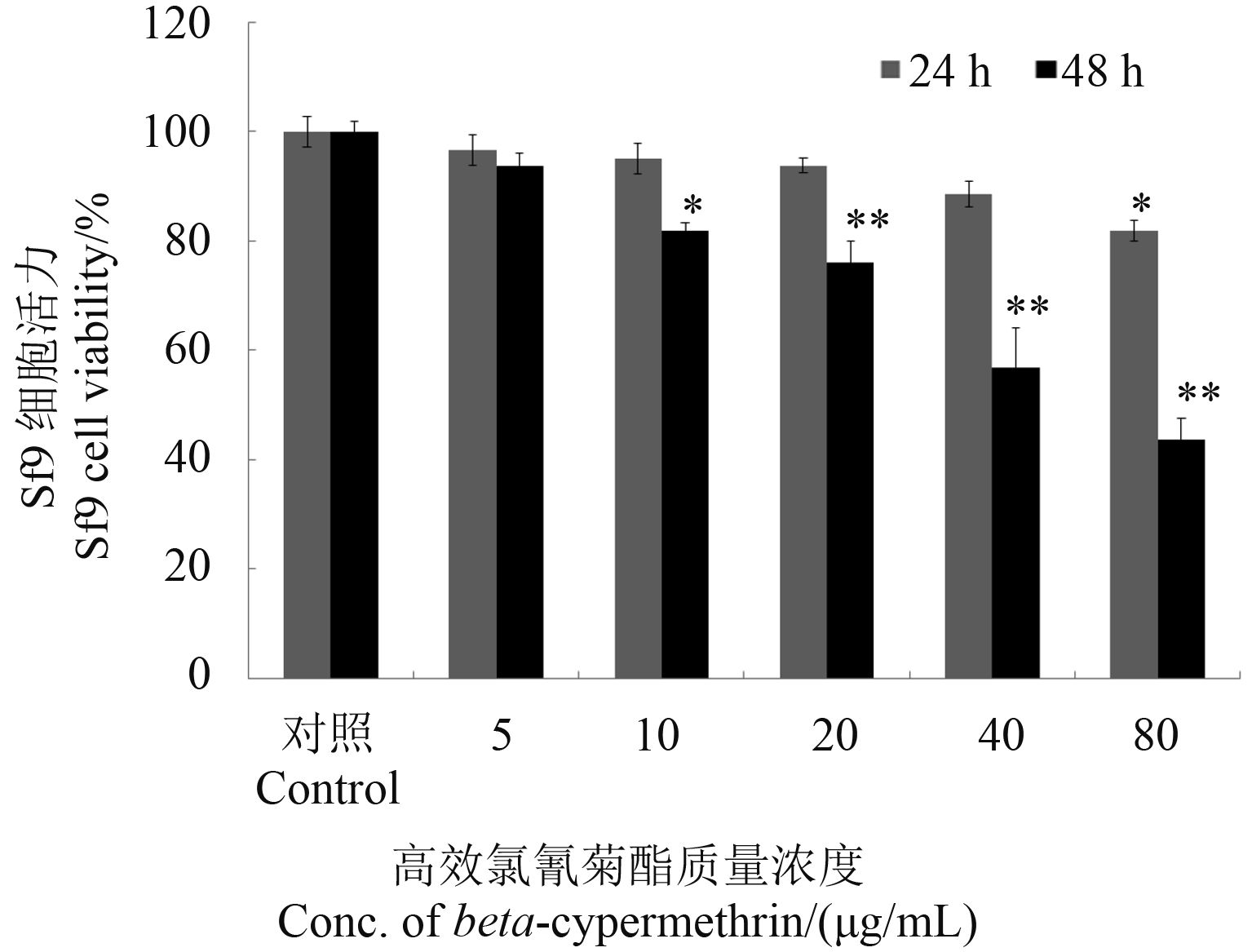
2 结果与分析 2.1 高效氯氰菊酯对 Sf9 细胞活力的影响结果 (图 1) 表明:高效氯氰菊酯对 Sf9 细胞活性的抑制作用呈现时间和剂量依赖关系,即 Sf9 细胞活力随高效氯氰菊酯浓度的升高而降低,24 和 48 h 处理组 IC 50 值分别为 447.7 和 58.46 μg/mL。
|
注:*表示 P ≤ 0.05 水平差异显著;**表示 P ≤ 0.01 水平差异显著。 Note: * Significant difference at P ≤ 0.05 level; ** Significant difference at P ≤ 0.01 level. 图 1 高效氯氰菊酯对 Sf9 细胞活力的影响 Fig. 1 Cytotoxicity of beta-cypermethrin on Sf9 cells |
2.2 高效氯氰菊酯对 Sf9 细胞形态变化的影响
显微检测 (图 2) 显示:对照组 Sf9 细胞内细胞质均匀且无明显颗粒,而高效氯氰菊酯处理组细胞内则出现了显著的空泡化现象,且随浓度升高空泡化现象加剧。在高浓度 (如 80 μg/mL) 下,2 h 即可检测到不明显的空泡;随着高效氯氰菊酯由 5 μg/mL 升高到 80 μg/mL,空泡化细胞的数量逐渐增加,轮廓逐渐清晰,且体积逐渐增大。研究表明,经不同浓度高效氯氰菊酯处理 6 h 后,Sf9 细胞形态变化与药剂浓度呈现剂量依赖关系。

|
注:图中黑色箭头所指即为经高效氯氰菊酯处理 Sf9 细胞后自噬泡的形成。 Note: The black arrows in panel indicated vacuole formation in beta-cypermethrin-treated Sf9 cells. 图 2 高效氯氰菊酯作用于 Sf9 细胞 6 h 后细胞形态的变化 (200 ×) Fig. 2 Cytological changes of Sf9 cells induced by beta-cypermethrin after 6 h (200 ×) |
2.3 高效氯氰菊酯处理后 Sf9 细胞典型的自噬形态
细胞质空泡化的形成被认为是典型的自噬形态学特征之一[16-17]。为进一步探究,于透射电子显微镜 (TEM) 下观察单个细胞 (图 3),发现高效氯氰菊酯处理组 Sf9 细胞与对照 (图 3A) 相比表现出典型的自噬形态:细胞核扩大和细胞质皱缩,尤其经 20 μg/mL 高效氯氰菊酯处理 2 h 后,Sf9 细胞质中可观察到典型双层膜自噬体和自噬体溶酶体的形成 (图 3C 中红色箭头所指)。

|
A:对照组细胞;B~C:经 20 μg/mL 高效氯氰菊酯处理 2 h 后的细胞,其中图 C 为图 B 的放大版 (10 ×)。 A: Control group; B-C: Exposed to 20 μg/mL beta-cypermethrin for 2 h, C: The larger version of B (10 ×). 图 3 高效氯氰菊酯诱导 Sf9 细胞自噬的透射电子显微观察图 Fig. 3 TEM observation figure of Sf9 cells exposed to beta-cypermethrin |
2.4 高效氯氰菊酯处理 Sf9 细胞后自噬泡的积累
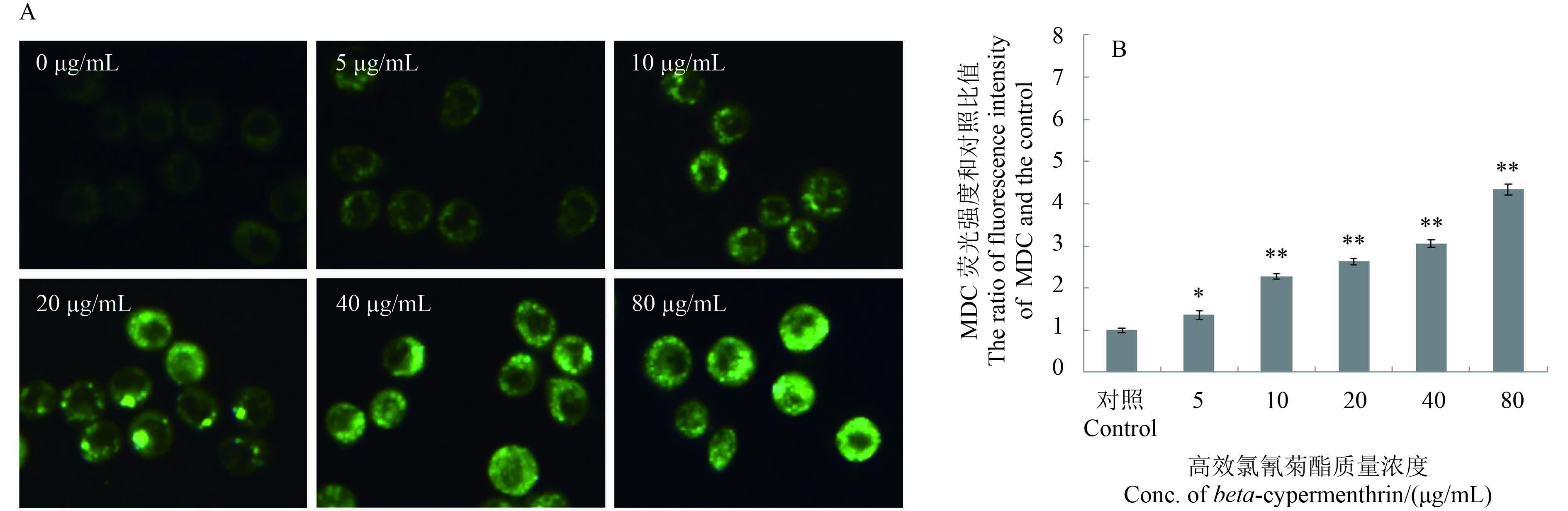
单丹磺酰戊二胺 (MDC) 荧光染色检测发现:6 h 后对照组 Sf9 细胞仅呈现较弱的绿色荧光,即自噬泡在其中积累不明显,而 10 μg/mL 高效氯氰菊酯处理组在电子显微镜下即可观察到清晰的绿色自噬泡,且随药剂浓度升高绿色荧光点显示更亮更明显 (图 4A)。采用 ImageJ 软件对图 4A 结果进行统计分析,发现高效氯氰菊酯诱导 Sf9 细胞自噬泡的积累呈现剂量依赖关系 (图 4B)。
|
A:经不同浓度高效氯氰菊酯处理后 Sf9 细胞荧光染色显微图像;B:高效氯氰菊酯处理组细胞与对照组细胞绿色荧光强度比值。 A: Fluorescence microscopic images of Sf9 cells treated with different concentrations of beta-cypermethrin; B: The ratio of green fluorescence intensity of MDC was plotted against the negative control. 注:* 表示 P ≤ 0.05 水平差异显著;** 表示 P ≤ 0.01 水平差异显著。Note: * Significant difference at P ≤ 0.05 level; ** Significant difference at P ≤ 0.01 level. 图 4 高效氯氰菊酯诱导 Sf9 细胞自噬的单丹磺酰戊二胺荧光染色检测结果 Fig. 4 MDC-labeled vesicles induced by beta-cypermethrin in Sf9 cells |
2.5 高效氯氰菊酯对 Sf9 细胞自噬相关蛋白表达水平的影响
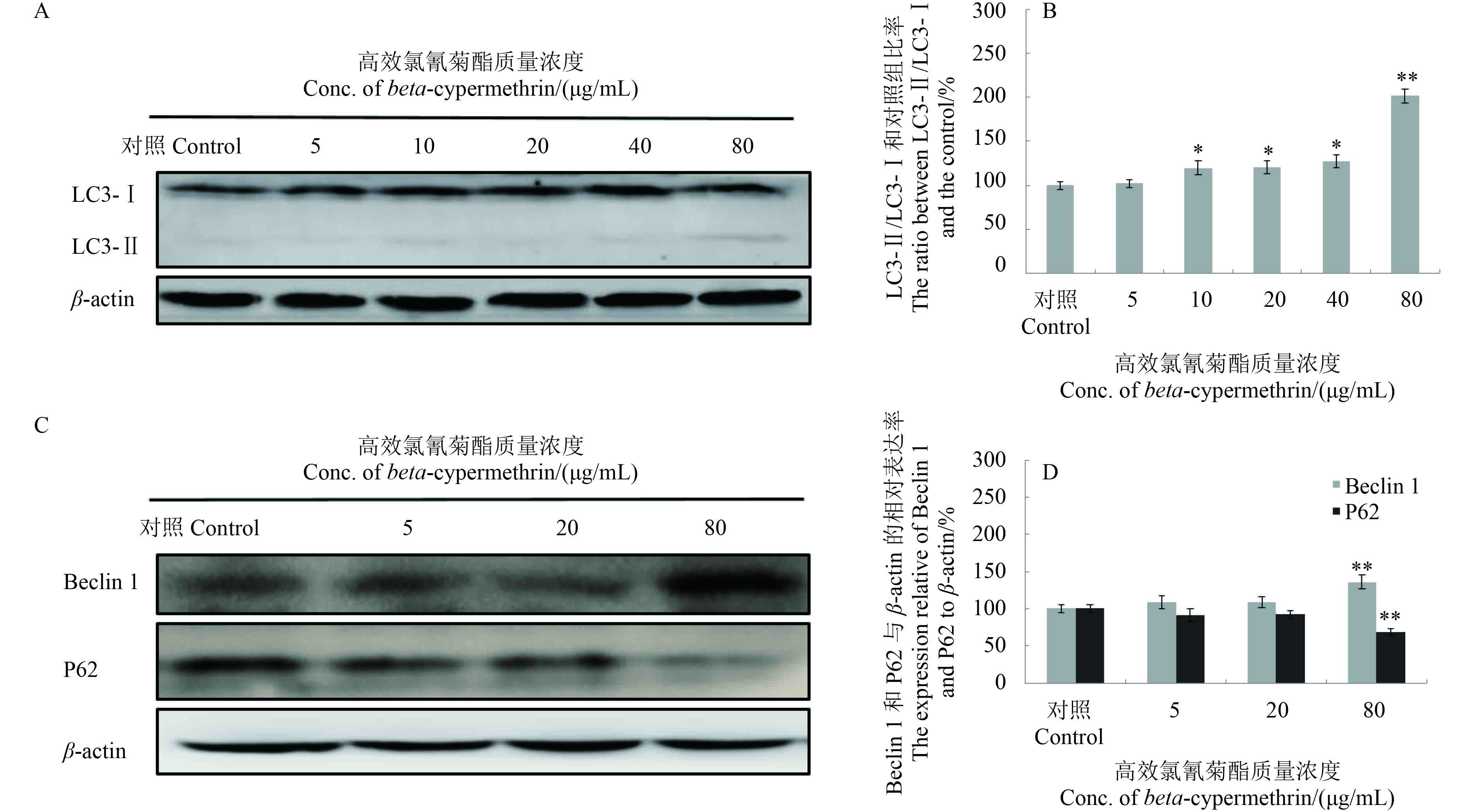
通过蛋白免疫印迹技术检测自噬相关蛋白 LC3-Ⅱ、p62 和 Beclin 1 家族,结果 (图 5) 显示:LC3-Ⅱ 蛋白表达量及 LC3-Ⅱ/LC3-Ⅰ 表达水平比均随高效氯氰菊酯浓度的升高而增加,呈现剂量依赖关系,其中 LC3-Ⅱ/LC3-Ⅰ 提高至对照的 201.32%;Beclin 1 蛋白表达水平的上升和 p62 表达水平的下调与高效氯氰菊酯处理浓度也呈现剂量依赖关系,其中 Beclin 1 表达水平上升至对照的 136.00%,P62 则下调至对照的 68.13% (图 5C 和 5D)。
|
A:LC3 和 β-actin 蛋白表达情况;B:LC3-Ⅱ/LC3-Ⅰ 和对照组比率;C:Beclin 1、p62 和 β-actin 蛋白表达情况;D:Beclin 1 和 p62 与 β-actin 的相对表达率。 A: Expression of LC3 and β-actin; B: The ratio between LC3-Ⅱ/LC3-Ⅰ and the control; C: Expression of Beclin1, p62 and β-actin; D: The expression relative of Beclin 1 and p62 to β-actin.注:* 表示 P ≤ 0.05 水平差异显著;** 表示 P ≤ 0.01 水平差异显著。 Note: * Significant difference at P ≤ 0.05 level; ** Significant difference at P ≤ 0.01 level. 图 5 高效氯氰菊酯诱导 Sf9 细胞自噬相关蛋白表达水平的变化 Fig. 5 The expression of autophagy-related proteins induced by beta-cypermethrin in Sf9 cells |
3 结论与讨论
目前已确认的高效氯氰菊酯的杀虫机理主要是通过作用于昆虫钠离子通道,引起昆虫的神经中毒症状[18],但已有越来越多研究表明,该化合物可能还具有其他杀虫机制[19-21]。本研究利用代表性的鳞翅目昆虫体细胞——Sf9 模式细胞,探讨了高效氯氰菊酯的其他潜在杀虫机制。噻唑蓝 (MTT) 染色法检测结果表明,高效氯氰菊酯对 Sf9 细胞具有显著的细胞毒性,认为这可能是其发挥杀虫活性的一个重要原因。进一步对产生细胞毒性的具体机制进行研究,发现高效氯氰菊酯处理可诱导 Sf9 细胞自噬泡的形成,且其诱导效应呈现剂量依赖关系。而自噬泡的产生与积累,很可能会导致细胞活力下降甚至死亡,从而威胁到昆虫正常的生命活动。
在细胞自噬发生过程中,关键性蛋白 LC3 (酵母 Atg8 基因的同源物)、Beclin 1 和 p62 发挥着重要作用[22]。其中,LC3-Ⅱ 和 LC3-Ⅰ 的相对表达比率可作为显著的自噬标记[23];P62 是一种泛素样结合蛋白,其与 LC3 相互作用形成复合物,参与细胞的自噬流[24];而 Beclin 1 则可通过与 PI3K Ⅲ 形成复合体,诱导自噬活性增强[25]。蛋白印迹 (WB) 检测结果显示,随着高效氯氰菊酯浓度增加,LC3-Ⅱ/LC3-Ⅰ 比值显著增大,p62 蛋白含量下调,Beclin 1 蛋白含量上调,且上述效应均呈现浓度依赖关系。该结果揭示了高效氯氰菊酯能显著诱导 Sf9 细胞发生自噬。
综上所述,高效氯氰菊酯对草地贪夜蛾 Sf9 细胞具有显著的细胞毒性,表现为可通过诱导细胞自噬的产生与积累抑制细胞活力甚至引起细胞死亡。该发现揭示高效氯氰菊酯可能存在新的杀虫机制,但目前还未能阐明其诱导 Sf9 细胞发生自噬作用的具体机理,以及是否还具有其他潜在的作用方式等,都尚需进一步研究明确。
| [1] |
刘尚钟, 王敏, 陈馥衡. 拟除虫菊酯类农药的研究和展望[J]. 农药, 2004, 43(7): 289–293.
LIU S Z, WANG M, CHEN F H. Research progress and development prospect of pyrethroid pesticide[J]. Chin J Pestic, 2004, 43(7): 289–293. |
| [2] | ZHANG C, WANG S H, YAN Y C. Isomerization and biodegradation of beta-cypermethrin by Pseudomonas aeruginosa CH7 with biosurfactant production [J]. Bioresour Technol, 2011, 102(14): 7139–7146. doi:10.1016/j.biortech.2011.03.086 |
| [3] | ZHUANG R, CHEN H, YAO J, et al. Impact of beta-cypermethrin on soil microbial community associated with its bioavailability: a combined study by isothermal microcalorimetry and enzyme assay techniques [J]. J Hazard Mater, 2011, 189(1-2): 323–328. doi:10.1016/j.jhazmat.2011.02.034 |
| [4] | CHEN L, XU P, DIAO J L, et al. Distribution, metabolism and toxic effects of beta-cypermethrin in lizards (Eremias argus) following oral administration [J]. J Hazard Mater, 2016, 306: 87–94. doi:10.1016/j.jhazmat.2015.11.053 |
| [5] | LIU L, HU J X, WANG H, et al. Effects of beta-cypermethrin on male rat reproductive system [J]. Environ Toxicol Pharmacol, 2010, 30(3): 251–256. doi:10.1016/j.etap.2010.06.007 |
| [6] | BRECKENRIDGE C B, HOLDEN L, STURGESS N, et al. Evidence for a separate mechanism of toxicity for the Type I and the Type II pyrethroid insecticides[J]. NeuroToxicology, 2009, 30(Suppl.1): 17–31. |
| [7] | YANG J, ZHANG Y, HAMID S, et al. Interplay between autophagy and apoptosis in selenium deficient cardiomyocytes in chicken[J]. J Inorganic Biochemistry, 2017, 170: 17. doi:10.1016/j.jinorgbio.2017.02.006 |
| [8] | HEPLER J R, KOZASA T, SMRCKA A V, et al. Purification from Sf9 cells and characterization of recombinant Gq alpha and G11 alpha. Activation of purified phospholipase C isozymes by G alpha subunits[J]. J Biol Chem, 1993, 268(19): 14367–14375. |
| [9] | MOUILLAC B, CARON M, BONIN H, et al. Agonist-modulated palmitoylation of β 2-adrenergic receptor in Sf9 cells [J]. J Biol Chem, 1992, 267(30): 21733–21737. |
| [10] | ALNEMRI E S, FERNANDES-ALNEMRI T, POMERENKE K, et al. FKBP46, a novel Sf9 insect cell nuclear immunophilin that forms a protein-kinase complex[J]. J Biol Chem, 1994, 269(49): 30828–30834. |
| [11] | ZHANG Y, LUO M M, XU W P, et al. Avermectin confers its cytotoxic effects by inducing DNA damage and mitochondria-associated apoptosis[J]. J Agric Food Chem, 2016, 64(36): 6895–6902. doi:10.1021/acs.jafc.6b02812 |
| [12] | LI X, LI Y, FANG S C, et al. Downregulation of autophagy-related gene ATG5 and GABARAP expression by IFN-λ1 contributes to its anti-HCV activity in human hepatoma cells[J]. Antiviral Res, 2017, 140: 83–94. doi:10.1016/j.antiviral.2017.01.016 |
| [13] | LI Y, LI G, WANG K, et al. Autophagy contributes to 4-amino-2-trifluoromethyl-phenyl retinate-induced differentiation in human acute promyelocytic leukemia NB4 cells[J]. Toxicol Appl Pharmacol, 2017, 319: 1–11. doi:10.1016/j.taap.2017.01.016 |
| [14] | ZHANG Y, WU J, XU W, et al. Cytotoxic effects of avermectin on human HepG2 cells in vitro bioassays [J]. Environ Pollut, 2017, 220: 1127–1137. doi:10.1016/j.envpol.2016.11.022 |
| [15] | WANG X Q, LI Y G, ZHONG S, et al. Oxidative injury is involved in fipronil-induced G2/M phase arrest and apoptosis in Spodoptera frugiperda (Sf9) cell line [J]. Pestic Biochem Physiol, 2013, 105(2): 122–130. doi:10.1016/j.pestbp.2012.12.008 |
| [16] | YANG M J, HAO Y W, GAO J F, et al. Spinosad induces autophagy of Spodoptera frugiperda Sf9 cells and the activation of AMPK/mTOR signaling pathway [J]. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol, 2017, 195: 52–59. doi:10.1016/j.cbpc.2017.02.008 |
| [17] | GOZUACIK D, KIMCHI A. Autophagy as a cell death and tumor suppressor mechanism[J]. Oncogene, 2004, 23(16): 2891–2906. doi:10.1038/sj.onc.1207521 |
| [18] |
伍一军, 冷欣夫. 杀虫药剂的神经毒理学研究进展[J]. 昆虫学报, 2003, 46(3): 382–389.
WU Y J, LENG X F. Recent advances in insecticide neurotoxicology[J]. Acta Entomol Sinica, 2003, 46(3): 382–389. |
| [19] | MANNA S, BHATTACHARYYA D, MANDAL T K, et al. Repeated dose toxicity of deltamethrin in rats[J]. Indian J Pharmacol, 2005, 37(3): 160–164. doi:10.4103/0253-7613.16212 |
| [20] | WIELGOMAS B, KRECHNIAK J. Toxicokinetic interactions of α-cypermethrin and chlorpyrifos in rats [J]. Pol J Environ Stud, 2007, 16(2): 267–274. |
| [21] | DONG W, ZHANG X B, ZHANG X Y, et al. Susceptibility and potential biochemical mechanism of Oedaleus asiaticus to beta-cypermethrin and deltamethrin in the Inner Mongolia, China [J]. Pestic Biochem Physiol, 2016, 132: 47–52. doi:10.1016/j.pestbp.2015.11.011 |
| [22] | WANG Y J, ZHANG W, LV Q Y, et al. The critical role of quercetin in autophagy and apoptosis in HeLa cells[J]. Tumor Biol, 2016, 37(1): 925–929. doi:10.1007/s13277-015-3890-4 |
| [23] | GENG J F, KLIONSKY D J. The Atg8 and Atg12 ubiquitin-like conjugation systems in macroautophagy.‘Protein modifications: beyond the usual suspects’ review series[J]. EMBO Rep, 2008, 9(9): 859–864. doi:10.1038/embor.2008.163 |
| [24] | JIANG P, MIZUSHIMA N. LC3- and p62-based biochemical methods for the analysis of autophagy progression in mammalian cells[J]. Methods, 2015, 75: 13–18. doi:10.1016/j.ymeth.2014.11.021 |
| [25] | ZOU M J, LU N, HU C, et al. Beclin 1-mediated autophagy in hepatocellular carcinoma cells: implication in anticancer efficiency of oroxylin A via inhibition of mTOR signaling[J]. Cell Signal, 2012, 24(8): 1722–1732. doi:10.1016/j.cellsig.2012.04.009 |
 2017, Vol. 19
2017, Vol. 19


