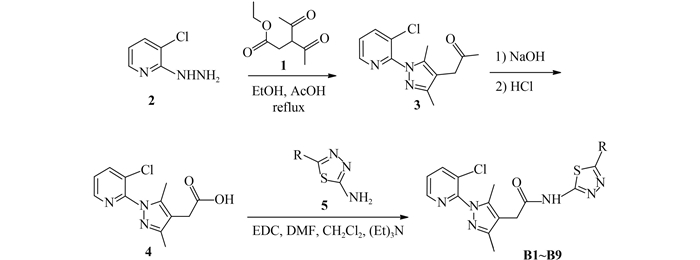
含氮杂环化合物有着独特的生物活性,且毒性低,内吸性高,常被用作医药和农药的结构组成单元,在医药和农药合成方面起着重要的作用[1-3]。研究发现,一些含有吡啶联吡唑结构单元的羧酸衍生物具有一定的生物活性[4-6]。本研究采用活性亚结构拼接法,将吡啶联吡唑乙酰基结构单元与5-取代-1, 3, 4-噻二唑-2-胺进行拼接,设计并合成了9个未见文献报道的含有噻二唑环的吡唑乙酰胺类化合物,对其结构进行了表征,并初步测定了其除草活性。目标化合物的合成路线见图式 1。
|
图式1 含1, 3, 4-噻二唑的吡啶联吡唑乙酰胺类化合物的合成路线 Scheme1 Synthetic route of pyridine linked pyrazole acetyl derivatives containing 1, 3, 4-thiadiazole moiety |
1 实验部分 1.1 仪器与试剂
Bruker AVANCE III 500-MHz核磁共振仪(以TMS为内标);DECAX-60000 LCQ Deca XP质谱仪(美国Thermo公司);GC2014气相色谱仪(岛津,杭州库伦科技有限公司);WRS-1B数字熔点仪(杭州科晓化工仪器设备有限公司,温度计未校正);IR-960傅立叶变换红外光谱仪(天津瑞岸科技有限公司);MP200B型电子天平(上海永亭光学仪器制造有限公司)。
溴乙酸乙酯(98%,上海阿拉丁生化科技股份有限公司);氨基硫脲(工业级,济南睿兴医药科技有限公司);水合肼(85%,国药集团化学试剂有限公司);其余试剂均为市售分析纯。
1.2 化合物的合成 1.2.1 3, 3-二乙酰基丙酸乙酯(1) 的合成参考文献[7]方法以1, 3-戊二酮为原料合成,得到黄色油状液体约4.96 g,收率89%。沸点164.5~166.1 ℃ (文献值[8] 165~166 ℃)。
1.2.2 3-氯-2-肼基吡啶(2) 的合成参考文献[8]方法由2, 3-二氯吡啶与水合肼反应制备,得到白色针状晶体5.8 g,收率81%。熔点168~170 ℃ (文献值[8] 171~173 ℃)。
1.2.3 3-氯-1-(2-吡啶基)-吡唑-4-基乙酸乙酯(3) 的合成参照文献[9]方法制备。在50 mL三口瓶中,加入9.3 g (0.05 mol) 化合物1、7.15 g (0.05 mol) 化合物2和50 mL乙醇,待固体溶解后加入0.3 g乙酸作催化剂,回流反应3~4 h,薄层层析[TLC,展开剂V (乙酸乙酯) :V (石油醚)=2 : 1]监测至原料反应完全。将反应液旋转蒸发脱去溶剂,用4倍质量的V (乙醇) :V (水)=5:1混合溶剂重结晶,得到白色晶体12.4 g,收率85%。熔点98~101℃ (文献值[9] 97~101 ℃)。
1.2.4 3-氯-1-(2-吡啶基)-吡唑-4-基乙酸(4) 的合成在50 mL圆底烧瓶中加入5.86 g化合物3 (0.02 mol),用少量乙醇溶解后,加入30%的氢氧化钠水溶液7.2 mL,再加水40 mL,在60 ℃水浴中反应3 h,TLC [(展开剂V (乙酸乙酯) :V (石油醚)=2 : 1)]监测至反应结束。冷却至室温后,在冰浴条件下用盐酸调节pH值为1~2。抽滤,固体用冰水洗涤,烘干,得到白色粉末4.73 g,收率89%。熔点169~171 ℃ (文献值[9] 170~172℃)。
1.2.5 5-取代-1, 3, 4-噻二唑-2-胺(5) 的合成通法参考文献[10]方法由氨基硫脲与羧酸反应合成。以5-1的合成为例:向50 mL三口烧瓶中,依次加入0.91 g (10 mmol) 氨基硫脲、3.72 g (15 mmol) 2-碘苯甲酸和12 mL浓盐酸,回流反应3 h。冷却至室温,用30%氢氧化钠溶液调节pH值至8~9,用冰水冷却,有大量白色固体析出。抽滤,水洗,干燥。用3倍质量的V (乙醇) :V (水)=2 : 1重结晶,得到浅黄绿色晶体。化合物5的理化数据见表 1。
|
|
表 1 5-取代-1, 3, 4-噻二唑-2-胺的理化数据 Table 1 The physicochemical data of 5-substituted-1, 3, 4-thiadiazol-2-amine |
1.2.6 目标化合物B (6) 的合成通法
在50 mL单口烧瓶中,分别加入1 mmol化合物4、10 mL二氯甲烷、1.2 mmol化合物5和1.7 mmol三乙胺,加入适量N, N-二甲基甲酰胺(DMF) 使化合物5溶解,在冰浴下加入1.2 mmol 1-乙基-(3-二甲基氨基丙基) 碳二亚胺盐酸盐(EDC),0 ℃下反应3~4 h后继续在室温下搅拌过夜。TLC [(展开剂V (石油醚) :V (乙酸乙酯)=3:1]监测至原料反应完全。依次用10 mL乙酸乙酯和5 mL水萃取2~3次,有机相用浓盐酸调节pH值至5~6,用清水洗涤2~3次。有机相依次用饱和碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠脱水,过滤,得到黄绿色澄清滤液,浓缩得到粗产物,用乙酸乙酯重结晶,得到固体(B)。
1.3 除草活性测试方法委托国家南方农药创制中心浙江基地参照文献[17]方法进行。以含1%吐温-80的DMF为溶剂,将供试化合物配成质量浓度为0.01~0.05 g/mL的母液,再用蒸馏水稀释至所需浓度,备用。以5%异丙酯草醚(pyribambenz isopropyl) 乳油(浙江省化工研究院有限公司提供) 为对照药剂,以喷施同等液量清水为空白对照。
供试靶标为马唐Digitaria sanguinalis Scop.、稗草Echinochloa crusgalli Beauv.、狗尾草Setaria viridis Beauv、苘麻Abutilon theophrasti Medicus、凹头苋Amaranthus lividus L.和反枝苋Amaranthus retroflexus,均由浙江省化工研究院有限公司提供。温室盆栽分别采用茎叶法和土壤法处理:取内径为7.5 cm的花盆,装复合土[V (菜园土) :V (育苗基质)=1 : 2]至3/4处,播种杂草靶标(发芽率≥85%),覆土约0.2 cm,待杂草长至3叶期左右时备用。苗前土壤封闭处理于处理前24 h种植。采用自动喷雾塔施药,有效施药剂量为150 g/hm2。待叶面药液晾干后移入温室培养(温度28 ℃,照度3 000 lx,光照时间为16 h光照/8 h黑暗,相对湿度75%),15 d后调查杂草株防效(%)。
2 结果与讨论 2.1 化合物合成合成目标化合物时,由于化合物4的结构不稳定,因而反应温度不能过高。按照文献[12]中报道的以甲苯为溶剂,尽管反应很快,但副产物较多,后处理麻烦,且收率过低;而以二氯甲烷为溶剂,0 ℃下反应温和,很好地控制了副产物的产生。
化合物5是由相应的酸和氨基硫脲在酸性条件下发生关环反应得到的,反应中常需用到浓硫酸、三氯氧磷和浓盐酸等环合试剂。需要指出的是,该反应的pH值需保持在8~9,过高会使胺在碱性条件下开环,过低则会影响产物胺的析出,导致收率降低。
2.2 目标化合物图谱解析目标化合物的理化性质及质谱数据见表 2,核磁共振氢谱数据见表 3。
|
|
表 2 目标化合物B1~B9的理化性质及质谱数据 Table 2 The analytical data and MS of the title compounds B1-B9 |
|
|
表 3 目标化合物B1~B9的核磁共振氢谱数据 Table 3 The1H NMR of the title compounds B1-B9 |
3 除草活性测试
结果(表 4) 表明:在150 g/hm2的处理剂量下,部分目标化合物对供试杂草表现出较好的除草活性。如在土壤处理条件下,化合物B2、B3、B4、B6和B8对反枝苋和凹头苋的抑制率均达到了100%,与对照药剂异丙酯草醚相当;在茎叶处理条件下,化合物B2、B7和B9对苘麻、反枝苋和凹头苋的抑制率分别为100%、95%和100%;化合物B6和B8对苘麻、反枝苋和凹头苋也表现出较高的抑制活性。
|
|
表 4 目标化合物除草活性测试结果(抑制率/%)(测试浓度:150 g/hm2) Table 4 The herbicidal activity of the title compounds (Inhibition rate/%)(Test concentration: 150 g/hm2) |
| [1] |
张进, 肖国民. 含氮杂环化合物的研究进展[J]. 石油化工, 2011, 40(6): 579–584.
ZHANG J, XIAO G M. Study progress in nitrogenous heterocyclic compounds[J]. Petchem Technol, 2011, 40(6): 579–584. |
| [2] | ZHAI Z W, YANG M Y, SUN Z H, et al. Facile and efficient synthesis of novel 1, 2, 3-thiadiazole derivatives using microwave irradiation[J]. J Chem Res, 2015, 39(6): 2828–2833. |
| [3] | MU J X, SHI Y X, YANG M Y, et al. Design, synthesis, DFT study and antifungal activity of pyrazolecarboxamide derivatives[J]. Molecules, 2016, 21(1): 68. doi:10.3390/molecules21010068 |
| [4] |
柴宝山, 林丹, 刘远雄, 等. 新型邻甲酰氨基苯甲酰胺类杀虫剂的研究进展[J]. 农药, 2007, 46(3): 148–153.
CHAI B S, LIN D, LIU Y X, et al. Recent advance on novel insecticidal anthranilic diamides[J]. Agrochemicals, 2007, 46(3): 148–153. |
| [5] |
张广才, 雷树祥, 谭成侠. 1-吡唑酰基-2-烷氧基羰基肼类化合物的合成及其生物活性[J]. 合成化学, 2006, 14(5): 458–462.
ZHANG G C, LEI S X, TAN C X. Synthesis of 1-pyrazol-5'-ylcarbonyl-2-(alkyloxycarbonyl) hydrazides and their biological activities[J]. Chin J Synth Chem, 2006, 14(5): 458–462. |
| [6] | LIU X H, SHI Y X, MA Y, et al. Synthesis of some N, N'-diacylhydrazine derivatives with radical-scavenging and antifungal activity[J]. Chem Biol Drug Des, 2009, 73(3): 320–327. doi:10.1111/jpp.2009.73.issue-3 |
| [7] | LASH T D, LAMM T R, SCHABER J A, et al. Normal and abnormal heme biosynthesis. Part 7. Synthesis and metabolism of coproporphyrinogen-III analogues with acetate or butyrate side chains on rings C and D. Development of a modified model for the active site of coproporphyrinogen oxidase[J]. Bioorg Med Chem, 2011, 19(4): 1492–1504. doi:10.1016/j.bmc.2010.12.053 |
| [8] |
郑毅, 王俊芳, 张应鹏, 等. 新型3-氯-1-(3-氯-2-吡啶)-1H-吡唑甲酰胺类化合物的合成[J]. 合成化学, 2010, 18(3): 341–344.
ZHENG Y, WANG J F, ZHANG Y P, et al. Synthesis of novel 3-bromine-1-(3-chloride-2-pyridine)-1H-pyrazolecarboxamide[J]. Chin J Synth Chem, 2010, 18(3): 341–344. doi:10.1002/cjoc.20000180315 |
| [9] | USHIO H, HAMADA M, WATANABE M, et al. Preparation of heterocycle amide derivatives as inhibitors for production of cytokines:WO 2012050159[P]. 2012-04-19. |
| [10] | ZHENG K B, HE J, ZHANG J. Synthesis and antitumor activity of N'-acetylamino-(5-alkyl/aryl-1, 3, 4-thiadiazole-2-yl)-5-fluorouracil derivatives[J]. Chin Chem Lett, 2008, 19(11): 1281–1284. doi:10.1016/j.cclet.2008.09.021 |
| [11] | SUN Z H, HUANG W, GONG Y Y, et al. Synthesis and herbicidal activity of new 1, 3, 4-thiadizols sulfourea derivative[J]. Chin J Org Chem, 2013, 33(12): 2612–2617. doi:10.6023/cjoc201306028 |
| [12] | AMIT C, PAYAL C, BAGHEL U S, et al. Synthesis, cytotoxic evaluation, Docking and QSAR study of N-(4-oxo-2-(4-((5-aryl-1, 3, 4-thiadiazol-2-yl) amino) phenyl) thiazolidin-3-yl) benzamides as antitubulin agents[J]. Curr Top Med Chem., 2016, 16(22): 2509–2520. doi:10.2174/1568026616666160212124316 |
| [13] | JOSHI S D, MORE U A, KOLI D, et al. Synthesis, evaluation and in silico, molecular modeling of pyrroyl-1, 3, 4-thiadiazole inhibitors of InhA[J]. Bioorg Chem, 2015, 59: 151–167. doi:10.1016/j.bioorg.2015.03.001 |
| [14] |
谭成侠, 吴克崇, 吴贯中.一种取代的吡唑乙酰胺类化合物及其制备方法和应用:CN105924435A[P]. 2016-09-07.
TAN C X, WU K C, WU G Z. Preparation of substituted pyrazoleacetamide derivatives with insecticidal, bactericidal and herbicidal activities:CN105924435A[P]. 2016-09-07. |
| [15] | KULSHRESHTHA A, PIPLANI P. Ameliorative effects of amide derivatives of 1, 3, 4-thiadiazoles on scopolamine induced cognitive dysfunction[J]. Eur J Med Chem, 2016, 122: 557–573. doi:10.1016/j.ejmech.2016.06.046 |
| [16] | LIU Y T, LIANG G T, YIN D W. Synthesis and antimicrobial activity of novel mancozeb derivatives containing 1, 3, 4-thiadiazole[J]. Res Chem Int, 2015, 41(4): 2019–2024. doi:10.1007/s11164-013-1328-4 |
| [17] |
农药室内生物测定试验准则植物生长调节剂第1部分:促进/抑制种子萌发试验浸种法:NY/T 2061.1-2011[S].北京:中国农业出版社, 2011.
Rules for evaluation of pepper for resistance to diseases-Part 1:Rule for evaluaton of pepper for resistance to phytophthora blight:NY/T2061.1-2011[S]. Beijing:China Agriculture Press, 2011. |
 2017, Vol. 19
2017, Vol. 19


