2. 湖南省永州市农业科学研究所, 湖南 永州 425100;
3. 湖南化工研究院有限公司 国家农药创制工程技术研究中心/湖南省农用化学品重点实验室, 长沙 410000
2. Yongzhou Agricultural Science Research Institute, Yongzhou 425100, Hunan Province, China;
3. Hunan Research Institute of Chemical Industry/National Engineering Research Center for Agrochemicals/Hunan Provincial Key Laboratory of Agricultural Chemicals, Changsha 410000, Hunan Province, China
硝磺草酮(mesotrione) 和2甲4氯钠(MCPA-Na)(化学结构式见 Scheme 1 ) 分属三酮类和苯氧羧酸类除草剂,可用于防除水稻阔叶杂草、部分禾本科杂草和莎草,且两者混用的防效优于单一药剂[1-3]。
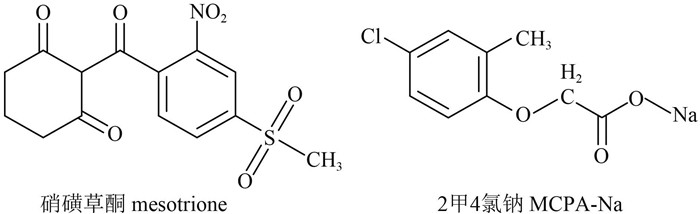
|
Scheme 1 |
硝磺草酮具有较高起始活性、残留活性,较强的水溶性和致癌性等特点,过量施用会对农产品安全、后茬作物安全及其他非靶标生物带来潜在危害[2],并可通过食物链传递对人体健康产生影响[4-5]。随着2甲4氯类除草剂使用量的增加及使用范围的日益扩大,其在作物中的残留及对人类健康和环境造成的危害也为人们所关注[6]。欧盟和世界贸易组织规定糙米中硝磺草酮的最大允许残留限量(MRL) 值为0.05 mg/L[2],日本为0.01 mg/L,美国和加拿大为0.01 mg/L[5],而中国尚未制定其在糙米中的MRL值。对2甲4氯钠进行残留分析时以2甲4氯(MCPA) 的残留量计[7]。日本制订MCPA在糙米中的MRL值为0.1 mg/L,美国和欧盟分别为1和0.05 mg/L[6],中国为0.05 mg/L[7]。
硝磺草酮的检测定方法主要有高效液相色谱(HPLC)-荧光检测法、HPLC-紫外检测法、HPLC-核磁共振和HPLC-质谱法(MS)[8-10]。硝磺草酮不适于用气相色谱分析[2]。其在水中残留检测的前处理方法主要是采用C18固相萃取[4],而在植物体上主要是采用固相分散萃取,如Barchan Ska等[11]采用基质分散固相萃取(matrix solid-phase dispersion, MSPD) 方法提取净化植物叶中的除草剂;贺敏等[12]利用乙腈和水的混合溶液提取玉米样品中的硝磺草酮,液-液分配净化。
2甲4氯的检测方法主要有气相色谱法(GC)[13]和HPLC[6, 14-16]。以HPLC为宜,因不需进行衍生化,且可以避免杂质干扰[6]。其前处理方法有碱水振荡提取[6]、酸碱调节pH值混合溶剂提取、层析柱净化[16]等。
目前,尚未见采用高效液相色谱-串联质谱法(HPLC-MS/MS) 同时测定硝磺草酮和2甲4氯残留的报道。为此,本研究以稻田生态系统为研究对象,建立了固相萃取-HPLC-MS/MS同时检测稻田中硝磺草酮和2甲4氯残留的方法;并采用该方法测定了2种农药的残留消解动态及最终残留量,以期为农药产品残留登记、田间安全施用评估及其有效成分残留分析提供理论参考。
1 材料与方法 1.1 仪器与试剂1290液相色谱-G6460三重四极杆质谱联用仪(美国安捷伦公司);AL204型分析天平(瑞士梅特勒•托利多仪器有限公司);SE202F百分之一天平(美国奥豪斯公司);HY-B1型回旋振荡器(江苏省金坛市医疗仪器厂);Hei-VAP旋转蒸发仪(德国海道尔夫);KL512型氮吹仪(北京康林科技);ProElut C18固相萃取柱(500 mg 3 mL) 和正相硅胶键合固相萃取柱(ProElut PSA) (迪马公司)。
97.0%硝磺草酮(mesotrione) 标准品,96.3% 2甲4氯(MCPA) 标准品(西宝生物科技公司);甲醇和甲酸均为质谱纯;其余试剂均为分析纯;水为超纯水。
1.2 样品前处理 1.2.1 提取土壤:取10 g土壤样品于100 mL锥形瓶中,加入10 mL 5%氯化钠水溶液、1 mL冰醋酸和10 mL乙酸乙酯,振荡提取30 min,于2 000 r/min下离心5 min;取上清液于40 ℃水浴下用氮气吹至近干,用1%甲酸-甲醇溶液定容至5 mL,涡旋5~10 s,过0.22 μm尼龙滤膜,待净化。
水稻植株、稻壳和糙米:称取10 g植株或糙米(谷壳5 g) 于250 mL塑料离心瓶中,加入30 mL 5%的氯化钠水溶液和3 mL冰醋酸,静置20 min后分2次加入乙酸乙酯,每次30 mL,于120 r/min下振荡提取30 min;残渣再用乙酸乙酯30 mL洗涤,合并全部滤液,于40 ℃水浴下旋蒸浓缩至近干,用V (乙酸乙酯) :V (石油醚)=1:9混合溶液定容至5 mL,待净化。
1.2.2 净化水稻植株、稻壳和糙米:将C18固相小柱分别用3 mL甲醇、3 mL乙酸乙酯和3 mL石油醚预淋洗,弃去馏出液;准确量取5 mL待净化样品过淋洗柱,弃去馏出液;先用V (乙酸乙酯) :V (石油醚)=1:1混合溶液2 × 3.0 mL洗脱,再用甲醇3.0 mL洗脱;收集所有洗脱液,于40 ℃水浴下用氮气吹至近干,用1%甲酸-甲醇溶液定容至10 mL,涡旋5~10 s,过0.22 μm尼龙滤膜,待测。
1.3 色谱和质谱检测条件色谱条件:C18色谱柱(2.1 mm×150 mm, 5 μm);柱温35 ℃;进样体积5 uL;采用梯度洗脱,流动相为A (0.1%甲酸水)、B (0.1%甲酸-甲醇溶液),流速0.4 mL/min。梯度洗脱程序见表 1。
|
|
表 1 梯度洗脱时间* Table 1 Time for the gradient elution* |
质谱条件:电喷雾离子源(ESI);正(硝磺草酮)/负(2甲4氯) 离子模式;离子喷雾电压(V) 3 500+/3 000-;干燥气温度350 ℃;干燥气流速6 L/min;雾化气压力103.5 kPa,多反应监测(MRM) 模式下硝磺草酮和2甲4氯的质谱参数见表 2。
|
|
表 2 多反应监测模式下硝磺草酮和2甲4氯的质谱参数 Table 2 Mass spectrum parameters of mesotrione and MCPA under the multiple reactions monitoring (MRM) mode |
1.4 标准溶液配制及标准曲线绘制
用甲醇溶解硝磺草酮和2甲4氯标准品,分别配成500 mg/mL的标准母液,于0 ℃下避光储存。根据试验要求,用甲醇稀释成不同质量浓度的标准工作溶液,即用即配。
用甲醇稀释硝磺草酮和2甲4氯标准母液,配成6个不同浓度的系列混合标准工作溶液。其中,硝磺草酮的质量浓度分别为0.001、0.002、0.01、0.1、1和2 mg/L;2甲4氯的质量浓度分别为0.005、0.01、0.05、0.5、5和10 mg/L。按1.3节的条件测定,分别以硝磺草酮、2甲4氯进样质量浓度(x) 为横坐标,定量检测离子对峰面积(y) 为纵坐标,绘制标准曲线。
1.5 添加回收试验分别准确称取水稻植株、糙米、土壤和田水空白样品,添加硝磺草酮和2甲4氯混合标准溶液,进行添加回收试验。添加水平分别为0.01、0.1、1 mg/L (硝磺草酮) 和0.05、0.5、5 mg/L (2甲4氯),重复5次。稻壳添加水平分别为0.02、0.2、2 mg/L (硝磺草酮) 和0.1、1、10 mg/L (2甲4氯),重复5次。
1.6 数据处理采用Agilent MassHunter Quantitative Analysis数据处理软件和Excel处理数据,按公式(1) 计算样品中硝磺草酮或2甲4氯残留量。
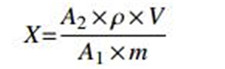
|
(1) |
其中:X为样品中硝磺草酮或2甲4氯的残留量,mg/L;ρ为测定用标准溶液浓度,mg/L;A1为硝磺草酮或2甲4氯标准溶液的峰面积;A2为样品溶液的峰面积;m为样品质量,g;V为进样体积,mL。
2 结果与分析 2.1 质谱条件的选择及优化采用G6460三重四极杆串联质谱仪(ESI源),通过配置的自动针泵进样系统,在多反应监测(MRM) 模式下对硝磺草酮(相对分子质量为339.32) 和2甲4氯(相对分子质量为200.45) 的质谱条件进行选择优化。硝磺草酮因含有羰基等多电子基团而适合在正离子模式下形成[M+H]+母离子,2甲4氯为苯氧羧酸类化合物,适合在负离子模式下离子化,产生的母离子为[M-H]-。结果表明:在正离子模式下,硝磺草酮进入一级质谱后,很容易产生稳定的[M+H]+分子离子峰;在负离子模式下,2甲4氯进入一级质谱后,产生稳定的[M-H]-分子离子峰。综合考虑,选择m/z=340.4为硝磺草酮的母离子,m/z=199.1为2甲4氯的母离子。
由图 1可知:硝磺草酮二级质谱的特征碎片m/z为228.0、104.0和297.0,可能的碎片为C8H5NO5S、C14H13O5S和C6O2,其中m/z为228.0响应值很高且稳定,因此将340.4/228.0作为定量离子;2甲4氯二级质谱的特征碎片m/z为141.0和155.0等,可能的碎片为C7H6ClO和C8H8ClO,其中141.0响应值很高且稳定,因此,将199.1/141.0作为定量离子。0~3.5 min使用正离子模式检测硝磺草酮,3.5~12 min使用负离子模式检测2甲4氯。确定两种待测物的准分子离子峰和特征碎片离子后,对其质谱参数进行了优化,结果见图 1。
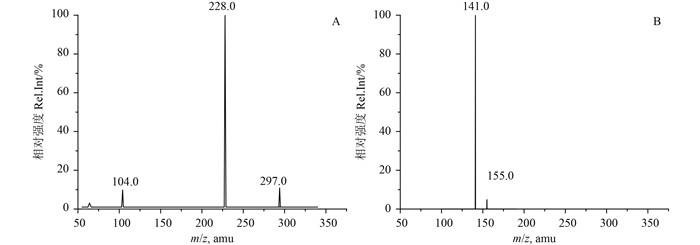
|
图 1 硝磺草酮(A) 和2甲4氯(B) 二级质谱图 Fig. 1 Tandem mass ion spectra of mesotrione (A) and MCPA (B) |
2.2 流动相的优化
本研究考察了甲醇-水和乙腈-水两种流动相体系的色谱分离效果。结果显示:当流动相为乙腈-水时,硝磺草酮响应值比以甲醇-水为流动相时差,因此选择甲醇-水流动相体系。当甲醇的体积分数为20%时,采用等度洗脱,2甲4氯峰形不佳;当甲醇体积分数提高到25%时,目标物出峰延迟,分离效果较差。当甲醇体积分数为80%时,采用梯度洗脱,硝磺草酮和2甲4氯出峰较好,分离效果明显。此外,在流动相中加入少量甲酸可以提高离子化效率,优化峰形,提高灵敏度。综合考虑,确定流动相为:0.1%甲酸水溶液(A)-0.1%甲酸-甲醇溶液(B),流速为0.4 mL/min,柱温35 ℃,进样量1 μL。梯度洗脱程序:0~6 min,20%~80% B;8~10 min,80% B;10~12 min,80%~20% B (表 1)。
2.3 净化剂的选择及优化比较了PSA和C18固相小柱及其用量对待测物回收率的影响。以50 mg的PSA净化水稻植株、稻壳、糙米和土壤提取液时,待测物在土壤中的回收率达70%~110%,而水稻植株、稻壳和糙米的回收率不达标。因此选用C18固相小柱对植株、稻壳和糙米进行净化。比较了V (乙酸乙酯) :V (石油醚)=1 : 2、2 : 2和2 : 1对净化效果的影响。结果表明:在2 : 2条件下,去除基质干扰效果明显,回收率达到80%~110%。故最终确定以50 mg的PSA为土壤的净化剂,以V (乙酸乙酯) :V (石油醚)=2 : 2和甲醇为淋洗剂过C18固相小柱净化水稻植株、稻壳和糙米基质。
2.4 线性关系及基质效应结果(表 3) 表明:在0.01~10 mg/L范围内,硝磺草酮和2甲4氯的响应值与其质量浓度间线性关系良好,相关系数均大于0.997。
采用基质标准曲线斜率和溶剂标准曲线斜率之比(k) 来评价基质效应:当k大于1.1时为基质增强效应,小于0.9时为基质减弱效应,而当k在0.9~1.1之间时,为基质效应不明显[17-19]。从斜率比(表 3) 可以看出:土壤和糙米对硝磺草酮具有基质减弱效应,植株、谷壳基质效应明显,田水无明显基质效应。土壤对2甲4氯具有基质减弱效应,田水、植株、谷壳和糙米对2甲4氯无明显基质效应。本研究采用样品净化方法来消除基质效应的影响。由表 4可知:样品经净化后其回收率在70%~120%之间,说明有效去除了基质效应[20-21]。
|
|
表 3 硝磺草酮和2甲4氯的线性范围、线性方程、相关系数及斜率比 Table 3 Linear ranges, regression, correlation coefficients (r), and slope of matrix/slope of solvent (k) for mesotrione and MCPA in different matrices |
2.5 方法的准确度、精密度和灵敏度
根据HPLC-MS/MS信噪比(S/N)=10和用添加方法检测出待测物在样品中的最低含量,得到硝磺草酮和2甲4氯的定量限(LOQ)。结果(表 3) 表明:硝磺草酮和2甲4氯的检出限分别为0.005和0.025 ng,LOQ分别为0.01和0.05 mg/L。均低于现有国内外残留限量[7, 23-26],可满足检测要求。在优化的HPLC-MS/MS条件下,硝磺草酮的相对保留时间约为2.6 min,2甲4氯约为3.9 min。
在0.001~2 mg/L添加水平下,硝磺草酮和2甲4氯在田水、土壤、水稻植株、稻壳和糙米中的平均回收率为75%~103%,相对标准偏差为0.1%~8.2% (n=5)(表 4)。表明该方法具有较好的准确性和稳定性,满足农药残留分析的要求,典型添加色谱图见图 2。
|
|
表 4 不同基质中硝磺草酮和2甲4氯的添加回收率及相对标准偏差 Table 4 The average recoveries and relative standard deviation (RSD) of mesotrione and MCPA in different matrices (n=5) |

|
A1:田水空白;A2:田水添加硝磺草酮(0.01 mg/L)和2甲4氯(0.05 mg/L); B1:田土空白;B2:田土添加硝磺草酮(0.01 mg/L)和2甲4氯(0.05 mg/L)。 A1: Blank water; A2:Water spiked with 0.01 mg/L mesotrione and 0.05 mg/L MCPA; B1: Blank soil; B2:Soil spiked with 0.01 mg/L mesotrione and 0.05 mg/L MCPA. 图 2 空白样品及添加回收样品的典型色谱图 Fig. 2 Chromatograms of blank and spiked samples |
2.6 实际样品分析
运用本研究所建立的方法,对中国湖南省宁乡县历经铺乡、江苏省句容市华阳镇、河南省新乡市原阳县2013-2014年稻田中的田水、土壤和植株(45 d消解动态);土壤、植株、稻壳和糙米(最终残留) 田间实际样品进行了测定。结果表明:在水稻植株消解动态试验样品中仅0~3 d中检出硝磺草酮(0.01~1.11 mg/L) 和2甲4氯钠(0.0536~5.20 mg/L);而所有最终残留试验样品中均未检出硝磺草酮和2甲4氯钠。说明硝磺草酮和2甲4氯钠按推荐用量在稻田中使用是安全的。
3 结论本研究建立了一种同时检测稻田中硝磺草酮和2甲4氯钠残留的HPLC-MS/MS检测方法。该方法简单、快速、灵敏度及准确度高,能够满足稻田中硝磺草酮和2甲4氯钠残留量的快速检测和确证的要求,可为农药登记残留田间试验样品的分析提供参考。
| [1] |
张玉聚, 孙化田, 王春生.
除草剂及其混用与农田杂草化学防治[M]. 北京: 中国农业科技出版社, 2000.
ZHANG Y J, SUN H T, WANG C S. Herbicide mix with using and weed chemical control[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [2] |
邓立刚, 李增梅, 赵善仓, 等. 超高效液相色谱-串联质谱法测定玉米中硝磺草酮及其代谢物残留量[J]. 分析化学, 2013, 41(8): 1269–1273.
DENG L G, LI Z M, ZHAO S C, et al. Determination of mesotrione and its metabolite residues in maize by ultra performance liquid chromatography coupled with tandem mass spectrometry[J]. Chin J Analyt Chem, 2013, 41(8): 1269–1273. |
| [3] |
徐妍, 杜微. 25%磺草酮·2甲4氯水剂高效液相色谱分析[J]. 农药, 2006, 45(5): 329–330.
XU Y, DU W. HPLC analysis of a sulcotrione·MCPA 25% SL[J]. Agrochemicals, 2006, 45(5): 329–330. |
| [4] |
王小梅, 谭培功, 曹正梅, 等. 固相萃取/高效液相色谱法测定水中痕量硝磺草酮[J]. 分析测试学报, 2015, 34(2): 216–220.
WANG X M, TANG P G, CAO Z M, et al. Determination of trace amounts of mesotrione in water by solid phase extraction and high performance liquid chromatography[J]. J Instrum Anal, 2015, 34(2): 216–220. |
| [5] |
张代辉, 滕国生, 李正强, 等. 高效液相色谱-串联质谱法测定食品中硝磺草酮[J]. 分析化学, 2012, 40(5): 811–812.
ZHANG D H, TENG G S, LI Z Q, et al. Determination of mesotrione in food by liquid chromatography tandem mass spectrometry[J]. Chin J Anal Chem, 2012, 40(5): 811–812. |
| [6] |
赵慧宇, 薄瑞, 薛佳莹, 等. 高效液相色谱-串联质谱法测定小麦中2甲4氯残留[J]. 农药学学报, 2010, 12(1): 105–108.
ZHAO H Y, BO R, XUE J Y, et al. Determination of MCPA residue in wheat using high performance liquid chromatography tandem mass spectrometry[J]. Chin J Pestic Sci, 2010, 12(1): 105–108. |
| [7] |
食品中农药最大残留限量:GB 2763-2014[S].北京:中国标准出版社, 2014.
National food safety standard-Maximum residue limits for pesticides in food:GB 2673-2014[S]. Beijing:China Standards Press, 2014. |
| [8] |
李岩, 于荣, 姜宜飞, 等. 硝磺·莠去津550克/升悬浮剂高效液相色谱分析方法研究[J]. 农药科学与管理, 2010, 31(5): 41–44.
LI Y, YU R, JIANG Y F, et al. Analytical method for the determination of mesotrione and atrazine 550g/L SC by HPLC[J]. Pestic Sci Admin, 2010, 31(5): 41–44. |
| [9] |
庞民好, 刘顺, 张利辉, 等. 新型玉米田除草剂甲基磺草酮在土壤中残留的高效液相色谱分析[J]. 河北农业大学学报, 2007, 30(5): 75–78.
PANG M H, LIU S, ZHAGN L H, et al. Residue analysis of mesotrione as a new maize herbicide in soil by HPLC[J]. J Agric Univ Hebei, 2007, 30(5): 75–78. |
| [10] | BARCHANSKA H, RUSEK M, SZATKOWSKA A. New procedures for simultaneous determination of mesotrione and atrazine in water and soil. Comparison of the degradation processes of mesotrione and atrazine[J]. Environ Monit Assess, 2012, 184(1): 321–334. doi:10.1007/s10661-011-1970-5 |
| [11] | BARCHANSKA H, BABILAS B, GLUZICKA K, et al. Rapid determination of mesotrione, atrazine and its main degradation products in selected plants by MSPD-HPLC and indirect estimation of herbicides phytotoxicity by chlorophyll quantification[J]. Intern J Environ Anal Chem, 2014, 94(2): 99–114. doi:10.1080/03067319.2013.791977 |
| [12] |
贺敏, 贾春虹, 余平中, 等. 55%硝磺·莠去津悬浮剂在玉米和土壤中的残留动态[J]. 农药, 2014, 53(8): 590–593.
HE M, JIA C H, YU P Z, et al. Residue dynamics of mesotrione·atrazine 55% SC in corn and soil[J]. Agrochemicals, 2014, 53(8): 590–593. |
| [13] |
匡科, 赵建亮, 应国光, 等. 气相色谱-负化学源质谱法对水中2-甲-4-氯和2, 4-滴的测定[J]. 分析测试学报, 2008, 27(8): 816–819.
KUAN K, ZHAO J L, YING G G, et al. Determination of MCPA and 2, 4-D in water by gas chromatography-negative chemical ionization mass spectrometry[J]. J Instrum Anal, 2008, 27(8): 816–819. |
| [14] |
文师倩, 袁竹青, 胡玫, 等. 2甲4氯·氯氟吡36%可湿性粉剂高效液相色谱分析[J]. 农药科学与管理, 2013, 34(5): 50–52.
WEN S Q, YUAN Z Q, HU M, et al. Analysis of MCPA·fluroxypyr-meptyl 36% WP by HPLC[J]. Pestic Sci Admin, 2013, 34(5): 50–52. |
| [15] |
初恒灿, 朱博, 阎亚南. 2甲4氯二甲胺与2, 4-滴二甲胺混合物的高效液相色谱分析[J]. 农药, 2012, 51(1): 35–36.
CHU H C, ZHU B, YAN Y N. Analysis of the mixture of MCPA-dimethgl aminesalt and 2, 4-D dimethylamine salt by HPLC[J]. Agrochemicals, 2012, 51(1): 35–36. |
| [16] |
陈柏. 26%2甲4氯钠·烟嘧磺隆悬浮剂在玉米及其土壤中的消解动态与残留[J]. 农药, 2013, 52(12): 887–888.
CHEN B. Residue and decline of MCPA-sodium and nicosulfuron 26% SC in corn and soil[J]. Agrochemicals, 2013, 52(12): 887–888. |
| [17] |
闫震, 聂继云, 徐国锋, 等. 超高效液相色谱-串联质谱法对比4种净化方式对不同色素含量基质中19种农药残留检测的影响[J]. 分析测试学报, 2014, 33(9): 1000–1009.
YAN Z, NIE J Y, XU G F, et al. Effects of four kinds of purification methods for determination of 19 pesticide residues in substrates of different pigments analyzed by ultra performance liquid chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2014, 33(9): 1000–1009. |
| [18] |
江泽军, 张鹏, 李永飞, 等. 分散固相萃取-高效液相色谱-串联质谱法测定水稻和土壤中的福美双与甲霜灵残留[J]. 农药学学报, 2015, 17(3): 313–320.
JIANG Z J, ZHANG P, LI Y F, et al. Simultaneous determination of thiram and metalaxyl residues in rice and soil by dispersive solid phase extraction and high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2015, 17(3): 313–320. |
| [19] | LIU X G, XU J, LI Y B, et al. Rapid residue analysis of four triazolopyrimidine herbicides in soil, water, and wheat by ultra-performance liquid chromatography coupled to tandem mass spectrometry[J]. Anal Bioanal Chem, 2011, 399(7): 2539–2547. doi:10.1007/s00216-010-4606-7 |
| [20] |
丛玉隆.
临床实验室管理学[M]. 北京: 中国医药科技出版社, 2004: 74-80.
CONG Y L. Clinical laboratory management[M]. Beijing: Chinese Medical Science and Technology Press, 2004: 74-80. |
| [21] |
张才成, 陈静, 方腊根. 回收试验与基质效应评价[J]. 实验与检验医学, 2011, 29(3): 269–270.
ZHANG C C, CHEN J, FANG L G. The evaluation of recovery test and matrix effects[J]. Exp Lab Med, 2011, 29(3): 269–270. |
| [22] |
农药残留试验准则:NY/T 788-2004[S].北京:中国农业出版社, 2004.
Guideline on pesticide residue trials:NY/T 788-2004[S]. Beijing:China Agriculture Press, 2004. http://www.oalib.com/references/17865438 |
| [23] | The Japan Food Chemical Research Foundation. Table of MRLs for agricultural chemicals[DB/OL].[2015-12-10]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=74400. |
| [24] | The Japan Food Chemical Research Foundation. Table of MRLs for Agricultural Chemicals[DB/OL].[2015-12-10]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=1100. |
| [25] | European Union. EU Pesticides database[DB/OL].[2015-12-10]. http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=pesticide.residue.CurrentMRL&language=EN. |
| [26] | WHO. Codex alimentarius international food standards:codex pesticides residues in food online database[DB/OL].[2015-12-10]. http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=pesticide.residue.CurrentMRL&language=EN. |
 2017, Vol. 19
2017, Vol. 19


