2. 中国农业大学 理学院, 北京 100193
2. College of Sciences, China Agriculture University, Beijing 100193, China
化学农药是农业面源污染中的主要污染源之一[1]。磺酰脲类除草剂因其活性高、除草谱广、选择性强、使用方便等特点深受农药市场的推崇[2]。据联合国粮食与农业组织 (FAO) 报道,磺酰脲类除草剂在世界范围内广泛应用,仅 1992-2011 年期间该类药剂的使用量即从 129 t 迅速增加到了 2 135 t,尤其在欧洲和北美地区,其用量增加了 100 倍以上[3]。中国农药网 2014 年公布的数据表明,2011 年全世界磺酰脲类除草剂的销售额已达 23.74 亿美元,占整个除草剂市场的 11.0%,其中销售额最高的为甲磺胺磺隆 (mesosulfuron-methyl) 和烟嘧磺隆 (nicosulfuron),两者总计达 2.80 亿美元[4]。磺酰脲类除草剂长期大量使用后,所造成的残留叠加效应对整个环境的影响不容忽视[5]。烟嘧磺隆是磺酰脲类除草剂的代表性品种,其淋溶性较强,易对土壤及地下水造成污染,对生态环境和人类健康存在潜在的威胁[6-8]。在农药污染治理方面,微生物因其种类丰富、分布广泛、适应性强和代谢途径多样的特点而逐渐呈现出显著优势。微生物降解具有有效、安全、廉价等特点,因而被认为是一种最有潜力的污染物处理策略[9]。本文拟针对烟嘧磺隆微生物降解的研究进展进行系统综述,旨在为其他磺酰脲类除草剂的微生物降解研究提供参考。
1 烟嘧磺隆的使用及危害烟嘧磺隆 (nicosulfuron) 属磺酰脲类玉米田苗后除草剂,对一年生和多年生禾本科杂草以及部分阔叶杂草、莎草科杂草具有很好的防治效果,已成为中国北方夏玉米田的常用除草剂品种[10],其化学结构式见图式 1。随着烟嘧磺隆的大规模使用,其所引起的残留及杂草抗药性问题日益突出[11]。由于烟嘧磺隆具有挥发性低和长残留的特性,易通过地表径流渗漏到地表水和地下水中造成污染[6-8, 12-15],并且易对后茬敏感作物造成药害[16-19]。2000 年,Battaglin 等[15]调查了美国中西部地区地下水中的农药残留情况,在其 50% 以上的河流样品中检测到了烟嘧磺隆及其降解产物。此外,在对后茬作物药害方面,Greenland[17]的研究表明,残存在土壤中的烟嘧磺隆对后茬卷心菜和洋葱的早期生长存在影响,并可造成洋葱减产;郝文波等[18]发现,烟嘧磺隆使用浓度在 0.01 mg/kg 左右可引起后茬烟草出现植株矮小、叶片畸形、主根短及须根少等症状,且持续时间较长。

|
图式 1 烟嘧磺隆化学结构式及其脲桥结构 Scheme1 Chemical structural and urea linkage |
2 降解烟嘧磺隆的微生物种类及降解特性
目前,科研工作者从土壤、农药污水处理池的活性淤泥及废水等受磺酰脲类除草剂污染的环境介质中,通过富集、筛选、驯化等手段,分离出了多种可降解烟嘧磺隆的微生物 (表 1)。已分离到的细菌包括假单胞菌属、芽孢杆菌属、微球菌属及产碱杆菌属等;而已分离到的可降解烟嘧磺隆的真菌种类主要有青霉属和曲霉属等。
从表 1 中可看出,从被不同种类磺酰脲类除草剂污染的环境介质中,均分离到了能够降解烟嘧磺隆的微生物,并呈现出了不同的降解能力,同时这些微生物在培养时间、温度、初始底物浓度及菌株接种量等方面均存在一定的差异。此外,就目前分离到的烟嘧磺隆降解菌株而言,细菌由于具有较强的适应能力以及易于诱发突变,因而在降解烟嘧磺隆的微生物中占据了主要地位,种类和数量均居多。尽管目前分离到的可降解烟嘧磺隆的真菌种类和数量较少,但其降解能力明显优于细菌。Zhao 等[20]从农田土壤中分离得到的粪产碱杆菌 ZWS11,对初始质量浓度为 500 mg/L 的烟嘧磺隆的降解率达 80% 以上;代鹏飞等[21]分离到的假单胞菌 YN-8 菌株对初始质量浓度为 100 mg/L 的烟嘧磺隆的降解率为 65.4%,而在相同的浓度下,青霉 YC-WC1 菌株能够使药剂完全降解。
|
|
表 1 可降解烟嘧磺隆的微生物种类及其降解特性 Table 1 Categories of nicosulfuron-degrading microorganisms and its degradation characteristics |
此外,在相同的降解条件下,不同学者分离得到的芽孢杆菌对烟嘧磺隆的降解能力存在差异,如杨亚君等[11]从污水处理池水样中分离到的芽孢杆菌菌株的降解能力低于 Lu 等[22]分离到的 YB1 菌株。还有研究表明,不同芽孢杆菌菌株所对应的最适降解条件也各不相同。齐萌等[23]从农药污水处理池活性淤泥中分离到的芽孢杆菌 ND1 菌株具有较高的降解能力,并且其降解条件优于杨亚君等[11]和 Lu 等[22]研究得到的降解条件。分析其原因可能是由于从不同生存环境分离得到的降解菌株对环境及底物的依赖程度不同。
从以上研究报道可以看出,目前对于烟嘧磺隆降解菌的研究主要是针对单一药剂的降解,而有关烟嘧磺隆与其他药剂复合污染降解菌的研究报道较少。同时大多数降解菌对高浓度烟嘧磺隆的适应性较差,降解速率较慢,不能将目标化合物完全矿化,限制了其实际应用。因此,今后应加强对烟嘧磺隆及其复合污染物具有高效降解能力菌株的研究,从而为进一步扩大菌株的应用范围提供菌种资源。
3 烟嘧磺隆的微生物降解途径现有研究发现,不同种类微生物、单一微生物以及复合微生物对烟嘧磺隆的降解途径均存在差异,并导致所产生的中间降解产物有所不同[29]。以下拟就烟嘧磺隆的微生物降解途径研究概况分类进行介绍。
3.1 烟嘧磺隆在土壤复合微生物作用下的降解烟嘧磺隆在土壤中的降解主要是由多种微生物共同作用实现的。其降解途径如图式 2 所示,降解产物包括:N,N-二甲基-2-氨基磺酰基-3-吡啶甲酰胺 (1)、(4,6-二甲氧基-乙-嘧啶) 脲 (2)、2-((4,6-二甲氧基嘧啶-2基)氨基)-N,N-二甲基菸酰胺 (3)、3-(N,N-二甲基氨基甲酰)-2-吡啶磺酸 (4) 和2-氨基-4,6-二甲氧基嘧啶 (5)。其中化合物 1 是烟嘧磺隆合成过程中重要的中间产物,其产生归结于母体化合物磺酰脲桥上 C—N 键的断裂,并可进一步通过脱氨作用生成化合物 4;化合物 2 的产生源自烟嘧磺隆磺酰脲桥上 S—N 键的断裂,并可进一步失去酰胺基 (–CONH2) 而生成烟嘧磺隆合成过程中的另一重要中间产物 5;母体化合物磺酰脲桥上与嘧啶环相连的氮原子在微生物的作用下直接进攻吡啶环上的碳原子,发生重排反应生成化合物 3;此外,3、4 和 5 最终可被微生物降解为 CO2 (6)。

|
图式 2 烟嘧磺隆在土壤复合微生物作用下的代谢途径[30] Scheme2 The metabolic pathways of nicosulfuron by complex microorganisms in soil[30] |
3.2 粪产碱杆菌 ZWS11 对烟嘧磺隆的降解途径
Zhao 等[20]利用高分辨液相色谱-质谱联用仪 (HRLC-MS) 分析了粪产碱杆菌 ZWS11 菌株降解烟嘧磺隆所得到的产物,同时结合标准物质的碎片离子最终确定了其 4 个降解产物分别为:化合物 1、化合物 5 及 2-氨基-4,6-二甲氧基嘧啶 (7)、2-(1-(4,6-二甲氧基-嘧啶-2-)-脲基)-N,N-二甲基-烟酰胺 (8),并由此推测出了该菌株对烟嘧磺隆的降解途径 (图式 3)。其中,化合物 1 和 5 来自于磺酰脲桥上 C—N 键的断裂;化合物 8 则来自于母体化合物的缩合反应——脱去官能团 –SO2– 并发生重排,同时伴随磺酰脲桥上 C—S 键的断裂;化合物 7 的产生源自磺酰脲桥上 C—N 键的断裂以及嘧啶环上进一步的脱甲基作用。

|
图式 3 粪产碱杆菌 ZWS11 菌株对烟嘧磺隆的降解途径[20] Scheme3 The degradation pathways of nicosulfuron by Alcaligenes faecalis ZWS11[20] |
3.3 假单胞菌属 YN-8 菌株对烟嘧磺隆的降解途径
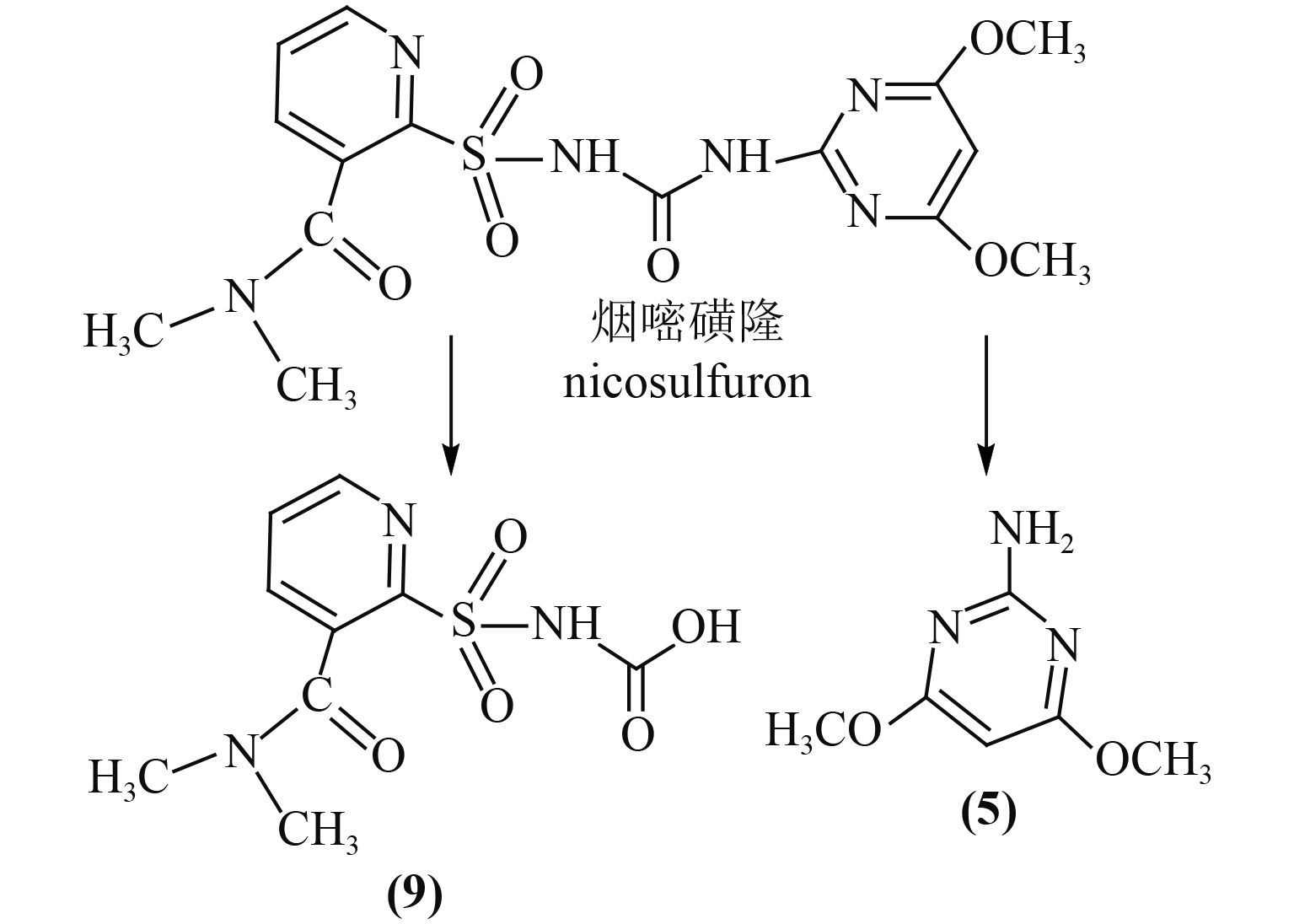
代鹏飞等[21]推测出了假单胞菌属 Pseudomonas sp. YN-8 菌株降解烟嘧磺隆的途径 (图式 4),其降解产物分别为 3-(二甲基烟酰胺) 吡啶-2-基磺酰氨基甲酸 (9) 及化合物 5,均源自磺酰脲桥上 C—N 键的断裂。
|
图式 4 假单胞菌属 YN-8 菌株对烟嘧磺隆的降解途径[21] Scheme4 The degradation pathways of nicosulfuron by Pseudomonas sp. YN-8[21] |
3.4 粘质沙雷氏菌 N80 菌株对烟嘧磺隆的降解途径
同样,Zhang 等[24]根据粘质沙雷氏菌 Serratia marcescens N80 菌株对烟嘧磺隆的主要降解产物推测了其降解途径(图式 5)。其中,化合物 1 和 5 在微生物作用下能够直接从烟嘧磺隆获得,分别来自于磺酰脲桥上 C—N 键的断裂。

|
图式 5 粘质沙雷氏菌 N80 菌株对烟嘧磺隆的降解途径[24] Scheme5 The degradation pathways of nicosulfuron by Serratia marcescens N80[24] |
3.5 黄篮状菌 LZM1 菌株对烟嘧磺隆的降解途径
Song 等[27]研究得到的黄篮状菌 Talaromyces flavus LZM1 菌株对烟嘧磺隆的降解途径与其他报道有所不同 (图式 6)。其中,化合物 1 和 5 并不能够在 LZM1 菌株的作用下直接获得,而是烟嘧磺隆分别先被降解为 2-(N-carbarnoylsulfamoyl)-N,N-dimethylnicotinamid (10) 和 2-isocyanato-4,6-dimethoxypyrimidine (11),同时烟嘧磺隆还可发生吡啶的开环反应,生成 E-N-((4,6-dimethoxypyrimidin-2-yl)carbamoyl)-1-(methylimino)methanesulfonamide (12),或者通过失去 –SO2– 官能团,生成 8。其中化合物 10 源自磺酰脲桥上的 –NH– 官能团与相连的嘧啶环发生 C—N 键断裂,11 则是由于磺酰脲桥内部 C—N 键的断裂;推测化合物 10 和 11 通过脱羧反应生成相应的 1 和 5,再进一步发生脱氨反应,分别生成 3-formylpyridine-2-sulfonamide (13) 和 4,6-二甲氧基嘧啶 (14)。值得一提的是,周珊[31]57-59分离得到的降解菌 Oceanisphaera psychrotolerans LAM-WHM-ZC 菌株对烟嘧磺隆的降解产物与宋金龙[32]34-37的报道相同。

|
图式 6 黄篮状菌 LZM1 菌株对烟嘧磺隆的降解途径[27] Scheme6 The degradation pathways of nicosulfuron by Talaromyces flavus LZM1[27] |
就已报道的微生物对烟嘧磺隆的降解产物进行比较,发现不同种类微生物降解同一化合物所产生的降解产物可能存在差异,这进一步验证了 Bhattacharjee 等[29]的观点。此外,烟嘧磺隆在土壤复合微生物菌群和单一微生物作用下的降解也存在较大差异,其原因可能是由于单一微生物不具备生物降解所需的大量酶,而土壤微生物是一个复合菌群,该菌群中可能携带了降解所需的不同的酶,从而使得药剂的降解途径及产物存在差异。在降解产物方面,烟嘧磺隆在微生物的作用下可获得 14 个不同的降解产物,其中化合物 1 和 5 是主要降解产物,也是合成烟嘧磺隆的主要中间体。在降解途径方面,烟嘧磺隆的大部分微生物降解产物都来自于磺酰脲桥的断裂,主要涉及以下几种断裂形式:1) 磺酰脲桥上的 –NH– 官能团与相连的嘧啶环发生 C—N 断裂,如化合物 10;2) C—N 断裂,如化合物 5 和 11;3) S—N 键断裂,如化合物 2;4) S—C 键断裂,如化合物 8。此外,上述研究表明,烟嘧磺隆通过不同的降解途径均可产生化合物 5。通过研究菌株对烟嘧磺隆的降解途径,不仅可为药剂污染土壤的生物修复提供理论依据,还有可能为新型磺酰脲类化合物的合成路径研究及设计提供思路。
4 与烟嘧磺隆相关的微生物降解酶相关研究表明,微生物主要通过降解酶而对化学农药产生降解作用,即微生物降解农药的实质是酶促反应。这些降解酶有些是微生物固有的 (组成型酶),有些则是在药剂驯化后诱导产生的 (诱导型酶)。目前,科研工作者已经从降解菌株中分离纯化得到一些与烟嘧磺隆相关的降解酶,主要有氧化酶[32-33]、水解酶[34-35]、酯酶[31, 36]、过氧化氢酶[37]及脱氢酶[37]等 (表 2)。
|
|
表 2 与烟嘧磺隆相关的降解酶 Table 2 The degradation enzymes related with nicosulfuron |
Kang 等[37]通过对枯草芽孢杆菌 B. subtilis YB1 菌株的粗酶液进一步分离纯化,经飞行时间质谱测定了不同蛋白条带的氨基酸序列,并在 NCBI 上进行了 BLAST 比对,确认该粗酶液主要包括锰 ABC 转运蛋白、植物过氧化氢酶 I 和乙偶姻脱氢酶 E1,但他们尚未开展针对单一酶的酶学性质和降解活性的研究,因此并未明确具体是何种酶对烟嘧磺隆起主要降解作用。宋金龙[32]78将分离到的黄篮状菌 LZMl 菌株胞内粗酶液经离子交换柱和疏水层析柱分离纯化后,通过凝胶层析最终得到了降解酶,其分子质量为 55 kDa,经飞行时间质谱测定,确定该降解酶为黄素单加氧酶。该酶的最适降解温度为 40 ℃,pH 值为 7.0,但其活性的维持需要辅酶或辅因子的存在,因此是一种辅酶依赖型降解酶。周珊[31]98研究发现,O. psychrotolerans LAM-WHM-ZC 菌株的降解酶——酯酶 E3 可有效降解烟嘧磺隆,在 45 ℃ 时该酶比较稳定,酶活保持在 80% 以上;酯酶 E3 在较广的温度 (25~60 ℃) 和 pH (7.0~8.5) 范围内酶活性均较好。
此外,有关降解菌株粗酶液对烟嘧磺隆的降解已有很多研究报道。Kang 等[38]研究了枯草芽孢杆菌 B. subtilis YB1 菌株粗酶液对烟嘧磺隆的降解,结果表明,在 35 ℃、pH 9.0 条件培养时,菌株的胞外酶对 5 mg/L 烟嘧磺隆的降解率为 66%,且该粗酶液在碱性条件下可保持较高的活性,但对高温非常敏感。赵卫松等[39]研究了粪产碱杆菌 A. faecalis ZWS11 菌株胞外粗酶液对烟嘧磺隆的降解特性,发现该粗酶液对烟嘧磺隆的降解率大于 80%,在 35~70 ℃、pH 5.0~8.0 时能保持较高的降解活性,具有较好的热稳定性和 pH 稳定性。但对该粗酶液中起关键降解作用的酶的种类尚未阐明,还有待于进一步研究。
5 烟嘧磺隆降解酶编码基因研究进展随着对降解酶研究的深入,越来越多的研究者认识到酶制剂比微生物制剂具有更广泛的应用前景,因此,研究者将更多的目光集中到了降解酶基因的克隆和表达上。总体来说,虽然关于磺酰脲类除草剂的研究时间不长,对其降解酶基因的研究相对有机磷类农药而言要少很多,但目前也已经取得一些成果,已有多个可降解磺酰脲类农药的降解酶基因被成功克隆。Omer 研究团队[33]首次从浅灰链霉菌 Streptomyces griseolus ATCC 11796 菌株获得了细胞色素 P450 单加氧酶 P450SU1 和 P450SU2,该降解酶可通过促使磺酰脲桥断裂,从而实现对磺酰脲类除草剂的降解,并进一步明确了编码这两个单加氧酶的基因分别为 suaC 和 subC。李顺鹏课题组[34]通过建立基因组文库的方法,从嗜甲基菌 Methylophilus sp. S113 菌株获得了噻吩磺隆水解酶基因 tsmE,该基因的表达产物在 1 h 内能够将 100 mg/L 的噻吩磺隆水解为无除草活性的噻吩磺隆酸。Ruan 等[35]通过对库特氏属 Kurthia huakuii LAM0713 菌株进行全基因组测序,克隆得到一个新的酯酶基因 sue,该基因经重组表达后能够在 15 min 内将 50 mg/L 的醚磺隆降解 43.2%。Hang 等[36]从降解菌 Hansschlegelia zhihuaiae S113 菌株中成功克隆了编码酯酶的基因 sulE,发现该基因的表达产物对多种磺酰脲类除草剂具有降解能力。
然而,目前已发现或报道的有关烟嘧磺隆微生物降解的基因仍较少。周珊[31]74-75通过对能够降解烟嘧磺隆的 O. psychrotolerans LAM-WHM-ZC 菌株进行全基因组测序,结合基因分析以及蛋白质数据库的功能注释,并进行重组蛋白的表达后,最终明确了编码酯酶的基因 e3 是菌株产生降解能力的功能基因。宋金龙[32]78-79从黄篮状菌 LZMl 菌株中纯化得到黄素单加氧酶,该酶可促使烟嘧磺隆的磺酰脲桥断裂,并明确了编码该降解酶的基因为 fmo。Kang 等[37]初步从 B. subtilis YB1 菌株粗酶液中获得了 3 个降解酶 (锰 ABC 转运蛋白、植物过氧化氢酶 1 和乙偶姻脱氢酶 E1) ,并克隆得到了编码降解酶的基因 (G1、G2 和 G3) ,但 3 个降解酶基因的表达产物是否对烟嘧磺隆具有降解能力还有待进一步验证。
6 存在问题与展望微生物降解技术是消除农药残留及保障农产品安全的有效途径之一,近年来,关于农药污染的微生物降解与修复受到了研究者的普遍关注。虽然针对磺酰脲类除草剂的微生物降解已有很多研究,但大部分都是关于降解菌的分离、降解特性和降解途径方面的报道,而从分子生物学水平研究微生物的降解基因以及从酶学角度研究蛋白性质的工作还较少,并且多数研究仍停留在实验室阶段,尚未进入工程示范阶段,更未形成产业化规模。因此该领域今后的研究工作应主要从以下几方面展开。
6.1 降解复合菌系培养以往有关磺酰脲类除草剂的微生物降解研究主要侧重于采用单一菌株进行纯培养,但单一菌株通常不具备生物降解所需的全部酶,并且在降解过程中会伴随中间产物的积累,不能够将目标化合物完全矿化。苏少泉[30]指出,在土壤微生物的作用下,烟嘧磺隆最终可被矿化为二氧化碳。然而众多单一菌株对烟嘧磺隆的降解并不能够使药剂彻底矿化[20-21, 24, 27, 31]。在自然环境中,农药残留往往存在于非常复杂的环境介质中,单一菌株即使在实验室内降解活性再高,投入到复杂的环境后也可能因无法生存而不能起到降解作用。而复合菌系的培养可通过微生物之间的群体作用和协同作用,经过多步反应以实现将目标化合物彻底矿化,并且能够抵抗生物降解过程中产生的有毒代谢产物[40]。
6.2 降解微生物的环境生态学研究将降解微生物接种到被农药污染的环境后,菌株能否适应复杂的环境不仅与外界条件有关,还涉及到与其他土著微生物之间的关系。一方面,接种到被农药污染环境中的降解微生物有可能受到土著微生物的影响 (如其他微生物的拮抗作用) 而不能够生长,因而也就不能成为优势菌株,从而失去对烟嘧磺隆的降解作用;另一方面,接种到环境中的降解微生物也可能会对土著微生物群落的多样性造成影响。降解微生物的生物安全性是其能够释放及应用于环境中的前提条件,因此,开展此方面的研究对深入了解添加的降解微生物与环境微生物的生态关系具有重要意义。
6.3 微生物降解基因的筛选目前关于微生物对磺酰脲类除草剂降解基因的研究仍较少,尤其是针对烟嘧磺隆降解基因的研究更少,这方面的研究工作有待加强。根据获得的烟嘧磺隆降解基因构建多功能的基因工程菌,为烟嘧磺隆污染环境的生物修复以及其生产厂化工废水的生物处理提供了新的思路。同时,降解基因的获得不仅丰富了基因资源库,而且在消除残留药害以及抗性转基因作物培育中均具有非常重要的理论和应用价值。
6.4 降解酶制剂的研究、开发与应用利用定点突变及随机突变等技术,对磺酰脲类除草剂的降解酶编码基因进行分子改造,构建突变体库,可筛选出降解性能更好的突变体基因[32]78-79。此外,将得到的降解酶开发成高效的酶制剂更有利于药剂残留污染的去除。降解酶制剂在田间的实际应用有待于进一步研究。
| [1] | ENCISO J, NELSON S D, PEREA H, et al. Impact of residue management and subsurface drainage on non-point source pollution in the Arroyo Colorado[J]. Sustain Water Qual Ecol, 2014, 3-4 :25–32. doi:10.1016/j.swaqe.2014.11.002 |
| [2] | SABADIE J. Nicosulfuron: alcoholysis, chemical hydrolysis, and degradation on various minerals[J]. J Agric Food Chem, 2002, 50 (3):526–531. doi:10.1021/jf010873s |
| [3] | DE LAFONTAINE Y, BEAUVAIS C, CESSNA A J, et al. Sulfonylurea herbicides in an agricultural catchment basin and its adjacent wetland in the St. Lawrence River basin[J]. Sci Total Environ, 2014, 479-480 :1–10. doi:10.1016/j.scitotenv.2014.01.094 |
| [4] |
磺酰脲类和咪唑啉酮类除草剂全球市场概述[DB/OL].中国农药网,[2014-01-15]. http://www.agrichem.cn/news/2014/1/15/201411510334746965.shtml
Overview the global market of sulfonylurea and imidazoline ketones herbicides[DB/OL]. Chinese Pesticide Network,[2014-01-15]. http://www.agrichem.cn/news/2014/1/15/201411510334746965.shtml. |
| [5] | BOURI M, GURAU M, SALGHI R, et al. Ionic liquids supported on magnetic nanoparticles as a sorbent preconcentration material for sulfonylurea herbicides prior to their determination by capillary liquid chromatography[J]. Anal Bioanal Chem, 2012, 404 (5):1529–1538. doi:10.1007/s00216-012-6221-2 |
| [6] | TRIGO C, SPOKAS K A, COX L, et al. Influence of soil biochar aging on sorption of the herbicides MCPA, nicosulfuron, terbuthylazine, indaziflam, and fluoroethyldiaminotriazine[J]. J Agric Food Chem, 2014, 62 (45):10855–10860. doi:10.1021/jf5034398 |
| [7] | REGITANO J B, KOSKINEN W C. Characterization of nicosulfuron availability in aged soils[J]. J Agric Food Chem, 2008, 56 (14):5801–5805. doi:10.1021/jf800753p |
| [8] |
张伟, 王进军, 张忠明, 等. 烟嘧磺隆在土壤中的吸附及与土壤性质的相关性研究[J]. 农药学学报, 2006,8 (3):265–271.
ZHANG W, WANG J J, ZHANG Z M, et al. Adsorption of nicosulfuron on soils and its correlation with soil properties[J]. Chin J Pestic Sci, 2006, 8 (3):265–271. |
| [9] | YONG Y C, ZHONG J J. Recent advances in biodegradation in China: new microorganisms and pathways, biodegradation engineering, and bioenergy from pollutant biodegradation[J]. Process Biochem, 2010, 45 (12):1937–1943. doi:10.1016/j.procbio.2010.04.009 |
| [10] |
霍静倩, 许文超, 康占海, 等. 50% 烟嘧磺隆·甲基磺草酮·氯氟吡氧乙酸异辛酯水分散粒剂防除夏玉米田杂草防效与安全性[J]. 农药, 2013,52 (5):374–376.
HUO J Q, XU W C, KANG Z H, et al. Control effect and security of nicosulfuron·mesotrione·fluroxypr-mepthyl 50% WG against weeds in summer corn field[J]. Pesticides, 2013, 52 (5):374–376. |
| [11] |
杨亚君, 刘顺, 武丽芬, 等. 可降解水体中烟嘧磺隆微生物的分离与筛选[J]. 农药学学报, 2007,9 (3):275–279.
YANG Y J, LIU S, WU L F, et al. Isolation and screening of microorganisms capable of degrading nicosulfuron in water[J]. Chin J Pestic Sci, 2007, 9 (3):275–279. |
| [12] |
蒋凡, 张伟, 张中明, 等. 烟嘧磺隆在土壤中的解吸特性及pH值对其吸附的影响[J]. 西南农业学报, 2008,21 (3):702–708.
JIANG F, ZHANG W, ZHANG Z M, et al. Desorption character of nicosulfuron and effect of pH on adsoroption of nicosulfuron in soils[J]. Southwest China J Agric Sci, 2008, 21 (3):702–708. |
| [13] | BROWN H M. Mode of action, crop selectivity, and soil relations of the sulfonylurea herbicides[J]. Pestic Sci, 1990, 29 (3):263–281. doi:10.1002/ps.v29:3 |
| [14] | SEGUIN F, DRUART J C, LE COHU R. Effects of atrazine and nicosulfuron on periphytic diatom communities in freshwater outdoor lentic mesocosms[J]. Ann Limnol-Int J Lim, 2001, 37 (1):3–8. doi:10.1051/limn/2001004 |
| [15] | BATTAGLIN W A, FURLONG E T, BURKHARDT M R, et al. Occurrence of sulfonylurea, sulfonamide, imidazolinone, and other herbicides in rivers, reservoirs and ground water in the Midwestern United States, 1998[J]. Sci Total Environ, 2000, 248 (2-3):123–133. doi:10.1016/S0048-9697(99)00536-7 |
| [16] | SIKKEMA P H, SOLTANI N, MCNAUGHTON K, et al. Broccoli, cabbage and cauliflower tolerance to sulfonylurea herbicides[J]. Crop Prot, 2006, 25 (3):225–229. doi:10.1016/j.cropro.2005.04.011 |
| [17] | GREENLAND R G. Injury to vegetable crops from herbicides applied in previous years[J]. Weed Technol, 2003, 17 (1):73–78. doi:10.1614/0890-037X(2003)017[0073:ITVCFH]2.0.CO;2 |
| [18] |
郝文波, 李丽春, 韩云, 等. 6种长效除草剂土壤残留致烟草药害症状及其致害临界值[J]. 广东农业科学, 2013,40 (9):80–82.
HAO W B, LI L C, HAN Y, et al. Study of critical concentration and symptoms in tobacco phytotoxicity caused by six soil residual herbicides[J]. Guangdong Agric Sci, 2013, 40 (9):80–82. |
| [19] |
王险峰, 关成宏, 范志伟. 磺酰脲类除草剂安全性评价[J]. 农药, 2010,49 (8):547–551.
WANG X F, GUAN C H, FAN Z W. Evaluation on safety of sulfonylurea herbicides[J]. Pesticides, 2010, 49 (8):547–551. |
| [20] | ZHAO W S, WANG C, XU L, et al. Biodegradation of nicosulfuron by a novel Alcaligenes faecalis strain ZWS11[J]. J Environ Sci, 2015, 35 :151–162. doi:10.1016/j.jes.2015.03.022 |
| [21] |
代鹏飞, 蔡天明, 汪林, 等. 一株烟嘧磺隆降解菌的分离鉴定及其降解特性与途径[J]. 环境科技, 2015,28 (4):12–17.
DAI P F, CAI T M, WANG L, et al. Isolation, identification, degradation characteristics and pathway of a nicosulfuron-degrading bacteria[J]. Environ Sci Technol, 2015, 28 (4):12–17. |
| [22] | LU X H, KANG Z H, TAO B, et al. Degradation of nicosulfuron by Bacillus subtilis YB1 and Aspergillus niger YF1[J]. Appl Biochem Microbiol, 2012, 48 (5):460–466. doi:10.1134/S0003683812050079 |
| [23] |
齐萌, 赵斌, 董金皋, 等. 烟嘧磺隆降解菌株的筛选及其降解特性初探[J]. 农药学学报, 2014,16 (3):330–336.
QI M, ZHAO B, DONG J G, et al. Isolation, identification and characterization of an Bacillus subtilis strain capable of degrading nicosulfuron[J]. Chin J Pestic Sci, 2014, 16 (3):330–336. |
| [24] | ZHANG H, MU W H, HOU Z G, et al. Biodegradation of nicosulfuron by the bacterium Serratia marcescens N80[J]. J Environ Sci Health B, 2012, 47 (3):153–160. doi:10.1080/03601234.2012.632249 |
| [25] |
齐萌, 敖兰, 商爱萍, 等. 烟嘧磺隆高效降解菌株的筛选及其降解特性研究[J]. 河北农业大学学报, 2014,37 (4):74–79.
QI M, AO L, SHANG A P, et al. The screening of the nicosulfuron-degradated strain and preliminary study on its degradation characteristics[J]. J Agric Univ Hebei, 2014, 37 (4):74–79. |
| [26] |
张国民, 张松柏, 刘勇, 等. 一株降解烟嘧磺隆光合细菌的分离鉴定及降解特性研究[J]. 环境污染与防治, 2011,33 (5):18–21.
ZHANG G M, ZHANG S B, LIU Y, et al. Isolation and identification of a nicosulfuron-degrading strain J5-2 and its degradation characteristics[J]. Environ Pollut Control, 2011, 33 (5):18–21. |
| [27] | SONG J L, GU J G, ZHAI Y, et al. Biodegradation of nicosulfuron by a Talaromyces flavus LZM1[J]. Bioresour Technol, 2013, 140 :243–248. doi:10.1016/j.biortech.2013.02.086 |
| [28] |
卫正. 烟嘧磺隆降解菌的筛选与代谢组学检测[D]. 北京: 中国农业科学院, 2014:19-20
WEI Z. Isolation and identification of nicosulfuron degrading strain and analysis of metabolomics[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014:19-20. |
| [29] | BHATTACHARJEE A K, DUREJA P. Light-induced transformation of tribenuron-methyl on glass, soil, and plant surface[J]. J Environ Sci Health B, 2002, 37 (2):131–140. doi:10.1081/PFC-120002985 |
| [30] |
苏少泉. 烟嘧磺隆在我国的开发[J]. 农药, 2003,42 (7):5–8.
SU S Q. Development of nicosulfuron in China[J]. Pesticides, 2003, 42 (7):5–8. |
| [31] |
周珊. 烟嘧磺隆降解菌的分离鉴定及降解特性研究[D]. 武汉: 华中农业大学, 2015
ZHOU S. Isolation, classification and degradation characteristics study of nicosulfuron-degrading bacteria[D]. Wuhan: Huazhong Agricultural University, 2015. |
| [32] |
宋金龙. 烟嘧磺隆降解菌黄篮状菌(Talaromyces flavus)的分离鉴定及降解机理研究[D]. 北京: 中国农业科学院, 2013
SONG J L. Isolation and identification of nicosulfuron-degradtive fungus (Talaromyces flavus) and study of degradation mechanism[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. |
| [33] | OMER C A, LENSTRA R, LITLE P J, et al. Genes for two herbicide-inducible cytochromes P-450 from Streptomyces griseolus[J]. J Bacteriol, 1990, 172 (6):3335–3345. doi:10.1128/jb.172.6.3335-3345.1990 |
| [34] |
李顺鹏, 何健, 杭宝建, 等. 噻吩磺隆水解酶基因tsmE及其应用: CN 102286501A[P]. 2011-12-21
LI S P, HE J, HANG B J, et al. Thifensulfuron-methyl hydrolase gene tsmE and its application: CN 102286501A[P]. 2011-12-21. |
| [35] | RUAN Z Y, ZHOU S, JIANG S H, et al. Isolation and characterization of a novel cinosulfuron degrading Kurthia sp. from a methanogenic microbial consortium[J]. Bioresour Technol, 2013, 147: 477-483. |
| [36] | HANG B J, HONG Q, XIE X T, et al. SulE, a sulfonylurea herbicide de-esterification esterase from Hansschlegelia zhihuaiae S113[J]. Appl Environ Microbiol, 2012, 78 (6):1962–1968. doi:10.1128/AEM.07440-11 |
| [37] | KANG Z H, REN C C, ZHANG J L, et al. Purification and cloning of nicosulfuron-degrading enzymes from Bacillus subtilis YB1[J]. Appl Biochem Microbiol, 2014, 50 (1):30–34. doi:10.1134/S0003683814010049 |
| [38] | KANG Z H, DONG J G, ZHANG J L. Optimization and characterization of nicosulfuron-degrading enzyme from Bacillus subtilis strain YB1[J]. J Integr Agric, 2012, 11 (9):1485–1492. doi:10.1016/S2095-3119(12)60148-8 |
| [39] |
赵卫松, 邱立红, 郭庆港, 等. 粪产碱杆菌ZWS11菌株对烟嘧磺隆的酶促降解特性[J]. 农药学学报, 2016,18 (4):472–480.
ZHAO W S, QIU L H, GUO Q G, et al. Enzymatic degradation characteristics of nicosulfuron by Alcaligenes faecalis ZWS11[J]. Chin J Pestic Sci, 2016, 18 (4):472–480. |
| [40] |
陈坚.
环境生物技术[M]. 北京: 中国轻工业出版社, 1999 : 279 -319.
CHEN J. Environmental biotechnology[M]. Beijing: China Light Industry Press, 1999 : 279 -319. |
 2016, Vol. 18
2016, Vol. 18


