吩嗪-1-羧酸 (phenazine-1-carboxylic acid,PCA,结构式见 Scheme 1) 最早是在染料合成中被发现的,随后作为染料中间体或滤色试剂被广泛研究[1-2]。直到 19 世纪 50 年代,科学家从链霉菌 Streptomyces chromogenus sp.和极毛杆菌 Pseudomonads fluorescens 等微生物代谢物中也分离提取到了吩嗪-1-羧酸,并发现其具有抗结核菌、抑制海藻生长等多种生物活性[3-4]。随后的研究发现,吩嗪-1-羧酸作为一个重要的微生物代谢产物在假单胞菌属 (Pseudomonads) 和链霉菌属 (Streptomycetes) 等微生物分泌物中广泛存在,并具有广谱的医用杀菌活性以及抗肺癌和白血病活性[5-7]。

|
Scheme 1 |
1996 年,上海交通大学许煜泉团队从上海郊区土壤中分离获得的假单胞菌株 M18 (Pseudomonassp.)的分泌物中发现了具有强烈农用抑菌活性的物质,其中之一经鉴定为吩嗪-1-羧酸[8]。研究发现,吩嗪-1-羧酸结构比较稳定,对水稻纹枯病、西瓜枯萎病、辣椒疫病、小麦全蚀病、西瓜炭疽病和油菜菌核病等病原菌具有广谱性农用抗菌活性[9-12],对人畜和环境无害,是研发绿色农药的理想化合物。2004 年经国家农药定名委员会正式定名为申嗪霉素 (shenqinmycin),并已由上海农乐生公司登记用于防治水稻纹枯病[13-16]。药效研究[17]表明:1.0% 申嗪霉素悬浮剂施药 1 d 后对水稻纹枯病菌的 EC50 值为 0.59 μg/mL,田间使用申嗪霉素质量浓度在 1.61~3.23 μg/mL 之间时,防效可达 73.88%,药效可持续 20 d。申嗪霉素抑制油菜菌核病菌 Sclerotinia sclerotiorum 51 个菌株菌丝生长的平均 EC50 值为 (3.31 ± 0.77) μg/mL,并且与常规杀菌剂多菌灵及菌核净无交互抗性关系[12]。随着申嗪霉素的推广应用,关于其对不同植物病原菌的抑菌活性研究也在不断展开,相信申嗪霉素将在更多的植物病原菌防治中发挥重要的作用。
由于吩嗪-1-羧酸的用途越来越广泛,关于其合成方法的研究也备受关注。吩嗪-1-羧酸的合成方法主要有两大类:一类是微生物发酵合成法。即利用经济有效的工程菌进行发酵,再从发酵液中分离提取出吩嗪-1-羧酸。该方法绿色环保,目前吩嗪-1-羧酸的产业化生产多采用此方法,但生产成本较高,工艺要求严格,对产业化发展也有所限制。另一类是化学合成法。由于吩嗪-1-羧酸的结构较为简单,化学合成法在生产成本和大规模产业化上都具有微生物发酵法不可比拟的优势,但要开发出一条绿色环保、经济高效具有产业化价值的全合成方法,仍有很长的路要走,因此,科学家们针对吩嗪-1-羧酸的全合成开展了一系列研究工作。鉴于目前尚未见关于吩嗪-1-羧酸合成的综述报道,本文拟就吩嗪-1-羧酸的合成研究进展进行综述。
1 吩嗪-1-羧酸的微生物发酵合成法吩嗪-1-羧酸广泛存在于假单胞菌属 (Pseudomonads)[18-19] 和链霉菌属 (Streptomycetes)[9, 13]等微生物的分泌物中,但在这些野生型菌株中吩嗪-1-羧酸的发酵效价仅为 0.2 g/L 左右,远达不到产业化生产的要求。因此,科学家们开展了吩嗪-1-羧酸生物合成机理及其调控机理的研究,并在此基础上对相关菌株进行了遗传和代谢改造,以期提高菌株的发酵效价[16]。近年来获得的 M18 衍生菌株 M18G,其吩嗪-1-羧酸的发酵效价已提高至 1.5~1.7 g/L[20]。许煜泉课题组在该领域进行了长期有效的研究[20-24],他们通过一种利用工程菌株 M18G 携带质粒 pME6032PHz 生产吩嗪-1-羧酸的方法,使吩嗪-1-羧酸的发酵效价提高到了 5.7~6.6 g/L 的水平[25]。
关于吩嗪-1-羧酸的生物合成机理,研究认为,莽草酸途径的终产物分支酸是吩嗪-1-羧酸生物合成的前体。在甲酸酯合酶 (PhzE) 的催化下,分支酸经脱氧、氨化生成 2-氨基脱氧分支酸 (ADIC),ADIC 再通过 PhzD 酶催化生成 2,3-二氢-3-羟基邻氨基苯甲酸 (DHHA);然后在 PhzF、PhzA、PhzB 等酶的催化下,经双键异构化、脱水环合以及氧化脱氢、脱 CO2 等过程,将 DHHA 转化为 5-氢-吩嗪-1-羧酸;再于 FMN-吡哆胺氧化酶 (PhzG) 催化下,生成 5,10-二氢-吩嗪-1-羧酸,最后经还原性电子穿梭形成吩嗪-1-羧酸 (PCA) [26-27]。如 Scheme 2 所示。
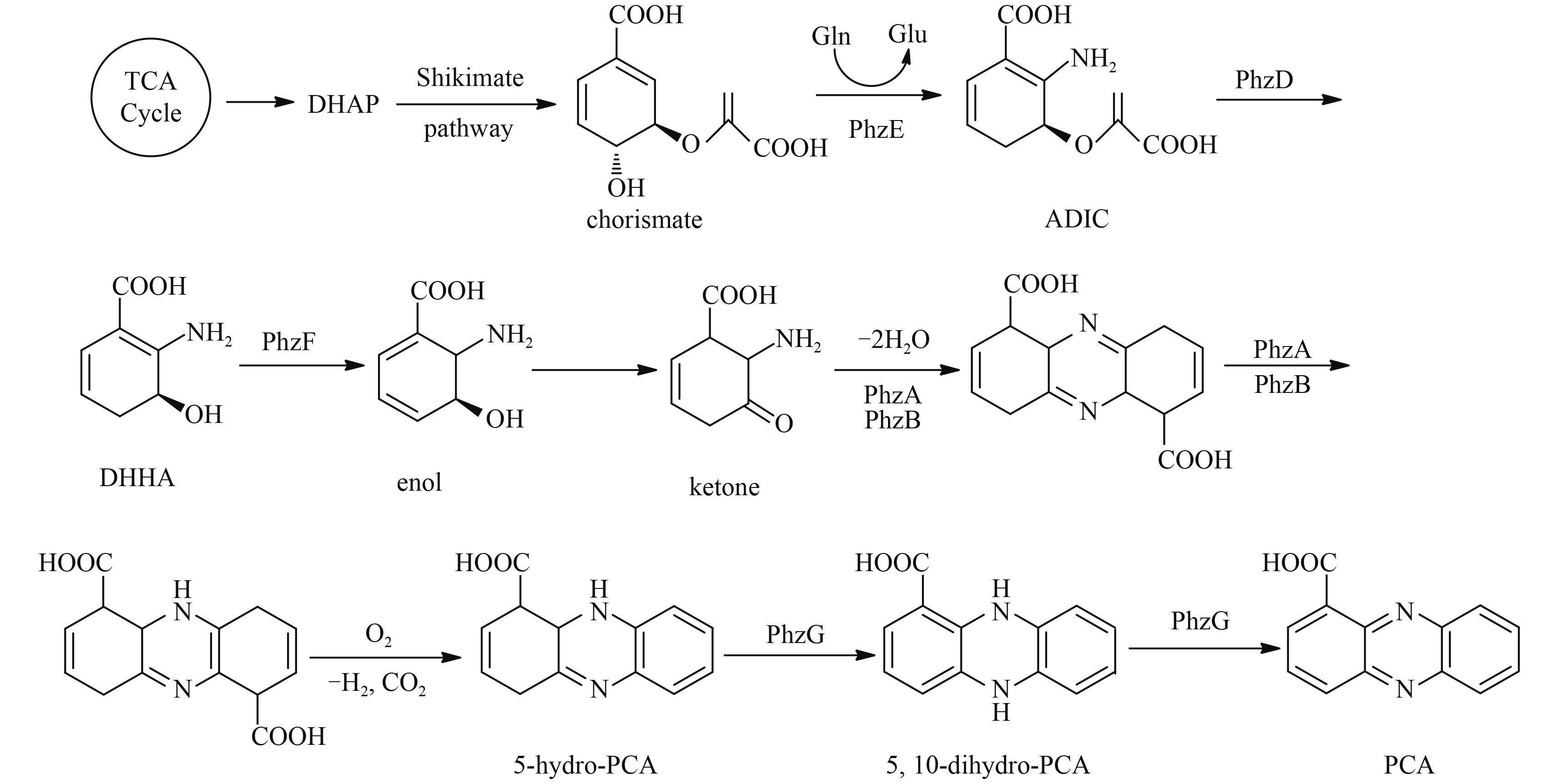
|
Scheme 2 |
2 吩嗪-1-羧酸及类似物的化学全合成法 2.1 Kogl 和 Postowsky 合成法
1930 年,Kogl 和 Postowsky 以邻氨基苯甲酸和硝基苯为原料,在碱性条件下,经过高温脱水环合,再经酸化、纯化等后处理过程,首次合成并发现了吩嗪-1-羧酸 (Scheme 3),但未报道其收率[1]。1982 年,欧进国等就其反应条件和纯化方法进行了改进,获得了光谱纯的产品,收率 6.1%[2]。该方法原料简单易得,只有一步反应,但是副反应多,产率低,不易纯化。

|
Scheme 3 |
2.2 Clemo 合成法
1934 年,Clemo 等以 1-甲基-2,3-环己二酮和邻苯二胺为原料,经脱水环合、碘氧化脱氢及氧化 3 步反应合成了吩嗪-1-羧酸,总收率为 14.5%[28] (Scheme 4)。Clemo 合成法较 Kogl 和 Postowsky 合成法在总收率上有较大提高,但是在碘氧化脱氢反应中需要用到大量的碘,以及在最后一步甲基氧化成羧基的过程收率较低,且需要用到铬酸,容易污染环境。
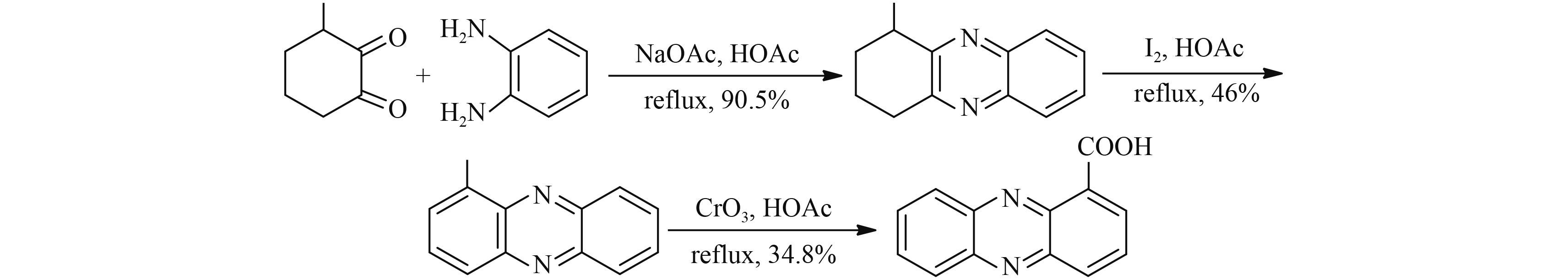
|
Scheme 4 |
1987 年,Rewcastle 等[29] 在 Clemo 合成法的基础上,设计并报道了以 1,2-环己二酮和 2,3-二氨基苯甲酸为原料,经环合、催化脱氢两步反应制得 4-甲基 (或甲氧基) 吩嗪-1-羧酸,总收率为 27.7% (Scheme 5)。该方法中中间体取代 2,3-二氨基苯甲酸价格较为昂贵,难以保存,需现制现用,并且对环境有一定的危害性;同时,该反应还需要用到大量的贵重金属钯作为催化剂,故成本较高。

|
Scheme 5 |
2.3 Vivian 合成法
1955 年,Vivian 等[30] 报道了以 3-硝基苯胺为起始原料,经过乙酰化氨基保护,2 位硝化,脱保护,氨基重氮化、氰化,再与苯胺偶联,催化环合,最后经氰基水解,共 7 步反应合成了吩嗪-1-羧酸 (Scheme 6)。该方法路线较长,且在 2 位硝化步骤中存在硝化位置选择性问题,故 2 位硝化产物收率很低,只有 12.6%。
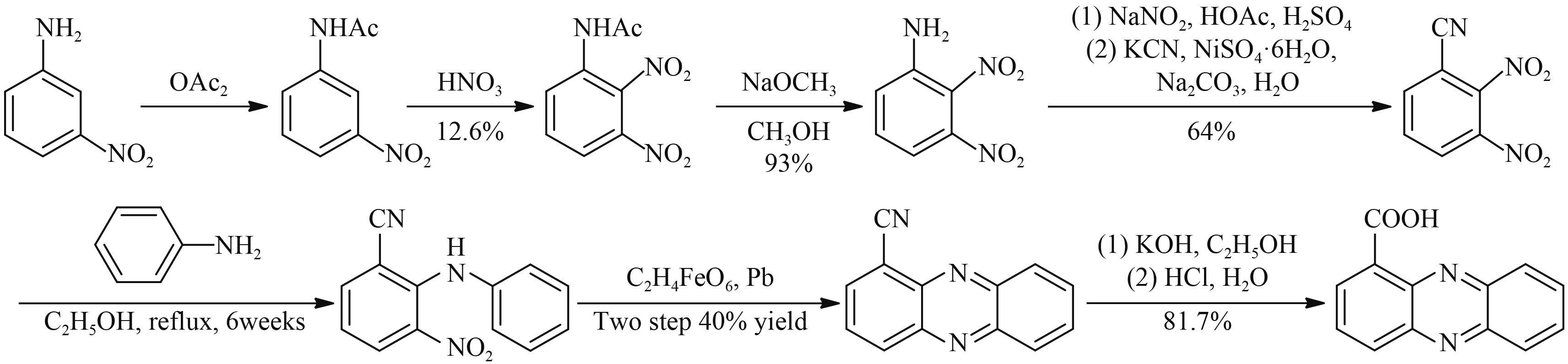
|
Scheme 6 |
2.4 Challand 合成法
1970 年,Challand 等[31] 报道以 2-溴-3-硝基苯甲酸酯为原料,与芳胺发生 Jourdan-Ullmann 偶联反应,然后经还原环化合成了吩嗪-1-羧酸的类似物 Griseoluteic acid (Scheme 7),总收率 64%。因为是快报通讯,作者未在论文中详述其具体反应过程。

|
Scheme 7 |
1987 年,Rewcastle 等[29] 针对上述方法做了进一步改进,直接以 2-溴-3-硝基苯甲酸为原料,与苯胺发生 Jourdan-Ullmann 偶联反应,再经 NaBH4 在碱性条件下还原环合合成吩嗪-1-羧酸,总收率达 65.5%。他们还发现,用邻氟苯胺替代苯胺同样可以合成吩嗪-1-羧酸 (Scheme 8)。但该方法中所用原料 2-溴-3-硝基苯甲酸价格昂贵,且产物需要经柱层析分离;在第 2 步反应中,会存在硝基被还原为氨基的副产物,影响产物的分离纯化,难以获得高收率且较高纯度的产品。
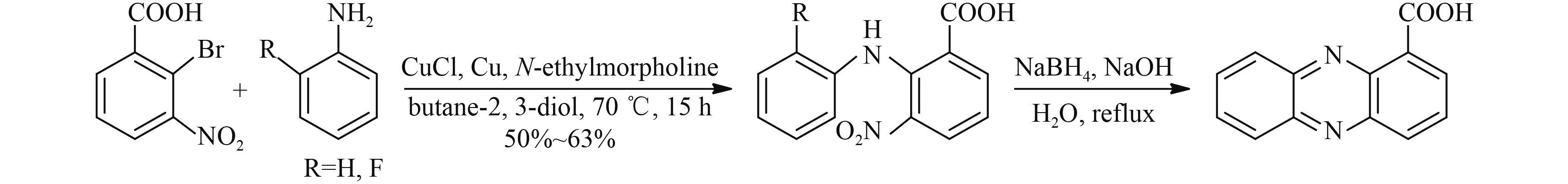
|
Scheme 8 |
2013 年,李雨等[32] 对该工艺路线进行了更进一步的改进和反应条件的优化,用 2-氯-3-硝基苯甲酸替代 2-溴-3-硝基苯甲酸作为起始原料,经偶联和环合两步反应得到目标化合物 (Scheme 9),收率高达 82.8%,反应条件更加温和,且成本有所降低。但 2-氯-3-硝基苯甲酸价格仍较为昂贵,并且市场上没有规模化供应,因此目前仅适合于实验室合成使用。

|
Scheme 9 |
在 Challand 合成法中,起始原料 2-卤代-3-硝基苯甲酸价格昂贵且不易得,因此,其成了制约该路线产业化发展的关键因素[33]。为解决此问题,人们又对 2-溴-3-硝基苯甲酸的合成进行了研究,主要合成方法如下。
2.4.1 以 3-硝基苯胺为原料合成法该方法以 3-硝基苯胺为原料,经乙酰基保护、溴化、去保护、重氮化、氰化及水解反应制得 2-溴-3-硝基苯甲酸,此方法反应步骤长,溴化选择性不高,收率只有 21%,且需要用到剧毒品氰化钾,合成 2-溴-3-硝基苯甲酸的总收率仅为 8.6%[30] (Scheme 10)。
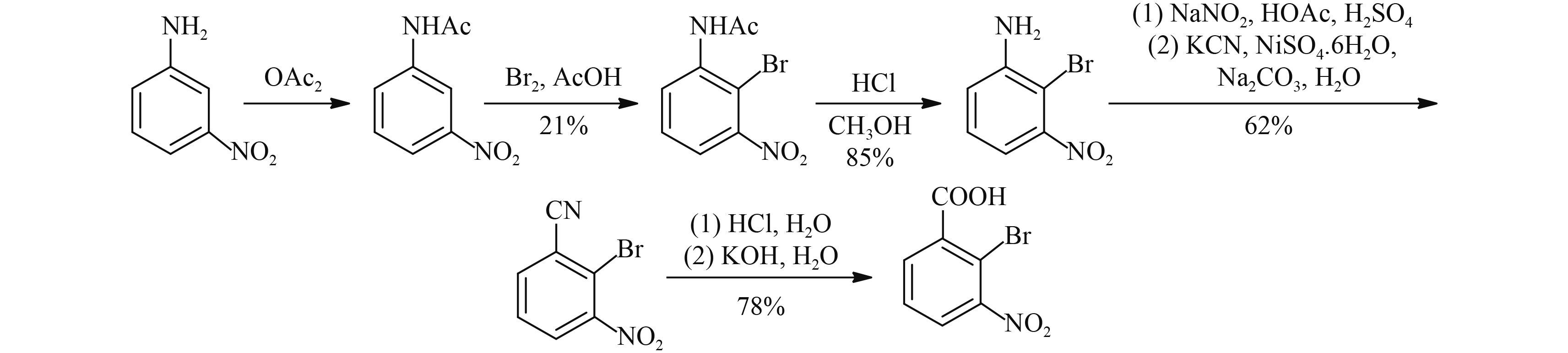
|
Scheme 10 |
2.4.2 以 2-硝基苯胺为原料合成法
2014 年,李宗成等[33] 针对以 3-硝基苯胺为原料合成 2-溴-3-硝基苯甲酸中存在的问题,在 Rewcastle 等的研究基础上[29],提出了一种新的合成方法:以 2-硝基苯胺为起始原料,先与三氯乙醛、盐酸羟胺等反应合成靛红,然后经双氧水氧化,氨基重氮化、溴化亚铜溴代 4 步反应合成了 2-溴-3-硝基苯甲酸,总收率为 50.2% (Scheme 11)。该方法在反应过程中需使用大量酸、碱,废水量大,而且溴化步骤中采用溴化亚铜为溴化试剂,带来了铜的回收以及容易产生重金属污染等问题,因此该方法目前仅适用于实验室合成 2-溴-3-硝基苯甲酸。
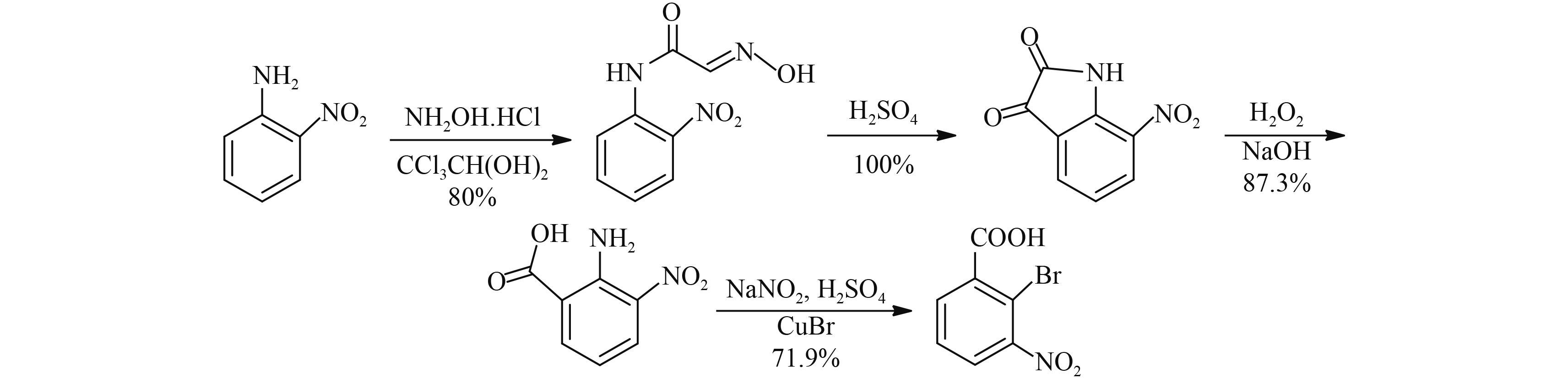
|
Scheme 11 |
2.5 以 2,3-二氨基甲苯为起始原料合成吩嗪-1-羧酸
2012 年,朱红军等[34] 报道了以 2,3-二氨基甲苯为起始原料,与邻苯二酚在氮气保护下于 150~240 ℃ 的高温下脱水环合,然后在空气中发生氧化反应生成 1-甲基吩嗪,进一步与氯气在偶氮异丁腈催化下发生氯代反应,最后经水解得到吩嗪-1-羧酸,总收率最高达到 72% (Scheme 12)。该方法步骤较短,原料简单易得,总收率高,但是在 1-甲基吩嗪的合成过程中,关环和氧化都需要在 200 ℃ 以上的高温下进行,反应时间长达 20~50 h,且均为无溶剂反应,反应条件较为苛刻。而之后在甲基转化为羧基的反应过程中,虽然氯气价格低廉,但会产生大量酸性废水。 2014 年,他们又针对由 1-甲基吩嗪转化为吩嗪-1-羧酸的过程进行了改进[35],将 1-甲基吩嗪与 N-溴代琥珀酰亚胺 (NBS) 在过氧苯甲酰催化下发生溴代反应,生成 1-溴甲基吩嗪,再经水解得到 1-羟甲基吩嗪,最后经氧化得到吩嗪-1-羧酸,总收率最高达到 92% 以上 (Scheme 13)。NBS 单溴代虽然大大减少了酸性废水,但是成本较高。
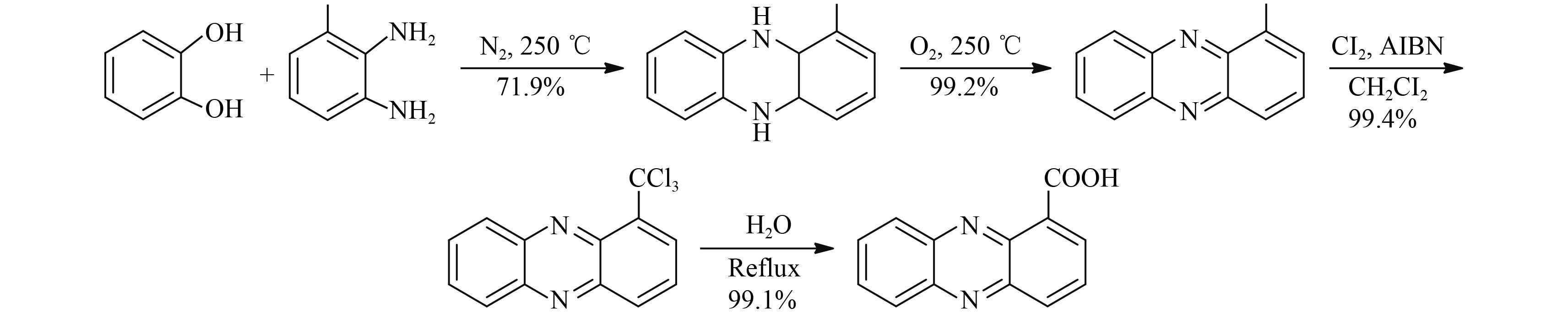
|
Scheme 12 |
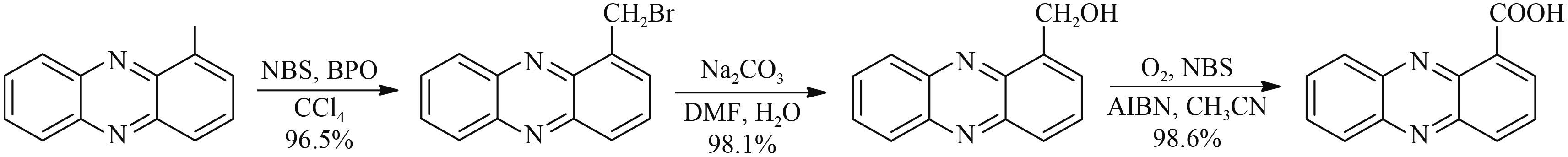
|
Scheme 13 |
3 小结与展望
综上所述,吩嗪-1-羧酸具有广谱的杀菌及抗肺癌和抗白血病活性,尤其对农业病害水稻纹枯病、西瓜枯萎病、辣椒疫病、小麦全蚀病、西瓜炭疽病和油菜菌核病等病原菌表现出优良的抗菌活性,并且对人畜和环境无害,已获准登记用于防治水稻纹枯病。其合成方法的研究也一直备受关注。目前,吩嗪-1-羧酸的合成方法主要有两大类:一类是微生物发酵合成法,目前吩嗪-1-羧酸的产业化生产多采用此方法,但是该方法生产成本较高,工艺要求严格,对其规模化产业发展有所限制。另一类是化学合成法,由于吩嗪-1-羧酸的结构较为简单,化学合成法在生产成本和大规模产业化上都具有微生物发酵合成法不可比拟的优势,但是目前关于吩嗪-1-羧酸全合成的研究还都处于实验室阶段,开发出一条绿色环保、经济高效、具有产业化价值的全合成方法,仍然是一个有待解决的重要课题。
| [1] | KÖGL F, POSTOWSKY J J. Über das grüne Stoffwechselprodukt des Bacillus chlororaphis[J]. Justus Liebig's Ann Chem, 1930, 480 (1):280–297. doi:10.1002/(ISSN)1099-0690 |
| [2] |
欧进国, 陆蕴华. 滤色试剂-吩嗪-1-羧酸的制备[J]. 化学试剂, 1982,4 (1):41–43.
OU J G, LU Y H. Synthesis of α-phenazine carboxylic acid——a liquid light filter agent[J]. Chem Reag, 1982, 4 (1):41–43. |
| [3] | ISONO K, SUZUKI S, SAWAZAKI T, et al. An antibiotic produced by Streptomyces chromogenus sp.[J]. J Antibiot, 1955, 8 (1):19–21. |
| [4] | NELSON C D, TOOHEY J I. Method of controlling the growth of noxious plants: US3367765[P]. 1968-02-06. |
| [5] |
刘家峰, 郭松坡, 姜标. 海洋溴吡咯生物碱的研究进展[J]. 有机化学, 2005,25 (7):788–799.
LIU J F, GUO S P, JIANG B. Progress in the study of marine Bromopyrrole Alkaloids[J]. Chin J Org Chem, 2005, 25 (7):788–799. |
| [6] | GRIBBLE G W. Naturally occurring organohalogen compounds——a survey[J]. J Nat Prod, 1992, 55 (10):1353–1395. doi:10.1021/np50088a001 |
| [7] | PÉE K H, LIGON J M. Biosynthesis of pyrrolnitrin and other phenylpyrrolederivatives by bacteria[J]. Nat Prod Rep, 2000, 17 (2):157–164. doi:10.1039/a902138h |
| [8] | HU H B, XU Y Q, CHEN F, et al. Isolation and characterization of a new Fluorescent Pseudomonas strain that produces both phenazine 1-carboxylic acid and pyoluteorin[J]. J Microbiol Biotechnol, 2005, 15 (1):86–90. |
| [9] | THOMASHOW L S, WELLER D M. Role of a phenazine antibiotic from Pseudomonas fluorescens in biological control of Gaeumannomyces graminis var. tritici[J]. J Bacteriol, 1988, 170 (8):3499–3508. doi:10.1128/jb.170.8.3499-3508.1988 |
| [10] | DUFFY B. Combination of pencycuron and Pseudomonas fluorescens strain 2-79 for integrated control of rhizoctonia root rot and take-all of spring wheat[J]. Crop Protect, 2000, 19 (1):21–25. doi:10.1016/S0261-2194(99)00078-2 |
| [11] | LEE J Y, MOON S S, HWANG B K. Isolation and in vitro and in vivo activity against Phytophthora capsici and Colletotrichum orbiculare of phenazine-1-carboxylic acid from Pseudomonas aeruginosa strain GC-B26[J]. Pest Manag Sci, 2003, 59 (8):872–882. doi:10.1002/ps.688 |
| [12] |
郑文君, 徐曙, 周明国. 申嗪霉素对油菜菌核病菌生物学活性的初步研究[J]. 农药学学报, 2011,13 (1):28–32.
ZHENG W J, XU S, ZHOU M G. Preliminary study on biological activity of shenqinmycin against Sclerotinia sclerotiorum[J]. Chin J Pestic Sci, 2011, 13 (1):28–32. |
| [13] |
许煜泉. 绿色微生物源抗菌剂申嗪霉素(M18)[J]. 精细与专用化学品, 2004,12 (20):8–9.
XU Y Q. Green microorganism based antimicrobial: shenqinmycin (M18)[J]. Fine Spec Chem, 2004, 12 (20):8–9. |
| [14] |
温广月, 张穗, 张红艳, 等. 新型微生物源农药申嗪霉素对水稻纹枯病菌的毒力测定及田间药效[J]. 植物保护, 2008,34 (4):143–145.
WEN G Y, ZHANG S, ZHANG H Y, et al. Novel microbial pesticide shenqinmycin virulence on rice sheath blight determination and field efficacy[J]. Plant Prot, 2008, 34 (4):143–145. |
| [15] |
张红艳, 赵胜荣, 许煜泉, 等. 申嗪霉素与增效剂复配对水稻纹枯病菌防治的增效作用[J]. 上海交通大学学报(农业科学版), 2007,25 (6):556–560.
ZHANG H Y, ZHAO S R, XU Y Q, et al. Synergistic effect of the complex between shenqinmycin and synergistic on rice sheath blight (Rhizoctonia solani) disease[J]. J Shanghai Jiaotong Univ (Agric Sci Ed.), 2007, 25 (6):556–560. |
| [16] |
方运玲, 孙爽, 申阅, 等. 微生物源农药申嗪霉素的研制与应用[J]. 农药学学报, 2014,16 (4):387–393.
FANG Y L, SUN S, SHEN Y, et al. Progress on the development and application of biopesticide shenqinmycin[J]. Chin J Pestic Sci, 2014, 16 (4):387–393. |
| [17] |
张红艳. 提高申嗪霉素对水稻纹枯病的防治效果的研究[D]. 上海: 上海交通大学, 2008
ZHANG H Y. Improving congtrol effects of shenqinmycin on rice sheath blight (Rhizoctonia solani) disease[D]. Shanghai: Shanghai Jiao Tong University, 2008. |
| [18] | PIERSON Ⅲ L S, PIERSON E A. Phenazine antibiotic production in Pseudomonas aureofaciens: role in rhizosphere ecology and pathogen suppression[J]. FEMS Microbiol Lett, 1996, 136 (2):101–108. doi:10.1111/fml.1996.136.issue-2 |
| [19] | KIM K J. Phenazine 1-carboxylic acid resistance in phenazine 1-carboxylic acid producing Bacillus sp. B-6[J]. J Biochem Mol Biol, 2000, 33 (4):332–336. |
| [20] |
张云, 胡洪波, 彭华松, 等. 产PCA基因工程菌M18G反复补料分批培养研究[J]. 工业微生物, 2007,37 (2):16–20.
ZHANG Y, HU H B, PENG H S, et al. Repeated fed-batch culture condition for PCA production by genetic engineering strain M18G[J]. Ind Microbiol, 2007, 37 (2):16–20. |
| [21] |
张锋华, 许煜泉, 张雪洪. 采用响应面分析法优化吩嗪-1-羧酸的发酵条件[J]. 现代农药, 2007,6 (2):15–18.
ZHANG F H, XU Y Q, ZHANG X H. Process optimization of phenazine-1-carboxylic acid fermentation by response surface analysis[J]. Mod Agrochem, 2007, 6 (2):15–18. |
| [22] | LI Y Q, JIANG H X, DU X L, et al. Enhancement of phenazine-1-carboxylic acid production using batch and fed-batch culture of gacA inactivated Pseudomonas sp. M18G[J]. Bioresour Technol, 2010, 101 (10):3649–3656. doi:10.1016/j.biortech.2009.12.120 |
| [23] | LI Y Q, JIANG H X, XU Y Q, et al. Optimization of nutrient components for enhanced phenazine-1-carboxylic acid production by gacA-inactivated Pseudomonas sp. M18G using response surface method[J]. Appl Microbiol Biotechnol, 2008, 77 (6):1207–1217. doi:10.1007/s00253-007-1213-4 |
| [24] | SU J J, ZHOU Q, ZHANG H Y, et al. Medium optimization for phenazine-1-carboxylic acid production by a gacA qscR double mutant of Pseudomonas sp. M18 using response surface methodology[J]. Bioresour Technol, 2010, 101 (11):4089–4095. doi:10.1016/j.biortech.2009.12.143 |
| [25] | ZHOU Q, SU J J, JIANG H X, et al. Optimization of phenazine-1-carboxylic acid production by a gacA/qscR-inactivated Pseudomonas sp. M18GQ harboring pME6032Phz using response surface methodology[J]. Appl Microbiol Biotechnol, 2010, 86 (6):1761–1773. doi:10.1007/s00253-010-2464-z |
| [26] | PIERSON III L S, PIERSON E A. Metabolism and function of phenazines in bacteria: impacts on the behavior of bacteria in the environment and biotechnological processes[J]. Appl Microbiol Biotechnol, 2010, 86 (6):1659–1670. doi:10.1007/s00253-010-2509-3 |
| [27] | MAVRODI D V, BLANKENFELDT W, THOMASHOW L S. Phenazine compounds in Fluorescent Pseudomonas spp. biosynthesis and regulation[J]. Annu Rev Phytopathol, 2006, 44 :417–445. doi:10.1146/annurev.phyto.44.013106.145710 |
| [28] | CLEMO G R, MCILWAIN H. A new phenazine synthesis. The phenazhydrins. Part I[J]. J Chem Soc, 1934 :1991–1993. doi:10.1039/jr9340001991 |
| [29] | REWCASTLE G W, DENNY W A, BAGULEY B C. Potential antitumor agents. 51. Synthesis and antitumor activity of substituted phenazine-1-carboxamides[J]. J Med Chem, 1987, 30 (5):843–851. doi:10.1021/jm00388a017 |
| [30] | VIVIAN D L, HARTWELL J L, WATERMAN H C. Phenazine syntheses. IV. nitriles[J]. J Org Chem, 1955, 20 (6):797–802. doi:10.1021/jo01124a013 |
| [31] | CHALLAND S R, HERBERT R B, HOLLIMAN F G. A new phenazine synthesis. The synthesis of griseoluteic acid, griseolutein A, and methyl diacetylgriseolutein B[J]. J Chem Soc D, 1970 (21):1423–1425. doi:10.1039/c29700001423 |
| [32] |
李雨, 于圣慧, 管月, 等. 一种申嗪霉素的合成方法: CN103373967A[P]. 2013-10-30
LI Y, YU S H, GUAN Y, et al. Synthesis method of shenqinmycin: CN103373967A[P]. 2013-10-30. |
| [33] |
李宗成, 李秀芳, 谢思勉, 等. 一种制备吩嗪-1-羧酸的方法: CN104829544A[P]. 2015-08-12
LI Z C, LI X F, XIE S M, et al. Preparation method for phenazine-1-carboxylic acid: CN104829544A[P]. 2015-08-12. |
| [34] |
朱红军, 朱晓林, 何广科, 等. 一种合成申嗪霉素方法: CN103304496A[P]. 2013-09-18
ZHU H J, ZHU X L, HE G K, et al. Method for synthesizing phenazine-1-carboxylic acid: CN103304496A[P]. 2013-09-18. |
| [35] |
朱红军, 展秋英, 朱晓林, 等. 一种合成吩嗪-1-羧酸的方法: CN104045601A[P]. 2014-09-17
ZHU H J, ZHAN Q Y, ZHU X L, et al. Method for synthesizing phenazine-1-carboxylic acid: CN104045601A[P]. 2014-09-17. |
 2016, Vol. 18
2016, Vol. 18


