噻虫胺 (结构式见图式 1),化学名称为 (E)-1-(2-氯-1,3-噻唑-5-基甲基)-3-甲基-2-硝基胍,属新烟碱类杀虫剂,具有内吸性、触杀和胃毒作用,可有效防治半翅目、鞘翅目和某些鳞翅目害虫,作为高毒农药的替代品种在农业生产中的应用日益广泛[1-4]。噻虫胺的作用机制是抑制乙酰胆碱酯酶受体,从而阻碍昆虫神经系统的正常传导[5],但也可能引起哺乳动物神经行为的变化[6]。鉴于噻虫胺对蜜蜂的高毒性,法国和德国等国家已经禁止或限制其使用[7]。

|
图式 1 噻虫胺结构式 Scheme1 Structure of clothianidin |
目前,在中国已有 16 家农药企业对噻虫胺进行登记,但除日本住友公司和江苏中旗作物保护股份有限公司为正式登记外,其余均为临时登记,登记的剂型包括颗粒剂、悬浮剂和水分散粒剂的单剂及复配剂型,登记作物主要为水稻、小麦、番茄和甘蔗,防治对象主要为水稻稻飞虱、小麦蚜虫、甘蔗上的蔗螟和蔗龟以及番茄上的烟粉虱等[8]。
关于噻虫胺的检测方法主要包括液相色谱法 (HPLC)[9-11]和液相色谱-质谱法 (LC-MS)[12-13]。Chowdhury 等[4]利用 HPLC 研究了 50% 噻虫胺水分散粒剂在茶叶中的消解动态。Hou 等[14]利用 QuEChERS 方法提取,并用 PVPP (交联聚乙烯吡咯烷酮) 净化除去茶叶中的多酚,利用 UPLC-MS/MS 检测了茶叶中的噻虫胺。但有关噻虫胺在番茄中的残留消解研究还较少,Li 等[15]采用固相萃取-气相色谱-电子捕获检测器 (GC-ECD) 的方法测定了噻虫胺在番茄和土壤中的消解规律,番茄样品采用固相萃取-旋转蒸发前处理方法,以 V (石油醚) : V (丙酮) = 6 : 4 作为洗脱剂,步骤繁琐;而土壤样品采用水-乙酸乙酯直接提取,无样品净化步骤;方法定量限均为 0.01 mg/kg。本研究采用分散固相萃取净化,液相色谱-串联质谱法开展了番茄及土壤中噻虫胺的分析方法研究,简化了前处理步骤,减少了前处理时间,降低了定量限 (0.005 mg/kg)。并于 2013-2014 年在北京、山东 (大棚) 和贵州 3 地进行了噻虫胺在番茄中的残留试验,研究了其残留消解规律,以期全面准确地评价噻虫胺在番茄上使用的安全性,并为噻虫胺在番茄中最高残留限量的制定及其科学使用提供依据。
1 材料与方法 1.1 仪器与试剂Agilent 1200 液相色谱仪 (Agilent 公司,美国);API 5000 串联四极杆质谱仪和 Analysis 工作软件 (AB SCIEX 公司,美国);十万分之一天平 (Mettler Toledo 公司,瑞士);超纯水仪 (Millipore 公司,美国);涡旋混匀器 (其林贝尔仪器有限公司,海门市);高速冷冻离心机 (Thermo 公司,美国);高速匀浆机 (博朗,匈牙利)。
99.5% 噻虫胺 (clothianidin) 标准品 (德国 Dr. Ehrenstofer 公司);50% 噻虫胺水分散粒剂 (clothianidin 50% WDG,山东省联合农药工业有限公司);PSA 分散固相萃取吸附剂 (天津博纳艾杰尔公司);乙腈和乙酸 (色谱纯);无水硫酸镁 (分析纯);MilliQ 超纯水。
供试番茄品种分别为‘中蔬 4 号’ (北京试验点)、‘真优美 202’ (山东试验点) 和‘大红 1 号’ (贵州试验点)。
1.2 田间试验设计试验分别在北京、贵州贵阳和山东淄博 3 市的郊区进行,按农药残留试验准则[16]的要求设计试验小区:空白对照区、低剂量处理区、高剂量处理区和消解动态处理区。每小区面积为 15 m2,每处理重复 3 次,随机排列,处理间设保护带。
1.2.1 消解动态试验番茄消解动态按推荐高剂量的 1.5 倍 (有效成分 90 g/hm2) 于番茄果实一半大小时喷雾施药;土壤消解试验采用单独喷雾施药,施药剂量也为推荐高剂量的 1.5 倍 (有效成分 90 g/hm2);另设清水空白对照。于施药后 0、1、3、5、7、10、14、21 和 28 d 以随机多点方式采样。在试验小区内不同方向及上下不同部位采集 6 个以上 (不少于 2 kg) 番茄果实;土壤样品采样深度为 0~10 cm,每小区取样 1~2 kg,去除杂草碎石,于 -20 ℃ 保存,备用。
1.2.2 最终残留试验设 2 个施药剂量:低剂量采用推荐高剂量 (有效成分 60 g/hm2),高剂量采用推荐高剂量的 1.5 倍 (有效成分 90 g/hm2),各设 3 次施药和 4 次施药 2 个处理,施药间隔期为 7 d,分别于距离最后一次施药 1、3、7 d 时采用随机方式取样。每小区取 6 个以上 (不少于 2 kg) 的采样点,采集生长正常、无病害、成熟的番茄果实;用土壤取样器采集深度为 0~15 cm 的土壤约 1 kg。
1.3 样品前处理分别称取番茄和土壤样品各 5 g (精确至 0.01 g) 于 50 mL 离心管中,加入 10 mL 含 0.1% 乙酸的乙腈溶液,均质提取,于 5 000 r/min 下离心 5 min;准确量取 2.0 mL 上清液于预先装有 50 mg PSA 分散固相萃取吸附剂和 150 mg MgSO4 的离心管中,涡旋 2 min 后于 5 000 r/min 下离心 5 min;取上清液过 0.22 μm 滤膜,待测。
1.4 检测条件色谱条件:Waters XBridge C18 色谱柱 (2.1 mm × 150 mm,3.5 μm),柱温 40 ℃,进样体积 5 μL。流动相 A:超纯水 + 0.1% 甲酸 + 5 mmol 的乙酸铵,B:甲醇 + 0.1% 甲酸 + 5 mmol 的乙酸铵;流速为 0.2 mL/min,梯度洗脱程序见表 1。
|
|
表 1 流动相梯度洗脱条件 Table 1 Eluent gradient conditions |
质谱条件:电喷雾离子源温度 (TEM) 450 ℃;雾化气压力 137.9 kPa (20 psi);辅助气压力 137.9 kPa (20 psi);气帘气压力 137.9 kPa (20 psi);电喷雾电离正离子模式喷雾电压 (IS+) 5500 V;碰撞室入口电压 (EP):13.4 V;去簇电压 (DP) 为 72.6 V;碰撞能量 (CE) 为 19.1 V;母离子为 250.3,子离子为 132.1、169.1 和 113.1,其中定量离子对 253.3 > 132.1。
1.5 标准溶液的配制及基质标准曲线绘制准确称取 0.01 g (精确至 0.000 01 g) 噻虫胺标准品,用乙腈溶解并准确定容至 100 mL,配制成 100 mg/L 的噻虫胺标准储备液,于 4 ℃ 下避光保存。准确量取噻虫胺标准储备液 1 mL 于 100 mL 容量瓶中,用乙腈定容,配成 1 mg/L 的标准工作溶液,即用即配。
将 1 mg/mL 的噻虫胺标准溶液分别用空白番茄及土壤样品提取液稀释,配成 1、10、20、100、200 和 500 ng/mL 系列基质匹配标准溶液,按 1.4 节的条件测定。以进样质量浓度为横坐标与对应的峰面积为纵坐标绘制标准曲线。
1.6 数据处理噻虫胺消解反应动力学方程采用一级动力学方程 ct = c0e-kt 进行拟合,以距施药的采样间隔为横坐标、噻虫胺的残留浓度为纵坐标绘制消解曲线。消解半衰期按公式 t1/2 = ln2/k 计算。其中,t1/2 为消解半衰期,k 为消解速率常数,c0 为噻虫胺的初始含量,ct 为 t 时刻噻虫胺的残留含量。
1.7 风险评估根据规范残留试验中值 (STMR/STMR-P) 或最大残留限量 (MRL) 计算某种农药国家估算每日摄入量 (NEDI)[17]:
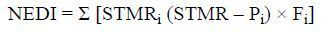
|
式中:STMRi 为农药在某一食品中的规范残留试验中值;STMR-Pi 为用加工因子校正的规范残留试验中值;Fi 为一般人群对某一食品的消费量。
计算 NEDI 时,如果没有合适的 STMR 或 STMR-P,可以使用相应的 MRL 值。
2 结果与分析 2.1 方法的线性范围、准确度及精密度本研究采用在乙腈中加入 0.1% 乙酸来提高番茄和土壤中噻虫胺的提取率;样品中的杂质采用 PSA 分散固相萃取吸附剂去除。外标法定量分析结果表明,在 1~500 ng/mL 范围内,噻虫胺的峰面积 (y) 与质量浓度 (x) 间呈线性关系,其回归方程为 y = 1.62 × 104x,相关系数 r = 0.999 2 (番茄);y = 2.23 × 104x,相关系数 r = 0.999 6 (土壤)。
从表 2 可知,在 0.005、0.01 和 0.05 mg/kg 添加水平下,噻虫胺在番茄中的平均回收率分别为 121%、120% 和 90%,相对标准偏差 (RSD) 分别为 5%、5% 和 4% (n = 5);在土壤中的平均回收率分别为 92%、91% 和 88%,RSD 分别为 5%、6% 和 4% (n = 5)。根据《农药残留试验准则》中最低检测浓度 (LOQ) 定义,番茄和土壤中噻虫胺的 LOQ 均为 0.005 mg/kg。
|
|
表 2 噻虫胺在番茄及土壤中的添加回收率和相对标准偏差 Table 2 Recoveries and relative standard deviations (RSD) for clothianidin in tomato and soil (n = 5) |
2.2 噻虫胺在番茄中的残留消解动态
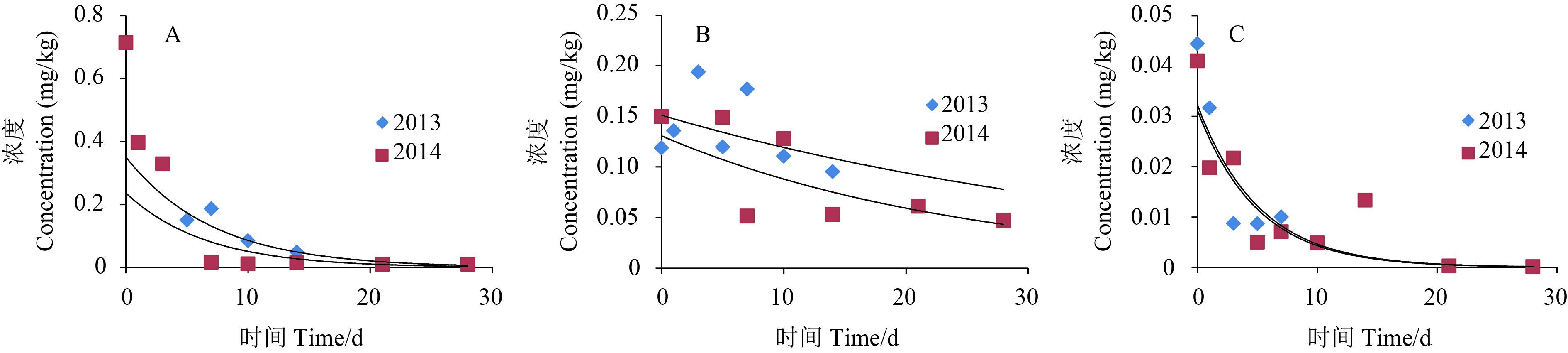
在北京、山东和贵州 3 个试验点 2013 年和 2014 年 2 年的田间试验中,番茄样品中噻虫胺的原始沉积量分别为 0.187、0.194、0.044 mg/kg 和 0.713、0.15、0.041 mg/kg。噻虫胺在番茄中的残留量与施药后间隔时间呈指数关系,消解动态符合准一级动力学或一级动力学方程回归曲线。如图 1 所示,消解动力学方程:2013 年北京试验点为 ct = 350.93e-0.14t,R2 = 0.930 5,半衰期 t1/2 = 4.9 d;山东 (大棚) 试验点为 ct = 207.8e-0.056t,R2 = 0.624 5,半衰期 t1/2 = 12.4 d;贵州试验点为 ct = 31.19e-0.199t,R2 = 0.777 5,半衰期 t1/2 = 3.5 d。2014 年北京试验点为 ct = 236.52e-0.153t,R2 = 0.653 3,半衰期 t1/2 = 4.5 d;山东 (大棚) 试验点为 ct = 130.66e-0.04t,R2 = 0.514 4,半衰期 t1/2 = 17.3 d;贵州试验点为 ct = 32.23e-0.195t,R2 = 0.842 4,半衰期 t1/2 = 3.6 d。
|
A:北京;B:山东;C:贵州。 A:Beijing; B:Shandong; C:Guizhou. 图 1 噻虫胺在番茄中的消解动态 Fig. 1 Dynamic curve of clothianidin residues in tomato |
2.3 噻虫胺在土壤中的残留消解动态
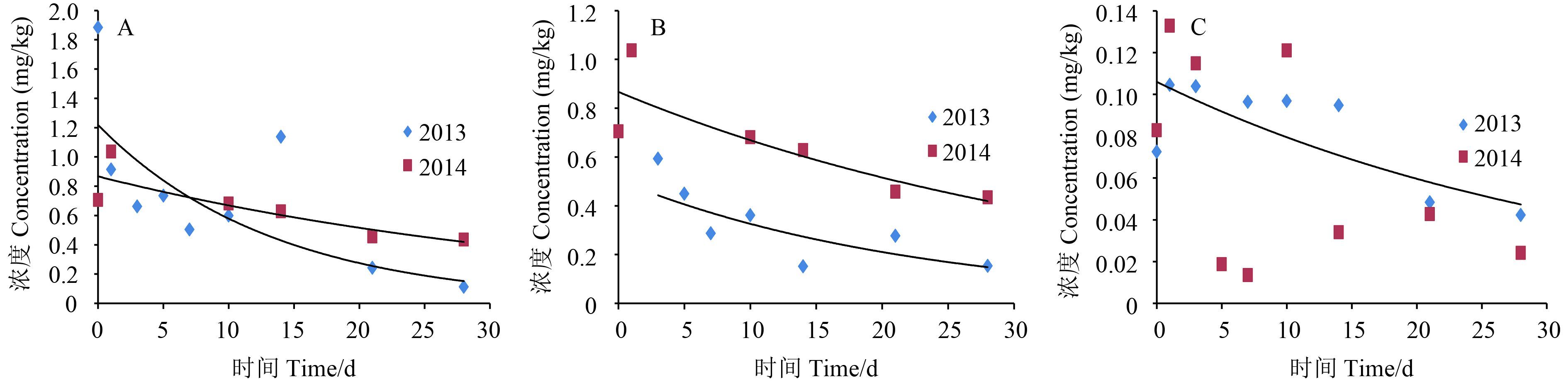
在北京、山东和贵州 3 个试验点的田间试验中,土壤中 2013 年和 2014 年噻虫胺的原始沉积量分别为 1.884、0.593、0.105 mg/kg 和 1.037、0.789、0.133 mg/kg。噻虫胺在番茄中的残留量与施药后间隔时间呈指数关系,消解动态符合准一级动力学或一级动力学方程回归曲线。如图 2 所示,消解动力学方程:2013 年北京试验点为 ct = 1 217.9e-0.074t,R2 = 0.718 3,半衰期 t1/2 = 9.4 d;山东 (大棚) 试验点为 ct = 505.04e-0.044t,R2 = 0.604 6,半衰期 t1/2 = 15.8 d;贵州试验点为 ct = 123.17e-0.037t,R2 = 0.858,半衰期 t1/2 = 18.7 d。2014 年北京试验点为 ct = 1 004.2e-0.033t,R2 = 0.951 2,半衰期 t1/2 = 21 d;山东 (大棚) 试验点为 ct = 695.73e-0.06t,R2 = 0.805 3,半衰期 t1/2 = 11.6 d;贵州试验点未拟合出消解曲线,也未得到半衰期。
|
A:北京;B:山东;C:贵州。 A:Beijing; B:Shandong; C:Guizhou. 图 2 噻虫胺在土壤中的消解动态 Fig. 2 Dynamic curve of clothianidin residues in soil |
2.4 噻虫胺在番茄和土壤中的最终残留量
目前,中国尚未制定番茄上噻虫胺的最大残留限量 (MRL) 值,日本、美国和欧盟制定的番茄上噻虫胺的 MRL 值分别为 3[18]、0.2[19] 和 0.05 mg/kg[20]。从最终残留量试验结果可以看出 (表 3):50% 噻虫胺水分散粒剂在有效成分 60 和 90 g/hm2 下施药 3~4 次,距末次施药间隔期为 1、3 和 7 d 时,所有试验点番茄中噻虫胺的最终残留量均低于日本规定的番茄中的 MRL 值 3 mg/kg;北京和贵州试验点番茄中噻虫胺的最终残留量也低于美国规定的番茄中的 MRL 值 (0.2 mg/kg),而山东试验点大棚番茄中噻虫胺最终残留量为 0.05~0.314 mg/kg,高于美国 MRL 值。在北京和山东试验点土壤中噻虫胺最终残留量分别为 0.04~0.352 和 0.182~2.06 mg/kg。
|
|
表 3 2013-2014年番茄和土壤中噻虫胺的最终残留量 Table 3 Final residue of clothianidin in tomato and soil in 2013 and 2014 |
2.5 风险评估结果
通过对国家估算每日摄入量 (NEDI) 与每人每日摄入总量 (ADI × bw,ADI 取值为 0.097 mg/(kg bw•d),bw 取值为 63 kg/bw) 进行比较,当 NEDI/ (ADI × bw) 比值低于 100% 时,认为该农药残留对一般人群健康的影响在可接受的风险水平,比值越小,风险越低[17, 21],在此基础上推荐最大残留限量 (MRL)。根据噻虫胺在中国的登记情况以及居民人均膳食结构,结合本试验得出的残留中值 0.038 mg/kg 进行风险评估。由表 4 可知:噻虫胺的风险为每人每日摄入总量 (ADI × bw) 的 3.4%。因此,推荐噻虫胺在番茄上的 MRL 值为 1 mg/kg,其风险为每人每日摄入总量 (ADI × bw) 的 4.9%。
|
|
表 4 风险评估计算表 Table 4 Risk assessment calculation table |
3 结论与讨论
噻虫胺在不同试验点番茄中消解速率差异较大,消解半衰期为 3.5~17.3 d,其中在北京和贵州番茄露地试验中消解半衰期分别为 4.5~4.9 和 3.5~3.6 d;而在山东大棚试验点番茄中的消解速率较慢,消解半衰期为 12.4~17.3 d。最终残留量的结果也表明,山东大棚条件下番茄中噻虫胺的残留量较高。这可能是由于在露地条件下,附着在番茄表面的农药受阳光、雨水等气候因子的影响较大,更易被稀释和消解。而在大棚条件下,虽然高温高湿能在一定程度上加快农药的消解,但空间相对封闭,受自然条件影响较小,因此消解较慢,这与丁悦等[22]对啶虫脒的研究结果相似。农药消解速率的快慢通常是由作物的品种、地域、气候等因素综合作用的结果。噻虫胺在不同作物上的消解半衰期也有所不同。陈雁君等[23]研究发现,噻虫胺在小白菜上消解较快,半衰期为 1.61~2.05 d,而 Chowdhury 等[4]研究发现,噻虫胺在小白菜上的消解半衰期为 4.07~4.49 d。黄莹莹[24]研究发现,噻虫胺在水稻中的消解较快,消解半衰期为 4.47~20.38 d,本研究中露地番茄中噻虫胺的消解速率与其在小白菜上的消解速率相近。
噻虫胺在不同试验点土壤中的消解速率较快,消解半衰期为 9.4~21 d,属易降解农药 (t1/2 < 30 d)[25]。本研究中,噻虫胺在北京和贵州试验点土壤中的消解半衰期分别为 9.4~21 d 和 18.7 d,而在山东大棚试验点土壤中的半衰期为 11.6~15.8 d,大棚与露地土壤中噻虫胺的消解速率相差不显著,这一现象与其在番茄果实中的消解行为有所不同。这可能与土壤类型、物化性质以及气候等因素有关。本研究中,北京试验点的土壤是潮土,pH 值为 6.8~7.2,山东试验点的土壤是壤土,pH 值为 7.94,贵州试验点的土壤是黏土,pH 值为 5.0~6.5。土壤的 pH 值与噻虫胺消解速率呈负相关性,说明噻虫胺的消解可能对 pH 值较敏感,土壤酸度越大,噻虫胺在土壤中的半衰期可能越长。
此外,由于中国尚未制定其在番茄中的限量标准,而欧盟关于噻虫胺的残留限量标准较严格,从本研究中无法获得安全间隔期。因此,根据日本的限量标准,当 50% 噻虫胺水分散粒剂以有效成分 60 g/hm2 推荐剂量在番茄生长到成熟个体一半大小时施药 3 次,施药间隔 7 d 时,推荐安全间隔期为 1 d;推荐噻虫胺在番茄上的 MRL 值为 1 mg/kg,其风险为每人每日摄入总量 (ADI × bw) 的 4.9%,在拟推荐最大残留量情况下不会对一般人群健康产生不可接受的风险。
| [1] |
李贤贤, 马晓丹, 薛明, 等. 噻虫胺等药剂对韭菜迟眼蕈蚊的致毒效应 [J]. 植物保护学报, 2014,41 (2)
:225–229.
LI X X, MA X D, XUE M, et al. Toxic effects of clothianidin and other five kinds of insecticides to Bradysia odoriphaga [J]. Acta Phytop Sinica, 2014, 41 (2) :225–229 . |
| [2] |
王钲.噻虫胺对葱蝇成虫的控制效应及在大蒜中的残留分析[D].泰安:山东农业大学,2012:7.
WANG Z.Efficacy of Clothianidin to adults of Delia antiqua (Meigen) and determination of clothianidin rsidues in garlic[D].Tai'an:Shandong Agricultural University,2012:7 |
| [3] | JESCHKE P, NAUEN R, SCHINDLER M, et al. Overview of the status and global strategy for neonicotinoids [J]. J Agric Food Chem, 2011, 59 (7) :2897–2908 . doi:10.1021/jf101303g |
| [4] | CHOWDHURY S, MUKHOPADHYAY S, BHATTACHARYYA A. Degradation dynamics of the insecticide:clothianidin (Dantop 50% WDG) in a tea field ecosystem [J]. Bull Environm Contam Tox, 2012, 89 (2) :340–343 . doi:10.1007/s00128-012-0671-2 |
| [5] | NAUEN R, EBBINGHAUS K U, SALGADO V L, et al. Thiamethoxam is a neonicotinoid precursor converted to clothianidin in insects and plants [J]. Pestic Biochem Phys, 2003, 76 (2) :55–69 . doi:10.1016/S0048-3575(03)00065-8 |
| [6] | de O I M, NUNES B V F, BARBOSA D R, et al. Effects of the neonicotinoids thiametoxam and clothianidin on in vivo dopamine release in rat striatum [J]. Toxicol Lett, 2010, 192 (3) :294–297 . doi:10.1016/j.toxlet.2009.11.005 |
| [7] | IWASA T, MOTOYAMA N, AMBROSE J T, et al. Mechanism for the differential toxicity of neonicotinoid insecticides in the honey bee,Apis mellifera [J]. Crop Prot, 2004, 23 (5) :371–378 . doi:10.1016/j.cropro.2003.08.018 |
| [8] |
中国农药信息网.农药登记数据.[DB/OL].[2016-05-07].http://www.chinapesticide.gov.cn/hysj/index.jhtml.
China Pesticide Information Network.Pesticide registration data.[DB/OL].[2016-05-07].http://www.chinapesticide.gov.cn/hysj/index.jhtml |
| [9] | WANG P, YANG X, WANG J, et al. Multi-residue method for determination of seven neonicotinoid insecticides in grains using dispersive solid-phase extraction and dispersive liquid-liquid micro-extraction by high performance liquid chromatography [J]. Food Chem, 2012, 134 (3) :1691–1698 . doi:10.1016/j.foodchem.2012.03.103 |
| [10] | TAPPARO A, GIORIO C, MARZARO M, et al. Rapid analysis of neonicotinoid insecticides in guttation drops of corn seedlings obtained from coated seeds [J]. J Environ Monit, 2011, 13 (6) :1564–1568 . doi:10.1039/c1em10085h |
| [11] |
侯如燕, 蔡荟梅, 张正竹, 等. 液相色谱法检测水果蔬菜中的烟碱类农药残留 [J]. 分析试验室, 2010,29 (2)
:59–63.
HOU R Y, CAI H M, ZHANG Z Z, et al. Determination of neonicotinoid pesticide residues in vegetables and fruits with high-performance liquid chromatography with diode-array detection [J]. Chinese J Anal Lab, 2010, 29 (2) :59–63 . |
| [12] | IWAFUNE T, OGINO T, WATANABE E. Water-based extraction and liquid chromatography-tandem mass spectrometry analysis of neonicotinoid insecticides and their metabolites in green pepper/tomato samples [J]. J Agric Food Chem, 2014, 62 (13) :2790–2796 . doi:10.1021/jf405311y |
| [13] | RAHMAN M M, FARHA W, ABD E A M, et al. Dynamic behaviour and residual pattern of thiamethoxam and its metabolite clothianidin in Swiss chard using liquid chromatography-tandem mass spectrometry [J]. Food Chem, 2015, 174 :248–255 . doi:10.1016/j.foodchem.2014.11.052 |
| [14] | HOU R Y, JIAO W T, XIAO Y, et al. Novel use of PVPP in a modified QuEChERS extraction method for UPLC-MS/MS analysis of neonicotinoid insecticides in tea matrices [J]. Anal Methods, 2015, 7 (13) :5521–5529 . doi:10.1039/C5AY00957J |
| [15] | LI L, JIANG G Q, LIU C Y, et al. Clothianidin dissipation in tomato and soil,and distribution in tomato peel and flesh [J]. Food Control, 2012, 25 (1) :265–269 . doi:10.1016/j.foodcont.2011.10.046 |
| [16] |
农药残留试验准则:NY/T 788-2004[S].北京:中国农业出版社,2004.
Guide-lines for pesticide residue testing:NY/T 788-2004[S].Beijing:China Agriculture Press,2004. |
| [17] |
简秋, 单炜力, 段丽芳, 等. 我国农产品及食品中农药最大残留限量制定指导原则 [J]. 农药科学与管理, 2012,33 (6)
:24–27.
JIAN Q, SHAN W L, DUAN L F, et al. Guidelines for the formulation of pesticide residues in agricultural products and foods in China [J]. Pestic Sci Admin, 2012, 33 (6) :24–27 . |
| [18] | The Japan Food Chemical Research Foundation.Clothianidin.[DB/OL].[2016-04-30].http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=20000. |
| [19] | Global MRL Database.Clothianidin.[DB/OL].[2016-04-30].https://www.globalmrl.com/db#query/2024C1A7843F4C5D4D9698077513CB38EC5000FC2F13123D8198D737837EEEBCE38E/1/50 |
| [20] | EU-Pesticides database.Clothianidin.[DB/OL].[2016-04-30].http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=pesticide.residre.CurrentMRL&language=EN |
| [21] | TANAKA T. Reproductive and neurobehavioral effects of clothianidin administered to mice in the diet [J]. Birth Defects Research Part B:Developmental and Reproductive Toxicology, 2012, 95 (2) :151–159 . doi:10.1002/bdrb.20349 |
| [22] |
丁悦, 孙星, 汪佳蕾, 等. 露地和大棚条件下啶虫脒在黄瓜和土壤中的残留及消解动态 [J]. 农药学学报, 2014,16 (1)
:110–114.
DING Y, SUN X, WANG J L, et al. Residue and dissipation of acetamiprid in cucumber and soil under open field and greenhouse conditions [J]. Chin J Pestic Sci, 2014, 16 (1) :110–114 . |
| [23] |
陈雁君, 王艳, 公茂礼, 等. 新型杀虫剂噻虫胺在小白菜上的残留动态研究 [J]. 分析试验室, 2008,27 (Z2)
:230–232.
CHEN Y J, WANG Y, GONG M L, et al. Study on residue dynamics of new pesticides clothianidin on pakchoi [J]. Chinese J Anal Lab, 2008, 27 (Z2) :230–232 . |
| [24] |
黄莹莹.噻虫胺在稻田中的残留消解和光解研究[D].长沙:湖南农业大学,2014:46.
HUANG Y Y.The residue degradation of clothianidin in paddy field and its photodegradation[D].Changsha:Hunan Agricultural University,2014:46 |
| [25] |
刘丰茂.
农药质量与残留实用检测技术[M]. 北京: 化学工业出版社, 2011 : 213 .
LIU F M. Practical analytical technology of pesticide and residue[M]. Beijing: China Agriculture Press, 2011 : 213 . |
 2016, Vol. 18
2016, Vol. 18


