2. 山东农业大学化学与材料科学学院, 山东 泰安 271018;
3. 山东省农业科学院农业质量标准与检测技术研究所/山东省食品质量与安全检测技术重点实验室, 济南 250100
2. College of Chemistry and Materials Science, Shandong Agricultural University, Tai’an 271018, Shandong Province, China;
3. Institute of Agricultural Quality Standards and Testing Technology Research, Shandong Academy of Agricultural Sciences/Key Laboratory of Test Technology on Food Quality and Safety of Shandong Province, Ji'nan 250100, China
硝磺草酮 (mesotrione,图式1) 为三酮类除草剂,是一种能够抑制杂草体内羟基苯基丙酮酸酯双加氧酶 (HPPD) 的苗前、苗后广谱、选择性除草剂,可以有效防除玉米田主要的阔叶杂草和一些禾本科杂草,已在中国得到广泛应用[1-3],但其大规模的使用或滥用也会对农产品质量安全、后茬作物及其他非靶标生物带来潜在的危害[4-5] ,美国俄亥俄州、加拿大安大略省以及中国都曾出现过硝磺草酮对玉米后茬作物如四季豆、大白菜及向日葵等产生药害的问题,导致作物减产,最严重的减产高达50%[6-7]。目前中国已制定硝磺草酮在玉米中的最大残留限量 (MRL) 值为0.01 mg/kg[8],欧盟规定了硝磺草酮及其代谢物4-甲砜基-2-硝基苯甲酸 (4-(methylsulfonyl)-2-nitrobenzoic acid,MNBA) 的 MRL 值为0.05 mg/kg[9]。微生物的分解作用是硝磺草酮降解的主要途径之一,其降解产物主要为 MNBA和2-氨基-4-甲砜基苯甲酸 (2-amino-4-(methylsulfonyl) benzoic acid,AMBA)(图式1)[10],部分代谢物表现出比母体化合物更高的毒性和环境持久性[11]。Bonnet 等[12]的研究表明,AMBA 毒性高于硝磺草酮,可能会严重干扰土壤生物群落结构,影响土壤功能;而 MNBA 毒性低于硝磺草酮。因此,硝磺草酮及其代谢物在土壤中的残留行为是其环境评价的主要内容。但目前尚未见同时测定土壤中硝磺草酮及其代谢物残留方法的研究报道。
|
图式 1 硝磺草酮 (A) 及其代谢物 MNBA (B)、AMBA (C) 的化学结构式 Scheme1 Molecular structures of mesotrione (A), MNBA (B) and AMBA (C) |
硝磺草酮、AMBA 和 MNBA 均易溶于水,具有难挥发和热不稳定性,无法进行气相色谱分析。目前,对硝磺草酮的分析多采用高效液相色谱法 (HPLC) 和超高效液相色谱-质谱联用法 (UPLC-MS/MS)。其中,HPLC 选择性差,灵敏度低[13-15],而选择 UPLC-MS/MS 测定硝磺草酮的灵敏度和准确度会更高,但现有的报道仅测定了硝磺草酮,未涉及其代谢物[16, 17]。因此,本研究以土壤为研究对象,通过对提取溶液、固相萃取柱净化条件以及色谱-质谱参数等进行优化,建立了土壤中硝磺草酮及其代谢物 (AMBA、MNBA) 残留的 UPLC-MS/MS 分析方法。
1 材料与方法 1.1 仪器及试剂LC-30A 超高效液相色谱系统 (日本岛津公司);AB SCIEX Triple Quad 4500三重四极杆串联质谱仪及 Analyst 工作站 (美国 AB SCIEX 公司);IKA MS3漩涡混合器 (德国 IKA 公司); KQ500E 型超声波清洗器 (昆山市超声仪器有限公司); JNC N-EVAPTM112型氮吹仪 (美国 Organomation 公司);Sigma 3K30高速冷冻离心机 (德国 Sigma 公司);Milli-Q A10超纯水系统 (美国 Millipore 公司)。
99% 硝磺草酮 (mesotrione) 和98% MNBA 标准品 (德国 Dr. Ehrenstorfer 公司);94% AMBA 标准品 (美国 Matrix Scientific 公司);Cleanert PAX 60 mg/3 mL Cartridge 固相萃取小柱 (天津博纳艾杰尔科技有限公司);乙酸钠和氨水均为分析纯;甲酸、甲醇和乙腈均为色谱纯。
1.2 土壤样品前处理 1.2.1 样品提取准确称取土壤样品10.0 g 于50 mL具塞塑料离心管中,加入25 mL V (乙腈):V (0.1% 氨水) = 10:90提取液,涡旋混匀后超声提取10 min,于7 000 r/min 下离心5 min,取上清液经滤纸过滤至50 mL 容量瓶中;向残渣中再加入15 mL 提取液,重复上述操作。合并两次滤液,并用提取液定容到50 mL,待净化。
1.2.2 净化将 PAX 型 SPE 阴离子交换固相萃取柱依次用3 mL 甲醇、3 mL 水活化平衡后加入25 mL 样品提取溶液,然后依次用3 mL 50 mmol/L 的乙酸钠水溶液和3 mL 甲醇淋洗,弃去淋洗液,抽至近干;用5 mL V (乙酸乙酯):V (甲醇):V (甲酸) = 87:9:4的溶液洗脱,收集洗脱液,于40 ℃ 水浴下氮气吹至近干;残留物用 V (乙腈):V (水) = 10:90定容至1.0 mL,涡旋混匀1 min,过0.22 μm 微孔滤膜,待测。
1.3 仪器检测条件 1.3.1 色谱条件Waters Acquity UPLC HSS T3色谱柱 (100 mm × 2.1 mm, 1.7 μm);柱温40 ℃,样品室温度10 ℃;进样体积5.0 μL;流动相 A 为0.3% 甲酸水溶液,流动相 B 为乙腈;流速0.5 mL/min,梯度洗脱。洗脱程序:0~2 min,95% A;2~3.5 min,95% A→80% A;3.5~7.5 min,80% A→30% A;7.5~8.5 min,30% A;8.5~9.5 min,30% A→95% A,于95% A 下保持4 min。
1.3.2 质谱条件电喷雾离子源 (ESI);负离子多反应监测模式 (MRM);离子源温度 (TEM) 450 ℃;雾化气压力 (GS1) 344.75 kPa (50 psi);辅助加热气压力 (GS2) 344.75 kPa (50 psi);气帘气压力 (CUR) 103.425 kPa (15 psi);电喷雾电压 (IS) 4 500 V;碰撞气体 (CAD) 48.265 kPa (7 psi);驻留时间 (dwell time) 50 ms。其他条件参数见表 1 。
|
|
表 1 硝磺草酮及其代谢物的 ESI--MS/MS 条件参数 Table 1 ESI--MS/MS conditions for the determination of mesotrione and its metabolites |
1.4 标准溶液配制及标准曲线绘制
分别准确称取0.01 g (精确至0.000 01 g) 硝磺草酮和代谢物 MNBA、AMBA 标准品,用 V (乙腈):V (水) = 50:50的溶液溶解并定容至100 mL,配制成100 mg/L 的标准储备液,于 -20 ℃ 避光保存。分别移取标准储备液1 mL 至10 mL 容量瓶中,用 V (乙腈):V (水) = 10:90的溶液稀释,配成10 mg/L 的混合标准溶液。用流动相作为稀释液,分别将混合标准溶液逐级稀释成0.1~200 μg/L 的系列标准工作溶液;同时称取10 g 空白土壤样品,按1.2节的前处理步骤提取净化后,与上述混合标准溶液混匀,配成系列基质匹配标准工作溶液。以进样质量浓度 (μg/L) 为横坐标,定量离子对的色谱峰面积为纵坐标,获得溶剂/基质标准曲线,用于考察方法的基质效应和线性关系。
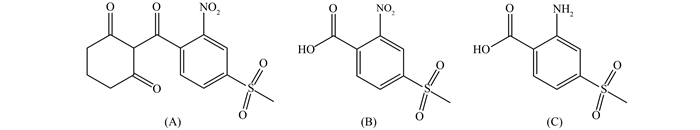
2 结果与分析 2.1 质谱条件的优化针泵恒流注射进样1 mg/L 的混合标准工作溶液,分别在电喷雾正离子模式 (ESI+) 和负离子模式 (ESI-) 下进行扫描。结果表明:硝磺草酮、MNBA 和 AMBA 在 ESI+ 模式下灵敏度较低,而在 ESI- 模式下具有更高的灵敏度,形成 [M-H]- 准分子离子峰,这是因为3种化合物均易在水溶液中发生电离而表现出弱酸性[14]。确定硝磺草酮、MNBA 和 AMBA 的母离子分别是 m/z 338.0、m/z 243.9和 m/z 213.9。在选定母离子后进行子离子扫描 (product ion scan),通过优化碰撞能量,可获得二级特征碎片离子 (图 1)。其中,硝磺草酮的主要特征碎片离子为 m/z 291.0、212.0和249.0,依据键能强弱以及碎片质荷比等信息,推测是丢失了 CO2 和 NO2 等碎片而产生的,它们分别代表 [M-H2NO2]-、[M-H-HNO2-CH3SO2]- 和 [M-NO2-CO2]- 峰;代谢物 MNBA 的主要特征碎片离子为 m/z 200.0、170.0和142.0,主要是丢失 CO2、CO 和 NO 等中性碎片而产生的,分别代表 [M-H-CO2]-、 [M-H-CO2-NO]- 和 [M-H-CO2-NO-CO]- 峰;代谢物 AMBA 主要的特征碎片离子为 m/z 170.0和155.0,主要是丢失 CO2、CO 中性碎片和 CH3 而产生的,分别代表 [M-H-CO2]- 和 [M-H-CO2-CH3]- 峰。对去簇电压和碰撞能量等质谱参数进行优化,获得对硝磺草酮、MNBA 和 AMBA 最高灵敏度的最佳仪器参数和特征碎片离子如表 1所示。
|
图 1 硝磺草酮 (a)、MNBA (b) 和 AMBA (c) 裂解图 Fig. 1 Proposed fragmentation scheme of mesotrione (a), MNBA (b) and AMBA (c) |
2.2 液相色谱条件的优化
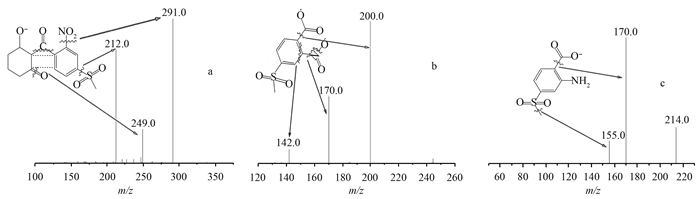
分别考察了不同色谱柱 [Hypersil GOLD (100 mm × 2.1 mm, 1.9 μm) 和 HSS T3 (100 mm × 2.1 mm, 1.7 μm)] 以及流动相 (乙腈-水、乙腈-5 mmol/L 乙酸铵、乙腈-0.3% 甲酸水) 对测定结果的影响。结果发现:以乙腈-水、乙腈-5 mmol/L 乙酸铵为流动相时,3种化合物均无保留;而以乙腈-0.3% 甲酸水为流动相时,3种化合物在 Hypersil GOLD 柱和 HSS T3柱上均有保留,但 HSS T3柱的分离度好于 Hypersil GOLD 柱。这是由于流动相的酸性环境抑制了3种化合物的电离,增强了化合物与色谱柱疏水基团 C18 链的相互作用,同时 HSS T3柱又具有保留水溶性的、极性较大的小分子化合物的特性。综合以上因素,最终选用了 HSS T3色谱柱,其标准选择离子色谱图见图 2。
|
图 2 硝磺草酮、MNBA 和 AMBA 的标准选择离子色谱图 Fig. 2 Typical MRM chromatogram of mesotrione, MNBA and AMBA at 10 μg/L |
2.3 提取条件的优化
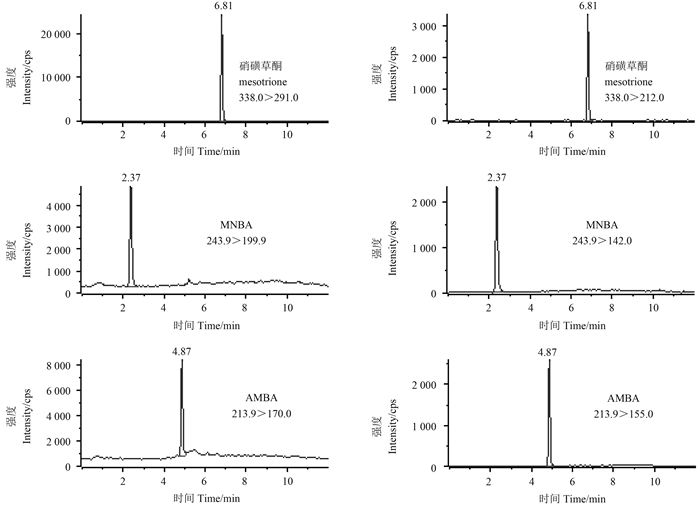
土壤中的农药易被有机质和矿物成分所吸附[18],因此对提取液的优化至关重要。本研究考察了不同提取液 (水、0.3% 甲酸-水、1% 甲酸-水、乙腈-水、0.1% 氨水)对土壤中硝磺草酮、MNBA 及 AMBA 回收率的影响。以褐土 (pH 8.1) 为研究对象,按1.2.1节的方法进行提取,提取液不经净化处理直接测定。结果 (图 3) 表明:以0.3% 甲酸-水和1% 甲酸-水溶液为提取液时,硝磺草酮和 AMBA 的回收率均 < 70%,且随着酸度增大,回收率降低,而对 MNBA 的影响较小;以水、0.1% 氨水、乙腈-水为提取液时,硝磺草酮及其代谢物回收率均 > 90%。由以上结果可知,土壤中有机质对硝磺草酮及其代谢物的吸附作用取决于土壤环境中的 pH 值,且 pH 值越大,越易淋溶,这与文献[19-20] 报道基本一致。因此,硝磺草酮及其代谢物的提取应选择在中性或弱碱性条件下进行,而具体提取液的选择要在固相萃取柱优化后方可确定。
|
图 3 不同提取液对提取效果的影响 Fig. 3 The effect of different extracting solutions to the recovery |
2.4 固相萃取柱条件的优化
硝磺草酮、MNBA 及 AMBA 均易电离形成阴离子,故本研究选用阴离子交换固相萃取柱 (SPE),并考察了 SPE 洗脱液及样品提取液 [0.1% 氨水、不同比例 (10%、20%、30%、40%、50%) 乙腈-0.1% 氨水溶液] 对硝磺草酮、MNBA 和 AMBA 回收率的影响。结果 (图 4~5) 表明:当提取液中乙腈比例超过20% 时,硝磺草酮与 AMBA 的回收率明显降低,而对 MNBA 的影响较小。综合考虑,最终选择 V (乙腈):V (0.1% 氨水) = 10:90作为样品提取液,V (乙酸乙酯):V (甲醇): V (甲酸) = 87:9:4作为 SPE 洗脱液。
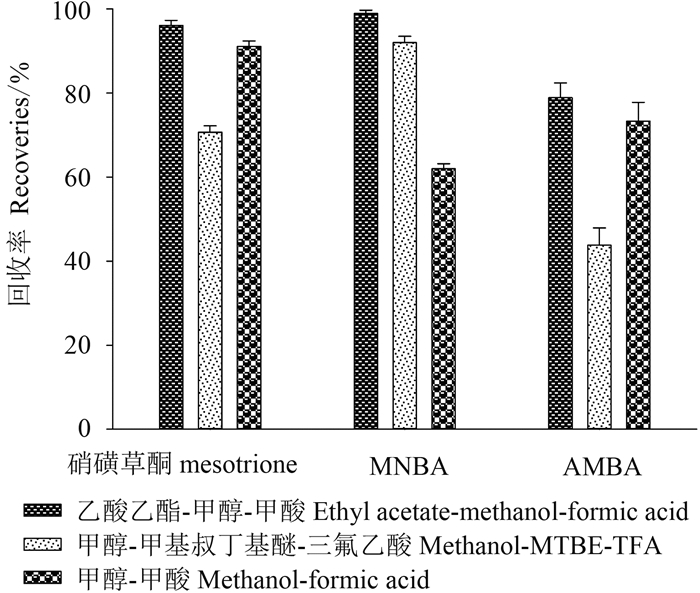
|
图 4 洗脱液的优化 Fig. 4 Optimization of the elution solution |
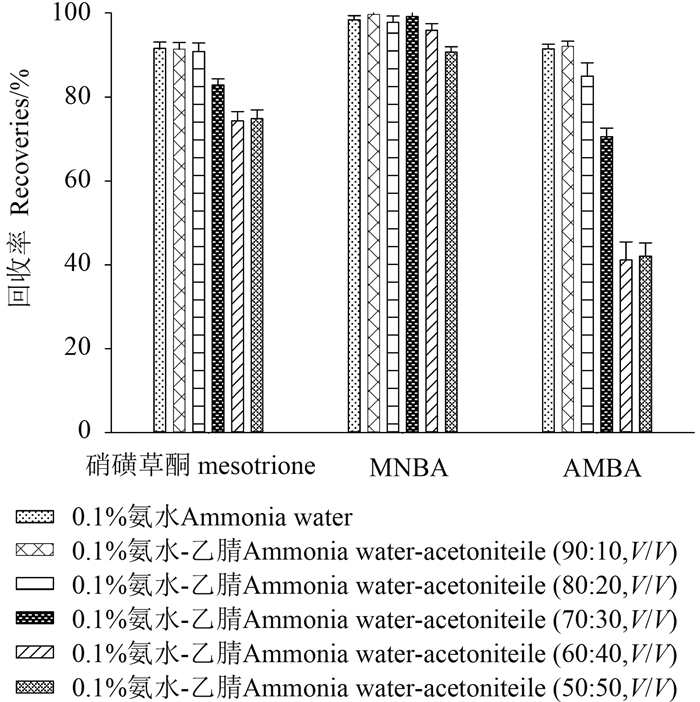
|
图 5 提取液的优化 Fig. 5 Optimization of the loading solution |
3种化合物在固相萃取柱上的吸附能力和在溶剂中受到的作用力由其化学结构特征决定。硝磺草酮由于苯环的共轭作用而可促进其电离;MNBA 邻位硝基由于与苯环的共轭作用及诱导作用,使其邻位碳原子的电子云密度降低,对羧基上的电子产生吸引作用,增强了 MNBA 的离解;而 AMBA 邻位氨基上的氮与羧羟基氢的氢键作用而最不易解离成酸根。由此可认为,3种化合物的酸性从高到低依次为 MNBA > 硝磺草酮 > AMBA,与阴离子固相萃取柱的作用力从大到小依次为 MNBA > 硝磺草酮 > AMBA,因此,固相萃取柱的优化既要考虑洗脱液的洗脱强度又要考虑样品提取液的组成。
2.5 方法的线性范围、基质效应和灵敏度由表 2 可知:3种化合物在试验范围内,其质量浓度与对应的峰面积间呈良好线性关系,r > 0.999。基质标准曲线与溶剂标准曲线斜率的比值可反映基质效应的强弱,硝磺草酮、MNBA 和 AMBA的斜率比值分别为0.86、0.83和0.91,具有一定的基质抑制效应,为使定量分析结果更准确,应采用同等基质配制的标准溶液进行定量分析。
|
|
表 2 硝磺草酮及其代谢物的标准曲线 Table 2 Standard curves of mesotrione and its metabolites |
以最小添加水平的3倍信噪比设定方法的检出限,10倍信噪比设定方法的定量限,硝磺草酮、MNBA 和 AMBA 检出限分别为0.1、0.3和0.2 μg /kg,定量限分别为0.3、1.0和0.6 μg /kg,检出限和定量限均低于中国和欧盟的 MRL 值,能够满足检测要求[8]。
2.6 方法的准确度和精密度结果 (表 3) 明:在0.3~50 μg/kg 添加水平下,磺草酮、MNBA 及 AMBA 在土壤中的平均回收率在73%~97% 之间,相对标准偏差 (RSD) 在2.4%~12.9% 之间 (n = 5)。在10 μg/kg 水平上考察了该方法在中性和酸性土壤 (黄土 pH 6.4,红土 pH 4.6) 条件下的适用性。结果 (图 6) 表明:其回收率在71%~85% 之间,表明该方法能够适用于不同 pH 类型土壤中硝磺草酮及其代谢物的测定。
|
|
表 3 硝磺草酮及其代谢物在土壤中的回收率和相对标准偏差(n=5) Table 3 Average recoveries and RSDs of mesotrione and its metabolite from soil (n=5) |
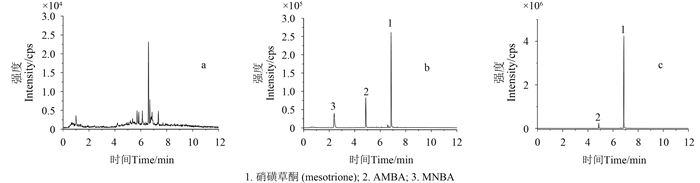
|
图 6 土壤空白 (a)、添加回收 (b) 及样品 (c) 总离子色谱图 Fig. 6 The total ion chromatograms of mesotrione in blank soils (a), spiked soils (b) and the sample (c) |
2.7 实际样品测定
采用室内模拟试验研究了硝磺草酮在江西红土中的代谢规律。将添加了10 mg/kg 硝磺草酮的红土置于35 ℃ 恒温黑暗培养箱中,定期取样,按1.2~1.3节的方法进行处理和测定。结果 (图 7) 表明:硝磺草酮在红土中的消解规律符合一级动力学方程 y = 9.851 9e-0.175x,r = -0.974 2,消解半衰期为4.0 d,其代谢物 AMBA 最高值为1.34 mg/kg (第10天),最大转化率为21.1%;MNBA 最高值为0.009 mg/kg (第2天),转化率低于0.2%,转化量非常少。AMBA 在红土中的残留量显著高于 MNBA,说明硝磺草酮优先代谢为 AMBA。
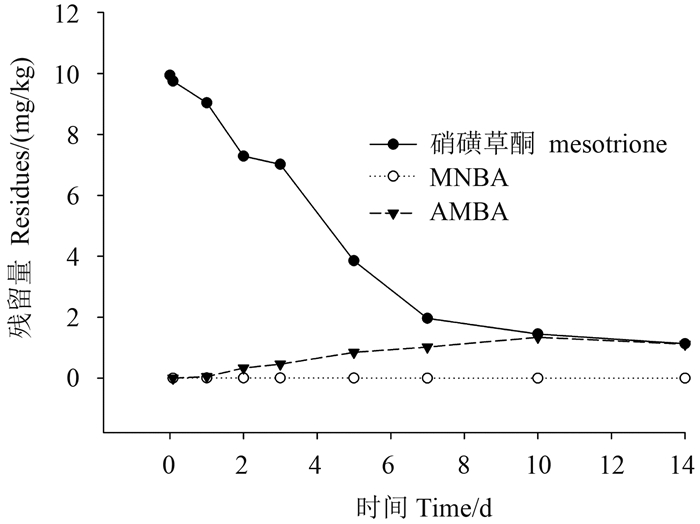
|
图 7 硝磺草酮及其代谢物在土壤中的消解动态 Fig. 7 The dissipation of mesotrione and its metabolites in soils |
3 结论
硝磺草酮及其代谢物 MNBA 及 AMBA 极性大小和其在土壤中的吸附性依赖于 pH 环境,其在中性或弱碱性条件下呈离子状态,而在酸性条件下则表现出非极性性质。基于以上因素,采用10% 乙腈-0.1% 氨水溶液提取,PAX 型 SPE 阴离子交换固相萃取柱净化,建立了土壤中硝磺草酮及其代谢物 MNBA 及 AMBA 同时测定的 UPLC-MS/MS 方法,该方法简单、灵敏度高,能够满足土壤中农药痕量分析的需要。同时,在方法优化试验中,推测出3种化合物的酸性从高到低依次为 MNBA > 硝磺草酮 > AMBA,进而可推断出在碱性土壤中的吸附能力从大到小依次为 MNBA > 硝磺草酮 > AMBA。所得结果可为进一步研究硝磺草酮的环境行为和相关产品中硝磺草酮残留控制提供技术支持。
| [1] |
张靖, 吕和平, 曹立冬, 等. 六种喷雾助剂提高硝磺草酮防除稗草及反枝苋效果的作用机理初探 [J]. 农药学学报, 2015,17 (3)
:348–356.
ZHANG J, Lü H P, CAO L D, et al. Synergism of six spray adjuvants on mesotrione in controlling Echinochloa crus-galli and Amaranthus retroflexus [J]. Chin J Pestic Sci, 2015, 17 (3) :348–356 . |
| [2] | MITCHELL G, BARTLETT D W, FRASER T E M, et al. Mesotrione: a new selective herbicide for use in maize [J]. Pest Manage Sci, 2001, 57 (2) :120–128 . |
| [3] | ŠOJIĆ D V, ORČIĆ D Z, ČETOJEVIĆ-SIMIN D D, et al. Kinetics and the mechanism of the photocatalytic degradation of mesotrione in aqueous suspension and toxicity of its degradation mixtures [J]. J Mol Catal A-Chem, 2014, 392 :67–75 . |
| [4] | CHAABAEN H, VULLIET E, CALVAYRAC C, et al. Behaviour of sulcotrione and mesotrione in two soils [J]. Pest Manage Sci, 2008, 64 (1) :86–93 . |
| [5] | MORO C V, BRICHEUX G, PORTELLI C, et al. Comparative effects of the herbicides chlortoluron and mesotrione on freshwater microalgae [J]. Environ Toxicol Chem, 2012, 31 (4) :778–786 . |
| [6] |
滕春红, 王金楠, 李晓薇, 等. 硝磺酮对轮作中后茬作物安全性的影响 [J]. 现代化农业, 2012 (11)
:1–2.
TENG C H, WANG J N, LI X W, et al. Effects and safety of mesotrione on succeding crops [J]. Modern Agric, 2012 (11) :1–2 . |
| [7] | ABIT M J M, AL-KHATIB K, REGEHR D L, et al. Differential response of grain sorghum hybrids to foliar-applied mesotrione [J]. Weed Technol, 2009, 23 (1) :28–33 . |
| [8] |
食品安全国家标准食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国农业出版社, 2014.
National food safety standard-Maximum residue limits for pesticides in food: GB 2763—2014[S]. Beijing: China Agriculture Press, 2014. |
| [9] | EU Pesticides database[DB/OL]. [2016-01-20]. http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=pesticide.residue.CurrentMRL&language=EN. |
| [10] | DURAND S, SANCELME M, BESSE-HOGGAN P, et al. Biodegradation pathway of mesotrione: Complementarities of NMR, LC-NMR and LC-MS for qualitative and quantitative metabolic profiling [J]. Chemosphere, 2010, 81 (3) :372–380 . |
| [11] | GIACOMAZZI S, COCHET N. Environmental impact of diuron transformation: a review [J]. Chemosphere, 2004, 56 (11) :1021–1032 . |
| [12] | BONNET J L, BONNEMOY F, DUSSER M, et al. Toxicity assessment of the herbicides sulcotrione and mesotrione toward two reference environmental microorganisms: Tetrahymena pyriformis and Vibrio fischeri [J]. Arch Environ Con Tox, 2008, 55 (4) :576–583 . |
| [13] | BENSALAH N, KHODARY A, ABDEL-WAHAB A. Kinetic and mechanistic investigations of mesotrione degradation in aqueous medium by Fenton process [J]. J Hazard Mater, 2011, 189 (1-2) :479–485 . |
| [14] | BARCHAANSKA H, BABILAS B, GLUZICKA K, et al. Rapid determination of mesotrione, atrazine and its main degradation products in selected plants by MSPD-HPLC and indirect estimation of herbicides phytotoxicity by chlorophyll quantification [J]. Int J Environ Anal Chem, 2013, 94 (2) :99–114 . |
| [15] | ALFERNESS P, WIEBE L. Determination of mesotrione residues and metabolites in crops, soil, and water by liquid chromatography with fluorescence detection [J]. J Agric Food Chem, 2002, 50 (14) :3926–3934 . |
| [16] |
张代辉, 滕国生, 李正强, 等. 高效液相色谱-串联质谱法测定食品中硝磺草酮 [J]. 分析化学, 2012,40 (5)
:811–812.
ZHANG D H, TENG G S, LI Z Q, et al. Determination of mesotrione in food by liquid chromatography tandem mass spectrometry [J]. Chin J Anal Chem, 2012, 40 (5) :811–812 . |
| [17] | CHEN X X, LI W M, WU Q, et al. Dissipation and residues of the herbicide mesotrione in maize and soil in open field [J]. Bull Environ Contam Tox, 2012, 88 (5) :772–775 . |
| [18] | PIERCE R H, OLNEY C E, FELBECK G T. Pesticide adsorption in soils and sediments [J]. Environ Lett, 1971, 1 (2) :157–172 . |
| [19] | DYSON J S, BEULKE S, BROWN C D, et al. Adsorption and degradation of the weak acid mesotrione in soil and environmental fate implications [J]. J Environ Qual, 2002, 31 (2) :613–618 . |
| [20] |
孔德洋, 石利利, 单正军, 等. 除草剂甲基磺草酮在土壤中的吸附及淋溶特性 [J]. 中国环境科学, 2008,28 (8)
:753–757.
KONG D Y, SHI L L, SHAN Z J, et al. Adsorption and leaching behavior of herbicide mesotrione in soils [J]. China Environ Sci, 2008, 28 (8) :753–757 . |
 2016, Vol. 18
2016, Vol. 18


