2. 北海道大学 农学院,札幌 060-8589, 日本
2. Hokkaido University, Research Faculty of Agriculture, Sapporo 060-8589, Japan
植物伯克霍尔德菌Burkholderia plantarii 是引起水稻秧苗细菌性立枯病的重要病原菌之一,其侵染性、繁殖力及适应性均很强,严重威胁水稻生产[1]。1985年,Azegami等[2]学者在日本千叶县秧田首次发现并报道了水稻秧苗细菌性立枯病,并分离得到病原菌株omigawa isolate。1987年,Azegami等[1]发现omigawa isolate与水稻细菌性谷枯病菌Pseudomonas glumae、唐菖蒲伯克霍尔德菌Pseudomonas gladioli、洋葱伯克霍尔德菌Pseudomonas cepacia等假单胞菌属Pseudomonasspp.在细菌学、病理学及血清学上的特性极为相似,omigawa isolate因此被划分到假单胞菌属,暂命名为Pseudomonas plantarii[1-2]。直到1994年,Urakami等学者根据化学分类学特性、DNA杂交数据、rRNA-DNA杂交数据以及5 S 和16 S rRNAs序列,将P. plantarii和P. glumae等重新分类,归属到Burkholderiaspp.[3]。
在自然界,B. plantarii常分布于苗床土、田水、植物种子及动植物残体中,进入秧田后在适宜的条件下完成初侵染,并通过种子和土壤传播进入再侵染循环。被侵染的秧苗在前期表现为矮缩、失绿和根系生长发育障碍,后期枯萎死亡。该病害曾在日本全国流行,并于近年在东南亚地区多次爆发,给水稻生产带来了灾难性的损失[2, 4]。目前,中国对B. plantarii的严重危害性认识不足,在防控方面的研究工作尚处于空白。尽管《中华人民共和国进境植物检疫性有害生物名录》至今已经过多次完善和修订,但B. plantarii并未被列入其中,这使得B. plantarii极有可能通过种子或土壤等传播途径进入中国[5]。
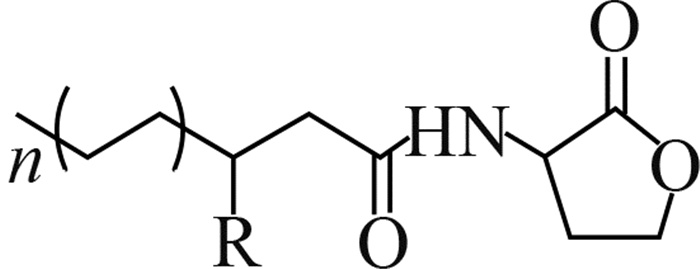
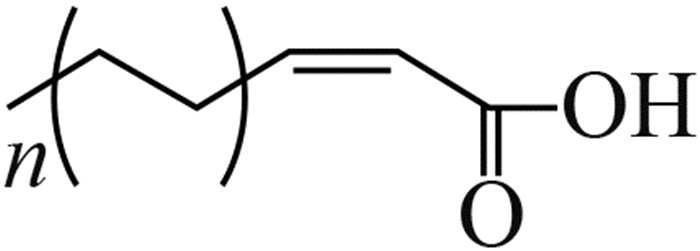
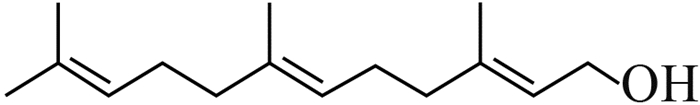
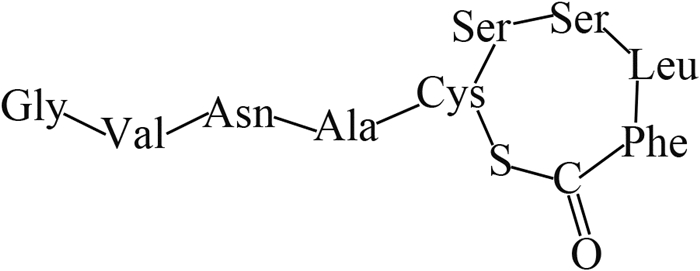
2014年,Wang等[6]通过分子生物学手段,在中国浙江、福建、黑龙江3省的稻田土壤及稻穗中发现了B. plantarii的分布,这表明B. plantarii已入侵中国稻田生态系统。由于中国水稻主产区的育秧季多处于高温高湿的气候条件,这为B. plantarii的生长、繁殖和扩散创造了有利的条件[7]。尤其是近年来全球温室效应的加剧和大棚育秧技术的推广,可能加剧该病害在中国的爆发流行[8-9]。
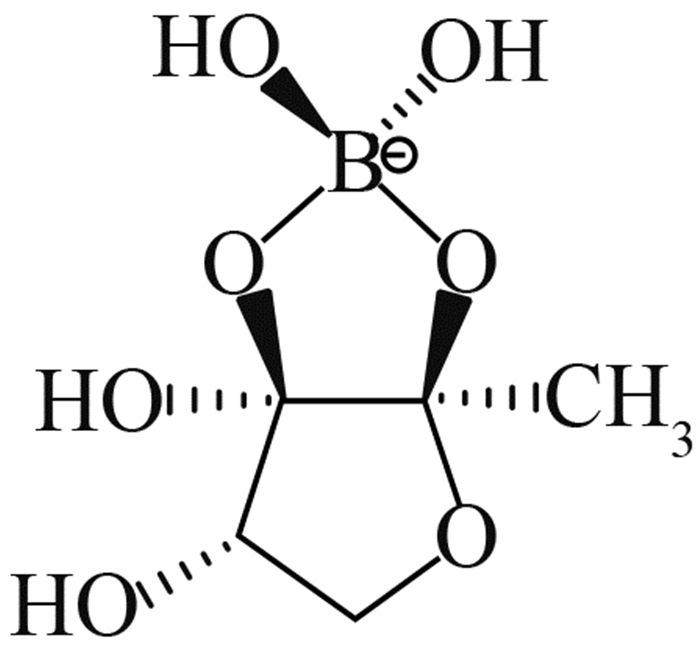
2 植物伯克霍尔德菌的毒力因子和致病机理目前,国际上对B. plantarii致病机理的研究已有一些报道。Azegami等[1]发现,被侵染的秧苗主要症状为根系发育受阻,在第3叶期表现出基部失绿黄化、矮缩、枯萎死亡等典型病征,这与B.glumae侵染秧苗后所表现的症状极为相似。但随着病情的发展,B.glumae侵染的秧苗变为褐色并在基部出现明显的腐烂,而B. plantarii侵染的秧苗则变为红褐色并枯萎,但无腐烂现象出现。基于病症上的明显差异,Azegami等推测B. plantarii与B. glumae在生理生化特性和致病机理上存在本质区别[1, 7]。Azegami等[1]采用B. plantarii发酵液提取物处理未被B. plantarii侵染的秧苗,发现其表现出了与被B. plantarii 侵染相同的症状。随后,他们成功分离了B. plantarii代谢物中引起水稻立枯病的毒力因子并鉴定了其分子结构 (图 1),命名为托酚酮(tropolone) [1]。

|
图 1 B. plantarii的毒力因子及致病机理 Fig. 1 Virulence factor of B. plantarii and its pathogenic mechanism |
已有研究发现,托酚酮不仅对禾本科植物具有较高的细胞毒性,对其他动植物细胞也存在广泛的毒性,如抑制桃种中乙烯利的生成[10],抑制葡萄多酚氧化酶[11]、蘑菇络氨酸酶[12]、腐食酪螨和粉尘螨金属蛋白酶[13],以及对人类和鼠科动物细胞的 DNA 也有损伤作用[14]等。但从生物活性角度而言,托酚酮则具有广谱的抗菌活性,甚至能抑制耐甲氧西林金黄色葡萄球菌(MRSA)的生长[15]。Zhao指出,托酚酮所具有的强烈的细胞毒性和广谱抗菌活性与其显著的金属阳离子螯合特性密不可分[16]。病理学研究发现,B. plantarii分泌的毒力因子托酚酮具有阳离子螯合能力,在铁离子富集的马铃薯葡萄糖琼脂培养基(PDA)下可观察到B. plantarii菌落周围产生了许多明显的褐色结晶体,经结构鉴定发现这种结晶体正是托酚酮与铁离子所形成的不溶性螯合物(图 1),这也揭示了托酚酮作为B. plantarii毒力因子介导引起的铁贫瘠,是导致水稻秧苗立枯病的重要致病机理[9] (图 1) 。
3 植物伯克霍尔德菌的群体感应系统及其生理功能研究进展 3.1 群体感应系统20世纪60年代,科学家们发现细菌个体之间存在如高等真核生物般复杂的信息交流和信号传导,这种现象被命名为群体感应(quorum sensing,QS) [17]。QS其实质是细菌生长发育过程中的一种信号通路调控系统,指细菌在其生长过程中分泌一种或多种信号分子,个体可通过感应这些信号分子的浓度来判断本身种群密度,当种群密度数达到一定的阈值后,一系列基因的表达可相应地被启动,以协调群体行为来适应环境的变化[18]。在大多数动植物病原菌中,QS可参与调控包括游动性、次生代谢、毒力因子生成及生物膜发育等与致病力紧密相关的细胞生理过程[19]。近年来,QS信号通路对病原菌毒力相关的群体行为的调控机理已成为医学和农业等领域的国际研究热点之一。
3.2 群体感应系统的调控机制QS最早发现于费氏弧菌Vibrio fischeri的生物发光现象,其QS系统包括luxI基因和luxR基因,其中luxI基因编码的LuxI蛋白负责合成N-酰化高丝氨酸内酯(N-acyl homoserine lactones,AHLs)信号分子,而luxR基因编码的LuxR蛋白负责对AHLs信号分子作出应答,两者协作实现对发光基因簇luxCDABEG操纵子转录的调控[20-21]。
QS系统的发现促进了相关研究的蓬勃发展,科学家们在不同细菌或真菌中发现了QS系统具有多样性,体现在不同的真/细菌中存在结构迥异的信号分子 (表 1),其命名常采用信号分子缩写作为前缀[22]。最具代表性的两类QS系统为AHLs-QS系统(可参与调控B. plantarii和B. cepacia等的致病力)和DSF-QS系统(可参与调控水稻白叶枯病菌Xanthomonas oryzae等的致病力)[23-26]。此外。最新研究还发现,在一种病原菌中致病基因的表达由多套QS系统共同调控。例如,铜绿假单胞菌Pseudomonas aeruginosa的致病力可由AHLs-QS、PQS-QS、Rhl-QS和Las-QS4套系统形成复杂的信号网络共同调控[27],而在新洋葱伯克霍尔德菌Burkholderia cenocepacia中,AHLs-QS、HHQ-QS和BDSF-QS 3套 QS系统共同调控着其毒素分泌和生物膜发育[25]。
|
|
表 1 典型的QS系统及其在微生物中的分布 Table 1 Distribution of typical QS molecules in various microbes |
中国开展植物病原菌QS信号通路研究较早的单位主要有中国科学院微生物研究所、中国农业科学院、中国农业大学、上海交通大学、复旦大学及南京农业大学,研究模型多为黄单胞菌Xanthomonas属[28-30]和瓜类细菌性果斑病菌Acidovorax属[31]。以B. plantarii为模型的研究报道,目前主要集中在生理生化特性方面:1)苯乙哌酮类代谢物的抗菌活性[32];2)鼠李糖脂的结构与类内毒素属性及其生物物理特性[33];3)B. plantarii双组分系统(two component system)的鉴定及其系统发育分析[34]。而对于B. plantarii的QS信号通路调控机理方面的研究仍处于起步阶段[35-36]。
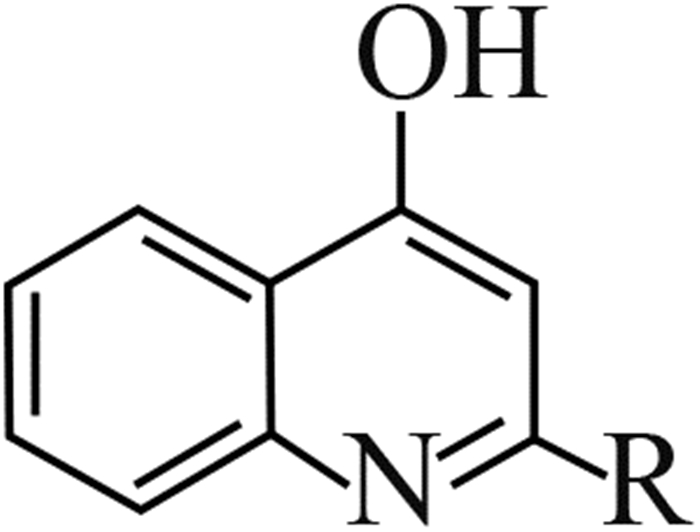
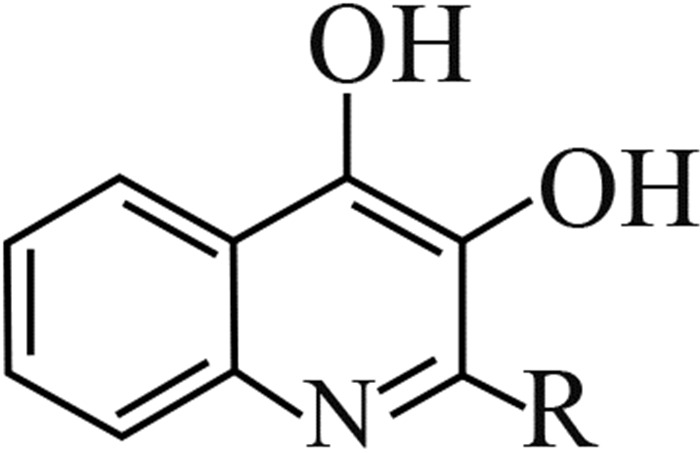
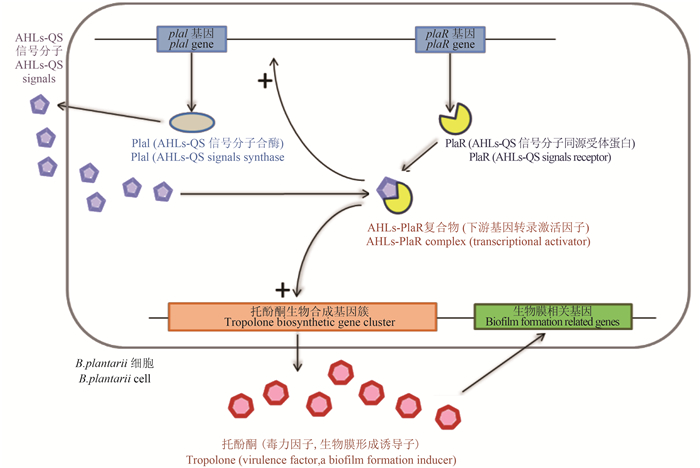
3.3 植物伯克霍尔德菌QS系统的研究进展QS对B. plantarii生理功能调控机制的相关研究,最早是由国际遗传工程和生物技术中心(ICGEB)的Solis等[37]开展起来的。他们鉴定了B. plantarii的AHLs-QS信号通路关键基因:AHLs信号分子合酶编码基因plaI和AHLs信号受体蛋白编码基因plaR,并通过plaI基因敲除技术和对水稻的生物测定,推测可能是AHLs-QS影响B. plantarii对水稻的致病性,但尚缺乏直接证据。直至2013年,Wang等[24]设计了plaI和plaR的特异性引物,结合荧光实时定量PCR和托酚酮生成分析,发现信号分子AHLs与受体蛋白PlaR结合后形成的转录激活因子不仅可正向调控plaI的表达,而且激活了下游毒力因子托酚酮的生成,这也首次揭示了AHLs-QS调控托酚酮生成的运作机理[24] (图 2) 。
|
图 2 AHLs-QS系统对B. plantarii致病力的调控机制 Fig. 2 Regulation of pathogenicity of B. plantarii by QS signaling pathway |
近年来,科学家们在 Xanthomonas属植物病原菌中还发现了一套全新的QS信号通路系统:DSF-QS信号通路(DSF分子结构见表 1) [23, 38]。有趣的是,这套DSF-QS信号通路也存在于Burkholderia属中[23, 38]。DSF-QS信号通路的关键结构元件之一DSF信号分子合酶在Xanthomonas属和Burkholderia cepaciacomplex菌群(BCC,包含B. cepacia、 B. cenocepacia等17个种)中均为烯脂酰辅酶A 水合酶家族的RpfF蛋白,而另一关键结构元件DSF信号分子感受器在Xanthomonas属中被发现是RpfC/RpfG双组分系统,在BCC菌群中则为RpfR受体蛋白(与RpfC具有36%的同源性)。这表明在B. plantarii中,DSF-QS信号通路极可能与AHLs-QS共同负责调控托酚酮的生成,但B. plantarii中DSF-QS信号通路的关键基因元件及其对B. plantarii毒力的调控机理还有待进一步探究。
4 病原菌群体淬灭及其生防应用研究进展 4.1 生物互作及种间信号分子的重要生态功能QS系统作为病原菌长期进化中形成的个体间调控机制,对于病原菌在与寄主植物或环境中其他微生物互作中获得竞争优势具有重要的生态学意义,而处于同一生态位的其他细菌甚至真核生物,在竞争压力下也必然进化出干扰或破坏病原菌QS系统的生存策略[39]。
生物互作是自然界中生物竞争的重要表现形式之一,植物病原菌与其他生物产生互作的主要场所在植物的根际。根际的概念最早是由德国微生物学家Lorenz Hiltner于1904年首次提出的,他将根际定义为根系周围、受根系生长影响的一个狭窄土壤区域。在这一区域中,约有5%~21% 被植物固定的有机碳以根系分泌物的形式释放出来[40]。受到根系分泌物的吸引,各种土著微生物在根际定殖过程中,具有近似生态位的生防菌与病原菌为争夺有限的食物资源和生存空间存在着激烈的生存竞争[41-42]。面对这种生存竞争,生防菌往往演化出了多套复杂的生存策略,其中最早被人类发现并加以利用的就是抗菌天然产物[43]。得益于20世纪以来天然产物化学、分析化学和微生物生态学的蓬勃发展,功能微生物及其抗菌活性成分被大量发现。据最新报道,至今已有两万多种抗菌天然产物小分子的结构得到鉴定[44]。不仅如此,近来研究还发现,在部分生防菌释放的次生代谢产物和大分子物质中,除了可杀死病原菌或抑制其生长的抗菌活性小分子组分外,还存在一类被称为种间信号分子 (interspecies signaling molecule) 的活性组分,其并不影响病原菌的生长和基础代谢,却能干扰病原菌种内QS信号通路,引起其致病力相关生理特性的退化[39]。因此,探索微生物种间互作中的种间信号分子为开发新型杀菌剂开辟了一条新路径。
4.2 种间信号分子阻断病原菌QS系统的作用机制目前研究发现,根据种间信号分子抑制病原菌QS系统的作用方式,其主要机制可分为以下几种:1)阻碍QS信号分子的产生,即阻碍QS信号分子浓度的积累,使其无法达到激活致病基因表达的阈值浓度。关于抑制QS信号分子产生的天然抑制剂的研究成果主要体现在P. aeruginosa,而在植物病害防控方面的相关研究报道稀少,将来的研究可侧重于从寄主植物和拮抗菌株中筛选能够抑制病原菌 QS信号分子合酶活性的次生代谢产物[45],并以其为先导化合物开发新型绿色生物杀菌剂。2)降解已产生的QS信号分子,即通过降解酶对已产生的QS信号分子进行降解。至今已从多种病原菌拮抗细菌中分离得到针对病原菌AHLs-QS系统的两类AHLs降解酶:AHLs内酯酶(AHLs-lactonase)和AHLs酰基转移酶(AHLs-acylase)[46, 54]。由于QS系统在不同病原菌中的多样性,对于结构迥异的QS信号分子降解酶的分离和鉴定研究仍处于初始阶段,QS信号分子降解酶的制剂研发必然是今后研究的重点之一。3)阻碍QS信号分子与受体蛋白的结合,即通过QS信号分子的类似物或拮抗剂与QS信号分子竞争结合其细胞内的特异受体(如LuxR家族受体蛋白),阻碍QS信号分子对致病基因表达的正常调控。4)其他作用机制,主要表现在基因转录水平和蛋白拓扑结构水平上的变化,如抑制QS信号通路关键基因的表达、引起信号通路调节因子构象改变以及导致信号分子受体蛋白周转变化等[47-53]。
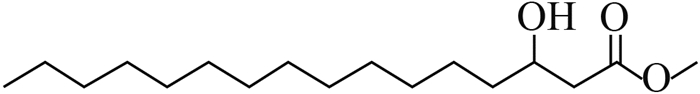
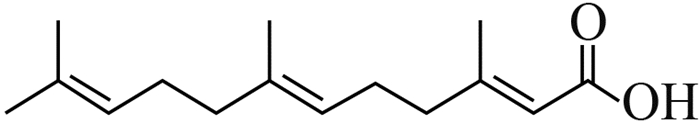
以QS系统为靶标的种间信号分子大多是从生物互作研究模型中得到的。如,海洋红藻 Delisea pulchra 分泌的卤化呋喃酮 (halogenated furanones) 可干扰附生细菌AHLs-QS系统调控的定殖能力[47-48],水稻根际绿粘帚霉 Trichoderma virens 分泌的倍半萜二烯醇 (carot-4-en-9,10-diol) 可抑制水稻苗枯病菌 B. plantarii AHLs-QS系统所调控的毒力因子及生物膜的形成[9, 24]。Rasmussen等发现,青霉菌 Penicillium spp.通过释放棒曲霉素 (patulin) 和青霉酸 (penicillic acid),干扰铜绿假单胞菌 P. aeruginosa的PQS信号通路[49],从而导致其毒力完整性的缺失。典型的微生物互作模型及次生代谢产物的种间信号分子详见表 2[49-54]。
|
|
表 2 典型的微生物种间信号分子及其作用机制 Table 2 Typical microbial interspecies signaling molecules and the mode of action |
目前,对于种间信号分子的研究仍以对分子作用机制的探索为主,而对于其在农业病害防治及临床医疗中的应用研发均有所滞后,因此基于种间信号分子所研发高效的商品化制剂也将是下一阶段亟需开展的重点研究方向。
4.3 种间信号分子类杀菌剂的研究展望美国、日本、意大利等多国科学家已开展对 B. plantarii 的相关研究,但多集中于其生理生化和致病机理方面[9, 55],如何有效抑制 B. plantarii 的致病力,以防控水稻细菌性立枯病仍是一个未解的世界性难题[9, 55]。目前,种子消毒剂和杀菌剂是防控水稻苗细菌性立枯病的主要措施,但这类化学药剂常以病原菌细胞的基础代谢和生长为作用靶点以达到杀菌效果[46]。在这种选择压力下,耐药菌株的比例上升,常诱发病原菌出现耐药性问题甚至导致药剂失效[56]。另一方面,残留在稻米及环境中的痕量杀菌剂对野生动物、鱼类、鸟类及其他非靶标生物等存在严重的负作用[57],对人类也有潜在的健康风险[58]。
以病原菌QS系统为作用靶标的新型杀菌剂在作用机制上区别于传统杀菌剂,其不但不会影响病原菌的基础生长和代谢,而且能有效阻断QS信号通路,从而抑制致病基因的表达,以达到控制病原菌致病力的目的,其显著优点在于既能有效削弱病原菌的致病力,又不致于使病原菌产生耐药性,且具有较低的生态风险[23]。
综上所述,自然界中生物互作现象千姿百态,有关分离和鉴定未知的QS信号分子拮抗剂的研究方兴未艾。中国幅员辽阔,地形复杂,气候类型多样,具有丰富的自然资源,大量可干扰病原菌QS系统的小分子化合物和大分子酶资源有待于探索和发现。因此立足于天然资源,筛选和鉴定具有抑制QS系统活性的种间信号分子(天然化合物和酶),将成为创制新型杀菌剂的趋势之一。基于此,寻求高效、安全、环境友好的新型微生物杀菌剂,建立水稻秧苗细菌性立枯病的有效防控体系,是切实保障中国水稻产量和品质的重要基础,也必将是化学农药减量减施综合技术的核心内容。
| [1] | AZEGAMI K, NISHIYAMA K, WATANABE Y, et al. Pseudomonas plantarii sp. nov, the casual agent of rice seedling blight [J]. Int J Syst Bacteriol, 1987, 37 (2) :144–152 . |
| [2] | AZEGAMI K, NISHIYAMA K, WATANABE Y, et al. Tropolone as a root growth-inhibitor produced by a plant pathogenic Pseudomonas sp. causing seedling blight of rice [J]. Ann Phytopathol Soc Jpn, 1985, 51 (3) :315–317 . |
| [3] | URAKAMI T, ITO-YOSHIDA C, ARAKI H, et al. Transfer of Pseudomonas plantarii and Pseudomonas glumae to Burkholderia as Burkholderia spp. and Description of Burkholderia vandii sp. nov. [J]. Int J Syst Bacteriol, 1984, 44 (2) :235–245 . |
| [4] | ADACHI N, TSUKAMOTO S, INOUE Y, et al. Control of bacterial seedling rot and seedling blight of rice by bacteriophage [J]. Plant Dis, 2012, 96 (7) :1033–1036 . |
| [5] |
王聪, 郑明慧, 王振华, 等. 植物检疫性有害生物名单发展综述与制订方法探讨 [J]. 植物检疫, 2014,28 (3)
:1–7.
WANG C, ZHENG M H, WANG Z H, et al. Review of the plant quarantine pest list and exploration of methods for its formulation [J]. Plant Quarant, 2014, 28 (3) :1–7 . |
| [6] | WANG M C, WEI P, CAO M C, et al. First report of rice seedling blight caused by Burkholderia plantarii in North and Southeast China [J]. Plant Dis, 2016, 100 (3) :645. |
| [7] | AZEGAMI K, NISHIYAMA K, KATO H. Effect of iron limitation on "Pseudomonas plantarii" growth and tropolone and protein production [J]. Appl Environ Microbiol, 1988, 54 (3) :844–847 . |
| [8] |
顾建清, 戴鼎, 顾菊根, 等. 机插水稻大棚育秧技术试验与研究 [J]. 中国农机化, 2011 (3)
:97–100.
GU J Q, DAI D, GU J G, et al. Transplanting rice seedling greenhouse experiment and research [J]. Chin Agric Mechan, 2011 (3) :97–100 . |
| [9] | WANG M C, HASHIMOTO M, HASHIDOKO Y. Carot-4-en-9, 10-diol, a conidiation-inducing sesquiterpene diol produced by Trichoderma virens PS1-7 upon exposure to chemical stress from highly active iron chelators [J]. Appl Environ Microbiol, 2013, 79 (6) :1906–1914 . |
| [10] | MIZUTANI F, RABBANY G A B M, AKIYOSHI H. Inhibition of ethylene production by tropolone compounds in young excised peach seeds [J]. J Jpn Soc Hortic Sci, 1998, 67 (2) :166–169 . |
| [11] | VALERO E, GARCIA-MORENO M, VARON R, et al. Time-dependent inhibition of grape polyphenol oxidase by tropolone [J]. J Agric Food Chem, 1991, 39 (6) :1043–1046 . |
| [12] | KAHN V, ANDRAWIS A. Inhibition of mushroom tyrosinase by tropolone [J]. Phytochemistry, 1985, 24 (5) :905–908 . |
| [13] | MORITA Y, MATSUMURA E, OKABE T, et al. Biological activity of tropolone [J]. Biol Pharm Bull, 2003, 26 (10) :1487–1490 . |
| [14] | INAMORI Y, TSUJIBO H, OHISHI H, et al. Cytotoxic effect of hinokitiol and tropolone on the growth of mammalian cells and on blastogenesis of mouse splenic T cells [J]. Biol Pharm Bull, 1993, 16 (5) :521–523 . |
| [15] | ARIMA Y, NAKAI Y, HAYAKAWA R, et al. Antibacterial effect of β-thujaplicin on Staphylococci isolated from atopic dermatitis: relationship between changes in the number of viable bacterial cells and clinical improvement in an eczematous lesion of atopic dermatitis [J]. J Antimicrob Chemother, 2003, 51 (1) :113–122 . |
| [16] | ZHAO J. Plant troponoids: Chemistry, biological activity, and biosynthesis [J]. Curr Med Chem, 2007, 14 (24) :2597–2621 . |
| [17] | MARSHALL J. Quorum sensing [J]. Proc Natl Acad Sci USA, 2013, 110 (8) :2690. |
| [18] | SCHUSTER M, JOSEPH SEXTON D, DIGGLE S P, et al. Acyl-homoserine lactone quorum sensing: from evolution to application [J]. Annu Rev Microbiol, 2013, 67 (1) :43–63 . |
| [19] | RUTHERFORD S T, BASSLER B L. Bacterial quorum sensing: its role in virulence and possibilities for its control [J]. Cold Spring Harb Perspect Med, 2012, 2 (11) :e78024. |
| [20] | STEVENS A M, GREENBERG E P. Quorum sensing in Vibrio fischeri: essential elements for activation of the luminescence genes [J]. J Bacteriol, 1997, 179 (2) :557–562 . |
| [21] | GALLOWAY W R J D, HODGKINSON J T, BOWDEN S D, et al. Quorum sensing in gram-negative bacteria: small-molecule modulation of AHL and AI-2 quorum sensing pathways [J]. Chem Rev, 2010, 111 (1) :28–67 . |
| [22] | GRANDCLMENT C, TANNIRES M, MORRA S, et al. Quorum quenching: role in nature and applied developments [J]. FEMS Microbiol Rev, 2016, 40 (1) :86–116 . |
| [23] | RYAN R P, DOW J M. Communication with a growing family: diffusible signal factor (DSF) signaling in bacteria [J]. Trends Microbiol, 2011, 19 (3) :145–152 . |
| [24] | WANG M C, HASHIMOTO M, HASHIDOKO Y. Repression of tropolone production and induction of a Burkholderia plantarii pseudo-biofilm by carot-4-en-9, 10-diol, a cell-to-cell signaling disrupter produced by Trichoderma virens [J]. PLoS One, 2013, 8 (11) :e78024. |
| [25] | SCHMID N, PESSI G, DENG Y Y, et al. The AHL- and BDSF-dependent quorum sensing systems control specific and overlapping sets of genes in Burkholderia cenocepacia H111 [J]. PLoS One, 2012, 7 (11) :e49966. |
| [26] | SUPPIGER A, SCHMID N, AGUILAR C, et al. Two quorum sensing systems control biofilm formation and virulence in members of the Burkholderia cepacia complex [J]. Virulence, 2013, 4 (5) :400–409 . |
| [27] | JAROSZ L M, OVCHINNIKOVA E S, MEIJLER M M, et al. Microbial spy games and host response: roles of a Pseudomonas aeruginosa small molecule in communication with other species [J]. PLoS Pathog, 2011, 7 (11) :e1002312. |
| [28] | WANG L, ZHANG L L, GENG Y F, et al. XerR, a negative regulator of XccR in Xanthomonas campestris pv. campestris, relieves its repressor function in planta [J]. Cell Res, 2011, 21 (7) :1131–1142 . |
| [29] |
孙蕾. 水稻白叶枯病菌群体感应信号DSF和c-di-GMP系统中重要基因的鉴定和功能分析[D]. 北京: 中国农业科学院, 2009.
SUN L. Identification and functional analysis of genes involved in DSF-mediated quorum sensing and c-di-GMP signaling system in Xanthomonas oryzae pv. oryzae[D]. Beijing: Chinese Academy of Agricultural Sciences, 2009. |
| [30] | HE Y W, WU J E, ZHOU L, et al. Xanthomonas campestris diffusible factor is 3-hydroxybenzoic acid and is associated with xanthomonadin biosynthesis, cell viability, antioxidant activity, and systemic invasion [J]. Mol Plant Microbe In, 2011, 24 (8) :948–957 . |
| [31] |
赵玉强, 韩振华, 高杜鹃, 等. 瓜类细菌性果斑病菌 LuxR 基因的功能分析 [J]. 农业生物技术学报, 2011,19 (3)
:542–548.
ZHAO Y Q, HAN Z H, GAO D J, et al. Functional analysis of LuxR gene in Acidovorax avenae subsp. citrulli [J]. J Agric Biotech, 2011, 19 (3) :542–548 . |
| [32] | MITCHELL R E, TEH K L. Antibacterial iminopyrrolidines from Burkholderia plantarii, a bacterial pathogen of rice [J]. Org Biomol Chem, 2005, 3 (19) :3540–3543 . |
| [33] | ANDR J, RADEMANN J, HOWE J, et al. Endotoxin-like properties of a rhamnolipid exotoxin from Burkholderia (Pseudomonas) plantarii: immune cell stimulation and biophysical characterization [J]. Biol Chem, 2006, 387 (3) :301–310 . |
| [34] | YUMIKO Y, KAORU N. Structure analysis of BasS and BasR in rice seedling blight pathogen Burkholderia plantarii[R]. Kiniki University, No.43, 2009: 31-35. |
| [35] |
杜艳芬, 廖璞. 微生物群体感应系统的研究进展 [J]. 国际检验医学杂志, 2013,34 (3)
:334–336.
DU Y F, LIAO P. Research progress on microbial quorum sensing system [J]. Int J Lab Med, 2013, 34 (3) :334–336 . |
| [36] |
刘长建, 权春善, 范圣第. Burkholderia 属 luxIR 同源群体感应系统的研究进展 [J]. 安徽农业科学, 2008,36 (14)
:5754–5756.
LIU C J, QUAN C S, FAN S D. Research advance in quorum-sensing system of luxIR homologs in genus Burkholderia [J]. J Anhui Agri Sci, 2008, 36 (14) :5754–5756 . |
| [37] | SOLIS R, BERTANI I, DEGRASSI G, et al. Involvement of quorum sensing and RpoS in rice seedling blight caused by Burkholderia plantarii [J]. FEMS Microbiol Lett, 2006, 259 (1) :106–112 . |
| [38] | DENG Y Y, SCHMID N, WANG C, et al. Cis-2-dodecenoic acid receptor RpfR links quorum-sensing signal perception with regulation of virulence through cyclic dimeric guanosine monophosphate turnover [J]. Proc Natl Acad Sci USA, 2012, 109 (38) :15479–15484 . |
| [39] | SHANK E A, KLEPAC-CERAJ V, COLLADO-TORRES L, et al. Interspecies interactions that result in Bacillus subtilis forming biofilms are mediated mainly by members of its own genus [J]. Proc Natl Acad Sci USA, 2011, 108 (48) :E1236–E1243 . |
| [40] | LUGTENBERG B, KAMILOVA F. Plant-growth-promoting rhizobacteria [J]. Annu Rev Microbiol, 2009, 63 (1) :541–556 . |
| [41] | BONFANTE P, ANCA I A. Plants, mycorrhizal fungi, and bacteria: a network of interactions [J]. Annu Rev Microbiol, 2009, 63 (1) :363–383 . |
| [42] | PHILIPPOT L, RAAIJMAKERS J M, LEMANCEAU P, et al. Going back to the roots: the microbial ecology of the rhizosphere [J]. Nat Rev Microbiol, 2013, 11 (11) :789–799 . |
| [43] | STRAIGHT P D, KOLTER R. Interspecies chemical communication in bacterial development [J]. Annu Rev Microbiol, 2009, 63 (1) :99–118 . |
| [44] | BRADER G, COMPANT S, MITTER B, et al. Metabolic potential of endophytic bacteria [J]. Curr Opin Biotechnol, 2014, 27 :30–37 . |
| [45] | SHANK E A, KOLTER R. New developments in microbial interspecies signaling [J]. Curr Opin Microbiol, 2009, 12 (2) :205–214 . |
| [46] | DONG Y H, WANG L H, ZHANG L H. Quorum-quenching microbial infections: mechanisms and implications [J]. Philos Trans R Soc Lond B Biol Sci, 2007, 362 (1483) :1201–1211 . |
| [47] | MANEFIELD M, RASMUSSEN T B, HENZTER M, et al. Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover [J]. Microbiology, 2002, 148 (4) :1119–1127 . |
| [48] | MANEFIELD M, TURNER S L. Quorum sensing in context: out of molecular biology and into microbial ecology [J]. Microbiology, 2002, 148 (12) :3762–3764 . |
| [49] | RASMUSSEN T B, SKINDERSOE M E, BJARNSHOLT T, et al. Identity and effects of quorum-sensing inhibitors produced by Penicillium species [J]. Microbiology, 2005, 151 (5) :1325–1340 . |
| [50] | CUGINI C, CALFEE M W, FARROW J M, et al. Farnesol, a common sesquiterpene, inhibits PQS production in Pseudomonas aeruginosa [J]. Mol Microbiol, 2007, 65 (4) :896–906 . |
| [51] | CHERNIN L, TOKLIKISHVILI N, OVADIS M, et al. Quorum-sensing quenching by rhizobacterial volatiles [J]. Environ Microbiol Rep, 2011, 3 (6) :698–704 . |
| [52] | KIM J, PARK W. Indole inhibits bacterial quorum sensing signal transmission by interfering with quorum sensing regulator folding [J]. Microbiology, 2013, 159 (12) :2616–2625 . |
| [53] | HIDALGO-ROMANO B, GOLLIHAR J, BROWN S A, et al. Indole inhibition of N-acylated homoserine lactone-mediated quorum signalling is widespread in Gram-negative bacteria [J]. Microbiology, 2014, 160 (11) :2464–2473 . |
| [54] | DONG Y H, ZHANG X F, XU J L, et al. Insecticidal Bacillus thuringiensis silences Erwinia carotovora virulence by a new form of microbial antagonism, signal interference [J]. Appl Environ Microbiol, 2004, 70 (2) :954–960 . |
| [55] | HAM J H, MELANSON R A, RUSH M C. Burkholderia glumae: next major pathogen of rice? [J]. Mol Plant Pathol, 2011, 12 (4) :329–339 . |
| [56] | ZHU H, HE C C, CHU Q H. Inhibition of quorum sensing in Chromobacterium violaceum by pigments extracted from Auricularia auricular [J]. Lett Appl Microbiol, 2011, 52 (3) :269–274 . |
| [57] | DAMALAS C A, ELEFTHEROHORINOS I G. Pesticide exposure, safety issues, and risk assessment indicators [J]. Int J Environ Res Public Health, 2011, 8 (5) :1402–1419 . |
| [58] | MIYAKE T, TATEISHI H, SAKUMA Y, et al. A novel soil-type biopesticide KNB422-soil against rice seedling diseases [J]. J Pestic Sci, 2012, 37 (2) :129–134 . |
 2016, Vol. 18
2016, Vol. 18