2. 福建省作物有害生物监测与治理重点实验室, 福州 350003;
3. 福建省种子管理总站, 福州 350001
2. Fujian Key Laboratory for Monitoring and Integrated Management of Crop Pests, Fuzhou 350003, China;
3. Fujian Seed Management Station, Fuzhou 350001, China
玉米小斑病(corn southern leaf blight)是全世界普遍发生的玉米叶部重要病害,1970年该病在美国大流行,造成经济损失高达10亿美元,曾在植病界引起极大震动[1]。随着玉米种植产业化的发展、品种更新和栽培制度的变革,玉米小斑病在各产区普遍发生,其中以夏玉米发病尤为严重,损失率可达30%~80%,甚至毁种绝收[2, 3]。化学防治是目前中国玉米小斑病防治的主要措施,常用杀菌剂有多菌灵(carbendazim)、代森锰锌(mancozeb)、甲基硫菌灵(thiophanate-methyl)、百菌清(chlorothalonil)、咪鲜胺(prochloraz)及烯唑醇(diniconazole)等。由于长期单一使用,部分地区的玉米小斑病菌Bipolaris maydis已对甲基硫菌灵及多菌灵等药剂产生了较强的抗药性,导致其防治效果显著降低[4, 5, 6]。
麦角甾醇脱甲基抑制剂(sterol demethylation inhibitor,DMI)类杀菌剂是甾醇途径合成抑制剂中最重要的一类杀菌剂,在植物真菌性病害防治中发挥着重要作用[7],目前该类杀菌剂对玉米小斑病菌仍表现出较强的毒力[8],对田间病害的防治效果较好[5]。但由于该类杀菌剂作用位点单一,随着其使用时间延长或剂量的提高,病原菌产生抗性的风险也较高。有研究表明,多种植物病原菌已对DMIs杀菌剂出现了敏感性降低或产生抗性的菌株,如在桃褐腐病菌Monilinia fructicola和苹果轮纹病菌Botryosphaeria berengeriana上已陆续检测到对丙环唑敏感性降低的菌株[9, 10, 11],同时发现了对烯唑醇敏感性显著降低的葡萄胶胞炭疽菌Colletotrichum gloeosporioides[12]、玉米穗腐病菌Fusarium verticillioides[13]和玉米小斑病菌[14],而在水稻恶苗病菌Fusarium moniliforme上也已检测到高抗咪鲜胺的菌株[15]。
监测病原菌对常用杀菌剂的敏感性,是保证有效防治病害的基础。以咪鲜胺、烯唑醇和丙环唑为代表的DMIs杀菌剂在中国已有10年以上的用药历史,同时也是福建省生产上防治玉米叶斑病的常用药剂。但关于玉米小斑病菌对这3种DMIs杀菌剂的敏感性如何,以及是否已产生抗药性的研究报道较少。为此,本研究测定了从中国福建省主要玉米产区(5个地区、15个市县)采集的185个玉米小斑病菌菌株对丙环唑、烯唑醇及咪鲜胺的敏感性,建立了其相对敏感基线,分析了供试菌株对3种杀菌剂敏感性间的相关性以及不同地区菌株的敏感性分布情况,以期为DMIs杀菌剂在玉米小斑病防治中的合理使用提供依据,并为田间病原菌的抗药性监测提供信息。
1 材料与方法 1.1 供试菌株2014年从中国福建省三明、南平、漳州、福州及莆田5个地区、15个市县不同玉米产区采集病样,采用常规组织分离法[16],经单孢纯化,共获得185株玉米小斑病菌Bipolaris maydis菌株,并经致病性测定。所有菌株均保存于4 ℃冰箱中。
1.2 药剂及试剂95%丙环唑(propiconazole)原药,浙江世佳科技有限公司;95%烯唑醇(diniconazole)原药,武汉远成共创科技有限公司;98.4%咪鲜胺(prochloraz)原药,江苏辉丰农化股份有限公司;二甲基亚砜,国药集团化学试剂有限公司。
1.3 病原菌对3种杀菌剂的敏感性测定采用菌丝生长速率法[17]测定。将丙环唑、烯唑醇和咪鲜胺原药用二甲基亚砜溶解,配制为1×104 μg/mL的母液,再用无菌的1%吐温-80溶液稀释,分别配制31.25、6.25、1.25、0.25、0.05、0.01和0.002 μg/mL系列质量浓度的含药马铃薯葡萄糖琼脂(PDA)培养基平板。供试菌株在PDA培养基上于28 ℃预培养5 d后,用直径5 mm的打孔器在靠近菌落边缘的同一圆周上打取菌饼,菌丝面朝下接种到含有不同浓度药剂的PDA培养基平板中央,另设不含药培养基平板作对照。每皿接种1个菌碟,并置于(28±1)℃的恒温培养箱中培养6 d后,用十字交叉法测量各处理的菌落生长直径(mm)[18]。每药剂浓度处理设4次重复,取平均值,按公式(1)计算各处理对菌丝生长的抑制率(%)。

将病原菌群体对供试药剂的敏感性从高到低分成不同区间,统计EC50值在各个区间的菌株占整个群体的频率(%)。以EC50值为x轴,相应的频率(%)为y轴,即得到病原菌群体对该种杀菌剂的敏感性分布图[19]。根据病原菌的敏感性频率分布建立其对3种杀菌剂的相对敏感基线。
1.5 病原菌对杀菌剂的敏感性水平划分利用所建立的相对敏感基线,按公式(2)计算各菌株的抗性倍数,并依据抗性倍数大小将病原菌对杀菌剂的敏感性划分为4个类型[20],按公式(3)计算各类型菌株出现的频率,以比较不同地区菌株之间对杀菌剂的敏感性差异。

抗性倍数≤ 2为敏感菌株(S);2 <抗性倍数≤ 5为低抗菌株(LR);5 <抗性倍数≤ 10为中抗菌株(MR);抗性倍数> 10为高抗菌株(HR)。

所得数据经DPS v6.55统计软件处理,通过菌丝生长抑制率几率值和药剂质量浓度对数值之间的线性回归分析,求出各药剂对菌株的毒力回归方程、相关系数(r)和EC50值。同时就供试菌株对杀菌剂的敏感性频次分布进行正态性检验,并采用Microsoft Excel 2003数据处理工作平台进行相关性分析。
2 结果与分析 2.1 玉米小斑病菌对3种杀菌剂的敏感性测定结果表明:185个玉米小斑病菌菌株对丙环唑的EC50值在0.018 6~7.779 μg/mL之间,平均为(0.656 5±0.061 6)μg/mL,最高值为最低值的418倍;对烯唑醇的EC50值在0.041 6~22.32 μg/mL之间,平均为(0.682 7±0.123 9)μg/mL,最高值为最低值的536倍;对咪鲜胺的EC50值在0.005 3~7.930 μg/mL之间,平均为(0.534 4±0.052 9)μg/mL,最高值是最低值的1 496倍。所检测的3种杀菌剂中,烯唑醇的平均EC50值最大,表明病原菌对其的敏感性最低。
将上述EC50值范围划分成13个区间,每个区间菌株出现的频率见图 1。通过DPS分析Shapiro-Wilk正态性检验结果,显示菌株对丙环唑(W=0.826 1,P=0.014 2 < 0.05)、烯唑醇(W=0.788 5,P=0.005 < 0.05)和咪鲜胺(W=0.718 9,P=0.000 9 < 0.05)的敏感性频次分布不符合正态分布,表明不同玉米小斑病菌对3种杀菌剂的敏感性均出现了分化,并已出现敏感性降低的亚群体。
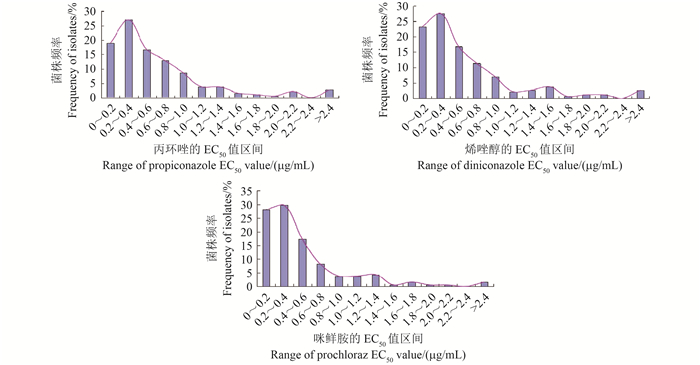 | 图 1 玉米小斑病菌对3种杀菌剂的敏感性频次分布 Fig. 1 The frequency distribution of sensitivity of B. maydis populations to the 3 fungicides |
供试菌株对丙环唑、烯唑醇和咪鲜胺的敏感性虽已出现一定的分化,但仍分别有95.14%、88.12%和90.82%的菌株集中位于图 1中相应的主峰范围内,其敏感性频率分布均为连续单峰曲线,通过DPS分析Shapiro-Wilk正态性检验结果,显示该群体菌株对丙环唑(W=0.887 9,P=0.160 9 > 0.05)、烯唑醇(W=0.971 6,P=0.903 0 > 0.05)和咪鲜胺(W=0.855 0,P=0.172 7 > 0.05)的敏感性频次分布呈近似正态分布,其EC50平均值分别为(0.519 9±0.028 4)、(0.407 9±0.020 4)和(0.381 8±0.020 2)μg/mL。因此可将此EC50平均值初步作为玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的相对敏感基线。
2.3 病原菌对3种杀菌剂敏感性的相关性分析相关性分析结果(图 2)表明:供试菌株对丙环唑、烯唑醇和咪鲜胺的敏感性均呈显著正相关性,表明玉米小斑病菌对这3种杀菌剂均存在一定程度的交互抗性。其中,菌株对丙环唑和烯唑醇的敏感性群体相关性最高,其相关系数(r)为0.886 2(P < 0.05),而对丙环唑和咪鲜胺的敏感性群体相关性(r=0.643 9,P < 0.05)以及对咪鲜胺和烯唑醇的敏感性群体相关性(r=0.607 7,P < 0.05)均较低,表明菌株对丙环唑和烯唑醇的交互抗性更为明显。
 | 图 2 玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的交互抗性 Fig. 2 Cross-resistance of B. maydis to propiconazole, diniconazole and prochloraz |
185个菌株中分别有15.14%、20.00%和17.30%的菌株对丙环唑、烯唑醇和咪鲜胺表现为敏感性下降,其中中抗菌株出现的频率分别为0.54%、3.24%和1.62%,高抗菌株出现的频率分别为1.08%、0.54%和0.54%,而高抗菌株中最不敏感菌株的抗性倍数分别达14.96、54.71和20.77。
不同地区采集的菌株对3种杀菌剂的敏感性存在较大差异。其中,漳州地区菌株对丙环唑和烯唑醇的平均EC50值最高,分别为0.959 1和1.287 μg/mL,表现为最不敏感;而福州地区菌株对丙环唑和烯唑醇的平均EC50值最低,分别为0.446 0和0.448 6 μg/mL,仍较为敏感;南平地区菌株对咪鲜胺的平均EC50值(0.601 8 μg/mL)最高;莆田地区菌株对咪鲜胺的平均EC50值(0.377 0 μg/mL)最低。
漳州地区检出了对丙环唑和烯唑醇分别表现为低抗、中抗和高抗的菌株,以及对咪鲜胺为低抗和高抗的菌株;南平地区检出了对丙环唑为低抗和高抗的菌株,对烯唑醇为低抗和中抗的菌株,以及对咪鲜胺为低抗的菌株;福州地区检出了对烯唑醇和咪鲜胺为低抗和中抗的菌株;三明地区检出了对烯唑醇为低抗的菌株,对咪鲜胺为低抗和中抗的菌株;而莆田地区仅检出了对烯唑醇为低抗的菌株。其相应的敏感性频率分布见表 1。
|
| 表 1 不同地区玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的敏感性水平 Table 1 Sensitivity level of B. maydis populations isolated from different areas in Fujian to propiconazole, diniconazole and prochloraz |
本研究结果显示,所采集的185个玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺均出现了敏感性分化,并已出现敏感性降低的亚群体,抗性菌株的抗性倍数分别高达14.96、54.71和20.77,其中最不敏感菌株的EC50值分别为最敏感菌株EC50值的418、536和1 496倍,表明来自福建省不同地区的玉米小斑病菌已对这3种DMIs杀菌剂产生了一定水平的抗性。张立新等[8]测定了安徽省不同地区玉米小斑病菌对烯唑醇的敏感性,也发现了敏感性下降的菌株(EC50值为76.81 μg/mL),其余菌株的EC50值介于0.162 4~4.258 μg/mL之间,本研究结果与之较为接近。在供试3种杀菌剂中,病原菌对烯唑醇的敏感性明显低于对丙环唑和咪鲜胺的,其原因还需从烯唑醇的田间用药频率及该类化合物是否易使病原菌产生抗药性突变等方面进行深入分析。
建立敏感基线是病原菌抗药性研究和监测的基础。本研究以组成连续单峰频次分布88%以上菌株群体的EC50平均值为依据,建立了玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的相对敏感基线,可为玉米小斑病菌的田间抗药性监测提供参考。通过分析,在福建省5个地区均检测到了敏感性下降的菌株及不同抗性倍数的抗性菌株。不同地区分离的玉米小斑病菌对3种杀菌剂的敏感性均存在较大差异,其中漳州地区菌株对丙环唑和烯唑醇的敏感性最差;南平地区菌株对咪鲜胺最不敏感;漳州地区菌株对丙环唑、烯唑醇及咪鲜胺均表现出了较高水平的抗性。病原菌对药剂的敏感性差异,除与自然界中病原菌本身的地理差异有关之外,也可能与种植地区使用该类药剂的种类、水平及历史有关。
众多研究表明,DMIs杀菌剂之间存在交互抗药性。Hsiang等报道,草坪草币斑病菌Sclerotinia homoeocarpa对DMIs杀菌剂表现出了一定趋势的交互抗性[21];刘鹏等的研究表明,苹果轮纹病菌对多菌灵和亚胺唑(imidazole)、多菌灵和丙环唑之间没有交互抗性,而对丙环唑和亚胺唑之间存在交互抗性[11];刘保友等研究发现,苹果轮纹病菌对苯醚甲环唑(difenoconazole)、氟硅唑(flusilazole)和戊唑醇(tebuconazole)之间具有交互抗性,在这3种药剂与代森锰锌之间不存在交互抗性[22]。本研究结果表明,玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺3种DMIs杀菌剂之间存在显著的交互抗性,其中对丙环唑和烯唑醇的交互抗性相关系数最高。由于咪鲜胺属于咪唑类DMIs杀菌剂,而烯唑醇和丙环唑属于三唑类DMIs杀菌剂,因此推测其交互抗性表现与杀菌剂的作用机制不同有关。有关玉米小斑病菌对DMIs类杀菌剂与其他类杀菌剂之间的交互抗性还需进一步明确。
目前生产上已普遍应用三唑类杀菌剂防治玉米叶斑病,尽管本研究测定的大多数菌株对丙环唑、烯唑醇和咪鲜胺仍表现敏感,但抗药性菌株的出现预示着采用丙环唑、烯唑醇及咪鲜胺等DMIs杀菌剂防治玉米小斑病具有一定的风险性。漳州地区地处福建省南部,作物复种指数较高,农民用药意识较好,同时该地区也是福建省玉米小斑病发生较为严重的地区。通过调查,该地区检测到抗性菌株的玉米农场曾使用咪鲜胺、烯唑醇及苯醚甲环唑等药剂进行病害防治。这表明田间病原菌群体对该类杀菌剂的敏感性会随着药剂使用时间的延长而降低,因此建议应加强玉米小斑病菌对该类药剂的敏感性监测,同时合理搭配使用其他具有不同作用机制的药剂,以减小对潜在抗性菌株的选择性压力,延缓病原菌对该类药剂的抗性发展。
| [1] | ULLSTRUP A J. The impacts of the southern corn leaf blight epidemics of 1970-1971[J]. Ann Rev Phytopathol, 1972, 10:37-50. |
| [2] | 王晓鸣, 晋齐鸣, 石洁, 等. 玉米病害发生现状与推广品种抗性对未来病害发展的影响[J]. 植物病理学报, 2006, 36(1):1-11.WANG X M, JIN Q M, SHI J, et al. The status of maize diseases and the possible effect of variety resistance on disease occurrence in the future[J]. Acta Phytopathol Sinica, 2006, 36(1):1-11. |
| [3] | 孙常刚. 玉米小斑病的发生与防治[J]. 安徽农学通报, 2012, 18(1):108-109.SUN C G. Occurrence and control of corn southern leaf blight[J]. Anhui Agric Sci Bull, 2012, 18(1):108-109. |
| [4] | 叶坤浩, 龚国淑, 祁小波, 等. 几种栽培措施对玉米纹枯病和小斑病的影响[J]. 植物保护, 2015, 41(4):154-159.YE K H, GONG G S, QI X B, et al. Effect of cultivation measures on sheath blight and southern leaf blight of corn[J]. Plant Protect, 2015, 41(4):154-159. |
| [5] | 谢伟烈, 郑卓辉, 谢艳华, 等. 5种杀菌剂防治甜玉米小斑病田间药效试验[J]. 广东农业科学, 2013, 40(9):77-79.XIE W L, ZHENG Z H, XIE Y H, et al. Test on control efficiency of 5 fungicides against Bipolaris maydis[J]. Guangdong Agric Sci, 2013, 40(9):77-79. |
| [6] | 李广领, 陈锡岭, 王建华, 等. 8种新型杀菌剂对玉米小斑病菌的室内毒力研究[J]. 湖南农业科学, 2006(5):74-77.LI G L, CHEN X L, WANG J H, et al. Toxicity effect of 8 fungicides against Bipolaris maydis in lab[J]. Hunan Agric Sci, 2006(5):74-77. |
| [7] | 詹家绥, 吴娥娇, 刘西莉, 等. 植物病原真菌对几类重要单位点杀菌剂的抗药性分子机制[J]. 中国农业科学, 2014, 47(17):3392-3404.ZHAN J S, WU E J, LIU X L, et al. Molecular basis of resistance of phytopathogenic fungi to several site-specific fungicides[J]. Scientia Agricultura Sinica, 2014, 47(17):3392-3404. |
| [8] | 张立新, 张军, 王建华, 等. 安徽省玉米小斑病菌对5种杀菌剂的敏感性[J]. 植物保护, 2011, 37(4):163-166.ZHANG L X, ZHANG J, WANG J H, et al. Sensitivity of Bipolaris maydis to five fungicides in Anhui province[J]. Plant Protect, 2011, 37(4):163-166. |
| [9] | SCHNABEL G, BRYSON P K, BRIDGES W C. Reduced sensitivity in Monilinia fructicola to propiconazole in Georgia and implications for disease management[J]. Plant Dis, 2004, 88(9):1000-1004. |
| [10] | BURNETT A, LALANCETTE N, MCFARLAND K. First report of the peach brown rot fungus Monilinia fructicola resistant to demethylation inhibitor fungicides in New Jersey[J]. Plant Dis, 2010, 94(1):126. |
| [11] | 刘鹏, 周增强, 国立耘. 苹果轮纹病菌对多菌灵、亚胺唑和丙环唑的敏感性[J]. 果树学报, 2009, 26(6):907-911.LIU P, ZHOU Z Q, GUO L Y. Sensitivity of Botryosphaeria berengeriana f. sp. piricola to carbendazim, imibenconazole and propiconazole fungicides[J]. J Fruit Sci, 2009, 26(6):907-911. |
| [12] | 邓维萍, 杨敏, 杜飞, 等. 葡萄胶孢炭疽菌对3种麦角甾醇脱甲基抑制剂类杀菌剂的敏感性[J]. 农药学学报, 2011, 13(3):245-252.DENG W P, YANG M, DU F, et al. Sensitivity of Colletotrichum gloeosporioides causing grape anthracnose to three sterol demethylation inhibitor(DMI) fungicides[J]. Chin J Pestic Sci, 2011, 13(3):245-252. |
| [13] | FAN J R, CHEN F P, DIAO Y, et al. The Y123H substitution perturbs FvCYP51B function and confers prochloraz resistance in laboratory mutants of Fusarium verticillioides[J]. Plant Pathol, 2014, 63(4):952-960. |
| [14] | 张立新, 董猛, 杨丽敏, 等. 安徽省玉米小斑病菌生理小种鉴定及对烯唑醇的敏感性[J]. 植物病理学报, 2011, 41(4):441-444.ZHANG L X, DONG M, YANG L M, et al. Identification of physiological races of Bipolaris maydis and their sensitivities to diniconazole in Anhui province[J]. Acta Phytopathol Sinica, 2011, 41(4):441-444. |
| [15] | 陈夕军, 卢国新, 童蕴慧, 等. 水稻恶苗病菌对三种浸种剂的抗性及抗药菌株的竞争力[J]. 植物保护学报, 2007, 34(4):425-430.CHEN X J, LU G X, TONG Y H, et al. Resistance of Fusarium moniliforme rice bakanae disease pathogen to 3 fungicides for seed-treatment and competition ability of resistant strains[J]. Acta Phytophyl Sinica, 2007, 34(4):425-430. |
| [16] | 方中达. 植病研究方法[M]. 3版. 北京:中国农业出版社, 1998:46.FANG Z D. Plant pathology research methods[M]. 3rd ed. Beijing:China Agriculture Press, 1998:46. |
| [17] | 范昆, 张雪丹, 余贤美, 等. 无花果炭疽病菌的生物学特性及8种杀菌剂对其抑制作用[J]. 植物病理学报, 2013, 43(1):75-81.FAN K, ZHANG X D, YU X M, et al. Biological characteristics of Colletotrichum gloeosporioides and inhibitory effects of eight fungicides[J]. Acta Phytopathol Sinica, 2013, 43(1):75-81. |
| [18] | 张素华. 杀菌剂生物测定方法的研究[J]. 南开大学学报(自然科学版), 2000, 33(4):37-40.ZHANG S H. The study on fungicidal bioassay method[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis(Natl Sci Ed), 2000, 33(4):37-40. |
| [19] | 张传清, 张雅, 魏方林, 等. 设施蔬菜灰霉病菌对不同类型杀菌剂的抗性检测[J]. 农药学学报, 2006, 8(3):245-249.ZHANG C Q, ZHANG Y, WEI F L, et al. Detection of resistance of Botryotinia fuckeliana from protected vegetables to different classes of fungicides[J]. Chin J Pestic Sci, 2006, 8(3):245-249. |
| [20] | 马志强, 李红霞, 袁章虎, 等. 苹果轮纹病菌对多菌灵抗药性监测初报[J]. 农药学学报, 2000, 2(3):94-96.MA Z Q, LI H X, YUAN Z H, et al. Preliminary research on detection of resistance of apple ring rot(Macrophoma kawatsukai) to carbendazim[J]. Chin J Pestic Sci, 2000, 2(3):94-96. |
| [21] | HSIANG T, YANG L, BARTON W. Baseline sensitivity and cross-resistance to demethylation-inhibiting fungicides in Ontario isolates of Sclerotinia homoeocarpa[J]. Eur J Plant Pathol, 1997, 103(5):409-416. |
| [22] | 刘保友, 张伟, 栾炳辉, 等. 苹果轮纹病菌对苯醚甲环唑和氟硅唑的敏感性及其交互抗性[J]. 植物病理学报, 2013, 43(5):541-548.LIU B Y, ZHANG W, LUAN B H, et al. Sensitivity of Botryosphaeria dothidea to difenoconazole and flusilazole and crossresistance of different fungicides[J]. Acta Phytopathol Sinica, 2013, 43(5):541-548. |
 2016, Vol. 18
2016, Vol. 18


