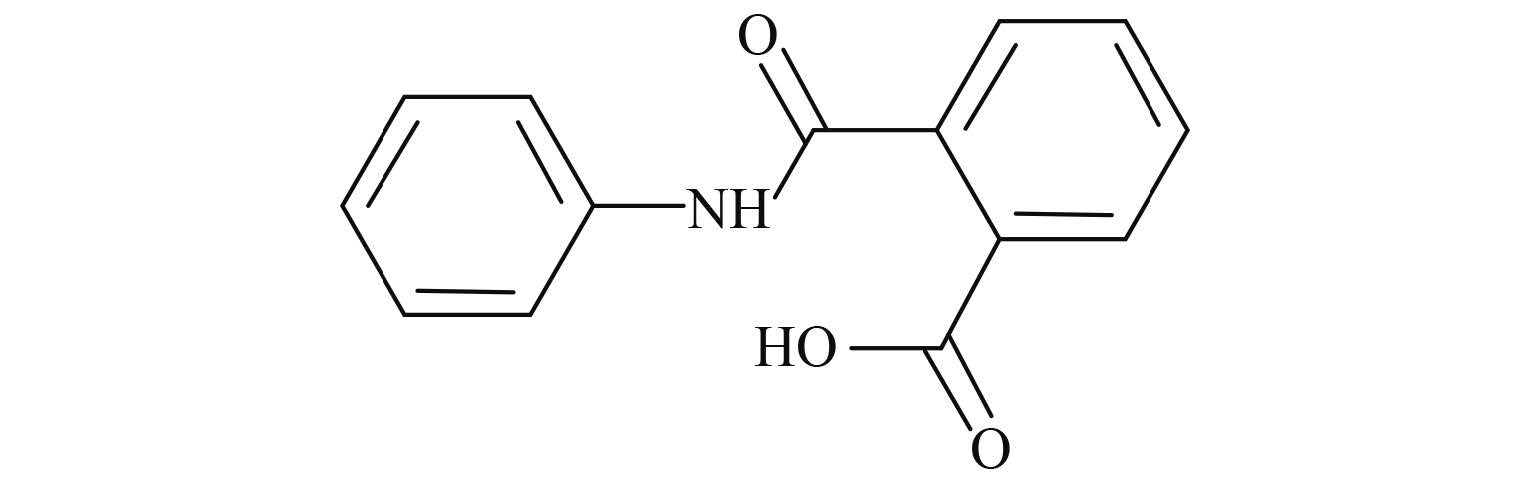
苯肽胺酸 (N-phenyl-phthalamic acid,PPA) (图式 1) 是一种植物生长调节剂,由匈牙利的 Neviki 研究机构研发[1, 2],CAS 号为 4727-29-1。其作用机理是通过延长植物柱头的寿命,提高授粉概率,从而提高农作物的产量。Nyéki 等的研究表明,苯肽胺酸对植物没有毒性,也不会造成单性结实[3]。由于其具有低毒、高效的优点,苯肽胺酸在农业上已得到广泛应用。但目前国内外针对该农药的研究主要涉及其对农作物产量及环境的影响方面[1, 2, 3],有关其在动物体内分布、代谢等基础研究的资料较少。毒物动力学是农药毒理学风险评价的重要组成部分,因此,笔者主要针对苯肽胺酸单剂量经大鼠胃肠道吸收后的毒物动力学及组织分布进行了研究,以期为阐明该农药在动物体内的生物转运过程,以及其风险评价和中毒的防治提供科学依据。
|
图式 1 苯肽胺酸 Scheme 1 N-phenyl-phthalamic acid |
Waters 2695 高效液相色谱仪配 Waters 2996 PDA 检测器 (HPLC-PDA,美国Waters公司);XB-NH2(4.6 mm×250 mm,5 μm) 色谱柱 (美国 Welch 公司);SZ93-1 自动双重纯水蒸馏器 (上海亚荣生化仪器厂);BS200S 千分之一电子天平 (北京赛多利斯天平有限公司);T18 匀浆机 (德国 IKA 集团);KDC-160HR 高速冷冻离心机 (科大创新股份有限公司中佳分公司)。
苯肽胺酸 (N-phenyl-phthalamic acid,PPA) 原药,由陕西上格之路生物科学有限公司提供,纯度≥97%,淡黄色粉末状,微溶于水,易溶于有机溶剂,使用前经 3 次重结晶。
试剂有色谱纯乙腈 (99.9%)、甲酸 (88%)及氯化钠 (99.5%);溶剂为金龙鱼食用调和油 (益海嘉里武汉粮油工业有限公司)。
1.2 实验动物SPF 级成年雄性 Sprague Dawley 大鼠 40 只,体重 230~314 g,由华中科技大学实验动物中心提供,合格证号:SCXK (鄂) 2010-0009,实验动物使用许可证号:SYXK (鄂) 2014-0046。饲养条件:室温 19~24 ℃,相对湿度 40%~70%,光周期 (明/暗) 12 h/12 h,独笼饲养,自由饮水和摄食。
1.3 动物分组与给药剂量选择动物染毒采用灌胃法。试验分为 3 组:血液组、组织分布组及排泄组,血液及排泄组每组4 只大鼠,组织分布组共设 6 个观测时间点,每个时间点 4 只大鼠。参照 OECD 相关要求[4],结合苯肽胺酸对大鼠的毒性作用 (急性经口毒性 LD50>5 000 mg/kg),灌胃给药剂量为 2 500 mg/kg,药液量为 10 mL /kg。由于苯肽胺酸难溶于水,配制时以食用油为溶剂。大鼠于给药前12 h 隔夜禁食,不禁水,灌胃后 2 h 自由进食。
1.4 生物样品制备血液组于给药后 0、5、15、30 min 和 1、2、4、8、12、24、36、48、72 h 各时间点分别通过尾尖采血法采集 0.5 mL 血样,9 000 r/min 下离心 8 min,分离血清;取 100 μL血清,加入 0.6 mL 含 0.4% 甲酸 (体积分数,余同) 的乙腈,充分振荡,提取苯肽胺酸;提取液于 4 ℃、15 000 r/min下离心 8 min,取上清液用 0.22 μm 一次性针式过滤器滤膜过滤,待 HPLC 测定。
组织分布组大鼠分别于给药后 2、4、8、24、48 及 168 h 断头处死并放净血液,立即在冰盘中剖取心脏、肝脏、脾脏、肺、肾脏、大脑、睾丸、肌肉及脂肪等脏器和组织,用预冷的生理盐水漂洗净残血,滤纸吸干,装入密封袋中,于 - 20 ℃ 条件保存,备用。
排泄组大鼠给药后单只饲养在代谢笼中,每天收集 24 h 的全部粪便和尿液,连续收集 7 d。尿液分装于离心管中,-20 ℃ 冰箱保存,粪便用培养皿避光晾干后磨粉、充分混匀,备用。
组织分布和排泄试验样品中苯肽胺酸的提取:准确称取 0.3 g 组织样品,加入 1.2 mL 含 0.4% 甲酸的乙腈,冰浴匀浆;尿液取 0.3 mL,粪便粉末称取 0.3 g,均分别加入 1.2 mL 含 0.4% 甲酸的乙腈,充分振荡 3 min。将上述样品静置 30 min,加入饱和氯化钠溶液 0.6 mL,充分振荡 3 min,静置 20 min;取上层清液加入离心管,于 4 ℃、15 000 r/min 下离心 8 min;上清液经 0.22 μm 滤膜过滤,待 HPLC 测定。
1.5 HPLC 测定条件苯肽胺酸含量测定参照赵欢欢等的方法[1]并进行了改进和优化:检测波长 254 nm,进样体积 10 μL,柱温 40 ℃,流速 1 mL/min。血液样品洗脱流动相为 V (乙腈) ︰V (0.4% 甲酸水溶液) = 65︰35,其余样品洗脱的流动相为 V (乙腈) ︰V (0.2% 甲酸水溶液) = 80︰20。在此条件下,方法的灵敏度、线性范围、准确度和精密度均较高,满足毒物动力学研究要求[5]。苯肽胺酸的 HPLC 谱图见图 1 (以血液和肾脏组织样本色谱图为例)。

|
A. 大鼠染毒 30 min 后血液样本色谱图;B. 大鼠染毒 4 h 后肾组织样本色谱图。 A. Chromatograms of serum sample in 30 min after administer; B. Chromatograms of kidney tissue sample in 4 h after administer. 图 1 血液和肝脏组织样本色谱图 Fig. 1 Chromatograms of serum and tissue samples |
采用 Waters 2695 empower 2 工作站对 HPLC 数据进行采集、分析;通过 DAS 3.2.6 软件对获得的血药检测数据进行拟合分析,采用非房室模型进行拟合,计算毒物动力学参数。
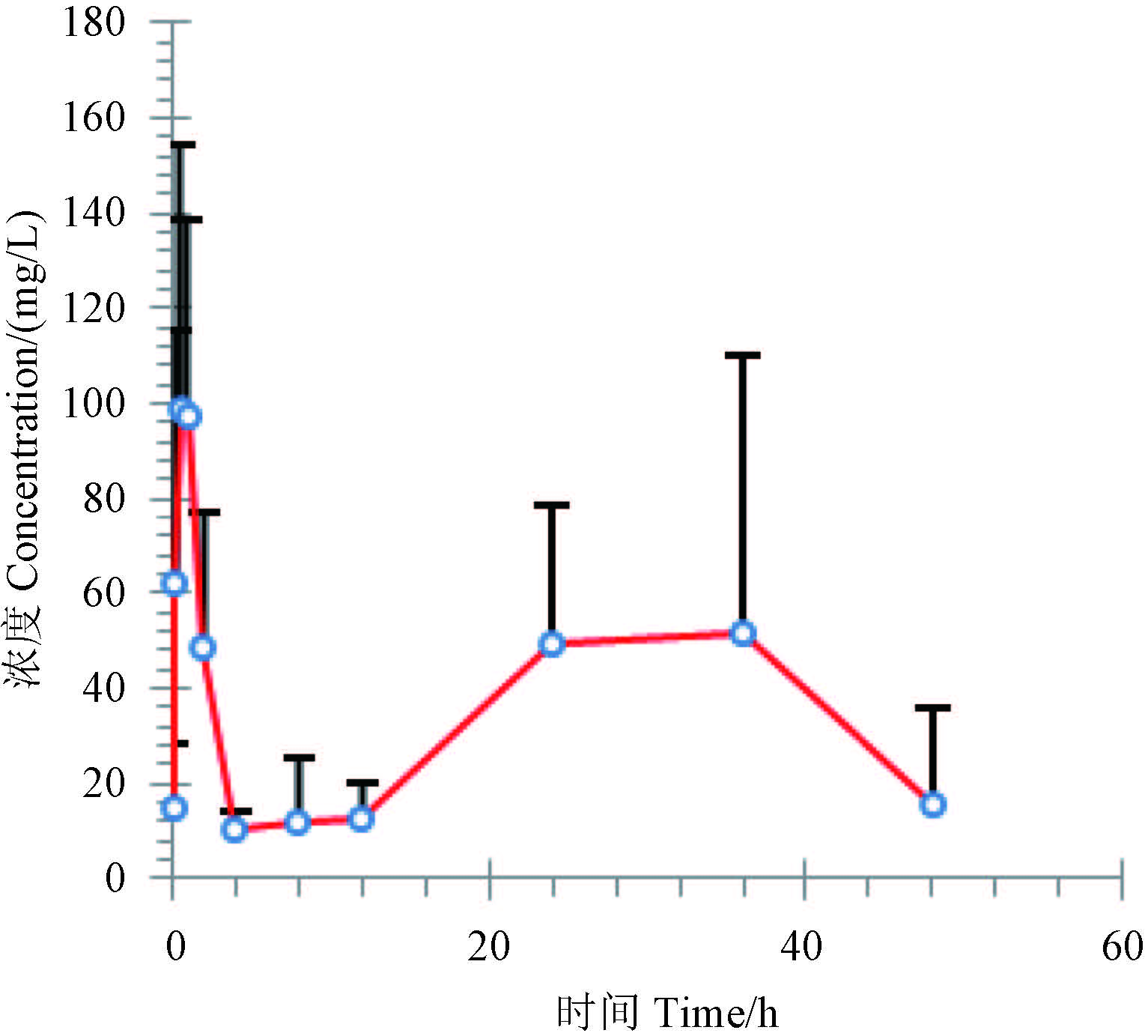
2 结果与分析 2.1 苯肽胺酸经胃肠道给药后的毒物动力学大鼠经苯肽胺酸灌胃染毒后,其血药平均浓度的经时过程曲线见图 2,主要毒物动力学参数见表 1。结果表明:大鼠对苯肽胺酸吸收速率较快,其半吸收期 t1/2ka 仅 9 min,血药浓度达峰时间 (tmax) 为 40.8 min,峰浓度 (Cmax) 值为 141.48 mg/L。从图 2 可见,血液中苯肽胺酸浓度在给药后 4 h 时降到最低,但从 12 h 开始又呈上升趋势,至 36 h 后再次开始下降,提示苯肽胺酸在大鼠体内可能存在肠-肝循环。苯肽胺酸在大鼠体内分布快且分布范围广,其半分布期 (t1/2α) 为 13.2 min,表观分布容积 (Vz/F) 为 17.54 L/kg,远大于机体的含水量。苯肽胺酸从大鼠体内消除也较快,其清除率 (CLz/F) 为 1.32 (L/h)/kg,体内平均驻留时间 (MRT(0-∞)) 为 25.69 h,消除半减期 (t1/2z) 为 7.77 h,即经过 4.5×t1/2z 约 35 h,95% 以上的苯肽胺酸可从大鼠体内消除。
|
图 2 灌胃染毒后大鼠血清中苯肽胺酸的浓度-时间曲线 Fig. 2 The concentration-time curve of PPA in rat serum after oral administration |
|
|
表 1 苯肽胺酸的毒物动力学参数 Table 1 Toxicokinetics parameters of PPA (n=4) |
测定结果表明,大鼠灌胃给予苯肽胺酸后不同时间,其在各组织、脏器中均有分布,浓度由高到低依次为:肾脏>肺>肝脏>心脏>脾脏>肌肉>睾丸>脂肪>大脑 (表 2)。其中,肾脏中最高含量达 192.7 μg/g,其最高浓度水平出现时间点分别在给药后 2 h 和 24 h。以血液为非靶向组织,根据药物浓度-时间曲线下面积(AUC) 计算各被测组织的靶向分配系数 (te),结果也显示,te>1 的仅有肾脏组织 (4.77),提示苯肽胺酸在动物体内分布时对肾脏具有相对较高的选择性。但在对试验大鼠的解剖中并未发现肾脏组织出现明显的病理变化,而染毒后第 7 d 的大鼠的脾脏却明显增大、质量显著增加,提示苯肽胺酸可能对动物免疫系统具有一定的损害作用。
|
|
表 2 各组织中苯肽胺酸的分布 Table 2 Distribution of PPA in tissue |
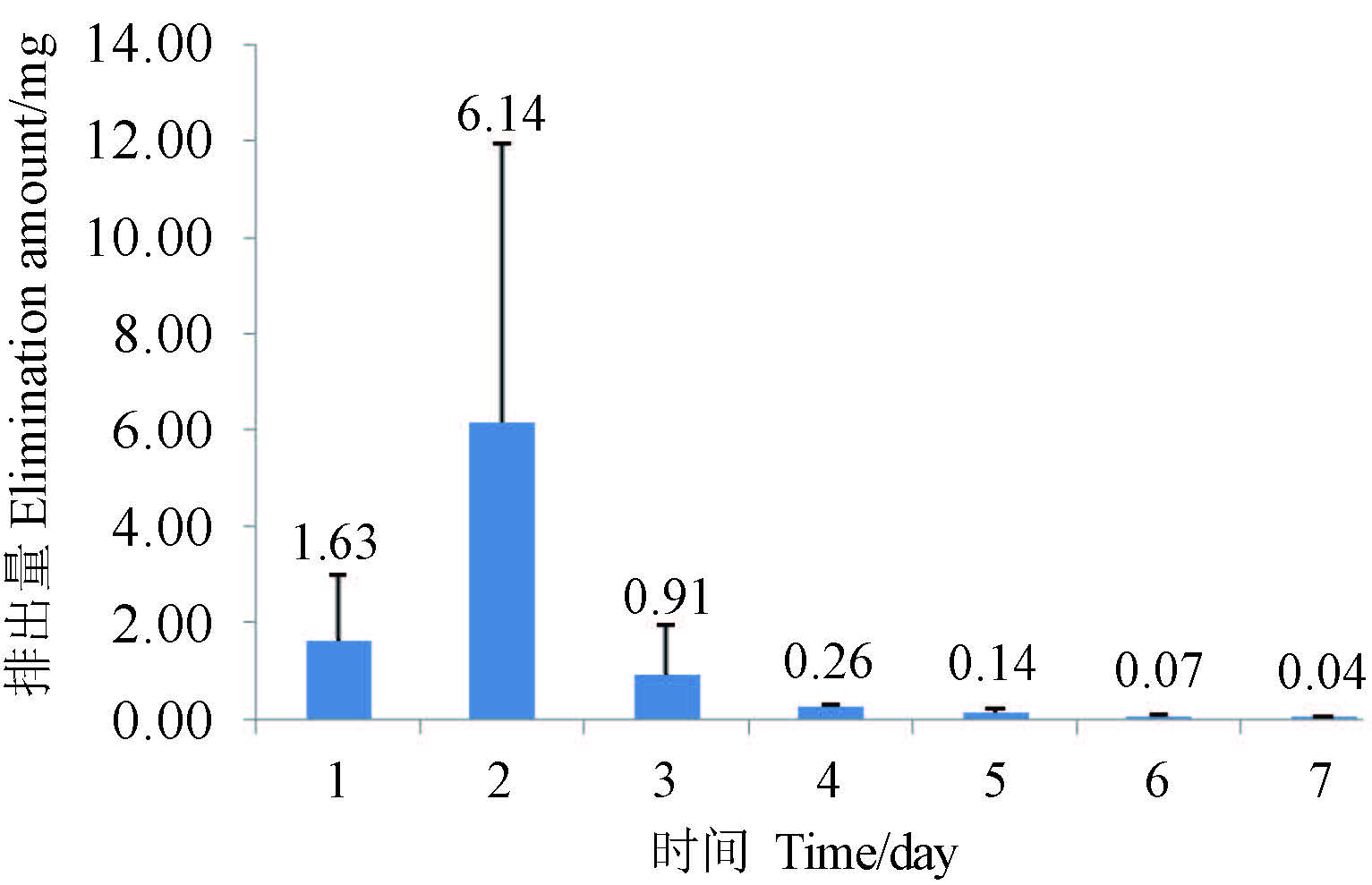
大鼠灌胃给予苯肽胺酸后粪便中排泄情况见图 3。7 d 经粪便排出的总量为 8.4 mg,占给药量 (大鼠平均体重为 231.2 g) 的 1.45%;连续 7 d 收集的尿液中均未检测出苯肽胺酸,分析这可能与药剂的脂溶性有关。
|
图 3 大鼠粪便中苯肽胺酸的含量 Fig. 3 Amount of PPA in rat feces |
毒物动力学研究结果表明:苯肽胺酸在大鼠体内吸收速率较快,t1/2ka 仅为 9 min,并可快速分布至全身,t1/2α 为 13.2 min,Vz/F 为 17.54 L/kg;苯肽胺酸从大鼠体内消除也较快,t1/2z 为 7.77 h,约经 35 h,体内 95% 以上的苯肽胺酸即可转化消除掉。
研究发现,苯肽胺酸的时间-血药浓度曲线出现了双峰现象,即在出现第一个血药峰浓度后,12 ~ 36 h 期间血药浓度又再次升高,出现了第二个峰浓度。根据类似化合物的研究[6, 7, 8, 9, 10, 11, 12, 13, 14],推测苯肽胺酸的羧基在Ⅱ相代谢酶尿苷二磷酸葡萄糖醛酸基转移酶的作用下可能与尿苷二磷酸葡萄糖醛酸发生了结合反应,该反应产物亲水性较强,可通过胆汁和泌尿系统排出。随胆汁排出的部分在肠道下段菌群的 β-葡萄糖醛酸酶作用下可发生水解,还原成苯肽胺酸,导致苯肽胺酸被重新吸收进入肠-肝循环,从而使其体内经时过程呈现双峰现象。具体的发生机制还有待通过建立体外肠-肝循环模型进一步研究。毒物代谢的研究途径有体内和体外两种[15],苯肽胺酸代谢产物研究可通过对动物血液、排泄物及组织等样本进行检测,了解代谢产物的种类和数量,同时通过离体肝脏灌流、细胞培养和微粒体孵育等体外试验,对代谢途径和机制进行研究。后续将就苯肽胺酸代谢产物的定性和定量等问题进行深入研究。
本研究还发现:大鼠肾脏组织中苯肽胺酸的浓度最高,靶向分配系数 te 达 4.77,且在连续 7 d 的尿液中均未检出苯肽胺酸,提示肾脏可能较其他组织对苯肽胺酸具有较高的亲和力;组织学检查未见肾脏组织出现异常,说明短时间内苯肽胺酸不会引起肾脏的组织病理改变;而在动物解剖中发现脾脏有明显肿大且质量显著增加,提示苯肽胺酸可能对动物免疫系统具有损害作用。此方面目前也尚未见相关研究报道,值得关注并进行深入研究。
| [1] | 新农药介绍[J]. 农药科学与管理, 1998(2):44-45.New pesticide is introduced[J]. Pest Sci Administ, 1998(2):44-45. |
| [2] | ZHAO H H, XU J, DONG F S, et al. Determination of phthalanilic acid residue in bean, fruits and vegetables using a modified QuEChERS method and ultra-performance liquid chromato-graphy/tandem mass spectrometry[J]. Anal Methods, 2014, 6(12):4336-4342. |
| [3] | RACSKÓ J. N-phenyl-phthalamic acid and fertilization effects on flowering, fruit set and fruit quality of apple (Malus domestica Borkh.)[J]. J Agric Sci, 2006, 24:24-28. |
| [4] | OECD guidelines for the testing of chemicals, section 4, test No. 417:toxicokinetics[S]. 2010-07-22. |
| [5] | 于敏, 张双庆, 李佐刚. 生物样品中化学药物定量分析方法验证的进展与解读[J]. 药物分析杂志, 2013, 33(11):2019-2024. YU M, ZHANG S Q, LI Z G. Progress and interpretation of quantitative analytical method validation of chemical medicines in biological samples[J]. Chin J Pharm Anal, 2013, 33(11):2019-2024. |
| [6] | 王心如. 毒理学基础[M]. 5版. 北京:人民卫生出版社, 2008:56-57. WANG X R. Basis of toxicology[M]. 5th ed. Beijing:People's Medical Publishing House, 2007:56-57. |
| [7] | 董婧, 陈西敬, 宋捷, 等. 阿托伐他汀大鼠体内药动学及肠肝循环研究[J]. 中国药科大学学报, 2008, 39(1):55-59. DONG J, CHEN X J, SONG J, et al. Pharmacokinetics and enterohepatic cycling of atorvastatin in rats[J]. J China Pharm Univ, 2008, 39(1):55-59. |
| [8] | PRUEKSARITANONT T, SUBRAMANIAN R, FANG X J, et al. Glucuronidation of statins in animals and humans:a novel mechanism of statin lactonization[J]. Drug Metab Dispos, 2002, 30(5):505-512. |
| [9] | VALLADARES-MÉNDEZ A, HERNÁNDEZ-NÚÑEZ E, CEDILLO-RIVERA R, et al. Synthesis, In vitro and in vivo giardicidal activity, and pharmacokinetic profile of a new nitazoxanide analog[J]. Med Chem Res, 2014, 23(6):3157-3164. |
| [10] | HELMY S A. Therapeutic drug monitoring and pharmacokinetic compartmental analysis of sulpiride double-peak absorption profile after oral administration to human volunteers[J]. Biopharm Drug Dispos, 2013, 34(5):288-301. |
| [11] | MIRFAZAELIAN A, MAHMOUDIAN M. A simple pharmacokinetics subroutine for modeling double peak phenomenon[J]. Biopharm Drug Dispos, 2006, 27(3):119-124. |
| [12] | BROEKHUYSEN J, STOCKIS A, LINS R L, et al. Nitazoxanide:pharmacokinetics and metabolism in man[J]. Int J Clin Pharmacol Ther, 2000, 38(8):387-394. |
| [13] | WILES D A, RUSSELL J L, OLSON K R, et al. Massive lindane overdose with toxicokinetics analysis[J]. J Med Toxicol, 2015, 11(1):106-109. |
| [14] | GODFREY K R, ARUNDEL P A, DONG Z M, et al. Modelling the double peak phenomenon in pharmacokinetics[J]. Comput Methods Programs Biomed, 2011, 104(2):62-69. |
| [15] | 柴士伟, 潘桂湘. 药物代谢研究方法简述[J]. 天津中医药, 2006, 23(1):83-85. CHAI S W, PAN G X. Drug metabolism research methods in brief[J]. Tianjin J Tradit Chin Med, 2006, 23(1):83-85. |
 2016, Vol. 18
2016, Vol. 18


