2. 沈阳化工研究院有限公司新农药创制与开发国家重点实验室, 沈阳 110021
2. State Key Laboratory of the Discovery and Development of Novel Pesticide, Shenyang Research Institute of Chemical Industry Co., Ltd., Shenyang 110021 China
荔枝霜疫霉是荔枝上的严重病害,主要为害荔枝的嫩梢、花穗、果枝和果实,造成落花、烂果和落果,其中以为害果实最严重,且在储运期间可继续为害,严重影响荔枝产量和鲜果品质。目前该病的流行频率及程度逐渐加重,已成为荔枝生产的重要障碍。据福建省厦门地区多年调查显示,霜疫霉病的平均发病率在 20%以上,严重者高达 60%,在春雨、梅雨季较长的年份,烂果率高达 30%~50%[1]。
荔枝霜疫霉病原菌为 Peronophythora litchii Chen ex ko et al,属卵菌门卵菌纲霜霉目霜疫霉科[2, 3],该病原菌浸染过程极短,荔枝结果期间属多雨季节,若不进行防治,该病害几乎每年都会发生流行。
QoI 类杀菌剂是一类杀菌谱广、作用方式独特的杀菌剂,其通过与线粒体 bc1 复合物上的醌氧化口袋的外壁 (the outer,quinone oxidizing pocket) 即 Oo 位点结合,可干扰菌体呼吸链上的电子传递,从而发挥抑菌作用[4, 5],其能有效防治子囊菌门、担子菌门、无性型真菌和卵菌引起的病害。由于其环境友好和对作物安全的特点,该类药剂在很短的时间内便占据了全球主要的杀菌剂市场。国内相关研究机构也陆续研发出一系列创制性的 QoI 类杀菌剂,包括沈阳化工研究院研发的烯肟菌酯、烯肟菌胺、SYP-2815 和浙江化工研究院研发的苯醚菌酯[6, 7]等 (结构式见图式1)。其中,烯肟菌酯是我国自主创制的第一个 QoI 类杀菌剂,2002 年获得农药登记,用于防治葡萄霜霉病,对小麦白粉病和黄瓜霜霉病也有较好的防治效果[8, 9];烯肟菌胺对小麦白粉病、小麦锈菌病、黄瓜霜霉病、葡萄霜霉病以及灰霉病等均能起到有效的抑制作用[10, 11, 12],王海强等通过测定 SYP-2815 的抑菌谱,发现其活性与嘧菌酯相当,甚至优于嘧菌酯[13]。苯醚菌酯能够有效防治黄瓜白粉病、小麦白粉病、黄瓜霜霉病和葡萄霜霉病等[14, 15]。
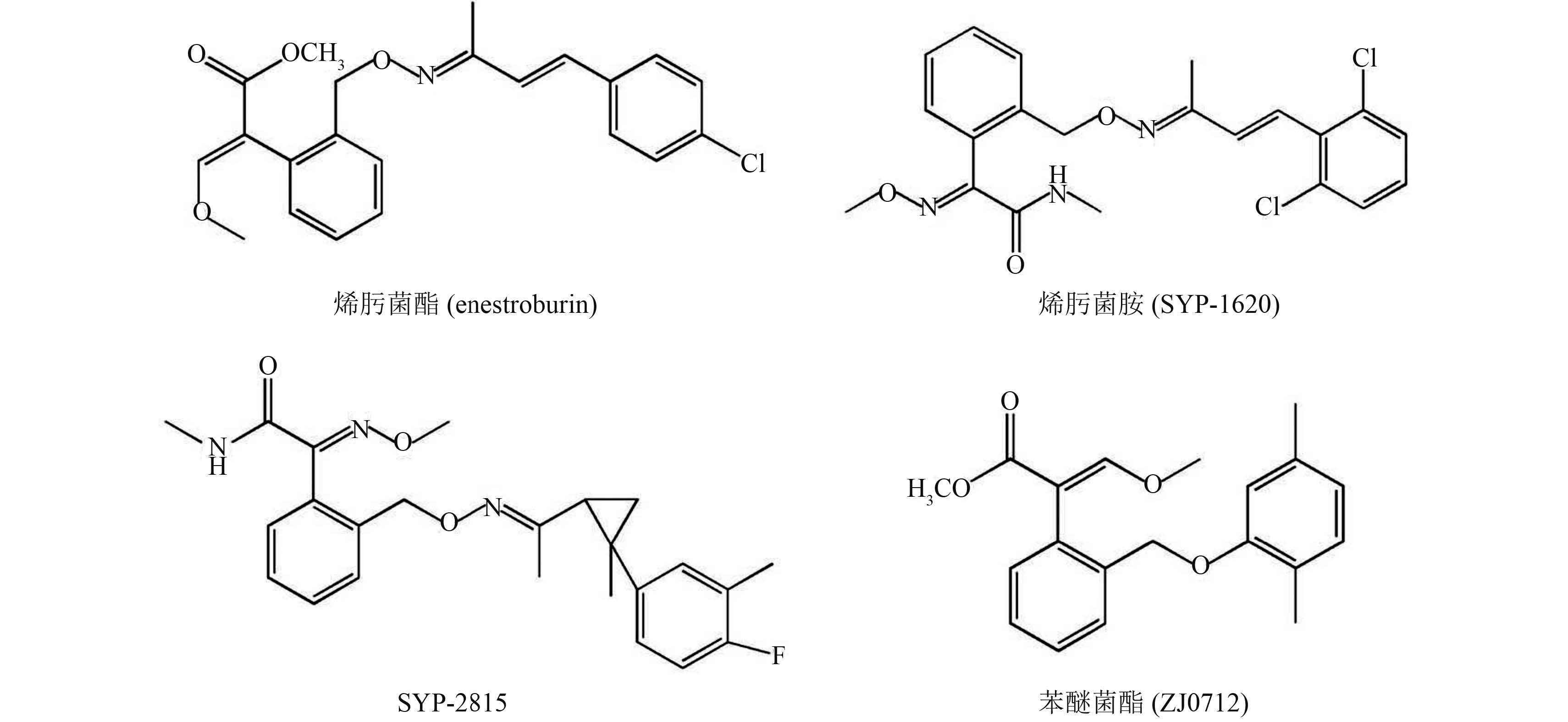
|
图式 1 我国自主创制的 QoI 类杀菌剂 Scheme 1 QoI fungicides developed by China |
2009 年,嘧菌酯以荔枝霜疫霉病为防治对象在中国获得农药登记。相关研究表明,离体条件下荔枝霜疫霉病菌对嘧菌酯具有较高的敏感性[16]。本研究比较了烯肟菌酯、烯肟菌胺、苯醚菌酯和 SYP-2815 对荔枝霜疫霉病菌不同生长发育阶段的活性差异,以期为建立荔枝霜疫霉对不同 QoI 类杀菌剂的敏感基线提供参考,为合理使用 QoI 类药剂防治荔枝霜疫霉病菌提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株及培养基荔枝霜疫霉病菌 Peronophythora litchii chen ex ko et al,由福建省农业科学院植物保护研究所赠予。
白云豆培养基:60 g 白云豆粉加入适量去离子水,煮沸 20 min,用三层纱布过滤;滤液中加入 12.5 g 琼脂粉,用去离子水定容至 1 L,煮沸,分装,灭菌。用于病原菌培养、保存以及菌丝生长及孢子囊产生的测定。
9‰水琼脂培养基:琼脂粉 9 g,用去离子水定容至 1 L,分装,灭菌。用于病原菌孢子囊及休止孢萌发的测定[17]。
1.1.2 药剂与仪器98% 苯醚菌酯 (ZJ0712) 原药,由浙江化工研究院提供;90% 烯肟菌酯(enestroburin)、98% 烯肟菌胺 (SYP-1620) 和 95% SYP-2815 原药,均由沈阳化工研究院提供。将供试原药配制成质量浓度为 1×104 µg/mL 的母液,于 4 ℃ 保存,备用。其中,苯醚菌酯用丙酮溶解,其他药剂用甲醇溶解。
BX60 多功能显微镜 (Olympus);CN15-T31 型光学显微镜 (北京永新诺华科技有限公司);KQ-250DE 型数控超声波清洗器 (昆山市超声仪器有限公司);WH-861 漩涡混合器 (太仓市华利达实验设备有限公司);XB-K-25 血球计数板 (上海安信光学仪器制造有限公司);2420 手动金属计数器 (深圳市龙泰源贸易有限公司)。
1.2 药剂对荔枝霜疫霉病菌菌丝扩展及孢囊梗形成和孢子囊产量的影响采用菌丝生长速率法[18]测定药剂对荔枝霜疫霉病菌菌丝扩展的影响。从白云豆培养基上培养 5 d 的荔枝霜疫霉病菌落边缘打取直径 5 mm 的菌饼,分别接种于含 4 种 QoI 类药剂系列浓度的白云豆培养基平板上。各药剂的质量浓度:烯肟菌胺为 0、0.5、1.0、2.0、4.0、6.0 和 8.0 µg/mL;苯醚菌酯和 SYP-2815 为 0、0.05、0.1、0.2、0.4 和 1.0 µg/mL;烯肟菌酯为 0、0.2、0.4、1.0、2.0 和 4.0 µg/mL;以含等量丙酮或甲醇的白云豆培养基平板为对照。各处理重复 3 次。于 25 ℃ 下黑暗培养 5 d 后,待测。
用十字交叉法测量菌落直径,根据公式 (1) 求出各处理对菌丝生长的抑制率、毒力回归方程、有效抑制中浓度(EC50)值及相关系数(r)[19]。

在上述测定后的菌落上挑取菌丝、制片,于显微镜下观察菌丝形态及孢囊梗形成情况。
采用十字交叉法打取直径 5 mm 的菌饼,加入 4 mL 去离子水制成孢子囊悬浮液,于 15 ℃ 下释放游动孢子 2 h;振荡混匀,取 10 µL 于血球计数板上,显微镜下计数,各处理重复 3 次。根据公式 (2) 求出各药剂不同浓度下对荔枝霜疫霉病菌孢子囊产量的抑制率、毒力回归方程、EC50值及相关系数。
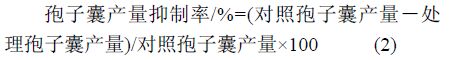
将荔枝霜疫霉病菌在白云豆培养基上于 25 ℃ 黑暗培养,取 7 d 菌龄的菌饼,制成 1×105 个/mL 的孢子囊悬浮液,待测。
1.3.1 对孢子囊萌发率的影响用无菌水稀释 4 种药剂母液,配成系列浓度的带药水琼脂平板。其中,烯肟菌胺为 0、0.1、0.2、0.4 和 0.8 µg/mL;苯醚菌酯为 0、0.02、0.05、0.125 和 0.2 µg/mL;SYP-2815为 0、0.02、0.08、0.1 和 0.15 µg/mL;烯肟菌酯为 0、0.05、0.1、0.2、0.35、0.5 和 1.0 µg/mL;以含等量无菌水的水琼脂平板为对照。取 100 µL 悬浮液均匀涂布于带药平板上,于 28 ℃ 下黑暗培养 10 h,显微镜下计数各处理的孢子囊萌发率,每处理重复 3 次。根据公式 (3) 求出不同药剂浓度对孢子囊萌发的抑制率、毒力回归方程、EC50值和相关系数。
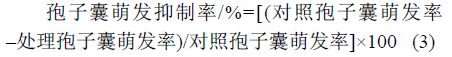
取孢子囊悬浮液于显微镜下计数 100 个孢子囊中的空囊数,即处理前释放率。在计数后的孢子囊悬浮液中添加用无菌水稀释后的药剂母液,分别制成含有 4 种药剂系列浓度的带药孢子囊悬浮液。其中,烯肟菌胺为 0、2.0、4.0、8.0 和 20.0 µg/mL;苯醚菌酯为 0、1.0、2.0、4.0、8.0 和 16.0 µg/mL;SYP-2815 为 0、2.0、4.0、10.0 和 20.0 µg/mL;烯肟菌酯为 0、1.0、2.0、4.0、8.0、16.0 和 32.0 μg/mL;以添加等量无菌水的孢子囊悬浮液为对照。于 15 ℃ 下光照处理 2 h 后计数 100 个孢子囊中的空囊数,即释放率,每处理重复 3 次。根据公式 (4) 计算药剂对游动孢子释放的抑制率。

用无菌水稀释 4 种药剂的母液,配制成系列浓度的带药水琼脂平板。其中,烯肟菌胺为 0、0.01、0.05、0.1、0.2、0.35 和 0.5 μg/mL;苯醚菌酯为 0、0.02、0.03、0.04、0.05、0.08、0.12 和 0.2 μg/mL;SYP-2815 为 0、0.05、0.1、0.15、0.2 和 0.4 μg/mL;烯肟菌酯为 0、0.02、0.05、0.1、0.15、0.2、0.3 和 0.4 μg/mL;以含等量无菌水的水琼脂平板为对照。取孢子囊悬浮液于 15 ℃ 下光照处理 2 h,获得游动孢子悬浮液;取两份游动孢子悬浮液,每份 100 µL 进行如下处理:一份均匀涂布于带药平板上,于室温下培养 1 h 后在显微镜下观察游动孢子消解及休止孢形成情况,每处理重复 3 次;另一份振荡 2 min,待绝大部分游动孢子停止游动,成为休止孢,均匀涂布于带药平板上,于 20 ℃ 下黑暗培养 4 h,调查不同处理的休止孢萌发率,每处理重复 3 次。根据公式 (5) 求出不同药剂浓度对休止孢萌发的抑制率、毒力回归方程、EC50值和相关系数。

结果 (表 1) 表明:4 种杀菌剂对荔枝霜疫霉病菌菌丝扩展表现出不同的活性。其中,烯肟菌酯、SYP-2815 和苯醚菌酯均表现出优异的抑菌作用,EC50值分别为 0.197 0、0.200 8 和 0.719 4 µg/mL;而烯肟菌胺抑菌活性较低,EC50 值为 1.257 9 µg/mL。显微观察发现:各药剂在低浓度时对菌丝形态和孢囊梗形成没有影响,但当药剂浓度接近 EC90 时,菌丝明显畸形,孢囊梗无法形成。以烯肟菌胺为例:当药剂质量浓度为 4.0 µg/mL 时,孢囊梗能正常形成;当质量浓度达到 8.0 µg/mL 时,药剂对菌丝扩展的抑制率为 88.64 %,孢囊梗无法形成,直接影响了孢子囊的产生 (图 1)。
|
|
表 1 4 种杀菌剂对荔枝霜疫霉病菌菌丝扩展的影响 Table 1 Effect of four fungicides on mycelia growth of Peronophythora litchii |

|
图 1 烯肟菌胺对荔枝霜疫霉病菌孢囊梗形成的影响 Fig. 1 Effect of SYP-1620 on sporangiophore form of Peronophythora litchii |
结果 (表 2) 表明:4 种杀菌剂对荔枝霜疫霉病菌孢子囊的产生均具有较强的抑制活性,其中烯肟菌酯、SYP-2815、苯醚菌酯和烯肟菌胺的EC50值分别为 0.212 7、0.262 1、0.355 8 和 0.816 0 µg/mL。
|
|
表 2 4 种杀菌剂对荔枝霜疫霉病菌孢子囊产量的影响 Table 2 Effect of four fungicides on sporangium production of Peronophythora litchii |
4 种杀菌剂均对荔枝霜疫霉病菌孢子囊的萌发表现出优异的抑制效果,其 EC50 值均小于 0.35 μg/mL (表 3)。其中,SYP-2815 和苯醚菌酯的抑制作用最显著,EC50值分别为 0.046 5 和 0.050 4 μg/mL,烯肟菌胺和烯肟菌酯次之。荔枝霜疫霉萌发的孢子囊大部分会在芽管一端产生次生孢子囊 (图 2A);随药剂浓度升高,产生次生孢子囊的数量减少,并且有的孢子囊萌发后芽管出现畸形膨大 (图 2B);当浓度进一步提高后,可完全抑制孢子囊的萌发 (图 2C)。
|
|
表 3 4 种杀菌剂对荔枝霜疫霉孢子囊萌发的影响 Table 3 Effect of four fungicides on sporangium germination of Peronophythora litchii |
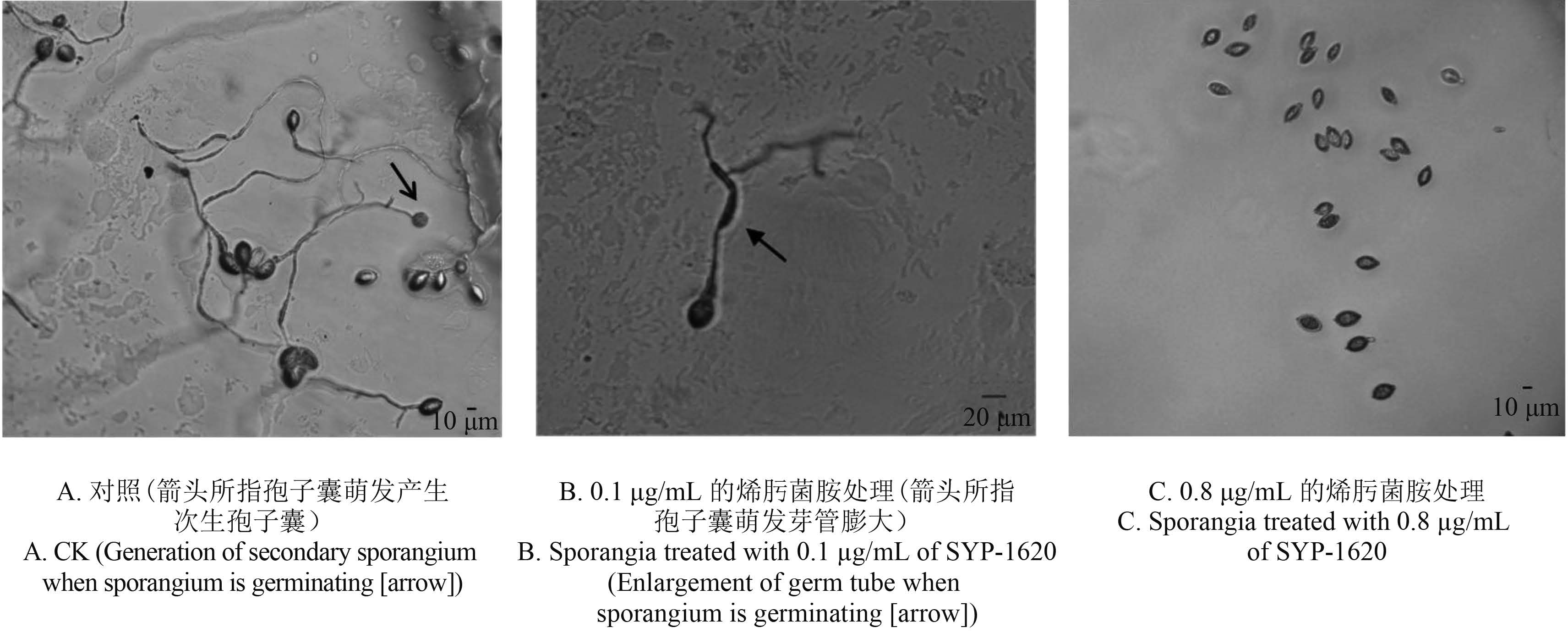
|
图 2 烯肟菌胺对荔枝霜疫霉孢子囊萌发的影响 Fig. 2 Effect of fungicides on sporangium germination of Peronophythora litchii |
4 种杀菌剂对荔枝霜疫霉孢子囊释放游动孢子的抑制效果均表现一般 (表 4),其EC50值介于 4.144 8~7.425 3 µg/mL 之间。
|
|
表 4 4 种杀菌剂对荔枝霜疫霉孢子囊释放游动孢子的影响 Table 4 Effect of 4 fungicides on zoospore release from sporangia of Peronophythora litchii |
本研究发现,未经药剂处理的游动孢子在停止游动后少部分会消解,消解时间从 20 min 到 2 h 不等,一部分会形成休止孢;药剂处理可加速荔枝霜疫霉游动孢子的消解,影响休止孢的形成。以 SYP-2815 为例,在浓度为 0.4 µg/mL 的带药平板上均匀涂布游动孢子悬浮液,分别于游动孢子停止游动后 0、30 和 60 s 观察同一视野下游动孢子的变化情况。结果显示,60 s 后视野下的游动孢子完全消解,无休止孢形成。其他 3 种药剂处理对休止孢的形成也具有明显的抑制作用,观察发现在 0.5 μg/mL 烯肟菌胺、0.2 μg/mL 苯醚菌酯和 0.4 μg/mL 烯肟菌酯的带药平板上均无休止孢形成。
空白无药平板上休止孢的萌发率大于 80.0%,而 4 种杀菌剂对荔枝霜疫霉休止孢萌发的抑制效果表现优异,EC50值均小于 0.2 μg/mL (表 5),活性从高到低依次是苯醚菌酯、SYP-2815、烯肟菌酯和烯肟菌胺,EC50值分别是 0.036 5、0.123 4、0.129 2 和 0.187 7 μg/mL。
|
|
表 5 4 种杀菌剂对荔枝霜疫霉休止孢萌发的影响 Table 5 Effect of four fungicides on cystospore germination of Peronophythora litchii |
结果 (表 6) 表明:4 种杀菌剂在病原菌发育的不同阶段表现出了不同的生物活性。其中,在菌丝扩展和孢子囊产生两个阶段,SYP-2815、苯醚菌酯和烯肟菌酯均表现出优异的抑菌活性,而烯肟菌胺的抑制作用中等;4 种杀菌剂对孢子囊和休止孢的萌发阶段均具有优异的抑制活性,但对游动孢子释放阶段的抑制效果较差;4 种杀菌剂在低浓度时对菌丝形态和孢囊梗的形成没有影响,但当药剂浓度接近 EC90 时,菌丝呈明显的畸形,孢囊梗无法形成。
|
|
表 6 4 种杀菌剂对荔枝霜疫霉病菌不同发育阶段的影响 Table 6 Effect of four fungicides on different development stages of Peronophythora litchii |
QoI 类杀菌剂以其杀菌谱广、作用方式独特、环境相容性好等特点,在生产中发挥着重要作用,但不同的杀菌剂品种间在抑菌特点及防治谱方面不尽相同[13]。已有研究报道,嘧菌酯对荔枝霜疫霉菌不同发育阶段都具有生物活性,同时表现出良好的杀菌作用和抑菌作用[16, 20];烯肟菌酯对黄瓜霜霉病菌 Pseudoperonospora cubensis 休止孢萌发无抑制作用,但对芽管伸长、孢子囊释放和游动孢子游动具有显著的抑制作用[21];我国创制的 6 种 QoI 类杀菌剂对水稻稻瘟病菌 Magnaporthe grisea 菌丝扩展、色素产生、产孢量、孢子萌发和芽管伸长各阶段均有不同程度的影响[7];本研究比较了 4 种中国创制的 QoI 类杀菌剂对荔枝霜疫霉病菌不同发育阶段的影响。结果表明,供试杀菌剂对荔枝霜疫霉病菌的菌丝扩展、菌丝形态、孢囊梗形成、孢子囊产生、孢子囊萌发、游动孢子释放、休止孢形成和萌发各阶段均有一定的影响,但影响程度存在差异。其中,4 种杀菌剂对荔枝霜疫霉病菌的孢子囊萌发和休止孢萌发阶段均具有优异的抑制活性。QoI 类杀菌剂属于能量抑制剂,而荔枝霜疫霉在孢子囊萌发及休止孢的萌发阶段需要消耗大量能量,因此,本研究结果进一步验证了 4 种杀菌剂的作用机制。试验中还发现,高浓度药剂处理能阻止孢囊梗的形成,进而使孢子囊形成受阻,说明 4 种杀菌剂除了能抑制能量的生成,表现抑菌作用外,在高浓度下还能发挥一定的杀菌作用。
在孢子囊萌发阶段,荔枝霜疫霉不同于致病疫霉和辣椒疫霉,其萌发有时会产生次生孢子囊[2]。本研究发现,QoI 类杀菌剂在抑制孢子囊萌发的同时,能抑制次生孢子囊的产生。同时,QoI 类杀菌剂在一定浓度下能够加速游动孢子的消解,导致休止孢无法形成,这一现象在黄瓜霜霉对烯肟菌酯的敏感性研究中也有报道[21],其原因有待于进一步探索。由于荔枝霜疫霉的孢子囊及游动孢子是该病害主要的初侵染源及再侵染源[1],上述结果表明,4 种杀菌剂对荔枝霜疫霉病能够起到很好的保护作用,可有效阻止病原菌的侵入。
SYP-2815、苯醚菌酯和烯肟菌酯对荔枝霜疫霉病菌菌丝扩展和孢子囊的产生阶段表现出较高的活性,烯肟菌胺次之。王海强等研究也表明,SYP-2815、苯醚菌酯和烯肟菌酯均具有一定的内吸传导活性[13]。因此,推测 SYP-2815、苯醚菌酯和烯肟菌酯在对寄主起到保护作用的同时,还兼具治疗作用,在田间实际生产中,病害发生前或发生后使用这 3 种杀菌剂,可以有效遏制病害的发生和发展。而前期研究也表明,烯肟菌胺主要以保护作用为主[13],因此,建议在发病前使用该药剂以阻止病原菌的侵入和预防病害的发生。综上分析,在田间施药时,可参照不同药剂对病原菌不同发育阶段的抑菌特点,选择合适的施药时期,以有效预防和控制病害的发生和蔓延。
| [1] | 梁改进, 陈加福, 魏雪英. 荔枝霜疫霉病的发生及防治[J]. 福建果树, 2001, 117(3):42-43. LIANG G J, CHEN J F, WEI X Y. Occurrence and prevention of litchi downy blight[J]. Fujian Fruits, 2001, 117(3):42-43. |
| [2] | 黄河, 王春平, 徐大雅. 荔枝霜疫霉的研究[J]. 真菌学报, 1983, 2(4):201-206. HUANG H, WANG C P, XU D Y. The research of Peronophythora litchii[J]. Mycosystema, 1983, 2(4):201-206. |
| [3] | 戚佩坤, 潘雪萍, 刘任. 荔枝霜疫病的研究-病原菌的鉴定及其侵染过程[J]. 植物病理学报, 1984, 14(2):114-119. QIN P K, PAN X P, LIU R. The research on identification and infection process of Peronophythora litchii[J]. Acta Phytopathologica Sinica, 1984, 14(2):114-119. |
| [4] | GISI U, SIEROTZKI H, COOK A, et al. Mechanisms influencing the evolution of resistance to Qo inhibitor fungicides[J]. Pest Manag Sci, 2002, 58(9):859-867. |
| [5] | LOTHAR E, BYRON Q, YONG F, et al. Crystallographic studies of quinol oxidation site inhibitors:a modified classification of inhibitors for the cytochrome bc1 complex[J]. J Mol Bio, 2004, 341:281-302. |
| [6] | 骆焱平, 李元祥, 赵培亮. 甲氧丙烯酸酯类杀菌剂的研究进展[J]. 中国科技论文在线, 2006, (1):20-26. LUO Y P, LI Y X, ZHAO P L. The research progress of strobilurins[J]. Science Paper Online, 2006, (1):20-26. |
| [7] | 王海强, 周俞辛, 王景元, 等. 水稻稻瘟病菌不同发育阶段对7种QoI类杀菌剂的敏感性[J]. 农药学学报, 2009, 11(4):434-440. WANG H Q, ZHOU Y X, WANG J Y, et al. Sensitivity of Magnaporthe grisea at different development stages to seven QoI fungicides[J]. Chin J Pestic Sci, 2009, 11(4):434-440. |
| [8] | 司乃国, 刘君丽, 李志念, 等. 创制杀菌剂烯肟菌酯生物活性及应用研究(Ⅰ)——黄瓜霜霉病[J]. 农药, 2003, 42:36-38. SI N G, LIU J L, LI Z N, et al. The research of biological activity and application of novel fungicide-enestroburin(I)[J]. Pesticides, 2003, 42:36-38. |
| [9] | 司乃国, 刘君丽, 张宗俭, 等. 创制杀菌剂烯肟菌酯生物活性及应用(Ⅱ)——小麦白粉病[J]. 农药, 2003, 42:39-40. SI N G, LIU J L, ZHANG Z J, et al. The research of biological activity and application of novel fungicide-enestroburin(Ⅱ)[J]. Pesticides, 2003, 42:39-40. |
| [10] | 司乃国, 刘君丽, 陈亮, 等. 创制杀菌剂烯肟菌胺生物活性及应用(Ⅰ)——小麦白粉病[J]. 农药, 2008, 47(10):712-714. SI N G, LIU J L, CHEN L, et al. The research of biological activity and application of novel fungicide-SYP-1620(Ⅰ)[J]. Agrochemicals, 2008, 47(10):712-714. |
| [11] | 周明国. 中国植物病害化学防治研究:第4卷[M].北京:中国农业科学技术出版社, 2004:37-42. ZHOU M G. China chemical prevention and control of plant disease research:V ol. 4[M]. Beijing:China's Agricultural Science and Technology Press, 2004:37-42. |
| [12] | ZHANG X K, WU D X, DUAN Y B, et al. Biological characteristics and resistance analysis of the novel fungicide SYP-1620 against Botrytis cinerea[J]. Pestic Biochem Physiol, 2014, 114:72-78. |
| [13] | 王海强. 六种QoI类杀菌剂的抑菌活性、吸收传导及抗性机制研究[D]. 北京:中国农业大学, 2009. WANG H Q. Study on the antifungal activity, uptake and transportation and resistance mechanisms of six QoI fungicides[D]. Beijing:China Agricultural University, 2009. |
| [14] | 陈定花, 朱卫刚, 胡伟群, 等. 新型广谱杀菌剂苯醚菌酯(ZJ0712)生物活性[J]. 农药, 2006, 45(1):18-21. CHEN D H, ZHU W G, HU W Q, et al. Biological activity of ZJ0712, a new strobilurin fungicide[J]. Agrochemicals, 2006, 45(1):18-21. |
| [15] | 王敏, 韩平, 卢晓红, 等. 黄瓜白粉病菌对苯醚菌酯敏感基线的建立及室内抗药性风险评价[J]. 植物病理学报, 2007, 37(6):660-665. WANG M, HAN P, LU X H, et al. Determination of sensitivity baseline of Sphaerotheca fuliginea to ZJ0712 and assessment of its laboratory resistant risk[J]. Acta Phytopathologica Sinica, 2007, 37(6):660-665. |
| [16] | WANG H C, SUN H Y, MA J X, et al. Fungicide effectiveness during the various developmental stages of Peronophythora litchii In vitro[J]. Journal of Plant Pathology, 2009, 157(7-8):407-412. |
| [17] | 方中达. 植病研究方法[M]. 第3版. 北京:中国农业出版社, 1998:122-124. FANG Z D. Plant disease research methods[M]. 3rd. Beijing:China Agriculture Press, 1998:122-124. |
| [18] | 张晓, 张艳军, 陈雨, 等. 嘧菌酯对番茄早疫病菌的抑制作用[J]. 农药学学报, 2008, 10(1):41-46. ZHANG X, ZHANG Y J, CHEN Y, et al. Inhibitory effect of azoxystrobin on Alternaria solani[J]. Chin J Pestic Sci, 2008, 10(1):41-46. |
| [19] | 黄彰欣. 植物化学保护实验指导[M]. 北京:农业出版社, 1993:103. HUANG Z X. Experimental guidance of plant chemical protection[M]. Beijing:Agriculture Press, 1993:103. |
| [20] | 周明国. 中国植物病害化学防治研究:第5卷[M]. 北京:中国农业科学技术出版社, 2006:218-221. ZHOU M G. China chemical prevention and control of plant disease research:Vol. 5.[M]. Beijing:China's Agricultural Science and Technology Press, 2006:218-221. |
| [21] | 王岩, 冯明鸣, 刘西莉, 等. 黄瓜霜霉病菌不同发育阶段对烯肟菌酯的敏感性[J]. 中国农业科学, 2006, 39(9):1810-1816. WANG Y, FENG M M, LIU X L, et al. Sensitivity of Pseudoperonospora cubensis at different development stages to enestroburin[J]. Scientia Agricultura Sinica, 2006, 39(9):1810-1816. |
 2016, Vol. 18
2016, Vol. 18


