农用抗生素是现代农药的重要组成部分,从微生物中寻找新型农用抗生素则是新农药创制的重要途径之一[1]。植物内生菌(endophytes)是指在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部的一类微生物,并且不会引起植物组织出现明显的病变[2]。作为一种重要的微生物类群,从植物内生菌次生代谢物中发现具有新颖分子骨架的生物活性化合物,是近年来天然产物药物研究的一个热点领域[3]。植物内生菌也是筛选抗菌、杀虫和除草活性物质的一个重要资源[4, 5]。在从内生菌代谢物中寻找具有新的农药活性物质的研究中,本课题组从冬青卫矛植株中分离出一株具良好抗菌活性的菌株(编号:G1)。初步抑菌活性研究表明,G1菌株发酵液对多种病原菌具有良好的抑制作用,为明确其发酵液的抑菌活性成分,本研究采用大孔树脂吸附和硅胶柱层析等技术,从G1菌株发酵液中分离出其主要抑菌活性成分为G13和G19。通过核磁共振波谱及质谱技术,结合相关文献对其结构进行了鉴定,并对其抑菌活性进行了初步评价。
1 材料与方法 1.1 供试材料 1.1.1 供试菌株放线菌G1,于2014年9月从西北农林科技大学校园一株冬青卫矛根部分离获得,初步鉴定为Streptomyces flavofuscus G1,保存于西北农林科技大学农药研究所。
1.1.2 培养基高氏一号培养基(可溶性淀粉20 g、NaCl 0.5 g、KNO3 1.0 g、K2HPO4·3H2O 0.5 g、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.01 g、琼脂15.0 g、纯净水1 000 mL,pH值7.4~7.6),用于G1菌株斜面及平板培养;小米液体培养基(小米10.0 g、葡萄糖10.0 g、氯化钠2.5 g、蛋白胨3.0 g、碳酸钙1.0 g、硫酸铵1.0 g、纯净水1 000 mL),用于G1菌株摇瓶发酵;牛肉膏蛋白胨琼脂培养基(牛肉膏3.0 g、蛋白胨10.0 g、氯化钠5.0 g、琼脂15.0 g、纯净水1 000 mL,pH值 7.2~7.4)和Mueller-Hinton肉汤培养基(杭州大和微生物试剂有限公司)用于病原细菌培养;PDA培养基(马铃薯200 g、葡萄糖20.0 g、琼脂15.0 g、纯净水1 000 mL)用于病原真菌培养。所有培养基均在121 ℃、1×105 Pa高压下灭菌30 min备用。
1.1.3 供试病原细菌枯草芽孢杆菌Bacillus subtilis(1.008 8)、蜡状芽孢杆菌Bacillus cereus(1.184 6)、铜绿假单孢菌Pseudomonas aeruginosa(1.203 1)、金黄色葡萄球菌Staphyloccocus aureus(1.008 9)、大肠埃希氏菌Escherichia coli(1.163 6),购自中国普通微生物菌种保藏管理中心。白菜软腐病菌Erwinia carotovora和猕猴桃溃疡病菌Pseudomonas syringae pv. actinidiae,由西北农林科技大学植物病理研究室提供;烟草青枯病菌Ralstonia solanacearum,由西南大学植物保护学院提供;水稻白叶枯病菌Xanthomonas oryzae pv. oryzae,由西北农林科技大学无公害农药研究中心提供。将病原细菌接种于牛肉膏蛋白胨琼脂培养基,于37 ℃下培养1 d。
1.1.4 供试病原真菌番茄灰霉病菌Botrytis cinerea、小麦赤霉病菌Fusarium graminearum、苹果炭疽病菌Colletotrichum gloeosporioides、玉米弯孢病菌Curvularia lunata、烟草赤星病菌Alternaria alternate、茄子黄萎病菌Verticillium dahlia、西瓜枯萎病菌Fusarium oxysporum、苹果树腐烂病菌Valsa mali和油菜菌核病菌Sclerotinia sclerotiorum,由西北农林科技大学农药研究所提供;棉花枯萎病菌Fusarium oxysporum f.sp.vasinfectum,由西北农林科技大学植物病理研究室提供。将病原真菌接种于PDA培养基,于25 ℃下培养3~7 d。
1.1.5 主要仪器及试剂HPD-100大孔吸附树脂,河北宝恩树脂科技有限公司;甲醇(HPLC级),美国Tedia公司;柱层析硅胶(粒径54~74 μm),青岛海洋化工厂;氨苄青霉素(USP级),国药集团化学试剂有限公司;95%嘧菌酯(azoxystrobin)原药,先正达(中国)投资有限公司;石油醚和乙酸乙酯均为市售分析纯。
分析型 HPLC 系统: Shimadzu LC-6AD高效液相色谱仪,具二极管阵列检测器,日本岛津公司;Bruker RPX 500 MHz核磁共振仪,德国Bruker公司;Thermo LCQ Advantage MAX质谱仪,美国Thermo公司。
1.2 试验方法 1.2.1 菌株鉴定参照文献中的方法进行G1菌株基因组DNA的提取,并以此为模板进行PCR扩增、扩增产物纯化后测序,利用16S rDNA序列对比分析对其进行分类鉴定[6]。
1.2.2 种子液制备将G1菌株接种于高氏一号培养基上,于25 ℃下培养7 d,接种于100 mL小米液体培养基中,于180 r/min、28 ℃下振荡培养16 h。
1.2.3 发酵液制备将20 mL种子液接种于80 mL小米液体培养基中,于180 r/min、28 ℃下振荡培养7 d。
1.2.4 活性成分的分离及鉴定将20 L发酵液用多层纱布过滤后经大孔吸附树脂HPD-100(1.0 kg)吸附,甲醇(3.0 L)解析,将甲醇解析液减压浓缩至约200 mL,浓缩液用少量硅胶拌匀晾干后进行硅胶柱层析,依次用V(石油醚)∶ V(乙酸乙酯)=8∶1、6∶1、4∶1、2∶1、1∶1,乙酸乙酯,V(乙酸乙酯)∶ V(甲醇)=8∶1、6∶1、4∶1、2∶1、1∶1及甲醇梯度洗脱,每100 mL收集1份,经薄层层析(TLC)检测后合并相同组分,共得7个组分: Fr.1(11 mg)、 Fr.2(90 mg)、Fr.3(48 mg)、Fr.4(244 mg)、Fr.5(291 mg)、Fr.6(356 mg)和Fr.7(387 mg),其中Fr.3和Fr.4具有较强的抑菌活性。经HPLC检测发现Fr.3为纯化合物,标记为化合物G13(48 mg);Fr.4经进一步硅胶柱层析纯化,得化合物G19(39mg)。
1.2.5 抑菌活性测定 1.2.5.1 对病原细菌的抑制作用采用肉汤微量稀释法[7]。从琼脂培养基中挑取4~5个相同形态的供试菌菌落,接入1.0 mL灭菌的Mueller-Hinton肉汤中,于35 ℃下培养至轻度混浊后转入0.9%生理盐水中,调整到麦氏浊度为0.5,再用Mueller-Hinton肉汤稀释200倍,其接种量相当于7.5×105 CFU/mL。将稀释好的接种液转入96孔板中,每孔加接种液100 μL,再分别加入100 μL不同质量浓度的药液,使最终浓度分别为100、50、25、12.5、6.25、3.13、1.56、0.78和0.39 μg/mL,每板另设不加药剂的空白对照、氨苄青霉素(ampicillin)阳性对照和加药不接菌阴性对照。每处理重复3次。于35 ℃下培养20 h,记录药剂对供试细菌的最低抑菌浓度(MIC)。
1.2.5.2 对病原真菌的抑制作用采用菌丝生长速率法[8]。准确称取10 mg待测化合物,先用500 μL二甲基亚砜(DMSO)溶解后,用无菌水配制成10 mg/mL的母液,再用无菌水梯度稀释得到系列浓度药液。将1.0 mL不同质量浓度的供试药液与9.0 mL融化的PDA培养基混匀,倒入无菌培养皿中制成带药培养基平板。待培养基凝固后,接入直径为4 mm的菌饼,菌丝面朝下。以嘧菌酯(azoxystrobin)作为阳性对照。每处理设3次重复。于25 ℃恒温箱中培养72~96 h,用十字交叉法测量菌落生长直径,按(1)式计算菌丝生长抑制率。

所得数据用SPSS软件求出毒力回归方程及抑制中浓度(IC50值),并进行相关性分析。
2 结果与分析 2.1 G1菌株的分类鉴定序列分析结果表明,菌株G1的16S rDNA 序列长度为1 457 bp,将该序列上传至NCBI GenBank,获得登记号KT252874,与GenBank中的序列进行相似性比较发现,其与Streptomyces flavofuscus(EU593623.1)的亲缘关系最近,因此初步鉴定其为Streptomyces flavofuscus G1。
2.2 活性成分分离及结构鉴定以活性追踪为指导,经大孔吸附树脂吸附,甲醇解析,硅胶柱层析等方法从菌株S. flavofuscus G1发酵液中分离鉴定出2个活性化合物G13(48 mg)和G19(39 mg)。
G13,黄色结晶,熔点:260.1~262.4 ℃(文献值[9]:263 ℃);UV (λMeOH):251,365 nm;ESI-MS:[M+H]+,m/z 283,相对分子质量为282。1H NMR (CDCl3,500 MHz),δ: 4.13 (s,3H),8.01~8.08 (m,2H),8.35 (d,J=7.0 Hz,1H),8.40 (d,J=7.0 Hz,1H),8.60 (dd,J=1.0,7.5 Hz,1H),9.00 (dd,J=1.0,7.5 Hz,1H),15.17 (br s,1H);13C NMR (CDCl3,125 MHz),δ:52.9,125.1,130.8,131.5,131.8,132.1,133.0,135.7,138.2,139.3,140.0,141.5,143.6,165.5,166.2。1H、13C NMR数据与Chatterjee等[10]报道的phencomycin基本一致,故将化合物G13鉴定为phencomycin(图式1)。
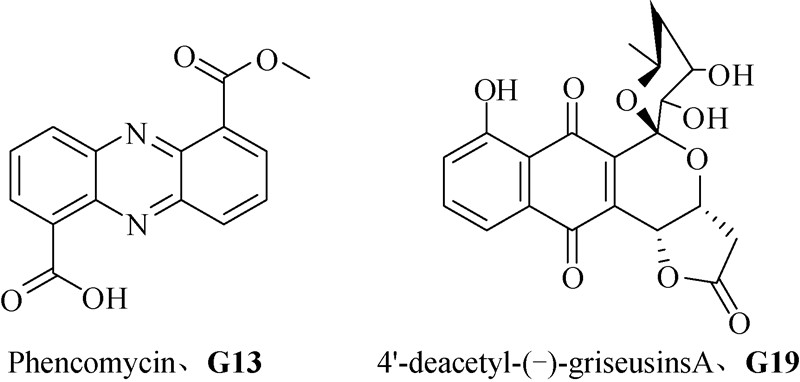 | 图 1 化合物phencomycin (G13) 和 4′-deacetyl-(-)-griseusins A (G19)的结构 Scheme 1 Structure of phencomycin (G13) and 4′-deacetyl-(-)-griseusins A (G19) |
G19,橘黄色粉末,熔点:169.4~171.2 ℃ (文献值[11]:172~174 ℃);[α] D24=- 201(c0.1,MeOH)[文献值[11] [α] D24=- 198(c0.1,MeOH)];UV (λMeOH):252,430 nm;ESI-MS:[M+H]+,m/z 403,相对分子质量为402。1H NMR (CDCl3,500 MHz),δ: 1.25 (d,J=6.0 Hz,3H),1.94~1.96 (m,1H),2.07~2.08 (m,1H),2.61~2.62 (m,1H),2.70~2.72 (m,1H),2.75~2.76 (m,1H),3.03 (dd,J=5.0,18.0 Hz,1H),4.16~4.18 (m,1H),4.22~4.23 (m,1H),4.82~4.84 (m,2H),5.27 (d,J=2.5 Hz,1H),7.27~7.29 (m,1H),7.62 (d,J=4.5 Hz,2H),11.9 (s,1H); 13C NMR (CDCl3,125 MHz),δ: 20.6,36.4,39.1,62.7,66.4,68.1,68.3,68.7,98.5,115.4,119.4,125.4,131.2,136.9,138.4,143.1,162.1,174.0,181.8,187.4。1H、13C NMR数据与Igarashi等[11]报道的4′- deacetyl-(-)-griseusins A基本一致,故将化合物G19鉴定为4′- deacetyl-(-)-griseusins A(图式1)。
2.3 化合物的抑菌活性 2.3.1 对病原细菌的抑制作用由表 1可以看出:化合物G19对9种供试病原细菌均有明显的抑制作用,对水稻白叶枯病菌、铜绿假单孢菌、蜡状芽孢杆菌及金黄色葡萄球菌的抑菌活性尤为突出,其MIC值均为1.56 μg/mL;而化合物G13仅有微弱的抗细菌活性。
|
|
表 1 化合物G13和G19对9种供试病原细菌的MIC值 Table 1 MIC values of G13 and G19 against nine strains of bacteria |
由表 2可以看出:化合物G13对油菜菌核病菌和苹果树腐烂病菌菌丝生长有强烈的抑制作用,在50 μg/mL下抑制率分别为94.7%和87.5%;对番茄灰霉病菌抑菌活性次之,抑制率为57.1%。化合物G19对苹果树腐烂病菌、小麦赤霉病菌和玉米弯孢病菌菌丝生长的抑制效果较明显,在50 μg/mL下抑制率分别为70.8%、60.0%和54.2%。进一步毒力测定结果(表 3)表明:化合物G13对油菜菌核病菌、苹果树腐烂病菌和番茄灰霉病菌IC50值分别为5.21、4.82 和41.56 μg/mL;化合物G19对苹果树腐烂病菌、小麦赤霉病菌和玉米弯孢病菌的IC50值分别为14.70、24.35 和32.35 μg/mL。
|
|
表 2 化合物G13和G19对10种供试病原真菌菌丝生长的抑制作用(50 μg/mL) Table 2 Inhibition of G13 and G19 against the mycelial growth of ten tested fungi (50 μg/mL) |
|
|
表 3 化合物G13和G19对供试病原真菌毒力 Table 3 Toxicity of G13 and G19 against tested fungi |
Phencomycin最初由Chatterjee等[10]于1995年从印度土壤放线菌Streptomyces sp. HIL Y-9031725代谢产物中首次分离获得。抑菌研究结果表明:Phencomycin对革兰氏阳性细菌表现出较弱的活性,且无任何抗真菌活性;1997年,德国学者Pusecker等[9]从一株海洋链霉菌发酵液中再次分离到该化合物,仅测定了其对两种革兰氏阳性菌的抑菌活性;2009年,我国学者韩晓等[12]从经核糖体工程改造的野生放线菌菌株代谢物中分离得到phencomycin,并研究了其抗肿瘤活性;2014年,韩国学者Han等[13]从Burkholderia glumae strain 411 gr-6代谢产物中分离到该化合物,评价了其对革兰氏阳性细菌抑菌活性。本研究首次从冬青卫矛内生放线菌Streptomyces flavofuscus G1分离获得phencomycin,系统评价了其对多种农用致病细菌和致病真菌的抑菌活性,结果表明,phencomycin对油菜菌核病菌和苹果树腐烂病菌的菌丝生长具有强烈抑制作用,但对供试细菌仅表现出微弱的抑菌活性。
4′-Deacetyl-(-)-griseusin A最初由日本学者Igarashi等[11]于1995年从放线菌MJ932-SF3的发酵液中分离得到,并报道了其抑菌活性,发现其对革兰氏阳性菌具有良好的抑制作用。2009年,土耳其学者Urgen等[14]从Streptomyces griseus strain M-33-5的代谢产物中再次分离到该化合物,报道其对两种革兰氏阳性细菌和两种肿瘤细胞表现出显著的抑制效果。4′-deacetyl-(-)-griseusin A对植物病原菌抑菌活性的研究未见报道。本研究结果表明,4′-deacetyl-(-)-griseusin A对供试10种病原真菌具有一定的抑制作用,其对苹果树腐烂病菌和小麦赤霉病菌菌丝生长的抑制效果尤为突出;对水稻白叶枯病菌、铜绿假单孢菌、蜡状芽孢杆菌、金黄色葡萄球菌及烟草青枯病菌均有强烈的抑制作用。
| [1] | 赵娜, 王海丽, 魏少鹏, 等. 放线菌C-411发酵液抑菌活性及活性成分[J]. 植物保护学报, 2013, 40(1): 73-77. Zhao Na, Wang Haili, Wei Shaopeng, et al. Antibacterial activity and active ingredients of Streptomyces albus C-411 [J]. Acta Phytophy Sin, 2013, 40(1): 73-77. (in Chinese) |
| [2] | Strobel G, Daisy B. Bioprospecting for microbial endophytes and their natural products [J]. Microbiol Mol Biol Rev, 2003, 64(7): 491-502. |
| [3] | 俞晓平, 陈列忠, 申屠旭萍. 植物内生菌及其代谢物在生物农药创制中的应用 [J]. 浙江农业学报, 2006, 18(5): 289-293. Yu Xiaoping, Chen Liezhong, Shentu Xuping. Review on plant endophyte and its secondary metabolites in the application of producing bio-pesticides[J]. Acta Agri Zhejiangensis, 2006, 18(5): 289-293. (in Chinese) |
| [4] | 李海燕, 刘丽. 产生物活性物质植物内生菌的研究进展 [J]. 天然产物研究与开发, 2004, 16(5): 482-485. Li Haiyan, Liu Li. Recent advances on bioactive com pounds producing endophytes [J]. Nat Prod Res Dev, 2004, 16(5): 482-485. (in Chinese) |
| [5] | 功能. 生物农药发展的机遇与挑战 [J]. 中国生物防治, 2001, 17(4): 184-185. Gong Neng. Opportunities and challenges in the development of biological pesticides [J]. Chin J Biolog Contr, 2001, 17(4): 184-185. (in Chinese) |
| [6] | 奥斯伯, 金斯顿, 塞德曼等. 精编分子生物学实验指南 [M]. 第4版. 北京: 科学出版社, 2005. Ausubel F M, Kingston R E, Seidman J G, et al. Short Protocols in Molecular Biology [M]. 4th ed. Beijing: Scientific Press, 2005. (in Chinese) |
| [7] | National Committee for Clinical Laboratory Standards. CLSI document M7-A8 Methods for dilution antimicrobial susceptibility tests for Bacteria that grow aerobically; approved standard [S]. 8th ed. Wayne, PA, USA: Clinical and Laboratory Standards Institute, 2009. |
| [8] | 吴文君. 植物化学保护实验技术导论 [M]. 西安: 陕西科学与技术出版社, 1987. Wu Wenjun. Introduction to Experimental Techniques of Plant Chemical Protection [M]. Xi'an: Shanxi Scientific & Technical Press, 1987. (in Chinese) |
| [9] | Pusecker K, Laatsch H, Helmke E, et al. Dihydrophencomycin methyl ester, a new phenazine derivative from a marine streptomycete [J]. J Antibiot, 1997, 50(6): 479-483. |
| [10] | Chatterjee S, Vijayakumar E K S, Franco C M M, et al. Phencomycin, a new antibiotic from a Streptomyces species HIL Y-9031725[J]. J Antibiot, 1995, 48(11): 1353-1354. |
| [11] | Igarashi M, Chen W, Tsuchida T, et al. 4'-Deacetyl-(-)-griseusins A and B, new naphthoquinone antibiotics from an actinomycete[J]. J Antibiot, 1995, 48(12): 1502-1505. |
| [12] | 韩晓, 崔承彬, 韩小贤, 等. 放线菌野生株代谢功能的核糖体工程改造与新产抗肿瘤活性产物研究[J]. 国际药学研究杂志, 2009, 36(6): 435-446. Han Xiao, Cui Chengbin, Han Xiaoxian, et al. Alteration of metabolic function of wild-type actinomycete strain by ribosome engineering and the metabolites newly produced with antitumor activity [J]. J Int Pharm Res, 2009, 36(6): 435-446. (in Chinese) |
| [13] | Han J W, Kim J D, Lee J M, et al. Structural elucidation and antimicrobial activity of new phencomycin derivatives isolated from Burkholderia glumae strain 411 gr-6 [J]. J Antibiot, 2014, 67(10): 721-723. |
| [14] | Urgen M, Kocaba F, Nalbantsoy A, et al. Bioassay-guided isolation of antibacterial and cytotoxic compounds from the mesophilic actinomycete M-33-5 [J]. Nat Prod Commun, 2010, 5(2): 249-252. |
 2015, Vol. 17
2015, Vol. 17


