2. 中化蓝天浙江省化工研究院有限公司, 杭州 310023
2. Sinochem Lantian Zhejiang Research Institute of Chemical Industry Co.Ltd., Hangzhou 310023, China
肟酯类化合物具有优良的杀虫、杀菌、除草和抗植物病毒活性,并因其具有独特的结构和新颖的作用机制,在农药领域应用日趋广泛[1]。而吡唑酰胺类衍生物同样具有广泛的农业生物活性,而且其吡唑环上取代基的位置及种类可有多种变化,作用机制新颖,具有广阔的发展前景[2]。2009年,日本农药株式会社公开了新型吡唑酰胺类杀螨剂pyflubumide(Scheme 1)的专利,其在果树、蔬菜、稻谷以及其他作物上均显示出了良好的杀螨活性[3]。
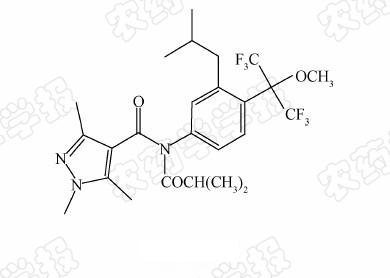 | Scheme 1 |
研究表明,在农药分子中引入二芳醚结构可以提高其光稳定性及生物活性,降低对哺乳动物的毒性及扩大生物活性谱[4, 5]。
笔者以pyflubumide的母体结构为先导,保留其吡唑酰胺部分活性基团,通过在吡唑环和酰胺结构中间引入不同脂链肟酯结构,同时在酰胺的N原子上连接一分子二芳基醚结构,设计合成了7个未见文献报道的1H-吡唑-4-肟酯乙酰胺类化合物,并进行了杀螨活性测试。目标化合物合成路线见Scheme 2。
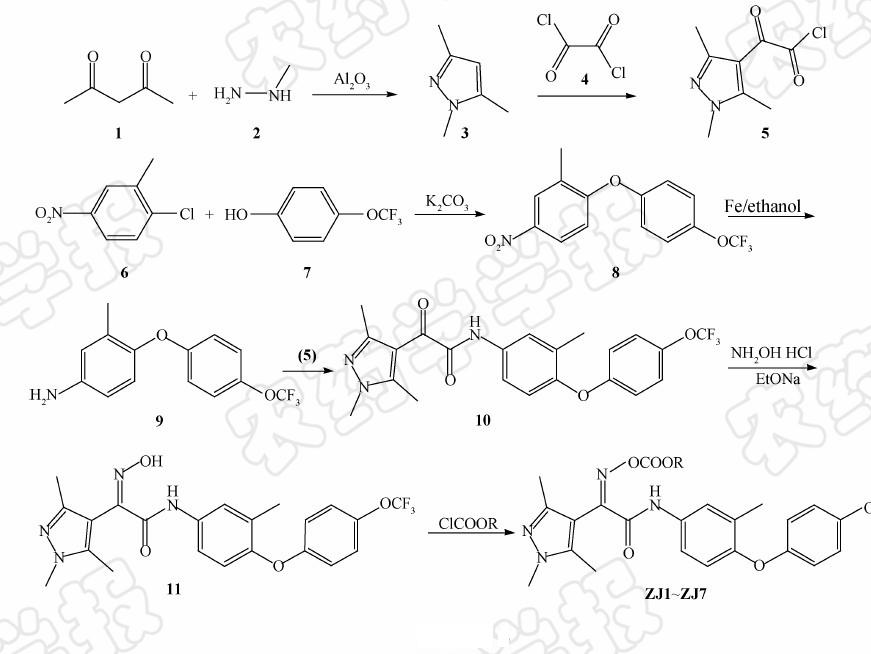 | Scheme 2 |
WRS-1A型数字熔点仪(温度计未校正);Varian-400型核磁共振仪(以CDCl3为溶剂,以TMS为内标);LCQ-Advantage质谱仪(ESI-MS);Yanaco MT-3CHN元素分析仪。 97%阿维菌素(abamectins)原药(浙江一帆化工有限公司);98%炔螨特(propargite)原药(南京仁信化工有限公司);其余试剂均为化学纯或试剂纯,未经处理。
参考文献[7]的方法。向制得的10.9 g(0.1 mol)中间体3中加入10 mL(0.12 mol)草酰氯和2 mL的N,N-二甲基甲酰胺(DMF),搅拌回流反应1 h,于室温下保温24 h。脱溶,得酰氯粗品12.7 g,不经提纯直接用于下一步反应。
参考文献[8]的方法。称取17.8 g (0.1 mol) 化合物7,用70.0 mL DMF溶解,加入17.2 g (0.1 mol)化合物6和20.7 g(0.15 mol)碳酸钾,升温至100 ℃,搅拌反应5 h,薄层层析(TLC) [展开剂V(乙酸乙酯)∶V(石油醚)=1∶3] 跟踪至反应结束。将反应液倒入冰水中,用乙酸乙酯萃取(50 mL×2),干燥脱溶后得棕黄色液体(8)26.6 g,收率85.0%。1H NMR,δ: 2.11(s, 3H, Ar-CH3), 6.56(d, 2H, J=8.0 Hz, Ar-H), 6.62(s, 1H, Ar-H), 6.78~6.84(m, 2H, Ar-H), 7.10(d, 2H, J=8.0 Hz, Ar-H)。
参考文献[9]的方法。在25.04 g(0.08 mol)中间体8中,加入100 mL乙醇、50 mL水和12.6 mL氯化铵饱和溶液,回流搅拌,分批加入8.96 g(0.16 mol)铁粉, 反应3 h后,TLC [V(乙酸乙酯)∶V(石油醚)=1∶4] 跟踪至反应结束,趁热过滤,滤液用乙酸乙酯萃取(45 mL×2),干燥脱溶后得红褐色液体18.56 g,收率82.2%。1H NMR,δ: 2.09(s, 3H, Ar-CH3), 3.58(s, 2H,NH2), 6.55(d, 2H, J=8.0 Hz, Ar-H), 6.61(s, 1H, Ar-H), 6.77~6.83(m, 2H, Ar-H), 7.10(d, 2H, J=8.0 Hz, Ar-H)。
参考文献[10]的方法。室温下,称取13.8 g(0.08 mol) 中间体5,用120 mL四氢呋喃溶解,加入22.6 g(0.08 mol) 中间体9和12.1 g(0.12 mol) 三乙胺,搅拌反应5 h后,TLC [V(乙酸乙酯)∶V(石油醚)=1∶2] 跟踪至反应结束,过滤,脱溶后得灰白色固体,经柱层析[V(乙酸乙酯)∶V(石油醚)=1∶2]分离,得到白色固体18.6 g,产率54.1%。1H NMR(DMSO), δ: 2.16(s, 3H, Ar-CH3), 2.27(s, 3H, pyrazolyl-3-CH3), 2.43(s, 3H, pyrazolyl-5-CH3), 3.73(s, 3H, pyrazolyl-N-CH3), 6.97~7.02 (m,2H,Ar-H), 7.34(d, 2H, J=8.0 Hz, Ar-H), 7.55(d, 2H, J=8.0 Hz, Ar-H), 7.67(s, 1H, Ar-H), 10.77(s, 1H, -CONH)。
参考文献[11]的方法。称取4.2 g(0.06 mol)盐酸羟胺、5.6 g(0.07 mol)乙酸钠于50 mL水中,室温搅拌至无气泡时止,配成羟胺水溶液备用。称取17.2 g(0.04 mol)中间体10,溶于200 mL乙醇中,缓慢滴加羟胺水溶液,滴毕,于80 ℃下回流,TLC [V(乙酸乙酯)∶V(石油醚)=1∶2]跟踪至反应结束。降至室温,将反应液倒入100 mL水中,用200 mL乙酸乙酯萃取,有机相用无水硫酸钠干燥,过滤,滤液脱溶,柱层析[V(乙酸乙酯)∶V(石油醚)=1∶2]分离得白色固体。 1H NMR,δ: 2.24(s, 3H, Ar-CH3), 2.43(s, 3H, pyrazolyl-3-CH3), 2.51(s, 3H, pyrazolyl-5-CH3), 3.77(s, 3H, pyrazolyl-N-CH3), 6.89(d, 2H, J=8.8 Hz, Ar-H), 6.94(d, 1H, J=8.4 Hz, Ar-H), 7.15~7.20(m, 2H,Ar-H), 7.49(d, 2H, J=8.8 Hz, Ar-H), 7.60(s, 1H, Ar-H), 8.75(s, 1H, -CONH); MS (ESI); m/z: 463[M+H]+; 元素分析(计算值): C 57.30(57.14), H 4.59(4.58), N 12.15(12.12)。
参考文献[12]的方法。室温下将0.5 g (1.2 mmol) 化合物11溶解到20.0 mL四氢呋喃中,加入1.8 mmol 氯甲酸酯和0.14 g (6 mmol) 氢化钠,室温下搅拌,TLC[展开剂V(乙酸乙酯)∶V(石油醚)=1∶3] 跟踪至反应完毕。将反应液倒入冰水中,用乙酸乙酯萃取,脱溶后,柱层析[V(乙酸乙酯)∶V(石油醚)=1∶3]得固体(ZJ1~ZJ7)。
参照《国家南方农药创制中心生测标准程序》[13] 进行。以含质量分数为0.1%吐温-80的DMF为溶剂,将目标化合物配制成质量分数为5%的母液,再用蒸馏水分别稀释成500、250和100 mg/L 的药液。以阿维菌素和炔螨特原药作阳性对照,以DMF作空白对照。
采用活体盆栽法[13]测试目标化合物对朱砂叶螨Tetranychus cinnabarinus的杀螨活性。用小盆钵(直径5 cm)播种蚕豆,待苗高约5~8 cm时,在每株苗上接入20头成螨;采用Potter喷雾法,将接入成螨的蚕豆苗置入喷雾塔,分别用不同质量浓度的药液和DMF喷雾,5~10 d后调查活虫数。统计各处理的死虫数和活虫数,计算校正死亡率(Abbott's公式)。
目标化合物的理化、质谱及元素分析数据见表1;核磁共振氢谱数据见表2。
在制备化合物5时,化合物3与草酰氯反应完毕后,反应液浓缩,未经纯化处理,直接与化合物9进行酰胺化反应,TLC跟踪发现得到2种产物。经柱层析分离,得到2种酰胺:化合物10和副产物1,3,5-三甲基-N-(3-甲基-4-(4-(三氟甲氧基)苯氧)苯基)-1H-吡唑-4-甲酰胺,其结构均经核磁共振氢谱确证。表明在化合物3的酰化反应中,生成了2种酰氯(化合物5和副产物1,3,5-三甲基-1H-吡唑-4-甲酰氯)。实验发现,酰化反应回流时间为1 h左右较好,时间越长,副产物越多。
此外, 在合成化合物8时,为减少副反应、提高收率,需控制反应温度在100℃以上。
| 表1 化合物ZJ的理化、质谱及元素分析数据 Table 1 Physicochemical LC-MS and elemental analysis data of ZJ compounds |
| 表2 化合物ZJ的核磁共振氢谱数据 Table 2 1H NMR data of ZJ compounds |
结果(表3)表明,目标化合物均具有一定的杀螨活性,其中,大部分化合物在 500 mg/L下对朱砂叶螨的致死率达100%,化合物ZJ2和ZJ6在250 mg/L下对朱砂叶螨的致死率达90%,但活性不及对照药剂阿维菌素和炔螨特。有关此类化合物的构效关系还有待进一步研究。
| 表3 目标化合物对朱砂叶螨的杀螨活性
Table 3 The acaricidal activity of title compounds
against Tetranychus cinnabarinus
|
| [1] | 宋宝安, 刘新华, 杨松, 等. 肟类衍生物的合成与农药生物活性的研究进展[J]. 有机化学, 2005, 25(5): 507-525. SONG Baoan, LIU Xinhua, YANG Song, et al. Recent advance in synthesis and biological activity of oxime derivatives[J]. Chin J Org Chem, 2005, 25(5): 507-525. (in Chinese) |
| [2] | 孔令华, 欧阳贵平, 冯道全. 吡唑酰胺类衍生物的生物活性及研究进展[J]. 精细化工中间体, 2009, 39(2): 1-6. KONG Linghua, OUYANG Guiping, FENG Daoquan. Biological activity of pyrazole lactams and their research progress[J].Fine Chem Intermed, 2009, 39(2): 1-6. (in Chinese) |
| [3] | TAKASHI F, HIDEO K, KOZO M, et al. Substituted pyrazolecarboxylic acid anilide derivative or salt thereof, intermediate thereof, agent for agricultural and horticultural use and use thereof: US 20090105325[P]. 2009-04-23. |
| [4] | KR?MER W, SCHIRMER U. Modern Crop Protection Compounds[M]. New York: Wiley, 2007: 462-463. |
| [5] | 王鸣华, 杨春龙, 蒋木庚. 含二芳醚类农药的研究进展[J]. 世界农药, 2002, 24(2): 13-15. WANG Minghua, YANG Chunlong, JIANG Mugeng. The research progress of pesticide containnig tolyloxy benzyl[J]. Word Pesticides, 2002, 24(2): 13-15. (in Chinese) |
| [6] | TEXIER-BOULLET F, KLEIN B, HAMLLIN J. Pyrrole and pyrazole ring closure in heterogeneous media[J]. Synthesis, 1986, 24: 409-411. |
| [7] | CHIRIAC C I. The direct carboxylation of pyrazoles[J]. Synthesis, 1986, 24: 753-755. |
| [8] | 童建颖, 石延霞, 刘幸海, 等. 含邻氟苯基的1, 2, 4-三唑类衍生物的合成及杀菌活性研究[J]. 有机化学, 2012, 32(12): 2373-2377. TONG Jianying, SHI Yanxia, LIU Xinghai, et al. Synthesis and fungicidal activity of 1, 2, 4-triazole derivatives containing 2-fluoro-phenyl moiety[J]. Chin J Org Chem, 2012, 32(12): 2373-2377. (in Chinese) |
| [9] | PRIME M E, ANDERSEN O A, BAKER J J, et al. Discovery and structure-activity relationship of potent and selective covalent inhibitors of transglutaminase 2 for huntington's disease[J]. J Med Chem, 2012, 55(3): 1021-1046. |
| [10] | XUE Y L, LIU X H, ZHANG Y G. Synthesis crystal structure and biological activity of 1-cyano-N-phenylcyclopropanecar-boxamide[J]. Asian J Chem, 2012, 24(4): 1571-1574. |
| [11] | 张春艳, 陈守聪, 王道全, 等. 新的 α -单取代环十二酮肟的合成及晶体结构[J]. 化学学报, 2010, 68(10): 989-995. ZHANG Chunyan, CHEN Shoucong, WANG Daoquan, et al. Synthesis and crystal structure of novel α -monosubstituted cyclodode canone oxime[J]. Acta Chimica Sinica, 2010, 68(10): 989-995. (in Chinese) |
| [12] | HIDEAKI M, KOICHI R. Retinoid prodrug compound: US 20100286427[P]. 2010-11-11. |
| [13] | 胡伟群, 朱卫刚, 陈定花, 等. 甲氧基丙烯酸酯类新化合物ZJ1621的生物活性[J]. 农药学学报, 2007, 9(3): 240-244. HU Weiqun, ZHU Weigang, CHEN Dinghua, et al. Biological activity of novel strobilurin compound ZJ1621[J]. Chin J Pestic Sci, 2007, 9(3): 240-244. (in Chinese) |
 2014, Vol.16
2014, Vol.16 


