赤霉素(gibberellins, GAs)作为一种重要的植物激素,到目前为止已经在微生物和高等植物中发现136种,其主要生理功能是促进植物茎节的伸长生长,对植物从种子萌发到开花结果等都担负着重要角色[1]。迄今为止,赤霉素已经在农业生产和商业应用中发挥了重要作用,对现代农业的发展具有深远影响。目前广为应用的赤霉素品种主要有GA3和GA4+7,它们在提高无籽葡萄产量、打破马铃薯休眠和酿造啤酒时促进大麦种子萌发等方面有较好的效果[2, 3]。大量研究表明,目前只发现有少数几种赤霉素分子具有生物活性,其他均为活性赤霉素分子的代谢产物或中间产物[4]。由于赤霉素是以贝壳杉烯为骨架的具有复杂结构的化合物,人工全合成困难,且成本较高,因而极大地限制了其衍生物的研发。因此,尽管生长素、细胞分裂素和乙烯等人工合成类似物质均已商品化并成功使用多年,但有关赤霉素功能类似物人工合成的研究报道却较少。目前,仅有报道指出以AC-94,377为代表的邻苯二甲酰亚胺类化合物表现出良好的类赤霉素生理活性。近年来,随着分子生物学和结构生物学领域科研技术的迅速发展, 人们对赤霉素受体蛋白的研究越来越深入,尤其是最近Murase等[5]成功鉴定了拟南芥中GA3/GA4-GID1A-DELLA的复合物晶体结构,这为以生物靶标蛋白为导向进行新型赤霉素功能类似物的合理设计奠定了重要基础。目前关于赤霉素的生理作用、生物合成以及其与其他激素之间的相互作用已有较全面的综述报道[6, 7],为了进一步阐明赤霉素发挥生理活性的机理及其与受体蛋白间的内在关系,笔者针对赤霉素及其功能类似物以及最新报道的赤霉素受体蛋白GIBBERELLIN INSENSITIVE DWARF1(GID1)的相关研究进展进行综述。
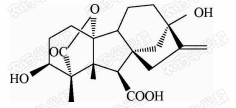
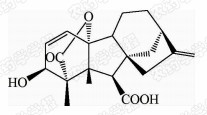
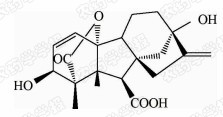
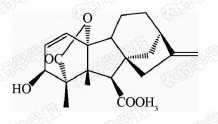
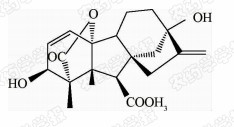
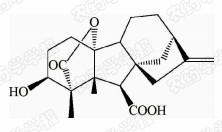
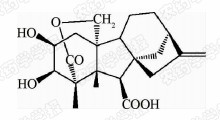
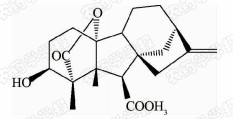
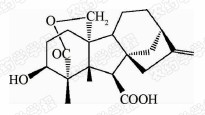
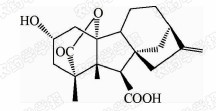
1938年,日本科学家薮田[8]首次从水稻恶苗病的病原菌赤霉菌 Gibberella fujikuroi 中提取得到了赤霉素晶体(GA3);1956年,薮田和住木[9]又从培养物过滤液中分离纯化出2种活性物质, 分别命名为赤霉素A和赤霉素B,后来人们发现它们是同一种物质,均为GA3;1958年,MacMillan[10]首次从高等植物未成熟的菜豆种子中提纯出了赤霉素GA1。随后,世界各国越来越多的科学家对赤霉素开展了卓有成效的研究,不断从多种微生物和高等植物中分离得到了136种结构类似的赤霉素分子[1]。根据所含碳原子数目的不同,赤霉素可分为C19-GAs和C20-GAs两大类,其中C20-CAs的活性普通低于C19-GAs。C19-GAs是由于在赤霉素代谢反应过程中失去了第20位碳,19位碳上羧基与10位碳形成一个内酯桥而得到的。目前,人们发现的具有良好生物活性的赤霉素主要包括GA1、GA3、GA4和GA7等(见图 1)。
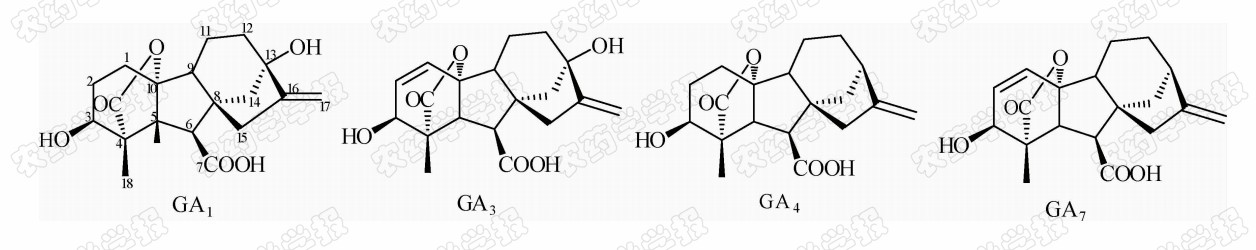 | 图 1 具有高活性的赤霉素分子结构式 Fig.1 The chemical structure of GAs with high bioactivity |
通过对矮化豌豆、水稻、大麦等植物进行活性试验以及对ɑ-淀粉酶进行活性测试,发现生理活性最好的是GA[11]3;而在对赤霉素受体GID1的竞争结合试验中,GA4要优于GA3一个数量级,其IC50值分别为2×10-7和4×10-6 mol/L,离体活性最好的为GA[12, 13]4。这可能是由于GA3分子的C1和C2间存在双键,阻止了GA3在植物体内被2-氧化酶氧化,因而活性降低[12]。通过对已报道的具有良好生物活性的赤霉素对比发现(见表 1),它们具有一些共同的结构特征:1) 6位碳原子连接的均为羧基;2)C19-GAs的相对生物活性要高于C20-GAs;3)3 β -OH是赤霉素分子具有高生物活性的特征基团,如GA1、GA3、GA4、GA7等均含有3 β -OH基团;4)具有2 β -OH的赤霉素不具有生物活性,如GA27。由于不同赤霉素在植物各器官或各生长阶段的分布有所不同,因此,大部分赤霉素在植物体中发挥的功能和生物活性高低都有待进一步深入研究[14]。
| 表 1 不同活性赤霉素的化学结构和离体活性Table 1Table 1 The chemical structure and bioactivities of different GAs |
1963年,Hartsuck等[15]利用X射线衍射法确定了GA3的晶体结构,随后有机化学家竞相开展了对赤霉素的合成研究,但实践 证明这一工作难度很大。以GA3为例,尽管其化学结构并不算太复杂,
1976年,美国氰胺(American Cyanamid)公司合成了一系列新型邻苯二甲酰亚胺类化合物( N -substituted phthalimides, NSPs),并对其在植株上进行了生物活性测试。结果发现,这类化合物具有类似于赤霉素的多重生物活性,即可以打破种子休眠,促进种子发芽,促进胚轴/茎的伸长,促进某些植物开花和无性结果,甚至可以促进植物中酸性磷酸酶、过氧化物酶活性的提高等[23]。在这类NSPs化合物中,表现最为突出的是AC-94,377(图 3),它在许多生物反应中都表现出与赤霉素类似的效果。例如,在有发芽抑制物质或远红外光条件下,它们均可以促进种子发芽, 代替光和冷处理[24]。为了阐明AC -94,377具有多重赤霉素功能活性的内在原因,1989年,Yalpani等[25]进一步研究了AC-94,377与高活性GA4对 黄瓜赤霉素结合蛋白(GA binding protein, GBP)的竞争性结合关系,结果惊奇地发现,AC-94,377与高活性GA4间存在着对GBP的线性竞争抑制关系,推断AC-94,377和GA4可能是竞争性地结合在 GBP的相同位点,而在GBP 中就包括赤霉素受体[26]。为了进一步发现具有更高活性的NSPs类化合物,Yalpani课题组以AC-94,377为先导,进一步设计并合成了一系列新型NSPs衍生物( 1~3 ),并对其进行了与GBP的结合活性测试[25]。结果发现,化合物 1 和 2 的活性要高于先导化合物AC-94,377,化合物 3 的活性与先导化合物相当(图 3)。
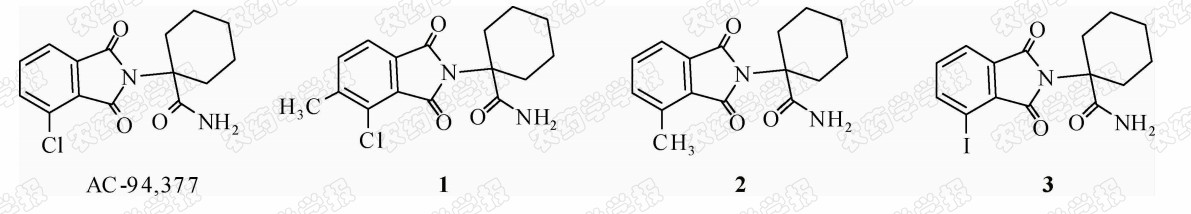 | 图 3 AC-94,377及高活性邻苯二甲酰亚胺类衍生物 Fig.3 AC-94,377 and some N -substituted phthalimides with high activities |
1992年,Suttle等[27]通过引入叠氮基探索了NSPs类衍生物的活性,结果发现,引入叠氮基后,化合物活性均低于先导分子AC-94,377。总之,NSPs类化合物这一人工合成的赤霉素功能类似物的发现,对新型赤霉素类似物的设计与开发提供了重要指导。
赤霉素作为一种羧化疏水阴离子,可溶于细胞间质和胞质,能够通过质子化作用主动运输进出细胞膜。在赤霉素信号转导途径中,存在着能与细胞膜结合的关键元件蛋白——可溶性赤霉素受体[7],由于其在赤霉素信号转导过程中发挥着重要作用而一直颇受关注。20世纪80年代,一系列GBP被列为赤霉素受体的候选物质,Stoddart和Keith等采用茎伸长实验测定了黄瓜胚轴中可溶性GBP与部分赤霉素分子的结合活性[28, 29]。 2005年,Nakajima等从豇豆幼苗中发现一个可溶性GBP具有赤霉素结合活性,进一步研究表明,这个可溶性GBP满足赤霉素受体的4个标准:即与赤霉素可逆结合,具有赤霉素饱和性,与有生理活性的赤霉素具有高亲和力,以及对有生理活性的赤霉素具有合理的配体特异性[30]。但有关这些GBP的结构尚未见进一步报道。
近年来, 对赤霉素受体的研究已取得重大突破。2005年,Ueguchi-Tanaka等[12]对水稻中与赤霉素信号相关的GID1基因进行克隆和编码,首次成功鉴定出可溶性赤霉素受体蛋白—GID1。这一突破性的发现不仅为丰富赤霉素信号转导途径提供了有力的基因组学和生物信息学证据,而且有利于人们更高效地获取完整的GID1分子结构信息,极大地推动了赤霉素信号转导分子机制的研究。基于这一研究成果,人们首次提出了赤霉素分子信号转导模型:GID1先与活性赤霉素结合,再和下游DELLA蛋白SLENDER RICE1(SLR1)发生相互作用,随后,SLR1通过SCFGID2蛋白酶降解,引起一系列下游反应。在这一赤霉素分子信号感知与传递过程中,赤霉素分子可能与这两个关键元件蛋白GID1和SLR1形成了稳定复合物[12],这为人们更好地认识和理解赤霉素信号转导机制提供了重要参考。这一水稻中赤霉素受体蛋白——GID1的首次成功鉴定,对整个GA信号转导机制的研究具有开创性意义。
随后2006年,Nakajima等[31]对拟南芥 Arabidopsis thaliana 中的GID1基因片段进行了克隆和表达,获得了3个具有赤霉素受体功能的等位重组蛋白AtGID1A、AtGID1B和AtGID1C,它们与水稻中的GID1具有高度同源性。进一步对3个等位蛋白分别与活性赤霉素分子和DELLA蛋白进行结合的研究发现,这3个等位蛋白GID1均对活性赤霉素表现出较强的结合能力,同时与DELLA蛋白也存在相互作用:当DELLA蛋白存在时,赤霉素与GID1的结合更为紧密。这一研究结果证明了受体GID1蛋白的确在赤霉素信号转导过程中发挥着重要作用,并在一定程度上有效地解释了上述提到的基于GID1蛋白的赤霉素信号转导模型。
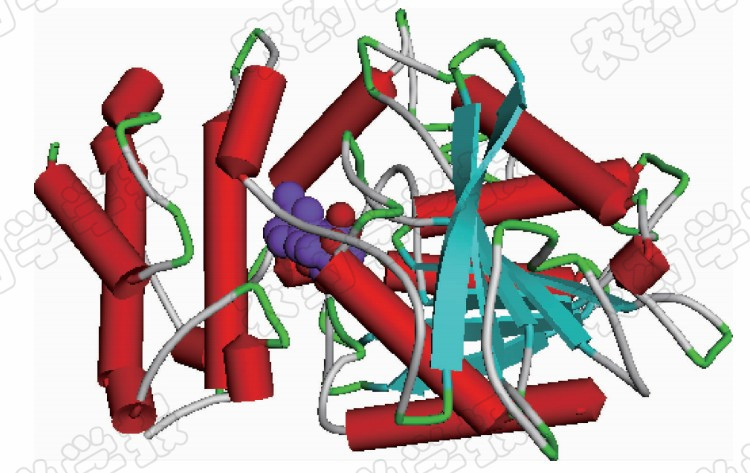
令人振奋的是,2008年,Murase等[5]首次成功获得了拟南芥的GA3-AtGID1A-DELLA和GA4-AtGID1A-DELLA的复合物晶体结构,如图 4所示。
对这一复合物的晶体结构进行分析,发现 AtGID1A是一个含有344个残基的球状单体蛋白,它由一个 α / β 核心结构域和独特的 N -末端延伸区组成。AtGID1A的核心结构域是由1个反平行和7个平行的八链混合 β -折叠结构、7个 α -螺旋结构和2个310螺旋结构组成。在该核心结构域中存在着1个可以容纳赤霉素分子的结合口袋,口袋上方覆盖着 N -末端延伸区。AtGID1A独特的 N -末端延伸区具有高度保守性(1~62残基),由3个螺旋结构( α a~ α c)和1个拓展环( α c- β 1)组成,形成一个平顶盖子,盖于受体蛋白结合口袋上方。
赤霉素受体GID1A晶体结构的成功报道,为基于生物靶标结构进行合理设计新型赤霉素类植物生长调节物质奠定了重要基础。几乎同时,Shimada等[32]也成功获得了水稻GA3-OsGID1和GA4-OsGID1的晶体结构,对比发现,水稻中OsGID1的结构和形态与拟南芥中AtGID1A具有高度相似性,是一个含354个残基的球状单体蛋白。总之,近年来这些有关赤霉素受体GID1家族蛋白结构及其与赤霉素分子间识别模式的研究成果,为阐明赤霉素及其类似物对受体蛋白GID1A的识别机理奠定了分子基础,更加有利于人们认识和理解植物体内赤霉素分子的信号转导机制。
DELLA蛋白是赤霉素信号转导途径中的另一重要元件蛋白,它属于GRAS家族,由于其共有高度保守的DELLA结构域而得名。在不同植物中,常见的DELLA蛋白都有所差异,如拟南芥中包括GA insensitive (GAI)、REPRESSOR of ga1-3 (RGA)、RGA-LIKE1 (RGL1)、RGL2和RGL3,水稻中是SLR1,小麦中是Reduced height (Rht),玉米中是Dwarf8 ( D8),大麦中是Slender1 (SLN1)等[33, 34]。尽管DELLA家族蛋白的 N -末端保守性不强,但它们具有2个高度保守的结构域DELLA和TVHYNP。2002年,Itoh等[35]利用水稻中SLR1基因的不同核苷酸缺失突变体,分析其DELLA蛋白不同结构域的功能,提出在DELLA蛋白中其高度保守的DELLA和TVHYNP结构域是赤霉素信号感知结构域,polyS/T/V(丝氨酸、苏氨酸、缬氨酸富集区)为调节结构域,LZ是二聚化结构域,其C端的VHIID、SH2和SAW等为阻遏结构域。
DELLA蛋白主要存在于植物细胞核中,参与植物的生长和生殖过程,能够作为负调节因子,对植物中的赤霉素信号转导起阻遏作用[34]。2001年,Silverstone等[36]研究表明,活性赤霉素分子可以诱导DELLA蛋白RGA、SLRl和SLNl在细胞核中的降解。2002年,Itoh等[35, 37]提出“赤霉素去阻遏抑制模型”,用来解释活性赤霉素分子调节DELLA蛋白的抑制作用。在该模型中,当DELLA蛋白的赤霉素信号感知区接收到赤霉素信号后,DELLA蛋白就会在细胞核内通过泛素蛋白体通道迅速发生降解[36],导致其阻遏作用被解除,植株表现出正常的赤霉素反应。
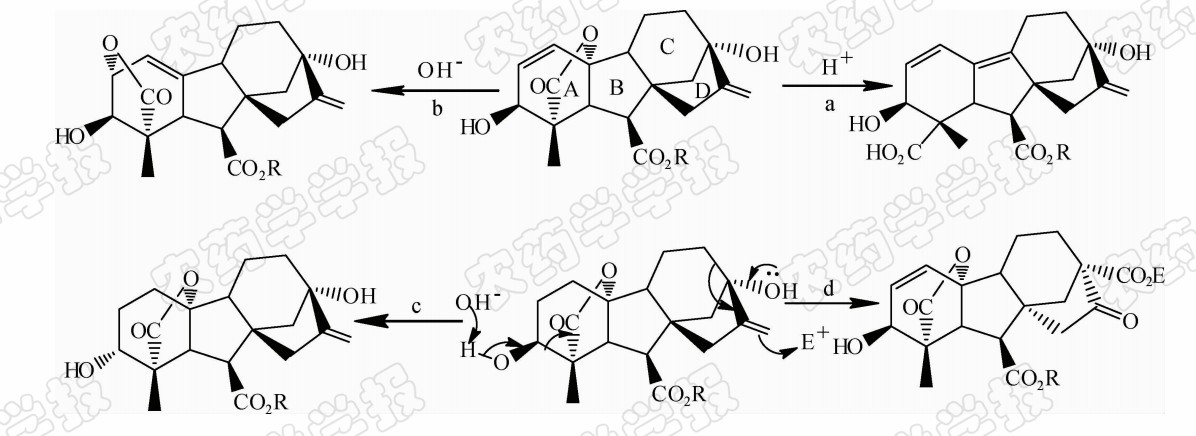
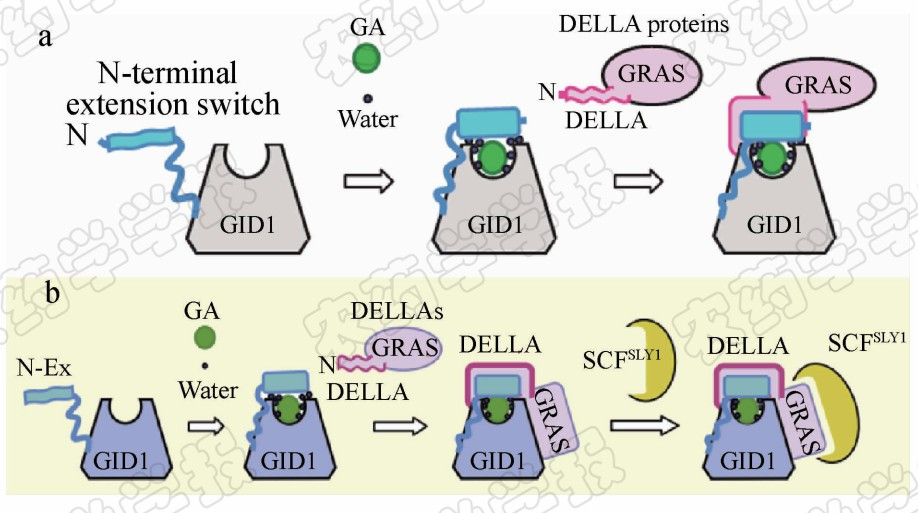
植物中GA-GID1-DELLA信号感知与传递过程是赤霉素信号转导机制的核心部分,也是引起DELLA蛋白降解的最主要途径。人们在不断认识和了解赤霉素信号传递过程的基础上,初步提出了赤霉素信号转导途径模型(图 5a)。在活性赤霉素存在的情况下,受体蛋白GID1首先与赤霉素结合,进而诱导其下游DELLA蛋白与二者形成三元复合体,释放出促生长转录因子,使赤霉素恢复生理功能[7]。在整个赤霉素信号传递过程中,赤霉素分子调节受体GID1和DELLA蛋白间的相互作用是关键。近年来,这一模型得到了不断完善(图 5b),最近有进一步研究指出,在拟南芥GA3-AtGID1A-DELLA复合物形成过程中,AtGID1A的 N -末端延伸区起到了感知赤霉素构象开关的作用[5]。当GID1A诱导赤霉素进入活性口袋后,GID1A的 N -末端延伸区可像盖子一样盖在活性口袋入口处。此时,折叠的 N -末端延伸区形成一个有利于DELLA蛋白N端DELLA/TVHYNP结构域与之作用的结合表面,诱导DELLA蛋白N端发生由弯曲形成螺旋的构象转变。在这一过程中,DELLA蛋白与GA-GID1二元复合物之间的相互作用会导致赤霉素与GID1结合作用的进一步增强,进而使DELLA蛋白N端构象转变,诱导其C端GRAS区域也与受体GID1结合,形成更加稳定的三元复合物,由此导致SCF复合体F-box蛋白对DELLA蛋白GRAS结构域识别能力的加强[4],促进DELLA蛋白泛素化降解,从而彻底解除对赤霉素诱导基因表达的抑制,使植物发生与赤霉素相关的正常生理反应[38]。2013年,郝格非等[39]又提出了新的赤霉素识别机制,认为赤霉素是通过作为“构象稳定剂”來介导受体蛋白GID1与DELLA蛋白之间分子识别的,而不是之前提出的“变构诱导剂”。这些研究将大大推动人 们认识植物中赤霉素识别受体的信号转导过程,有利于人们更清晰地理解高等植物的生长发育过程。
近年来,随着分子生物学和结构生物学的迅猛发展,人们对活性赤霉素激活GID1 进而诱导DELLA 蛋白解除其抑制作用的信息传递通路已经基本明晰,但对不同活性赤霉素与受体蛋白GID1发生特异性结合的分子识别作用规律还不十分明确。目前,对于赤霉素与水稻受体GID1产生相互作用的关键残基已有一些定点突变的研究[40],但关于赤霉素与拟南芥受体GID1A之间产生相互作用的关键氨基酸残基,以及二者之间存在的分子间作用力性质等还有待进一步研究,最近已有研究指出,疏水作用和氢键作用对于赤霉素与拟南芥受体GID1A的识别与结合尤为重要[41, 42]。AC-94,377作为人工合成的植物生长调节物质,在农业实际应用中若能取代赤霉素将产生明显的经济效果,NSPs这类赤霉素功能类似物的发现,对于开发新骨架的赤霉素功能类似物具有重要指导作用。最近,对赤霉素受体蛋白GID1的首次鉴定及GA-GID1A-DELLA三元复合物等晶体结构的成功获得,使得基于生物靶标结构开发新型的赤霉素功能类似物已成为可能[43]。因此,利用现代计算机辅助分子设计技术,结合化学合成和生物活性筛选方法,有望开发出具有新颖骨架结构的高效赤霉素功能类似物,更好地应用于未来的农业生产实际中。
| [1] | DAVIES P J. Plant Hormones: Physiology, Biochemistry and Molecular Biology[M]. Dordrecht, Boston: Kluwer Academic, 1995. |
| [2] | HEDDEN P. The genes of the green revolution[J]. Trends Genet, 2003, 19: 5-9. |
| [3] | PENG J R, RLCHARDS D E, HARTLEY N M, et al. ‘Green Revolution’ genes encode mutant gibberellin response modulators[J]. Nature, 1999, 400: 256-261. |
| [4] | 黄先忠, 马正强. DELLA家族蛋白与植物生长发育的关系[J]. 植物生理学通讯, 2004, 40(5): 529-532. |
| [5] | MURASE K, HIRANO Y, SUN T P, et al. Gibberellin-induced DELLA recognition by the gibberellin receptor GID1[J]. Nature, 2008, 456: 459-464. |
| [6] | 李保珠, 赵翔, 安国勇.赤霉素的研究进展[J].中国农学通报, 2011, 27(1):1-5. LI Baozhu, ZHAO Xiang, AN Guoyong.Recent advances in research of gibberellins[J].Chin Agric Sci Bull, 2011, 27(1):1-5.(in Chinese) |
| [7] | 张国华, 张艳洁, 丛日晨, 等.赤霉素作用机制研究进展[J].西北植物学报, 2009, 29(2):412-419. ZHANG Guohua, ZHANG Yanjie, Cong Richen, et al.Advances on gibberellins mechanism[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(2):412-419. (in Chinese) |
| [8] | YABUTA T, SUMIKI Y. On the crystal of gibberellin, a substance to promote plant growth[J]. J Agric Chem Soc, 1938, 14: 1526. |
| [9] | RADLE M. Occurrence of substances similar to gibberellic acid in higher plants[J]. Nature, 1956, 178: 1070-1071. |
| [10] | MACMILLAN J, SUTER P J. The occurrence of gibberellin A1 in higher plants: Isolation from the seed of runner bean (Phaseolus multiflorus)[J]. Naturwissenschaften, 1958, 45: 46. |
| [11] | BERGNER C, LISCHEWSKI M, ADAM G, et al. Biological activity of gibberellin analogues[J]. Planta, 1982, 155: 231-237. |
| [12] | UEGUCHI-TANAKA M, ASHIKARI M, NAKAJIMA M, et al. GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellins[J]. Nature, 2005, 437: 693-698. |
| [13] | YALPANI N, SRIVASTAVA L M. Competition for in vitro[3H]Gibberellin A4 binding in cucumber by gibberellins and their derivatives[J]. Plant Physiol, 1985, 79: 963-967. |
| [14] | 王伟, 朱平, 程克棣.植物赤霉素生物合成和信号传导的分子生物学[J].植物学通报, 2002, 19(2):137-149. WANG Wei, ZHU Ping, CHENG Kedi.Molecular biology of the plant gibberellin biosynthesis and signaling[J]. Chin Bull Bot, 2002, 19(2):137-149.(in Chinese) |
| [15] | HARTSUCK J A, LIPSCOMB W N. Molecular and crystal structure of the Di-p- bromobenzoate of the methyl ester of gibberellic acid[J]. J Am Chem Soc, 1963, 85: 3414-3419. |
| [16] | COREY E J, DANHEISER R L, CHANDRASEKAYAN S, et al. Stereospecific total synthesis of gibberellic acid, a key tricylic intermediate. J Am Chem Soc, 1978, 100: 8031-8034. |
| [17] | HOOK J M, MANDER L N, URECH R. Total synthesis of gibberellic acid: The hydrofluorene route[J]. J Am Chem Soc, 1980, 102: 6628-6629. |
| [18] | MANDER L N. New strategies for the construction of highly functionalized organic molecules: applications to C19 gibberellin synthesis[J]. Acc Chem Res, 1983, 16(2): 48-54. |
| [19] | 潘鑫复, 赵河.赤霉素合成的研究进展[J].有机化学, 1990, 10(2):97-105. PAN Xinfu, ZHAO He.Progress in the approaches to the synthesis of gibberellins[J].Chin J Org Chem, 1990, 10(2):97-105.(in Chinese) |
| [20] | 刘建平.环丙烷骨架赤霉素衍生物的合成及结构鉴定[J].云南民族学院学报:自然科学版, 2002, 11(4):222-224. LIU Jianping.Synthesis and structural determination of GA derivative with cyclo propyl skeleton[J]. J Yunnan Univ Nationalities:Nat Sci Ed, 2002, 11(4):222-224.(in Chinese) |
| [21] | 吴佳. 赤霉素GA3及GA4+7的部分结构修饰合成与反应研究[D]. 昆明: 云南大学, 2006. |
| [22] | 李鹏辉. 赤霉酸衍生物的合成及生理活性研究[D]. 昆明: 云南大学, 2010. |
| [23] | SUTTLE J C, HULTSTRAND J F. Physiological studies of a synthetic gibberellin-like bioregulator[J]. Plant Physiol, 1987, 84: 1068-1073. |
| [24] | SIMONOVIC A, GRUBISIC D, GIBA A, et al. Interaction of gibberellins and fusicoccin in growth retardant and far red light inhibited germination of lettuce seeds[J]. Plant Growth Regul, 2000, 32(1): 9l-97. |
| [25] | YALPANI N, SUTTLE J C, HULTSTRAND J F, et al. Competition for in vitro[3H] gibberellin A4 binding in cucumber by substituted phthalimides[J]. Plant Physiol, 1989, 91: 823-828. |
| [26] | 李伟强, 刘小京, 山口信次郎.一种赤霉素的功能类似物:邻苯二甲酰亚胺 (phthalimide)[J].植物生理学通讯, 2005, 41(1):111-115. LI Weiqiang, LIU Xiaojing, YAMAGUCHI S.A gibberellic:like bioregulator N-substituted phthalimide[J]. Plant Physiol Commun, 2005, 41:111-115.(in Chinese). |
| [27] | SUTTLE J C, HULTSTRAND J F, TANAKA F S. The biological activities of five azido N-substituted phthalimides: potential photoaffinity reagents for gibberellin receptors[J]. Plant Growth Regul, 1992, 11: 311-318. |
| [28] | STODDART J L. Interaction of[3H] gibberellin A1 with a subcellular fraction from lettuce (Lactuca sativa L.) hypocotyls. I. Kinetics of labeling[J] Planta, 1979, 146: 353-361 |
| [29] | KEITH B, FOSTER N A, BONETTEMAKER M, et al. In vitro gibberellin A4 binding to extracts of cucumber hypocotyls[J]. Plant Physiol, 1981, 68: 344-348. |
| [30] | PARK S H, NAKAJIMA M, HASEGAWA M, et al. Similarities and differences between the characteristics of gibberellin-binding protein and gibberellin 2-oxidases in adzuki bean (Vigna angularis) seedlings[J]. Biosci Biotechnol Biochem, 2005, 69: 1508-1514. |
| [31] | NAKAJIMA M, ASHIKARI M, TAKASHI Y, et al. Identification and characterization of Arabidopsis gibberellin receptor[J]. The Plant Cell, 2006, 46: 880-889. |
| [32] | SHIMADA A, UEGUCHI-TANAKA M, NAKATSU T, et al. Structural basis for gibberellin recognition by its receptor GID1[J]. Nature, 2008, 456: 459-464. |
| [33] | IKEDA A, UEGUCHI-TANAKA M, SONODA Y, et al. Slender rice, a constitutive gibberellins response mutant, is caused by a null mutation of the SLR gene, an ortholog of the height regulating gene GAI/RGA/RHT/D8[J]. Plant Cell, 2001, 13: 999-1010. |
| [34] | LEE S, CHENG H, PENG J, et a1. Gibberellin regulates Arabidopsis seed germination via RGL2, a GAI/RGA-like gene whose expression is up-regulated following imbibitions[J]. Genes Dev, 2002, 16: 646-658. |
| [35] | ITOH H, UEGUCHI-TANAKA M, SATO Y, et a1. The gibberellin signaling pathway is regulated by the appearance and disappearance of SLENDER RICE1 in nuclei[J]. Plant cell, 2002, 14: 57-70. |
| [36] | SILVERSTONE A L, JUNG H S, SUN T P, et a1. Repressor: Gibberellin-induced rapid reduction of RGA protein in Arabidopsis[J]. Plant Cell, 2001, 13: 1555-1566. |
| [37] | 黄先忠, 马正强.DELLA家族蛋白与植物生长发育的关系[J].植物生理学通讯, 2004, 40(5):529-532. HUANG Xianzhong, MA Zhengqiang.Progress in studies on DELLA protein family in plant growth and development[J]. Plant Physiol Commun, 2004, 40(5):529-532.(in Chinese) |
| [38] | HARBERD N P, BELFIELD E, YASUMURA Y. The Angiosperm Gibberellin-GID1- DELLA growth regulatory mechanism: how an ""inhibitor of an inhibitor"" enables flexible response to fluctuating environments[J]. The Plant Cell, 2009, 21: 1328-1339. |
| [39] | HAO Gefei, YANG Shenggang, YANG Guangfu, et al. Computational gibberellin-binding channel discovery unraveling the unexpected perception mechanism of hormone signal by gibberellin receptor[J]. J Comput Chem, 2013, 34: 2055-2064. |
| [40] | XIANG Hongyu, TAKEUCHI H, TSUNODA Y, et al. Thermodynamic characterization of OsGID1-gibberellin binding using calorimetry and docking simulations[J]. J Mol Recognit, 2011, 24: 275-282. |
| [41] | 刘鸿晨.以GID1为靶向赤霉素分子作用机制的研究.北京:中国农业大学, 2010 LIU Hongchen.Molecular mechanism study of GA molecules based on GID1A.Beijing:China Agricultural University, 2010.(in Chinese) |
| [42] | DUAN Hongxia, LI Dongling, LIU Hongchen, et al. Computational insight into novel molecular recognition mechanism of different bioactive GAs and the Arabidopsis receptor GID1A[J]. J Mol Model, 2013, 19: 4613-4624. |
| [43] | 李冬玲.以赤霉素受体GID1A为靶标的新型赤霉素功能类似物的合理设计[D].北京:中国农业大学, 2013 LI Dongling.Rational design of novel GA functional analogues based on GA receptor GID1A[D].Beijing:China Agricultural University, 2013.(in Chinese) |
 2013, Vol. 15
2013, Vol. 15