文章信息
- 孙诗谣, 饶钦雄, 程琳, 杨俊花, 赵志辉
- SUN Shiyao, RAO Qinxiong, CHENG Lin, YANG Junhua, ZHAO Zhihui
- PINK1/Parkin通路介导的线粒体自噬在十溴联苯醚诱导肉鸡肾脏损伤中的作用
- Effects of mitochondrial autophagy mediated by PINK1/Parkin pathway in kidney injury of broilers exposed to decabromodiphenyl ether
- 南京农业大学学报, 2021, 44(4): 756-765
- Journal of Nanjing Agricultural University, 2021, 44(4): 756-765.
- http://dx.doi.org/10.7685/jnau.202008022
-
文章历史
- 收稿日期: 2020-08-21
2. 上海市农业科学院农产品质量标准与检测技术研究所, 上海 201403
2. Institute for Agri-Food Standards and Testing Technology, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China
十溴联苯醚(BDE-209)是目前最具代表性且使用最为广泛的一种溴代阻燃剂, 常被添加于纺织品、电子产品及高分子材料等[1]。其化学分子式为C12Br10O, 具有亲脂疏水、难降解、易沉积、易迁移等特性。BDE-209已在不同环境介质中被检出, 并且可降解为具有较强毒性的低溴联苯醚、甲基化或羟基化代谢产物[2-3]。除暴露环境外, BDE-209还可通过食物链进入人和动物机体, 并已在人的皮肤、头发、指甲及母乳内检出其残留[4-6]。随着BDE-209在生物体内的不断富集, 极易引起神经、免疫和生殖毒性以及癌症等[7-8]。目前, BDE-209对环境及生物安全均造成严重的威胁, 其危害与防控也成为研究的热点。
在中国, 禽肉是仅次于猪肉的第二大肉类消费品, 预测至2030年鸡肉的人均消费量每年将达11.22 kg[9]。然而, 有资料显示在家禽饲料、鸡蛋、鸡肉以及鸡的皮肤、肝脏、脾脏、肾脏等组织器官内均检测出BDE-209残留[10-12], 不仅威胁消费者健康, 也给家禽养殖业造成巨大的损失。目前, 有关BDE-209对家禽的毒理学研究报道较少, 深入探索BDE-209对肉鸡的毒性作用, 不仅可以揭示BDE-209对家禽的危害, 对精准防控可持续污染物的危害也具有重要意义。
肾脏是机体重要的器官, 不仅可以通过生成尿液的方式清除体内的代谢产物和废弃物, 还可通过重吸收以保留水分及其他营养物质, 对保障机体内环境稳定, 促使新陈代谢具有重要作用。有证据揭示, 肾脏也是多溴联苯醚(polybrominated diphenyl ethers, PBDE)重要的靶器官之一, 其中BDE-209在209种多溴联苯醚同系物中使用最为广泛。以100 mg·kg-1·d-1 BDE-209灌胃饲养小鼠20 d后, 出现严重的肾水肿[13]。其他研究也表明, 血清尿素氮(CRE)和肌酐(BUN)含量在BDE-209暴露下也明显升高, 小鼠肾脏抗氧化能力下降和脂质过氧化程度增加[14-15]。此外, BDE-209诱导大鼠肾上腺髓质嗜铬细胞瘤细胞株PC12线粒体自噬空泡增多[16]。然而, BDE-209导致肾脏损伤是否与组织氧化应激和线粒体自噬有关还未见报道。本研究以AA肉鸡为试验动物, 探索不同浓度BDE-209饲喂对血清及肾脏损伤相关指标、氧化应激与自噬水平的影响, 旨在为揭示BDE-209的肾脏毒性及作用机制提供理论依据。
1 材料与方法 1.1 试剂与仪器设备BDE-209, 白色粉末, 纯度大于98%, 购自中国上海麦克劳林生物有限公司。Real-time PCR所用试剂TB GreenTM Premix EX Taq、ROX Reference Dye Ⅱ、RNase-free H2O及Prime-Script RT-PCR试剂盒为大连TaKaRa公司产品。兔抗p62、LC3、Parkin抗体和鼠抗β-actin抗体, 辣根过氧化物酶(HRP)标记的山羊抗兔IgG, HRP标记的山羊抗鼠IgG, 4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole, DAPI), 抗荧光淬灭封片剂, 自发荧光淬灭剂, BSA(牛血清白蛋白), 20×柠檬酸抗原修复液, RIPA(radio immunoprecipitation assay)裂解液以及磷酸化蛋白酶抑制剂均为Servicebio公司产品。兔抗PINK1抗体为Abcam公司产品。总抗氧化能力(total antioxidant capacity, T-AOC)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性和丙二醛(malondialdehyde, MDA)含量等检测试剂盒均购自南京建成生物工程研究所。线粒体膜电位检测试剂盒(JC-1)购自上海碧云天生物技术有限公司。无水乙醇、二甲苯等试剂均为国产分析纯, 购自国药(上海)集团化学试剂有限公司。
仪器: 台式冷冻离心机(Eppendorf); AU5800全自动生化分析仪(Beckman); 高速组织研磨仪(Servicebio); 多功能荧光酶标仪(Multiskan Sky, Thermo); 全景组织切片扫描仪(3D Histech Pannoramic 250);正置荧光显微镜(Nikon Eclipse C1)及显微镜相机控制器(Nikon DS-U3);微量紫外分光光度计(Quawell Q3000);荧光定量PCR仪(QuantStudio 5);电泳凝胶成像系统(Kodak 1D)。
1.2 动物饲养与试验设计150只体况良好的1日龄雄性AA白羽肉鸡, 购自江苏广大畜禽有限公司, 随机分为5组, 每组设置6个重复, 每个重复5只。分别在5个试验组基础日粮中添加0、0.004、0.04、0.4和4.0 g·kg-1 BDE-209。光照处理: 1~3 d, 每天光照24 h; 4~28 d, 每天光照23 h; 29~42 d, 每天光照5 h后黑暗饲养1 h, 每天4次循环。饲养第1周, 鸡舍温度保持35 ℃, 随后每周降低3 ℃直至第5周。维持相对湿度40%~50%。试验在上海市农业科学院肉鸡养殖场进行。试验开始前, 按所设剂量分别将BDE-209逐级稀释后均匀拌入饲料中, 每天提供干净水源及所配饲料供肉鸡自由采食。日粮配置依据《中国肉鸡的饲养标准: NT/T 33—2004》及已有配方参考配制(表 1)[17-18]。另外, 基础日粮中BDE-209及PBDE含量采用气相色谱-高分辨率质谱仪(Thermo Fisher)检测, 其浓度均低于0.000 2 mg·kg-1。
| 原料组成Ingredients | 水平/% Level | 营养水平计算值Calculated nutrient values | 水平/% Level | |||
| 0~21 d | 22~42 d | 0~21 d | 22~42 d | |||
| 玉米Maize | 62.5 | 65.2 | 代谢能2 Metabolizable energy2 | 11.22 | 12.16 | |
| 大豆粕Soybean meal | 23.5 | 22.3 | 粗蛋白Crude protein | 17.13 | 16.48 | |
| 麸皮Wheat bran | 1.6 | 0.6 | 粗脂肪Crude fat | 6.18 | 7.12 | |
| 全脂大豆粉Full-fat soybeans | 2.0 | 3.2 | 钙Ca | 1.54 | 1.07 | |
| 鱼粉Fish meal | 4.0 | 3.0 | 总磷Total P | 0.43 | 0.40 | |
| 大豆油Soybean oil | 2.0 | 2.6 | 可利用磷Available P | 0.21 | 0.19 | |
| 盐NaCl | 0.5 | 0.3 | 赖氨酸Lysine | 1.85 | 1.26 | |
| 石粉Limestone powder | 1.6 | 0.5 | 蛋氨酸Methionine | 0.29 | 0.27 | |
| 磷酸一钙Monocalcium phosphate | 0.3 | 0.3 | ||||
| 预混料1 Premix1 | 2.0 | 2.0 | ||||
| 合计Total | 100 | 100 | ||||
| 注: 1)预混料为每千克饲料提供: 维生素A 12 000 IU, 维生素D 5 000 IU, 维生素E 50 IU, 维生素K 3 mg, 维生素B1 2 mg, 维生素B2 6 mg, 烟酸60 mg, 泛酸18 mg, 吡哆醇4 mg, 生物素0.2 mg, 叶酸1.75 mg, 维生素B12 0.016 mg, 铜8 mg, 碘1 mg, 铁80 mg, 锰100 mg, 钼1 mg, 硒0.15 mg, 锌80 mg; 2)代谢能单位为MJ·kg-1。 Note: 1)The premix provided the following per kg of the diet: vitamin A 12 000 IU, vitamin D 5 000 IU, vitamin E 50 IU, vitamin K 3 mg, vitamin B1 2 mg, vitamin B2 6 mg, nicotinic acid 60 mg, pantothenic acid 18 mg, pyridoxine 4 mg, biotin 0.2 mg, folic acid 1.75 mg, vitamin B12 0.016 mg, copper 8 mg, iodine 1 mg, iron 80 mg, manganese 100 mg, molybdenum 1 mg, selenium 0.15 mg, zinc 80 mg; 2)The unit of metabolizable energy is MJ·kg-1. | ||||||
试验结束时, 每只鸡用真空管翅静脉采血5 mL, 3 000 r·min-1离心15 min, 分离收集上层血清, 全自动血液生化分析仪检测BUN和CRE浓度。
1.3.2 肾脏样品采集及氧化应激指标检测每个试验组每个重复随机选取3只, 共90只进行宰杀, 手术剖解迅速分离肾脏, 一部分切取1.0 cm×1.0 cm×0.5 cm组织块, 固定于体积分数为4%的福尔马林溶液, 用于石蜡切片分析; 另一部分加入OCT包埋剂, -20 ℃保存用于冰冻切片, 剩余组织置于1.5 mL离心管中, -80 ℃保存。
取0.1 g低温冷冻肾脏组织, 加入900 μL无菌生理盐水, 冰浴匀浆, 3 000 r·min-1离心15 min, 取上清液, 依据试剂盒操作说明检测T-AOC、SOD、GSH-Px活性和MDA含量。
1.3.3 肾脏组织病理学检测固定后常规取材, 脱水透明, 石蜡包埋, 制成4 μm石蜡切片, 二甲苯及梯度乙醇脱蜡, 脱水, 依据苏木精-伊红(HE)染色程序依次染色, 封片, 使用全景组织切片扫描仪(3D Histech Pannoramic 250)拍照观察。
1.3.4 肾脏线粒体膜电位(JC-1)检测取冰冻组织, 常规切片, 室温复温, 控水滴加JC-1稀释液, 1∶500稀释, 37 ℃孵育20 min, PBS(pH7.4)洗涤3次, 封片, 于荧光显微镜下观察及采集图像。
1.3.5 自噬蛋白p62与LC3的免疫荧光组化检测将石蜡切片依次经二甲苯、梯度乙醇脱蜡至水; 抗原修复后, 50 g·L-1脱脂奶粉封闭; 分别加入一抗(兔抗p62, 1∶300;兔抗LC3, 1∶300), 湿盒4 ℃孵育过夜; 加入二抗(HRP标记的山羊抗兔IgG, 1∶400), 室温避光孵育50 min; 自发荧光淬灭后使用DAPI复染细胞核; 封片, 在荧光显微镜下观察并采集图像。
1.3.6 RT-qPCR检测自噬关键基因的表达Trizol一步法提取肾脏总RNA, 微量紫外分光光度计测定RNA的浓度及纯度。采用Prime-Script RT-PCR试剂盒完成反转录后将cDNA进行qPCR检测。qPCR反应体系(20 μL): cDNA 1 μL, TB GreenTM Premix EX Taq 10 μL, ROX Reference Dye Ⅱ 0.4 μL, 引物0.4 μL, RNase-free H2O 7.8 μL。反应条件: 95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 20 s, 60 ℃ 1 min, 95 ℃ 15 s, 40个循环。引物参照已有序列, 并选用鸡GAPDH作为内参基因[19-20], 由上海派森诺生物科技有限公司合成(表 2)。
| 基因 Genes |
基因登陆号 GenBank ID |
引物对序列 Prime pairs sequences(5′→3′) |
| LC3-Ⅰ | XM_417327 | TTACACCCATATCAGATTCTTG/ATTCCAACCTGTCCCTCA |
| LC3-Ⅱ | NM_001031461 | CTTCTTCCTCCTGGTGAACG/GCACTCCGAAAGTCTCCTGA |
| p62 | XM_001233248 | GTGACTCCTGCTTCTCCTAATC/CGTAGCAGACTCTGTGTTACTC |
| PINK1 | NM_001389481 | TGCAGTTGTTGGAAGGTGTG/CAGCCAGCAGAATCGAACTC |
| Parkin | XM_419615 | GTCCAGCAAAGCATCGTTCA/CAACGATGGAAGGATGCTGG |
| GAPDH | NM_204305 | GCCATCACAGCCACACAGAAGA/CGGCAGGTCAGGTCAACAACAG |
| 注: LC3-Ⅰ: 微管相关蛋白1轻链3-Ⅰ基因Microtubule-associated protein 1 light chain 3-Ⅰgene; LC3-Ⅱ: 微管相关蛋白1轻链3-Ⅱ基因Microtubule-associated protein 1 light chain 3-Ⅱ gene; p62: 选择性自噬接头蛋白p62基因Selective autophagic adaptor protein sequestosome 1(p62)gene; PINK1: PTEN诱导激酶1基因PTEN-inducible kinase 1 gene; Parkin: E3泛素化蛋白Parkin基因E3 ubiquitinated protein Parkin gene; GAPDH: 甘油醛-3-磷酸脱氢酶基因Glyceraldehyde-3-phosphate dehydrogenase gene. | ||
准确称取0.1 g肾脏组织于匀浆管中, 置于高速组织研磨仪中匀浆, 12 000 r·min-1离心10 min, 收集上清液, BCA试剂盒检测总蛋白浓度。100 g·L-1SDS-PAGE分离蛋白, 转膜, 用50 g·L-1脱脂奶粉(0.5% TBST溶解)室温封闭1 h。分别加一抗(鼠抗β-actin, 1∶4 000;兔抗p62, 1∶1 000;兔抗LC3, 1∶1 000;兔抗PINK1, 1∶1 000;兔抗Parkin, 1∶750), 4 ℃孵育过夜。TBST洗涤后分别加二抗(HRP标记的山羊抗鼠IgG, 1∶3 000;HRP标记的山羊抗兔IgG, 1∶3 000), 室温孵育30 min。TBST洗涤后加入ECL化学发光剂, 凝胶电泳成像系统(Kodak 1D)显影, Image J软件分析条带灰度值。
1.4 数据分析采用SPSS 16.0统计软件进行数据分析, 差异显著性检验采用单因素方差分析(ANOVA), 结果均以平均值±标准差(x±SD)表示。
2 结果与分析 2.1 不同剂量BDE-209对肉鸡血清BUN及CRE浓度的影响由表 3可见: 与对照组相比, BDE-209处理组BUN和CRE浓度均升高, 其中0.04、0.4和4.0 g·kg-1 BDE-209组具有显著性差异(P < 0.05), 且呈剂量依赖效应。其中, 0.4和4.0 g·kg-1 BDE-209组还分别显著高于0.004和0.04 g·kg-1 BDE-209组(P < 0.05), 但0.4和4.0 g·kg-1 BDE-209组间无显著差异(P>0.05)。
| BDE-209剂量/(g·kg-1) Dosage of BDE-209 |
c(BUN)/(mmoL·L-1) | c(CRE)/(μmoL·L-1) |
| 0(CK) | 0.52±0.16c | 3.08±0.64c |
| 0.004 | 0.84±0.16bc | 4.17±0.48bc |
| 0.04 | 1.08±0.24b | 5.93±0.62b |
| 0.4 | 2.71±0.26a | 10.67±0.61a |
| 4.0 | 2.70±0.24a | 10.75±0.69a |
| 注: 同列数据肩标不同字母表示在0.05水平差异显著(P < 0.05)。下同。 Note: The different letters in same row indicate significant difference at 0.05 level. The same as follows. | ||
由表 4可见: 与对照组相比, BDE-209各处理组T-AOC活性无显著变化(P>0.05)。0.4和4.0 g·kg-1 BDE-209组SOD活性均显著低于对照和0.004和0.04 g·kg-1 BDE-209组(P < 0.05);0.04、0.40和4.0 g·kg-1 BDE-209组GSH-Px活性也均显著低于对照和0.004 g·kg-1 BDE-209组(P < 0.05), 且0.4和4.0 g·kg-1 BDE-209组均显著低于0.04 g·kg-1 BDE-209组(P < 0.05), 但0.4和4.0 g·kg-1 BDE-209组之间无显著差异(P>0.05)。与之相反, 0.04、0.4和4.0 g·kg-1 BDE-209组MDA含量均显著上升(P < 0.05), 且0.4和4.0 g·kg-1 BDE-209组也均显著高于0.04 g·kg-1 BDE-209组(P < 0.05), 但二者之间无显著差异(P>0.05)。
| BDE-209剂量/(g·kg-1) Dosage of BDE-209 |
T-AOC活性/(IU·mg-1) Activity of T-AOC |
SOD活性/(IU·mg-1) Activity of SOD |
GSH-Px活性/(IU·mg-1) Activity of GSH-Px |
MDA含量/(nmol·mg-1) Content of MDA |
| 0(CK) | 80.62±7.67 | 239.25±16.84a | 14.41±1.02a | 0.018±0.003c |
| 0.004 | 78.96±3.49 | 197.33±13.90a | 13.95±1.18a | 0.017±0.005c |
| 0.04 | 83.90±9.49 | 221.24±12.22a | 9.89±0.71b | 0.034±0.003b |
| 0.4 | 54.27±12.82 | 79.04±13.84b | 6.44±1.23c | 0.059±0.001a |
| 4.0 | 55.93±8.58 | 63.41±14.16b | 4.36±0.73c | 0.062±0.003a |
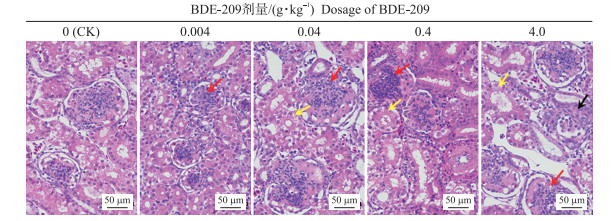
HE染色结果(图 1)显示: 对照组肾小球、肾小管形态结构正常, 肾间质与皮质间无炎性细胞浸润, 未见肾小管上皮细胞脱落等病理现象。0.004 g·kg-1 BDE-209组肾小球内细胞数量增多, 肾小球体积增大(红色箭头); 0.04 g·kg-1 BDE-209组肾小球肥大, 体积增大(红色箭头), 且见轻度肾小管正常结构消失(黄色箭头); 0.4 g·kg-1 BDE-209组肾小球内容物增多(红色箭头), 且肾小管上皮细胞水肿, 胞质疏松(黄色箭头); 4.0 g·kg-1 BDE-209组肾脏组织内肾小球体积增大且基底膜增厚, 伴随细胞成分增多(红色箭头), 多见肾小管上皮细胞中度水肿, 胞质疏松淡染(黄色箭头), 局部肾小管正常结构消失并伴有大量炎性细胞浸润(黑色箭头)。
|
图 1 不同剂量BDE-209处理的肉鸡肾脏组织病理学变化 Fig. 1 Renal histopathological changes of broilers treated with different doses of BDE-209 |
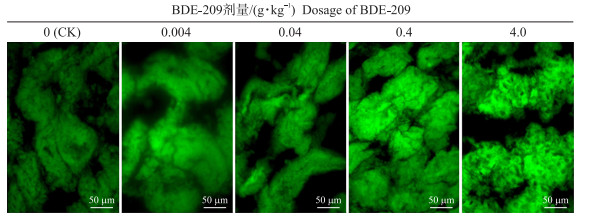
线粒体膜电位(JC-1)检测结果(图 2)显示: 经不同浓度BDE-209饲喂42 d后, 肾脏线粒体呈受损状态, 线粒体膜电位下降, JC-1不能聚集于线粒体基质中, JC-1单体增多至绿色荧光增强, 且随BDE-209浓度的增加, 绿色荧光逐渐增强。
|
图 2 不同剂量BDE-209对肉鸡肾脏线粒体膜电位的影响(JC-1) Fig. 2 Effects of different doses of BDE-209 exposed to broilers on renal mitochondrial membrane potential(JC-1) |
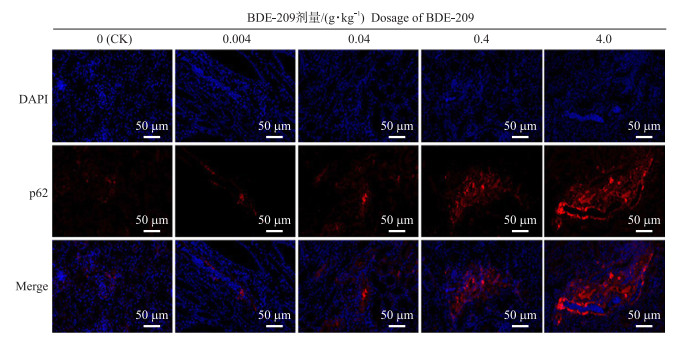
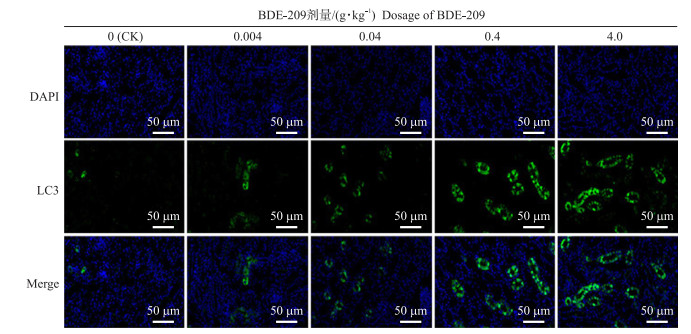
免疫荧光染色结果(图 3、图 4)显示, 不同剂量BDE-209饲喂肉鸡42 d后, 自噬蛋白p62和LC3在肉鸡肾脏内均被激活, 其中红色荧光染色(图 3)显示p62蛋白为阳性, 绿色荧光染色(图 4)显示LC3为阳性, 均呈现浓度依赖性增强。进一步统计结果显示: 与对照组相比, 0.004和0.04 g·kg-1 BDE-209组p62表达量均增加, 但无显著性差异(P>0.05), 0.4和4.0 g·kg-1 BDE-209组p62蛋白表达量均显著上升(P < 0.05)(图 5-A)。此外, 与对照组相比, 添加BDE-209组LC3蛋白的表达均显著升高(P < 0.05)(图 5-B)。
|
图 3 不同剂量BDE-209处理的肉鸡肾脏p62蛋白免疫组化分析 Fig. 3 Immunohistochemical analysis of p62 in kidney of broilers exposed to different doses of BDE-209 蓝色荧光表示细胞核; 红色荧光表示p62蛋白阳性表达。 Blue fluorescence shows nucleus; red fluorescence shows the positive expression of p62 protein. |
|
图 4 不同剂量BDE-209处理的肉鸡肾脏LC3蛋白免疫组化分析 Fig. 4 Immunohistochemical analysis of LC3 in kidney of broilers exposed to different doses of BDE-209 蓝色荧光表示细胞核; 绿色荧光表示LC3蛋白阳性表达。 Blue fluorescence shows nucleus; green fluorescence shows the positive expression of LC3 protein. |

|
图 5 不同剂量BDE-209处理的肉鸡肾脏p62(A)与LC3(B)蛋白表达免疫组化相对荧光值统计 Fig. 5 Relative fluorescence values statistics of p62(A)and LC3(B)proteins expression in kidney of broilers exposed to different doses of BDE-209 不同字母表示差异显著(P < 0.05)。下同。 Different letters indicate significant difference(P < 0.05). The same as follows. |
转录水平结果(图 6)显示: 与对照组相比, 0.04、0.4和4.0 g·kg-1 BDE-209组肉鸡肾脏p62转录水平均显著升高, 且3组间均存在显著性差异(图 6-A); 此外, 0.04、0.4和4.0 g·kg-1 BDE-209组LC3-Ⅱ/LC3-Ⅰ值均显著高于对照组(P < 0.05), 其中4.0 g·kg-1 BDE-209组显著高于0.04 g·kg-1 BDE-209组(P < 0.05), 0.004 g·kg-1 BDE-209组与对照组、0.04与0.4 g·kg-1 BDE-209组、0.4与4.0 g·kg-1 BDE-209组无显著性差异(P>0.05)(图 6-B); 同时, 与对照组相比, 0.04、0.4和4.0 g·kg-1 BDE-209组PINKI转录水平均显著上升(P < 0.05), 0.004 g·kg-1 BDE-209组无显著变化(P>0.05)(图 6-C); 各组间Parkin转录水平无显著变化(P>0.05)(图 6-D)。
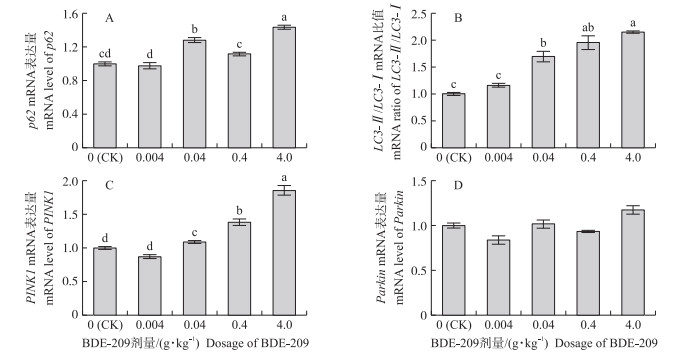
|
图 6 不同剂量BDE-209对肉鸡肾脏p62(A)、LC3-Ⅱ/LC3-Ⅱ(B)、PINK1(C)和Parkin(D)mRNA表达的影响 Fig. 6 Effects of different doses of BDE-209 exposed to broilers on the mRNA levels of p62(A), LC3-Ⅱ/LC3-Ⅰ(B), PINK1(C)and Parkin(D)in kidney |
Western blot结果(图 7、图 8)显示: BDE-209作用42 d后, 与对照组相比, 0.004、0.04、0.4和4.0 g·kg-1 BDE-209组p62蛋白表达水平均显著上升(P < 0.05), 呈梯度依赖增加效应(P < 0.05)(图 7-A); BDE-209处理组LC3-Ⅱ/LC3-Ⅰ值显著高于对照组(P < 0.05), 0.04、0.4和4.0 g·kg-1 BDE-209组也均显著高于0.004 g·kg-1 BDE-209组(P < 0.05)(图 7-B)。BDE-209处理后, 0.04、0.4和4.0 g·kg-1 BDE-209组PINK1蛋白的表达水平均显著高于对照组和0.004 g·kg-1 BDE-209组(P < 0.05), 但这3组之间无显著差异(P>0.05);0.004 g·kg-1 BDE-209组的PINK1蛋白表达低于对照组(P < 0.05)(图 8-A)。线粒体自噬关键蛋白Parkin表达水平各组之间没有差异(P>0.05), 与转录水平结果一致(图 8-B)。
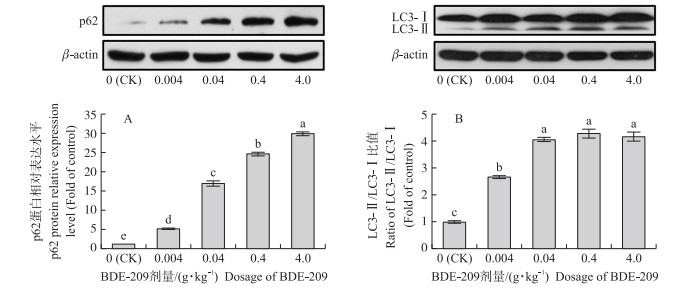
|
图 7 不同剂量BDE-209对肉鸡肾脏p62(A)蛋白表达和LC3-Ⅱ/LC3-Ⅰ(B)蛋白表达比值的影响 Fig. 7 Effects of different doses of BDE-209 exposed to broilers on the expression of p62(A) and the ratio of LC3-Ⅱ/LC3-Ⅰ(B)proteins in kidney |
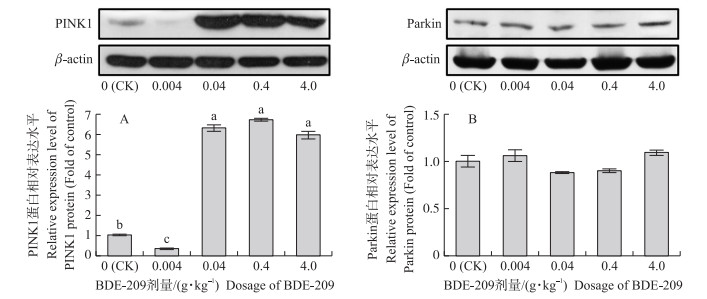
|
图 8 不同剂量BDE-209对肉鸡肾脏PINK1(A)和Parkin(B)蛋白表达的影响 Fig. 8 Effects of different doses of BDE-209 exposed to broilers on the expression of PINK1(A)and Parkin(B)proteins in kidney |
肾脏是机体排出废物及毒素的主要器官之一, BUN和CRE是表征肾脏功能的重要指标。本试验中, 肉鸡饲喂BDE-209后, 血清BUN和CRE浓度呈剂量依赖性增高。Milovanovic等[14]发现, 大鼠灌胃31.25和62.5 mg·kg-1·d-1 BDE-209 28 d后, 血清BUN和CRE浓度均显著升高, 与本试验结果契合。Yang等[13]也发现, 经BDE-209暴露的大鼠, 尿液CRE含量升高。可见, BDE-209会引起肉鸡肾脏损伤。组织病理学也呈现一致的结果, BDE-209导致肉鸡肾脏肾小球肿大、内容物增多并伴随炎性细胞浸润、局部肾小管结构肿胀、肾小管上皮细胞脱落至管腔等现象。已有研究表明, BDE-209可引起SD大鼠肾脏水肿[13]。Feng等[21]给C57BL/6大鼠灌胃BDE-209, 引起肾小管变性及扩张, 炎性细胞浸润。结果提示: BDE-209能破坏肾小球和肾小管的组织结构, 从而影响肾脏正常的过滤和重吸收功能, 导致血清BUN和CRE积累, 因此推测肾脏也是BDE-209毒性作用的一个重要靶器官。
氧化应激是机体抵御外界有毒有害物质入侵及自我保护的一种方式, 同时也是一个复杂的诱导与毒性效应调控过程。PBDE可引起动物肾脏组织抗氧化状态发生改变[14-15]。本试验肉鸡饲喂BDE-209后, 抗氧化酶SOD和GSH-Px活性降低, 脂质过氧化物MDA含量显著上升, 表明BDE-209破坏了肉鸡肾脏组织的氧化平衡。BDE-209能引起小鼠肾脏组织的急性氧化应激和脂质过氧化反应[15]; Wistar大鼠暴露BDE-209后, GSH-Px酶活性较对照组显著降低[14], 本试验结果与之一致。此外, BDE-209可使PC12细胞活性氧(reactive oxygen species, ROS)积累[16]; 多溴联苯醚同系物之一四溴联苯醚(4-bromodiphenyl ether, BDE-47)也可激发细胞氧化应激, 显著抑制GSH-Px活性, 导致ROS过量积累, 诱导肾脏毒性效应[22-23]。可见, BDE-209暴露能降低肉鸡肾脏的抗氧化酶活性, 促进MDA含量升高, 表明氧化应激在BDE-209诱导的肾脏损伤中发挥重要作用。
自噬是真核细胞中普遍存在的一种动态分解代谢过程, 对于维持机体内环境的稳态, 参与细胞生长发育、成熟分化及程序性死亡具有重要调控作用[24]。同时, 自噬还是细胞氧化还原信号的关键传感器, 过度的氧化应激可直接激活自噬, 干扰自噬正常程序的发生, 反之自噬也可为保持氧化还原稳态提供能量或减缓损伤[25]。微管相关蛋白1轻链3(LC3)通常以LC3-Ⅰ的形式溶解于细胞质中, 当自噬发生时, LC3-Ⅰ与磷脂酰乙醇胺共价连接形成LC3-Ⅱ定位于自噬体上, 然后通过N端与泛素化蛋白p62一同在溶酶体内降解, 激发自噬[26]。因此, 当发生自噬时, p62会在细胞质内不断降解; 反之当自噬功能受损或减弱时, p62蛋白会积累于细胞质中。本试验中, 免疫荧光组化、qPCR和Western blot检测结果均显示, BDE-209作用后肾脏组织中自噬蛋白p62表达和LC3-Ⅱ/LC3-Ⅰ比值均显著上调。已有研究报道BDE-47诱导PC12细胞内p62蛋白和LC3-Ⅱ蛋白表达量均上升, 预示BDE-47促进PC12细胞自噬体形成, 但p62的表达量增加, 阻碍了自噬体的降解[27]。此外, 人肝母细胞瘤HepG2细胞暴露BDE-100后, p62蛋白表达量和LC3-Ⅱ/LC3-Ⅰ蛋白表达的比值均上升[28], 与本试验结果一致。这些数据表明BDE-209促进肉鸡肾脏LC3-Ⅰ蛋白向LC3-Ⅱ蛋白转换, 激发自噬体的形成, 但p62蛋白积累, 使得自噬溶酶体降解过程受阻, 无法清除受损细胞, 造成肾脏自噬修复功能降低, 引起组织器官损伤。
线粒体是产生氧化应激的主要场所, 自噬对受损线粒体的清除、维持线粒体数量和质量及能量平衡具有重要作用。PINK1/Parkin通路是调控线粒体自噬的经典上游途径, PINK1是一种丝氨酸/苏氨酸蛋白激酶, 正常状态下, 以较低水平附着于线粒体内膜, 当线粒体受损时, 线粒体膜电位下降, 激活及泛素化细胞质中的E3泛素化蛋白Parkin, 最终自噬蛋白p62结合线粒体膜上的泛素化蛋白, 同时配合LC3形成自噬体后被溶酶体降解[29]。本试验结果显示, BDE-209暴露后, 肉鸡肾脏线粒体膜电位下降, 肾脏PINK1转录水平和蛋白表达水平增加, 表明肾脏线粒体损伤自噬被激活。然而各组Parkin转录及蛋白表达水平均无显著差异。董理鑫[27]推测BDE-47促使PC12细胞线粒体受损且膜电位下降, 同时BDE-47通过下调Parkin表达阻碍受损线粒体自噬, 加剧线粒体损伤, 本试验结果与之一致。目前仍没有BDE-209对PINK1/Parkin通路的研究, 但其他环境污染物如重金属镉可通过氧化应激介导PINK1/Parkin途径, 促进PINK1过度表达, 破坏线粒体功能而引起小鼠肾脏损伤[30-31]。肌红蛋白通过促进PINK1蛋白表达和抑制Parkin蛋白表达促使大鼠肾小管上皮细胞凋亡[32]。据此, 笔者推测BDE-209在引起氧化水平失衡后, 诱导PINK1蛋白过表达; Parkin蛋白缺乏使得PINK1蛋白在线粒体内膜积累, 导致线粒体自噬平衡紊乱, 线粒体损伤; p62蛋白过度积累, 自噬溶酶体途径受阻, 损伤线粒体无法自噬清除, 逐渐积累最终导致肾脏损伤。
综上所述, BDE-209暴露引起肉鸡肾脏氧化失衡, 导致氧化应激, 激活PINK1/Parkin信号途径, 肾脏线粒体发生损伤, 进而诱导LC3-Ⅰ蛋白向LC3-Ⅱ蛋白转化, 上调p62蛋白阻碍自噬体降解, 使肉鸡肾脏产生不可逆的组织损伤。这些结果不仅阐述BDE-209致肉鸡肾脏毒性的作用机制, 为污染物BDE-209诱导肉鸡毒性效应的相关研究提供数据支撑, 而且对有效持久防控有机污染物措施的提出具有重要意义。
| [1] |
de Wit C A. An overview of brominated flame retardants in the environment[J]. Chemosphere, 2002, 46(5): 583-624. DOI:10.1016/S0045-6535(01)00225-9 |
| [2] |
Guo T F, Lin T, Li Y Y, et al. Occurrence, gas-particle partitioning, and sources of polybrominated diphenyl ethers in the atmosphere over the Yangtze River Estuary, East China Sea[J]. Science of the Total Environment, 2019, 693: 133538. DOI:10.1016/j.scitotenv.2019.07.344 |
| [3] |
Zhen X M, Tang J H, Liu L, et al. From headwaters to estuary: distribution and fate of halogenated flame retardants(HFRs) in a river basin near the largest HFR manufacturing base in China[J]. Science of the Total Environment, 2018, 621: 1370-1377. DOI:10.1016/j.scitotenv.2017.10.091 |
| [4] |
郑晓波, 罗孝俊, 麦碧娴. 持久性卤代有机污染物(PHCs)在食物网中的生物放大研究进展[J]. 矿物岩石地球化学通报, 2020, 39(1): 30-43, 4. Zheng X B, Luo X J, Mai B X. Research progress on biomagnification of persistent halogenated compounds(PHCs) in food webs[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2020, 39(1): 30-43, 4 (in Chinese with English abstract). |
| [5] |
Lorber M. Exposure of Americans to polybrominated diphenyl ethers[J]. Journal of Exposure Science & Environmental Epidemiology, 2008, 18(1): 2-19. |
| [6] |
Newton S M, Lau C, Gurcha S S, et al. The evaluation of forty-three plant species for in vitro antimycobacterial activities; isolation of active constituents from Psoralea corylifolia and Sanguinaria canadensis[J]. Journal of Ethnopharmacology, 2002, 79(1): 57-67. DOI:10.1016/S0378-8741(01)00350-6 |
| [7] |
Lv Q Y, Wan B, Guo L H, et al. In vitro immune toxicity of polybrominated diphenyl ethers on murine peritoneal macrophages: apoptosis and immune cell dysfunction[J]. Chemosphere, 2015, 120: 621-630. DOI:10.1016/j.chemosphere.2014.08.029 |
| [8] |
Qian B, Wang C Q, Zhao C C, et al. Effects of maternal exposure to BDE209 on neuronal development and transcription of iodothyronine deiodinase in offspring mice[J]. Toxicology Mechanisms and Methods, 2019, 29(8): 569-579. DOI:10.1080/15376516.2019.1624906 |
| [9] |
虞祎, 俞韦勤. 基于肉鸡品种差异视角的我国鸡肉消费市场预测[J]. 中国家禽, 2017, 39(14): 41-45. Yu Y, Yu W Q. Forecast of chicken consumption market in China based on broiler breed difference[J]. China Poultry, 2017, 39(14): 41-45 (in Chinese with English abstract). |
| [10] |
Wang J X, Bao L J, Shi L, et al. Characterizing PBDEs in fish, poultry, and pig feeds manufactured in China[J]. Environmental Science and Pollution Research, 2019, 26(6): 6014-6022. DOI:10.1007/s11356-018-04057-2 |
| [11] |
Wang J X, Bao L J, Luo P, et al. Intake, distribution, and metabolism of decabromodiphenyl ether and its main metabolites in chickens and implications for human dietary exposure[J]. Environmental Pollution, 2017, 231: 795-801. DOI:10.1016/j.envpol.2017.08.084 |
| [12] |
Polder A, Müller M B, Brynildsrud O B, et al. Dioxins, PCBs, chlorinated pesticides and brominated flame retardants in free-range chicken eggs from peri-urban areas in Arusha, Tanzania: levels and implications for human health[J]. Science of the Total Environment, 2016, 551/552: 656-667. DOI:10.1016/j.scitotenv.2016.02.021 |
| [13] |
Yang W J, Fu J J, Wang T, et al. Alterations of endogenous metabolites in urine of rats exposed to decabromodiphenyl ether using metabonomic approaches[J]. Journal of Environmental Sciences, 2014, 26(4): 900-908. DOI:10.1016/S1001-0742(13)60533-1 |
| [14] |
Milovanovic V, Buha A, Matovic V, et al. Oxidative stress and renal toxicity after subacute exposure to decabrominated diphenyl ether in Wistar rats[J]. Environmental Science and Pollution Research, 2015, 25: 7223-7230. |
| [15] |
祝星, 陈晓晓, 杨旭. 十溴联苯醚(BDE-209)对离体条件下小鼠肾脏和脑组织SOD活力和MDA含量的影响(英文)[J]. 生态毒理学报, 2012, 7(2): 209-214. Zhu X, Chen X X, Yang X. Effects of decabromodiphenyl ether(BDE-209) on SOD activities and MDA contents in mouse kidney and brain tissues: an in vitro study[J]. Asian Journal of Ecotoxicology, 2012, 7(2): 209-214. |
| [16] |
Liu Q, Wang K, Shao J, et al. Role of taurine in BDE 209-induced oxidative stress in PC12 cells[M]//Advances in Experimental Medicine and Biology. Dordrecht: Springer, 2017: 897-906.
|
| [17] |
Dinani O P, Tyagi P K, Mandal A B, et al. Effect of feeding rice based distillers dried grains with solubles and gluten meal on nutrient transporter genes and immunity in broiler chickens[J]. Veterinary World, 2018, 11(11): 1592-1596. |
| [18] |
Duskaev G K, Rakhmatullin S G, Kazachkova N M, et al. Effect of the combined action of Quercus cortex extract and probiotic substances on the immunity and productivity of broiler chickens[J]. Veterinary World, 2018, 11(10): 1416-1422. DOI:10.14202/vetworld.2018.1416-1422 |
| [19] |
马飞洋, 杨帆, 唐兆新, 等. 高铜对肉鸡心肌细胞线粒体自噬的影响[J]. 中国兽医科学, 2019, 49(5): 659-664. Ma F Y, Yang F, Tang Z X, et al. Effects of high dietary copper on mitophagy in cardiomyocytes of broilers[J]. Chinese Veterinary Science, 2019, 49(5): 659-664 (in Chinese with English abstract). |
| [20] |
王雨. miR-122通过靶定PKM2调节自噬影响砷诱导的鸡肝损伤[D]. 哈尔滨: 东北林业大学, 2019. Wang Y. miR-122 regulates arsenic-induced liver damage by targeting PKM2/autophagy axis in chickens[D]. Harbin: Northeast Forestry University, 2019(in Chinese with English abstract). |
| [21] |
Feng Y, Hu Q L, Meng G, et al. Simulating long-term occupational exposure to decabrominated diphenyl ether using C57BL/6 mice: biodistribution and pathology[J]. Chemosphere, 2015, 128: 118-124. DOI:10.1016/j.chemosphere.2015.01.012 |
| [22] |
Wang H, Tang X X, Sha J J, et al. The reproductive toxicity on the rotifer Brachionus plicatilis induced by BDE-47 and studies on the effective mechanism based on antioxidant defense system changes[J]. Chemosphere, 2015, 135: 129-137. DOI:10.1016/j.chemosphere.2015.03.090 |
| [23] |
Shan Q, Zhuang J, Zheng G H, et al. Troxerutin reduces kidney damage against BDE-47-induced apoptosis via inhibiting NOX2 activity and increasing Nrf2 activity[J]. Oxidative Medicine and Cellular Longevity, 2017. DOI:10.1155/2017/6034692 |
| [24] |
杨方晓, 李莲, 赵若含, 等. 褪黑素对HT-2毒素诱导的牛卵巢颗粒细胞内质网应激与自噬的影响[J]. 南京农业大学学报, 2020, 43(1): 143-150. Yang F X, Li L, Zhao R H, et al. Effects of melatonin on endoplasmic reticulum stress and autophagy in bovine ovarian granulosa cells induced by HT-2 toxin[J]. Journal of Nanjing Agricultural University, 2020, 43(1): 143-150 (in Chinese with English abstract). DOI:10.7685/jnau.201812028 |
| [25] |
何子甜, 白洁. 氧化应激与自噬相互作用的分子机制[J]. 中国老年学杂志, 2016, 36(6): 1505-1507. He Z T, Bai J. Molecular mechanism of the interaction between oxidative stress and autophagy[J]. Chinese Journal of Gerontology, 2016, 36(6): 1505-1507 (in Chinese). DOI:10.3969/j.issn.1005-9202.2016.06.107 |
| [26] |
齐鸣, 谭碧娥. 自噬调节动物氧化应激反应的分子机制[J]. 动物营养学报, 2020, 32(9): 3993-4002. Qi M, Tan B E. Molecular mechanism of autophagy regulating oxidative stress in animals[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 3993-4002 (in Chinese with English abstract). |
| [27] |
董理鑫. 自噬在PBDE-47致PC12细胞线粒体损伤中的作用[D]. 武汉: 华中科技大学, 2017. Dong L X. Role of autophagy in PBDE-47-induced mitochondrial damage in PC12 cells[D]. Wuhan: Huazhong University of Science and Technology, 2017(in Chinese with English abstract). |
| [28] |
Pereira L C, Duarte F V, Varela A T I F, et al. An autophagic process is activated in HepG2 cells to mediate BDE-100-induced toxicity[J]. Toxicology, 2017, 376: 59-65. DOI:10.1016/j.tox.2016.05.022 |
| [29] |
张明军, 罗俊一, 杨毅宁. PINK1、Parkin与泛素协同调控线粒体自噬的研究进展[J]. 医学综述, 2020, 26(10): 1887-1892. Zhang M J, Luo J Y, Yang Y N. Research progress in PINK1, Parkin and ubiquitin concerted regulation of mitophagy[J]. Medical Recapitulate, 2020, 26(10): 1887-1892 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-2084.2020.10.003 |
| [30] |
王莉, 闻双全, 贺双江, 等. 慢性镉暴露对小鼠大脑皮质的毒性损伤作用[J]. 畜牧与兽医, 2021, 53(2): 50-55. Wang L, Wen S Q, He S J, et al. Toxic damage effect of chronic cadmium exposure on the cerebral cortex of mouse[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(2): 50-55 (in Chinese with English abstract). |
| [31] |
韦雪. 镉通过ROS介导的PINK1/Parkin途径诱导小鼠肾和脑发生线粒体自噬[D]. 兰州: 兰州大学, 2014. Wei X. Cadmium induces mitophagy through ROS-mediated PINK1/Parkin pathway in mouse kidney and brain[D]. Lanzhou: Lanzhou University, 2014(in Chinese with English abstract). |
| [32] |
Chen Z G, Wang J X, He J, et al. Myoglobin mediates autophagy of NRK-52E in rat renal tubular epithelial cells via the Pink1/Parkin signaling pathway[J]. Medical Science Monitor, 2020, 26: e923045. |




