文章信息
- 曹秋瑜, 姚望, 杜星, 潘增祥, 李齐发
- CAO Qiuyu, YAO Wang, DU Xing, PAN Zengxiang, LI Qifa
- Dcn基因在猪卵巢颗粒细胞凋亡中的作用
- The role of Dcn gene in porcine ovarian granulosa cell apoptosis
- 南京农业大学学报, 2021, 44(4): 748-755
- Journal of Nanjing Agricultural University, 2021, 44(4): 748-755.
- http://dx.doi.org/10.7685/jnau.202001011
-
文章历史
- 收稿日期: 2020-01-07
核心蛋白聚糖(decorin, Dcn)是细胞外基质(extracellular matrix, ECM)的重要组成成分, 是富含亮氨酸的小蛋白聚糖(proteoglycan)家族的成员[1], 主要参与胞外信号传导、发育以及癌症等重要生理和病理过程的调控[2-3]。在介导胞外信号转导过程中, Dcn作为一种高亲和力拮抗配体, 可与细胞膜上受体如酪氨酸激酶受体、Toll样受体和整合素结合, 进而调控相关通路的信号转导过程[4]。还有报道证实Dcn在个体发育及器官形成过程中发挥重要的作用, 例如重组Dcn蛋白可通过降低α肌动蛋白、纤连蛋白和层连蛋白水平, 最终促进小鼠眼角膜完整性的恢复[5]。另外, Dcn还可通过介导FOXD1对BMP/SMAD信号通路的调控, 进而影响小鼠肾脏的发育[6]。在介导癌症等疾病发生方面Dcn也扮演着重要的角色, 例如在人肝癌发生过程中Dcn通过阻断EGFR、Met、IGF-IR、PDGFR和VEGFR2等各种受体而干扰肿瘤发生的微环境, 进而影响肝癌的发生[7]。对Dcn基因敲除小鼠(Dcn-/-)进行研究, 发现30%的敲除小鼠表现为肠道肿瘤发生, 且肿瘤细胞具有低分化率、高增殖率等特点[8]; 同时还发现敲除小鼠的肝脏组织多表现为肝硬化表型, 且Dcn的缺失与肝纤维化的发生呈显著正相关[9]。不仅如此, 人Dcn基因上的单碱基缺失(c.941delC)可能与先天性眼角膜受损相关, 认为Dcn在先天性眼角膜受损病的发病过程中发挥重要作用[10]。因此, 对Dcn基因及其功能的探究也可为探索其介导的多种生物学过程发生的机制提供相应的研究方向和思路。
在生殖系统中, 研究发现Dcn是灵长类动物卵巢细胞外基质重要的组成部分, 是多种细胞因子信号传导的调节剂, 可能参与调节卵泡的发育过程[11]。Dcn是TGF-β信号通路的天然抑制剂[12-13], 而TGF-β通路被证实是哺乳动物卵泡发育的关键信号通路, 参与猪卵泡闭锁和颗粒细胞凋亡的调控[11, 14], 由此推测Dcn可能参与调控猪卵泡颗粒细胞的凋亡过程。但目前关于猪Dcn基因在卵巢颗粒细胞功能中的作用尚不清楚。本文拟克隆猪Dcn基因, 了解其基因和编码蛋白特征, 构建Dcn过表达载体, 分析其在猪卵巢颗粒细胞凋亡中的作用, 为阐明Dcn在猪卵泡发育和繁殖性状调控中的作用提供科学依据。
1 材料与方法 1.1 试验动物商品母猪的新鲜卵巢采自江苏省南京市天环屠宰场, 屠宰后立即采集双侧卵巢放置于37 ℃的生理盐水中, 2 h内带回实验室。
1.2 卵巢颗粒细胞总RNA的提取及Dcn基因表达水平的荧光定量PCR检测利用无菌医用注射器收集猪卵泡颗粒细胞, 通过离心(1 500 r·min-1, 5 min)将颗粒细胞与卵泡液进行分离, 纯化后的颗粒细胞用于培养、处理和总RNA提取。RNA提取采用TRIzol kit(Invitrogen公司)进行, 具体操作步骤参考说明书。反转录采用PrimeScriptTM反转录试剂盒(TaKaRa公司)进行。反应体系: 500 ng总RNA、反转录酶2 μL, 加去离子水至10 μL; 反应条件: 37 ℃ 15 min, 85 ℃ 5 s。反转录产物置-20 ℃保存。猪Dcn基因真核表达载体转染颗粒细胞24 h后, 采用上述方法提取细胞总RNA并反转录为cDNA。以GAPDH作为内参基因, 采用荧光定量试剂AceQ QPCR SYBR Green Master Mix(南京诺唯赞公司)对猪Dcn基因mRNA表达水平进行定量分析。反应体系: 上、下游引物各0.2 μL, ROX 0.2 μL, cDNA模板0.7 μL, SYBR Primix EX TaqTM HS DNA聚合酶5 μL, 加去离子水至10 μL。反应程序: 95 ℃预变性5 min; 95 ℃ 10 s, 60 ℃ 30 s, 40个循环, 熔解曲线程序95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s。
1.3 Dcn基因的PCR扩增和过表达载体的构建根据GenBank数据库中猪Dcn基因cDNA序列(GenBank ID: NM_213920.1)设计扩增Dcn基因编码区全序列的引物, 并在扩增引物的5′端分别加入NheⅠ和XhoⅠ酶切位点用于Dcn基因过表达载体的构建。根据猪Dcn与GAPDH基因编码区序列(GenBank ID: NM_001206359.1)设计定量引物。引物由南京擎科生物科技有限公司合成, 具体序列见表1。PCR扩增体系: 上、下游引物(F/R)各2 μL, cDNA模板2 μL(反转录体系稀释3倍), DNA聚合酶(南京诺唯赞公司)25 μL, 加去离子水至50 μL。PCR反应程序: 95 ℃预变性2 min; 95 ℃变性10 s, 60 ℃退火15 s, 72 ℃延伸40 s, 共30个循环; 最后72 ℃延伸5 min; 4 ℃保存。PCR产物经1.5 g·L-1琼脂糖凝胶电泳鉴定后, 切取目的条带送至南京擎科生物科技有限公司进行测序。采用双酶切法构建猪Dcn基因真核生物表达载体。具体过程: 首先使用限制性内切酶NheⅠ和XhoⅠ(上海生工生物工程有限公司)在37 ℃环境中同时酶切上述纯化的阳性产物与pcDNA3.1质粒2 h后, 将酶切产物进行纯化, 加入适量T4连接酶并置于16 ℃过夜连接。连接产物通过热激法转化感受态DH5α, 挑取单克隆菌落扩培并进行测序鉴定。对阳性克隆采用Endo-free Plasmid Mini Kit(北京索莱宝科技有限公司)提取质粒, 并将其命名为pcDNA3.1-Dcn。
1.4 生物信息学分析利用DNAMAN v5.22软件进行序列比对、开放阅读框预测、碱基组成和氨基酸组成分析。利用MEGA v5.1软件构建哺乳动物系统发育树, 哺乳动物和外类群Dcn基因序列下载自GenBank数据库(https://www.ncbi.nlm.nih.gov/), 包括绵羊(NM_001009218.1)、山羊(NM_001285555.1)、人(NM_001920.5)、小鼠(NM_001190451.2)、牛(NM_173906.4)、猕猴(XM_001104261.3)、鸡(NM_001030747.2)、斑马鱼(NM_131697.1)。利用ProtParam在线工具(https://web.expasy.org/protparam/)预测蛋白质理化性质, 利用UniProtKB的Swiss-Prot数据库(https://web.expasy.org/docs/swiss-prot_guideline.html)分析猪Dcn蛋白的细胞定位。利用NCBI网站中的CD Search程序(www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测Dcn蛋白的结构域。利用GOR Ⅳ在线工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)预测Dcn蛋白二级结构。利用SWISS-MODEL在线工具(https://swissmodel.expasy.org/interactive)预测Dcn蛋白的三级结构。
1.5 猪卵巢颗粒细胞培养和转染使用含有庆大霉素的生理盐水和体积分数为75%的乙醇反复清洗新鲜采集的健康母猪卵巢。利用无菌医用注射器吸取有腔卵泡(直径3~5 mm)的颗粒细胞, 将分离的颗粒细胞利用PBS清洗2次后置于细胞培养板中进行培养。培养基为含体积分数为15%胎牛血清和1 g·L-1青(链)霉素的F12/DMEM培养基(美国Gibico公司)。使用HighGene转染试剂(武汉爱博泰克公司)将猪Dcn基因真核生物表达载体和pcDNA3.1载体瞬时转染体外培养的颗粒细胞, 以pcDNA3.1空载质粒转染的细胞作为对照。
1.6 Dcn过表达后猪卵巢颗粒细胞中相关蛋白表达水平检测Dcn过表达载体转染体外培养的颗粒细胞48 h后, 用RIPA裂解液提取细胞中总蛋白, 并利用BCA法对蛋白浓度进行检测。利用Western blot对细胞中的Dcn蛋白水平进行检测[15-16]。抗体采用2.5 g·L-1牛血清白蛋白溶液进行稀释。抗体包括: 兔抗Dcn抗体(1∶1 000, 美国Affinity公司), 鼠抗GAPDH抗体、兔抗cleaved-Caspase3抗体、羊抗兔抗体(二抗)、兔抗鼠抗体(二抗)(均为1∶1 000, 上海生工生物工程有限公司)。
1.7 Dcn过表达后猪卵巢颗粒细胞凋亡水平分析Dcn过表达载体转染体外培养的颗粒细胞48 h后, 使用不含EDTA的胰酶消化颗粒细胞, 待细胞完全脱落后加入等量全有培养基(含15%胎牛血清的F12/DMEM培养基)终止消化并收集细胞, 利用预冷的磷酸盐缓冲液(PBS)清洗后, 使用100 μL 1× Binding Buffer重悬细胞, 加入5 μL Annexin V-FITC和5 μL PI染色液, 轻轻吹匀并置于避光、室温条件下孵育10 min, 加入400 μL 1× Binding Buffer轻轻吹打均匀。染色后的样品于1 h内在流式细胞仪(美国BD FACSCalibur)中进行细胞凋亡水平的检测。检测时, FITC的绿色荧光在FL1通道检测, PI的红色荧光在FL2通道检测[17], 检测结果用FlowJo V7.6软件进行分析。
1.8 数据处理与统计分析利用Excel 2010和GraphPad Prism v6软件进行数据处理和统计学分析。试验结果数据均以平均值±标准误(x±SE)表示。2处理组间采用双尾t测验进行0.05和0.01水平的显著性分析。
2 结果与分析 2.1 猪Dcn基因编码区的扩增与核苷酸序列分析利用引物对P1(表1)扩增猪Dcn基因编码区, 得到清晰单一的电泳条带, 条带大小与预期相符(图 1-A)。将目的条带进行切胶、纯化和测序, 结果获得猪Dcn基因编码区全长序列, 序列长度为1 083 bp(图 1-B)。序列分析发现猪Dcn基因编码区包含A碱基313个(28.9%)、T碱基270个(24.9%)、C碱基273个(25.2%)、G碱基227个(21.0%)。一致性分析发现猪Dcn基因编码区核苷酸序列与绵羊、山羊、人、小鼠、牛和猕猴等哺乳动物的一致性分别为93.17%、93.17%、89.96%、89.96%、93.72%和89.69%, 与鸡和斑马鱼等的一致性分别为76.18%和64.88%, 说明哺乳动物Dcn基因编码区核苷酸序列比较保守。利用9个物种Dcn基因编码区核苷酸序列构建的系统发育树(图 1-C)显示, 7个哺乳动物聚为一类, 而外类群鸡和斑马鱼各自聚为一类; 在哺乳动物中, 偶蹄目的猪、牛、山羊和绵羊聚为一个分支, 灵长目的人和猕猴聚为一个分支, 而啮齿目的小鼠单独为一个分支。聚类结果与传统分类法一致。

|
图 1 猪Dcn基因编码区序列克隆与分析 Fig. 1 Cloning and analysis of pig Dcn coding region A. PCR产物电泳结果Electrophoretogram of PCR product; 1-3:PCR产物PCR product; M: DL5000 marker. B. 猪Dcn基因编码区序列核苷酸序列Nucleotide sequence of pig Dcn coding region; C. 基于Dcn基因编码区序列构建系统发育树Phylogenetic tree based on Dcn coding region sequence. |
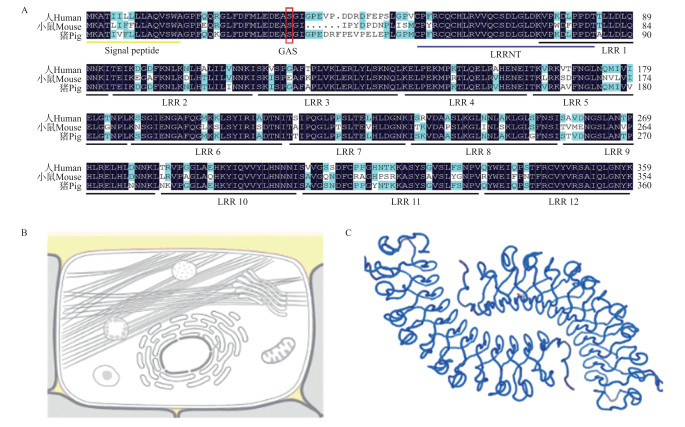
猪Dcn基因编码蛋白有360个氨基酸(图 2-A), 其中亮氨酸的含量最高, 为13.3%, 其次是天冬氨酸和赖氨酸, 含量均为8.3%。一致性分析发现猪Dcn蛋白氨基酸序列与绵羊、山羊、人、小鼠、牛和猕猴等哺乳动物的一致性分别为95.5%、95.2%、92.6%、81.6%、96.0%和92.6%, 与鸡和斑马鱼等的一致性分别为79.3%和68.6%, 说明哺乳动物Dcn蛋白氨基酸序列也比较保守。利用NCBI网站CD Search工具预测结构域预测结果显示, Dcn蛋白含有1个信号肽(signal peptide), 同时还含有糖胺聚糖附着位点(glycosaminoglycan attachment site, GAS)、富亮氨酸重复序列N端结构域(leucine rich repeat N-terminal domain, LRRNT)和12个富亮氨酸重复序列(leucine-rich repeat, LRR)等重要的保守结构域。
|
图 2 猪Dcn蛋白氨基酸序列与人、小鼠的比较(A)以及蛋白定位(B)和三级结构(C) Fig. 2 Alignments of amino acid sequence with human and mouse(A), cellular localization(B) and space structure(C)of pig Dcn protein GAS: 糖胺聚糖附着位点Glycosaminoglycan attachment site; LRRNT: 富亮氨酸重复序列N端结构域Leucine rich repeat N-terminal domain; LRR: 富亮氨酸重复序列Leucine-rich repeat. |
猪Dcn基因编码蛋白相对分子质量为39.89×103, 理论等电点为8.84, 不稳定系数为30.01, 表明猪Dcn是一种十分稳定的蛋白。猪Dcn蛋白脂肪族氨基酸指数为97.47, 亲水性为-0.243, 表明猪Dcn蛋白具有较强的脂溶性。通过细胞精细定位分析证实猪Dcn蛋白主要分布在细胞外基质中(图 2-B)。另外, 通过对猪Dcn蛋白二级结构分析发现猪Dcn蛋白的α螺旋含量30%、延长链含量16.39%、无规卷曲含量53.61%。三级结构预测结果显示猪Dcn蛋白呈马蹄铁形状(图 2-C)。
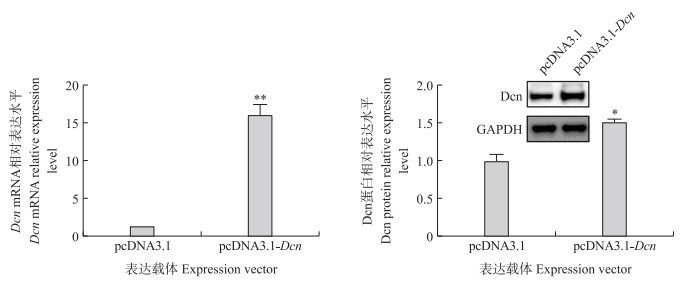
2.3 猪Dcn基因过表达载体构建Dcn基因经扩增、酶切并连接pcDNA3.1-basic载体中, 经测序验证构建成功, 命名为pcDNA3.1-Dcn。以pcDNA3.1空载质粒作为对照, 将pcDNA3.1-Dcn转染体外培养的猪卵巢颗粒细胞中, 荧光定量PCR和Western blot检测过表达效果。结果显示, 与对照组相比, pcDNA3.1-Dcn转染组颗粒细胞中的Dcn基因mRNA水平极显著升高, 同时Dcn蛋白水平也显著升高(图 3), 表明该质粒过表达效果显著。
|
图 3 猪Dcn过表达效率验证 Fig. 3 Verification of pig Dcn overexpression efficiency *P<0.05, **P<0.01. The same as follows. |
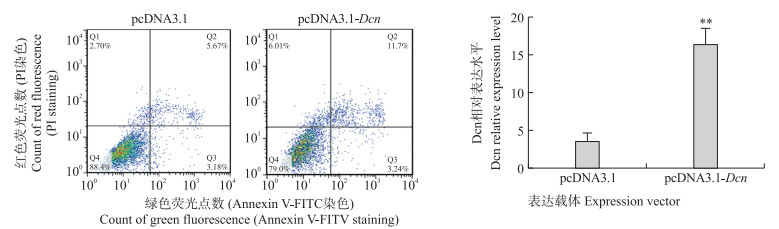
为了进一步了解Dcn基因在猪卵巢颗粒细胞凋亡中的作用, 我们将构建的猪Dcn基因真核生物表达载体pcDNA3.1-Dcn瞬时转染体外培养的猪卵巢颗粒细胞中。转染48 h后利用流式细胞技术(FACS)检测猪卵巢颗粒细胞的凋亡率。结果(图 4)显示: 相较于对照组(平均凋亡率为6.53%), Dcn过表达后猪卵巢颗粒细胞的凋亡率极显著升高(平均凋亡率为15.15%), 表明Dcn过表达可极显著促进猪卵巢颗粒细胞凋亡, 暗示Dcn可能作为促凋亡因子在猪卵泡发育过程中发挥功能。
|
图 4 Dcn过表达对猪卵巢颗粒细胞凋亡的影响 Fig. 4 Effect of Dcn overexpression on porcine ovarian granulosa cell apoptosis |
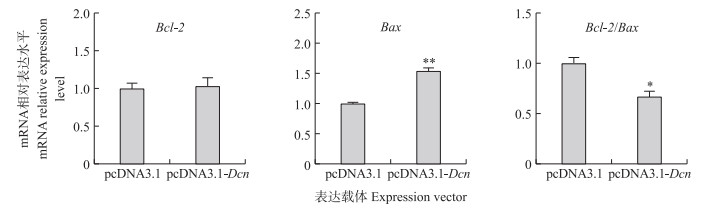
为了进一步验证Dcn基因在猪卵巢颗粒细胞凋亡中的作用, 本文将构建的猪Dcn基因真核表达载体pcDNA3.1-Dcn瞬时转染体外培养的猪卵巢颗粒细胞中, 采用荧光定量PCR检测凋亡标志基因表达水平。结果(图 5)显示, 相较于对照组, Dcn过表达组颗粒细胞内抑凋亡基因Bcl-2 mRNA表达水平并未发生显著变化, 而促凋亡基因Bax的mRNA水平极显著上调, 同时Bcl-2与Bax表达水平的比值显著下调。这些结果进一步证实了Dcn作为促凋亡因子在猪卵巢颗粒细胞凋亡中发挥作用。
|
图 5 过表达Dcn对猪卵巢颗粒细胞中凋亡标志基因mRNA表达水平的影响 Fig. 5 Effects of Dcn overexpression on the expression levels of apoptosis-related genes in porcine granulosa cells(GC) |
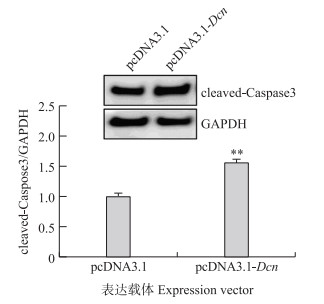
将构建的猪Dcn基因真核表达载体pcDNA3.1-Dcn瞬时转染体外培养的猪卵巢颗粒细胞中, 采用Western blot技术检测凋亡标志蛋白cleaved-Caspase3表达水平。如图 6所示: 与对照组相比, Dcn过表达组颗粒细胞内cleaved-Caspase3蛋白水平极显著升高, 进一步证实了Dcn可诱导猪卵巢颗粒细胞凋亡。
|
图 6 过表达Dcn对猪卵巢颗粒细胞中凋亡标志蛋白cleaved-Caspase3水平的影响 Fig. 6 Effects of Dcn overexpression on levels of apoptosis- related protein cleaved-Caspase3 in porcine GC |
Dcn是一种细胞外基质的核心蛋白聚糖, 其编码基因于1986年首次在人成纤维细胞系IRM-90中被克隆[18]。小鼠、绵羊和山羊等多个哺乳动物Dcn基因相继被成功鉴定[19-21], 但目前关于猪Dcn基因的研究较少。本文采用PCR扩增和测序技术获得了猪Dcn基因编码区全序列, 发现其核苷酸序列长度与其他哺乳动物如人、小鼠和山羊等相同, 且序列一致性较高, 表明哺乳动物Dcn基因在进化过程中是比较保守的。另外, 通过对Dcn基因编码蛋白分析发现, 其氨基酸序列在哺乳动物中具有较高的一致性, 且拥有相似的结构域和空间结构。在构成方面, Dcn通常由1个相对分子质量40×103左右的蛋白和1个硫酸皮肤素或硫酸软骨素糖胺多糖(GAG)侧链组成, 且后者主要结合在蛋白N末端4号丝氨酸残基上[22]。在结构域方面, 哺乳动物Dcn蛋白都含有1个糖胺聚糖附着位点(GAS)、2个半胱氨酸残基簇、1个富亮氨酸重复序列N端结构域(LRRNT)和多个富亮氨酸重复序列(LRR), 其中人Dcn蛋白有10个LRR[2], 其他哺乳动物如鼠、山羊和绵羊的Dcn蛋白则均为12个[19-21], 猪Dcn蛋白也为12个。GAS位点的存在能够使GAG与Dcn蛋白N末端牢牢结合, 确保Dcn蛋白构成与功能的完整性[22]。LRR功能结构域则包含多个与其他蛋白互作的靶点, 进而保障了Dcn蛋白功能的多样性。例如LRR Ⅴ/Ⅵ是Dcn上VEGFR2与EGFR的识别与互作靶点, 二者分别与Dcn结合后导致相关信号通路失活, 进而参与调控血管内皮细胞的状态与血管形成[23]; LRR Ⅶ则是CollagenⅠ蛋白的高亲和力结合基序, 有助于两者的结合进而调控CollagenⅠ蛋白的装配过程[24]; 另外, LRR Ⅻ位点承担Dcn与结缔组织生长因子(connective tissue growth factor, CTGF)互作, 最终影响纤维化疾病的发生过程[25]。在空间结构方面, 猪Dcn蛋白三级结构为马蹄铁形状, 这与Järvinen等[26]预测的人Dcn蛋白的三级结构相似。这种弯曲凹面结构对于维持Dcn蛋白的二聚化至关重要, 进而确保Dcn在非激活状态下的稳定性[27]。
作为一种核心蛋白聚糖成员和富含亮氨酸的小分子蛋白, Dcn可调控多种重要的细胞生物学过程, 包括细胞的生长与分化、增殖、凋亡、自噬和血管生成, 以及细胞癌变等[15, 28]。Dcn在介导不同细胞类型发生凋亡过程中扮演了重要的角色, 例如Dcn通过不同途径介导血管内皮细胞[29-30]、系膜细胞[31]、胆管癌细胞[32]与人肝癌细胞[33]等发生凋亡。但目前关于Dcn基因在调控猪卵巢功能与颗粒细胞状态方面的研究还未见报道。因此, 本试验通过成功构建猪Dcn基因真核生物表达载体并转染体外培养的猪卵巢颗粒细胞后, 发现Dcn过表达能显著促进颗粒细胞凋亡, 并且伴随着凋亡标志基因与标志蛋白表达水平的显著上调, 首次证实在猪卵巢颗粒细胞中Dcn作为促凋亡因子发挥功能。Peng等[21]在对山羊的研究中也发现了同样的现象, 即在体外培养的山羊卵巢颗粒细胞中过表达Dcn可显著促进细胞的凋亡率, 同时严重阻滞细胞周期进程。目前关于Dcn介导哺乳动物卵巢颗粒细胞凋亡的分子机制尚不清楚。综合相关文献, 我们提出3种假设: 1)作为细胞外基质的重要组成部分, Dcn可抑制多种关键信号通路的激活与信号转导过程, 其中就包含多个参与调控哺乳动物卵巢颗粒细胞状态(凋亡)与功能的信号通路, 例如结缔组织生长因子(CTGF)[34]、表皮细胞生长因子(EGF)[35]、胰岛素样生长因子(IGF)[36-37]以及转化生长因子β(TGF-β)[38-39]等信号通路; 2)Dcn作为一种吞噬性蛋白聚糖可介导细胞自噬过程的发生[29], 而后者在卵泡发育过程中同样也扮演着重要的角色。前人研究也证实哺乳动物卵巢颗粒细胞在卵泡发育的各个阶段均有自噬性凋亡的发生[40], 进而影响卵泡发育与闭锁过程; 3)本试验结果显示Dcn基因的异常表达能够引起凋亡相关基因与蛋白表达的显著变化。因此推测Dcn基因的异常表达可能通过若干未知途径破坏卵巢颗粒细胞内凋亡环境的稳态, 进而引起细胞凋亡。在本研究中, 我们证实了Dcn的促凋亡活性, 后续研究将会着重探究Dcn介导猪卵巢颗粒细胞凋亡的潜在分子机制。
| [1] |
McEwan P A, Scott P G, Bishop P N, et al. Structural correlations in the family of small leucine-rich repeat proteins and proteoglycans[J]. Journal of Structural Biology, 2006, 155(2): 294-305. DOI:10.1016/j.jsb.2006.01.016 |
| [2] |
Karamanos N K, Piperigkou Z, Theocharis A D, et al. Proteoglycan chemical diversity drives multifunctional cell regulation and therapeutics[J]. Chemical Reviews, 2018, 118(18): 9152-9232. DOI:10.1021/acs.chemrev.8b00354 |
| [3] |
Mochizuki M, Güç E, Park A J, et al. Growth factors with enhanced syndecan binding generate tonic signalling and promote tissue healing[J]. Nature Biomedical Engineering, 2020, 4(4): 463-475. DOI:10.1038/s41551-019-0469-1 |
| [4] |
Long K, Moss L, Laursen L, et al. Integrin signalling regulates the expansion of neuroepithelial progenitors and neurogenesis via Wnt7a and Decorin[J]. Nature Communication, 2016, 7: 10354. DOI:10.1038/ncomms10354 |
| [5] |
Hill L J, Moakes R J A, Vareechon C, et al. Sustained release of decorin to the surface of the eye enables scarless corneal regeneration[J]. NPJ Regenerative Medicine, 2018, 3: 23. DOI:10.1038/s41536-018-0061-4 |
| [6] |
Fetting J L, Guay J A, Karolak M J, et al. FOXD1 promotes nephron progenitor differentiation by repressing decorin in the embryonic kidney[J]. Development(Cambridge, England), 2014, 141(1): 17-27. |
| [7] |
Horváth Z, Kovalszky I, Fullár A, et al. Decorin deficiency promotes hepatic carcinogenesis[J]. Matrix Biology, 2014, 35: 194-205. DOI:10.1016/j.matbio.2013.11.004 |
| [8] |
Bi X, Tong C, Dockendorff A, et al. Genetic deficiency of decorin causes intestinal tumor formation through disruption of intestinal cell maturation[J]. Carcinogenesis, 2008, 29(7): 1435-1440. DOI:10.1093/carcin/bgn141 |
| [9] |
Baghy K, Dezso K, László V, et al. Ablation of the decorin gene enhances experimental hepatic fibrosis and impairs hepatic healing in mice[J]. Laboratory Investigation, 2011, 91(3): 439-451. DOI:10.1038/labinvest.2010.172 |
| [10] |
Rødahl E, van Ginderdeuren R, Knappskog P M, et al. A second decorin frame shift mutation in a family with congenital stromal corneal dystrophy[J]. American Journal of Ophthalmology, 2006, 142(3): 520-521. DOI:10.1016/j.ajo.2006.03.064 |
| [11] |
Adam M, Saller S, Ströbl S, et al. Decorin is a part of the ovarian extracellular matrix in primates and may act as a signaling molecule[J]. Human Reproduction(Oxford, England), 2012, 27(11): 3249-3258. DOI:10.1093/humrep/des297 |
| [12] |
Goetsch K P, Niesler C U. The extracellular matrix regulates the effect of decorin and transforming growth factor beta-2(TGF-β2) on myoblast migration[J]. Biochemical and Biophysical Research Communications, 2016, 479(2): 351-357. DOI:10.1016/j.bbrc.2016.09.079 |
| [13] |
Cianfarani F, de Domenico E, Nyström A, et al. Decorin counteracts disease progression in mice with recessive dystrophic epidermolysis bullosa[J]. Matrix Biology, 2019, 81: 3-16. DOI:10.1016/j.matbio.2018.12.001 |
| [14] |
Liu H X, McKenna L A, Dean M F. The macromolecular characteristics of cartilage proteoglycans do not change when synthesis is up-regulated by link protein peptide[J]. Biochimica et Biophysica Acta(BBA): General Subjects, 1999, 1428(2/3): 191-200. |
| [15] |
Du X, Zhang L F, Li X Y, et al. TGF-β signaling controls FSHR signaling-reduced ovarian granulosa cell apoptosis through the SMAD4/miR-143 axis[J]. Cell Death & Disease, 2016, 7(11): e2476. |
| [16] |
李烈川, 申明, 宁彩波, 等. 过氧化氢诱导猪卵巢颗粒细胞自噬及其对凋亡的影响[J]. 南京农业大学学报, 2016, 39(5): 814-818. Li L C, Shen M, Ning C B, et al. Induction of granulosa cell autophagy and effects in apoptosis by hydrogen peroxide in porcine ovaries[J]. Journal of Nanjing Agricultural University, 2016, 39(5): 814-818 (in Chinese with English abstract). DOI:10.7685/jnau.201601001 |
| [17] |
崔军, 邓益锋, 孟范勇, 等. 过表达TRPV6基因对小鼠破骨细胞钙转运基因与凋亡相关基因表达的影响[J]. 畜牧与兽医, 2018, 50(12): 113-119. Cui J, Deng Y F, Meng F Y, et al. Effect of overexpression of the transient receptor potential vanilloid 6 gene on apoptosis and calcium transport in mouse osteoclasts[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(12): 113-119 (in Chinese with English abstract). |
| [18] |
Krusius T, Ruoslahti E. Primary structure of an extracellular matrix proteoglycan core protein deduced from cloned cDNA[J]. Proc Natl Acad Sci USA, 1986, 83(20): 7683-7687. DOI:10.1073/pnas.83.20.7683 |
| [19] |
Scholzen T, Solursh M, Suzuki S, et al. The murine decorin. Complete cDNA cloning, genomic organization, chromosomal assignment, and expression during organogenesis and tissue differentiation[J]. Journal of Biological Chemistry, 1994, 269(45): 28270-28281. DOI:10.1016/S0021-9258(18)46924-4 |
| [20] |
Wu W X, Zhang Q, Unno N, et al. Characterization of decorin mRNA in pregnant intrauterine tissues of the ewe and regulation by steroids[J]. American Journal of Physiology Cell Physiology, 2000, 278(1): C199-C206. DOI:10.1152/ajpcell.2000.278.1.C199 |
| [21] |
Peng J Y, Gao K X, Xin H Y, et al. Molecular cloning, expression analysis, and function of decorin in goat ovarian granulosa cells[J]. Domestic Animal Endocrinology, 2016, 57: 108-116. DOI:10.1016/j.domaniend.2016.05.006 |
| [22] |
Mann D M, Yamaguchi Y, Bourdon M A, et al. Analysis of glycosaminoglycan substitution in decorin by site-directed mutagenesis[J]. Journal of Biological Chemisty, 1990, 265(9): 5317-5323. DOI:10.1016/S0021-9258(19)34123-7 |
| [23] |
Khan G A, Girish G V, Lala N, et al. Decorin is a novel VEGFR-2-binding antagonist for the human extravillous trophoblast[J]. Molecular Endocrinology, 2011, 25(8): 1431-1443. DOI:10.1210/me.2010-0426 |
| [24] |
Kalamajski S, Aspberg A, Oldberg A. The decorin sequence SYIRIADTNIT binds collagen type I[J]. Journal of Biological Chemistry, 2007, 282(22): 16062-16067. DOI:10.1074/jbc.M700073200 |
| [25] |
Vial C, Gutiérrez J, Santander C, et al. Decorin interacts with connective tissue growth factor(CTGF)/CCN2 by LRR12 inhibiting its biological activity[J]. Journal of Biological Chemistry, 2011, 286(27): 24242-24252. DOI:10.1074/jbc.M110.189365 |
| [26] |
Järvinen T A H, Prince S. Decorin: a growth gactor antagonist for tumor growth inhibition[J]. BioMed Research International, 2015, 2015: 654765. |
| [27] |
Islam M, Gor J, Perkins S J, et al. The concave face of decorin mediates reversible dimerization and collagen binding[J]. Journal of Biological Chemistry, 2013, 288(49): 35526-35533. DOI:10.1074/jbc.M113.504530 |
| [28] |
Han B, Li Q, Wang C, et al. Decorin regulates the aggrecan network integrity and biomechanical bunctions of cartilage extracellular matrix[J]. ACS Nano, 2019, 13(10): 11320-11333. DOI:10.1021/acsnano.9b04477 |
| [29] |
Buraschi S, Neill T, Goyal A, et al. Decorin causes autophagy in endothelial cells via Peg3[J]. Proc Natl Acad Sci USA, 2013, 110(28): E2582-E2591. DOI:10.1073/pnas.1305732110 |
| [30] |
Neill T, Sharpe C, Owens R T, et al. Decorin-evoked paternally expressed gene 3(PEG3) is an upstream regulator of the transcription factor EB(TFEB) in endothelial cell autophagy[J]. Journal of Biological Chemistry, 2017, 292(39): 16211-16220. DOI:10.1074/jbc.M116.769950 |
| [31] |
Wu H J, Wang S X, Xue A M, et al. Overexpression of decorin induces apoptosis and cell growth arrest in cultured rat mesangial cells in vitro[J]. Nephrology(Carlton), 2008, 13(7): 607-615. |
| [32] |
Yu X, Zou Y F, Li Q, et al. Decorin-mediated inhibition of cholangiocarcinoma cell growth and migration and promotion of apoptosis are associated with E-cadherin in vitro[J]. Tumour Biology, 2014, 35(4): 3103-3112. DOI:10.1007/s13277-013-1402-y |
| [33] |
Hamid A S, Li J R, Wang Y L, et al. Recombinant human decorin upregulates p57KIP(2) expression in HepG2 hepatoma cell lines[J]. Molecular Medicine Reports, 2013, 8(2): 511-516. DOI:10.3892/mmr.2013.1510 |
| [34] |
Guo T Y, Zhang J B, Yao W, et al. CircINHA resists granulosa cell apoptosis by upregulating CTGF as a ceRNA of miR-10a-5p in pig ovarian follicles[J]. Biochimica et Biophysica Acta(BBA): Gene Regulatory Mechanisms, 2019, 1862(10): 194420. DOI:10.1016/j.bbagrm.2019.194420 |
| [35] |
Gubbiotti M A, Neill T, Frey H, et al. Decorin is an autophagy-inducible proteoglycan and is required for proper in vivo autophagy[J]. Matrix Biology, 2015, 48: 14-25. DOI:10.1016/j.matbio.2015.09.001 |
| [36] |
李建, 姚望, 杜星, 等. miR-1307在猪卵巢颗粒细胞周期中的作用[J]. 畜牧与兽医, 2021, 53(2): 1-7. Li J, Yao W, Du X, et al. The role of miR-1307 in the cell cycle of porcine granulosa cells[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(2): 1-7 (in Chinese with English abstract). |
| [37] |
Han Y, Wang S M, Wang Y Z, et al. IGF-1 inhibits apoptosis of porcine primary granulosa cell by targeting degradation of BimEL[J]. International Journal of Molecular Sciences, 2019, 20(21): E5356. DOI:10.3390/ijms20215356 |
| [38] |
Zhou J L, Liu J Y, Pan Z X, et al. The let-7g microRNA promotes follicular granulosa cell apoptosis by targeting transforming growth factor-β type 1 receptor[J]. Molecular and Cellular Endocrinology, 2015, 409: 103-112. DOI:10.1016/j.mce.2015.03.012 |
| [39] |
Du X, Liu L, Li Q Q, et al. NORFA, long intergenic noncoding RNA, maintains sow fertility by inhibiting granulosa cell death[J]. Communications Biology, 2020, 3: 131. DOI:10.1038/s42003-020-0864-x |
| [40] |
Yadav A K, Yadav P K, Chaudhary G R, et al. Autophagy in hypoxic ovary[J]. Cellular and Molecular Life Sciences, 2019, 76(17): 3311-3322. |




