文章信息
- 周颖, 李燕, 陶瑜, 王建军, 侯喜林, 李英
- ZHOU Ying, LI Yan, TAO Yu, WANG Jianjun, HOU Xilin, LI Ying
- 不结球白菜抗坏血酸相关基因BcMDHAR2功能验证
- Functional verification of ascorbic acid related gene BcMDHAR2 in non-heading Chinese cabbage
- 南京农业大学学报, 2021, 44(4): 628-636
- Journal of Nanjing Agricultural University, 2021, 44(4): 628-636.
- http://dx.doi.org/10.7685/jnau.202011019
-
文章历史
- 收稿日期: 2020-11-19
抗坏血酸(AsA)又称维生素C, 是维持动植物生命所必需的抗氧化剂。AsA参与许多基本的生理过程, 如氧化应激的防御机制[1]、维生素E的还原状态维持、跨膜电子传输、细胞分裂和生长调节等[2]。作为一种重要的抗氧化剂, AsA能有效清除有毒自由基和活性氧(ROS), 使植物提高对盐、臭氧和冷应激处理的耐受性[3-4]。
目前AsA主要合成途径是肌醇途径、古洛糖途径、D-甘露糖/L-半乳糖途径、半乳糖醛酸途径[5-8]。除合成途径外, AsA的代谢途径对植物体内AsA含量也有一定的影响, 该途径被称为AsA-GSH循环途径[9]。AsA可以从单脱氢抗坏血酸盐和脱氢抗坏血酸盐中再生, 其中已知的作用酶有: 单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、抗坏血酸氧化酶(AAO)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)[10-13]。
通过筛选AsA合成代谢相关基因的上游调控因子或与表达区域结合的蛋白, 寻找调控AsA合成途径的基因表达量的影响因素, 从而达到通过育种途径或栽培措施改变植物中抗坏血酸含量的目的。MDHAR可使AsA由氧化态转化为还原态。研究发现, 由于不结球白菜生长早期AsA分解较少, MDHAR的活性在生长前期很低, 长到4叶1心后该酶活性才开始上升, 对不结球白菜生长后期维持AsA含量十分关键[14]。MDHAR作为抗氧化物酶参与植物生长调控, 目前对于该酶的研究大多主要集中在其对胁迫以及激素处理的响应上, 如Zhang等[15]发现在低浓度的ABA处理下, 白苜蓿中MDHAR表达量上调; 喷施植物激素或生长调节剂对小麦幼苗中抗氧化酶活性及相关基因表达量起到增强作用[16]; Eltayeb等[17]发现MDHAR过表达转基因烟草增强了对盐、臭氧的耐受性; Ren等[18]发现MDHAR1负调控烟草中的AsA含量; Stevens等[19]发现番茄果实AsA含量与MDHAR活性有关, 进而影响其抗寒能力; Gest等[20]发现MDHAR 3 通过光调控来对AsA含量产生影响, MDHAR活性改变后, D-甘露糖/L-半乳糖途径的基因对光的响应产生变化。但是关于MDHAR表达水平的具体调控机制目前还未见深入研究。
人体内缺少合成AsA的关键基因, 不能合成AsA, 因此只能通过食物摄取, 蔬菜是人体AsA的主要来源之一。不结球白菜(Brassica campestris ssp. chinensis)是中国南方最重要的蔬菜之一。目前, 在不结球白菜中已经初步验证了MDHAR1的功能[18], 在转基因烟草中进行相关基因表达量分析, 发现MDHAR1对烟草中AsA含量负调控。而Sano[21]发现MDHAR家族的各同源基因呈现出多样的亚细胞定位和生化特征。因此, 探索该家族同源基因的功能有一定的意义。本研究以不结球白菜'苏州青'为材料, 对MDHAR2进行功能验证, 利用病毒诱导的基因沉默(VIGS)技术[22-23]对叶片中AsA代谢循环相关基因MDHAR2进行沉默, 并对该基因沉默后AsA-GSH循环途径相关基因表达量进行分析, 同时对沉默后叶片中AsA的含量进行测定, 以期探明不结球白菜中MDHAR 2 基因对AsA含量的影响及其调控机制, 为未来更深入研究MDHAR 2 功能提供一定理论基础。
1 材料与方法 1.1 试验材料供试材料为不结球白菜(Brassica campestris ssp. chinensis)品种'苏州青', 由南京农业大学园艺学院不结球白菜课题组提供。
1.2 试验方法 1.2.1 不结球白菜BcMDHAR2基因克隆参照RNA Simple Total RNA Kit[天根生化科技(北京)有限公司]说明书提取不结球白菜'苏州青'叶片RNA, 使用Prime ScriptTMⅡ1st Strand cDNA Synthesis Kit(TaKaRa)反转录合成的cDNA作为克隆模板。参照大白菜数据库中BraMDHAR2(Bra005775)序列, 在不结球白菜数据库(http://nhccbase.njau.edu.cn/website/)中进行BLAST序列比对, 取完整的ORF两端设计引物(表 1)。PCR反应体系(20 μL): cDNA模板1 μL, 正、反向引物各1 μL, 2×Prime Star Max DNA聚合酶10 μL, ddH2O 7 μL。反应程序: 95 ℃ 5 min; 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 2 min; 72 ℃ 10 min; 4 ℃保存。PCR产物用12 g · L-1琼脂凝胶电泳检测, 目的片段用凝胶回收试剂盒(OMEGA)纯化回收, 连接至PEAZY-Blunt载体, 转化大肠杆菌感受态Trans-T1, 挑取阳性克隆进行测序, 获得目的基因, 命名为BcMDHAR2(登录号: MW539062)。
| 引物名称Primer name | 序列Sequence(5′→3′) | 用途Usage |
| BcMDHAR2-F/R | ATGGCGGAAGAGAAGAGCTTCAAGT/TTACATGTTGCTGACGAAGGAAAGT | 基因扩增Gene amplification |
| BcMDHAR2-att-F/R | CACCATGGCGGAAGAGAAGAGCTTCAAGT/CATGTTGCTGACGAAGGAAAGT | 构建载体Construction of vector |
| BcMDHAR2-RT-F/R | AGAGACCGTGTTGTTTGGGG/AGCCTTAGCAATCGCCTTGT | |
| BcACTIN-F/R | GTTGCTATCCAGGCTGTTCT/AGCGTGAGGAAGAGCATAAC | |
| BcAAO1-RT-F/R | TCAGCCTCCACCACCACTAG/GCCTAACAAGACTTACCGAATCAG | |
| BcAAO2-RT-F/R | GATAGTGGCGGTGGCTATCT/GACGATAGTGTCTCCAGCGA | |
| BcAPX-RT-F/R | TGTACTCTGCTTCGTTCCTAATGG/CCGTGCTCTCATCGCCAAG | 实时荧光定量RT-qPCR |
| BcDHAR1-RT-F/R | CAGCAGACTTATCCTTGGCA/CAACCAGCAATCACATCCTC | |
| BcDHAR2-RT-F/R | AAGATCTCAGCAGCGGATTT/TTTGCGCCTCTGTATTCTTG | |
| BcGR1-RT-F/R | GGAGGAGGGTACATTGCTGT/GTCAAACTTGTTTGCGGATG | |
| BcGR2-RT-F/R | GGAGGAGGGTACATTGCTGT/GCCAAACTTGTTTGTGGATG | |
| BcMDHAR2-PTY-F/R | ATGAACGTGAAGGCAAATGGCAAAGCTGTGGTTGTTGGTG/CACCAACAACCACAGCTTTGCCATTTGCCTTCACGTTCAT | 病毒诱导的基因沉默(VIGS)Virus induced gene silencing |
采用Bioxm2.7软件对所获得的基因序列进行核酸序列比对以及氨基酸序列分析。不同物种MDHAR2的氨基酸序列从NCBI(https://www.ncbi.nlm.nih.gov/)GenBank数据库中搜索获得, 通过DNAMAN 6.0进行多重序列比对, 进化树构建用MEGA 6软件完成。基因定位分析使用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)。
1.2.3 亚细胞定位分析利用gateway技术将BcMDHAR2基因序列插入pEarleyGate 103载体上[24]。在基因引物两端加上attB接头(表 1), 使用PCR获得含接头的目的片段并将目的片段导入TOPO载体。用限制性内切酶MluⅠ将TOPO-BcMDHAR2质粒进行单酶切, 再通过LR反应将目的基因片段与载体相融合。测序后获得重组质粒pEarleyGate103-BcMDHAR2-GFP。采用液氮冻融法将重组质粒转入农杆菌GV3101。
将含有目的质粒的GV3101农杆菌接种于含卡那霉素的LB培养基中, 28 ℃、180 r · min-1过夜培养, 6 000 r · min-1离心5 min, 去上清液; 加入1 mL缓冲液[10 mmol · L-1 MgCl2, 10 mmol · L-12-(N-吗啉)乙磺酸单水物(MES), 150 μmol · L-1乙酰丁香酮]清洗1遍, 离心, 弃上清液; 加入相同体积缓冲液, 重悬, 静置4 h, 使D600为0.8左右。将菌液注射进1个半月龄的烟草叶片中, 60 h后, 使用4′, 6-二脒基-2-苯基吲哚(DAPI)染料染色, 荧光共聚焦显微镜观察发光情况, 分析亚细胞定位结果。
1.2.4 非生物胁迫以及激素处理将不结球白菜'苏州青'种子催芽2~3 d后部分移至32孔穴盘中, 置于不结球白菜系统生物学实验室的气候室中, 光照/黑暗时间为16 h/8 h(昼/夜), 温度为22 ℃, 待植株生长至4叶1心时选择长势整齐一致的进行处理。
1) 外源激素处理。于08:00时, 对不结球白菜叶片分别进行以下处理: 100 μmol · L-1赤霉素(GA); 100 μmol · L-1脱落酸(ABA); 1 mmol · L-1茉莉酸甲酯(MeJA)(0.1%二甲基亚砜助溶, 对照为0.1%二甲基亚砜溶液), 于0、2、4、6、8、10、12、24、48 h取样, 取0.1 g样品提取RNA, 3次重复。
2) 低温处理。于08:00进行4 ℃低温处理, 于0、1、2、3、6、9、12、24、48 h取样。
3) 盐胁迫和重金属(Cu2+)处理。待不结球白菜种子萌发至子叶展开后, 放入Hoagland营养液中, 待植株生长至4叶1心时, 在含100 mmol · L-1NaCl的营养液、75 μmol · L-1 CuSO4 · 5H2O营养液中培养。取样时间同低温处理。
4) 光周期处理。将长至4叶1心的'苏州青'转移至22 ℃、湿度75%的光照培养箱中, 缓苗之后, 分别进行16 h/8 h(昼/夜)以及8 h/16 h(昼/夜)长短日照处理, 分别在长日照光照0、4、8、12、16 h, 黑暗4、8 h, 以及短日照光照0、4、8 h, 黑暗4、8、12、16 h时取样。
1.2.5 基因表达量分析参照RNA Simple Total RNA Kit(TianGen)说明书提取'苏州青'叶片RNA。按照Hifair Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)试剂盒(上海翊圣生物科技有限公司)说明书反转录成cDNA, 按照Hieff qPCR SYBR Green Master Mix(上海翊圣生物科技有限公司)说明书体系进行加样。使用荧光定量PCR仪, 进行PCR扩增, 程序为: 95 ℃ 5 min, 95 ℃ 10 s, 60 ℃ 30 s, 40个循环。采用ΔΔCT法计算基因相对表达量。采用SPSS 22以及Excel 2016软件分析数据。
1.2.6 病毒诱导基因沉默载体构建及植株接种采用杨学东等[25]方法, 选取40 bp序列: 5′-ATGAACGTGAAGGCAAATGGCAAAGCTGTGGTTGTTGGTG-3′, 另一条链反向互补, 共80 bp, 由南京金斯瑞生物科技有限公司合成。用SnaBⅠ酶切pTY载体, 使用连接酶将合成序列同酶切载体37 ℃过夜连接, 转化大肠杆菌, 方法同1.2.1节。使用无内毒素质粒大提试剂盒[天根生化科技(北京)有限公司]提取pTY-BcMDHAR2质粒。使用金粉包裹质粒, 基因枪轰击3片真叶的'苏州青', 使质粒转入植物体内, 并以基因枪轰击pTY空载的植株和正常生长的'苏州青'为对照, 15 d后观察发病症状。取发病植株叶片提取RNA, 荧光定量PCR分析基因表达量, 方法同1.2.5节。
1.2.7 不结球白菜AsA和总AsA(T-AsA)含量测定采用Fontannaz等[26]的方法测定叶片中AsA含量, 加入1.5 mL 0.1%草酸, 4 ℃、12 000 r · min-1离心20 min, 取过滤后的上清液使用超高效液相色谱仪(UltiMate 3000)测定AsA和T-AsA含量。氧化型抗坏血酸(DHA)含量为T-AsA与AsA含量之差。采用Excel 2016软件分析处理数据。
1.2.8 不结球白菜超氧化物歧化酶(SOD)活性测定使用总SOD测试盒(南京建成生物科技公司)测定沉默植株中SOD活性, 具体参考Li等[27]的方法。
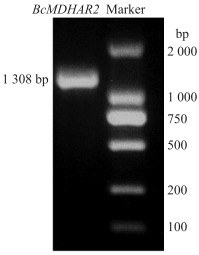
2 结果与分析 2.1 不结球白菜BcMDHAR2基因的克隆提取不结球白菜'苏州青'叶片RNA, 反转录后进行BcMDHAR2基因PCR扩增, 得到1 300 bp左右的目的片段, 如图 1所示。经测序, 不结球白菜BcMDHAR2基因ORF全长1 308 bp, 编码435个氨基酸。
|
图 1 BcMDHAR2基因PCR扩增产物 Fig. 1 PCR amplified product of BcMDHAR2 gene |
序列分析表明: BcMDHAR2与芜菁的MDHAR2同源性达100%(图略)。将BcMDHAR2的氨基酸序列与其他8个物种进行同源性分析, 结果(图 2)发现, BcMDHAR2的氨基酸序列与芜菁和野甘蓝相似性达100%, 与萝卜相似性为99%, 与拟南芥、亚麻芥、芥菜等相似性达85%以上, 与醉蝶花、黄瓜、番茄相似性均在74%以上, 表明在进化过程中该基因保守性高, 与芜菁亲缘关系最近。

|
图 2 不结球白菜与其他物种MDHAR2同源氨基酸比对(A)及进化树分析(B) Fig. 2 The alignment of MDHAR2 homologous amino acid(A)and phylogenetic tree analysis(B) in non-heading Chinese cabbage and other plants |
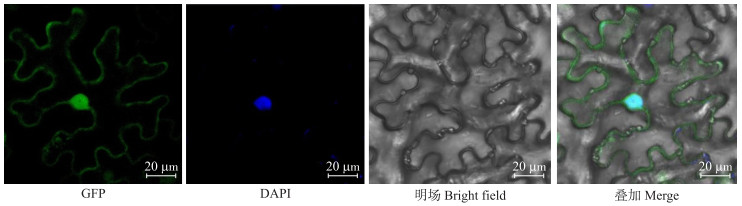
使用Plant-mPLoc进行在线预测, 结果表明BcMDHAR2定位于细胞质和细胞膜上。将BcMDHAR2在烟草中瞬时表达, 结果(图 3)发现, BcMDHAR2-GFP融合蛋白在细胞核、细胞膜、细胞质上发光, 表现为明显的绿色荧光, 核上的绿色荧光与核染料DAPI蓝光重合, 这表明BcMDHAR2不仅定位在细胞膜、细胞质上, 还在细胞核上表达。
|
图 3 BcMDHAR2在本氏烟草叶片中亚细胞定位 Fig. 3 Subcellular localization of BcMDHAR2 in Nicotiana benthamiana |
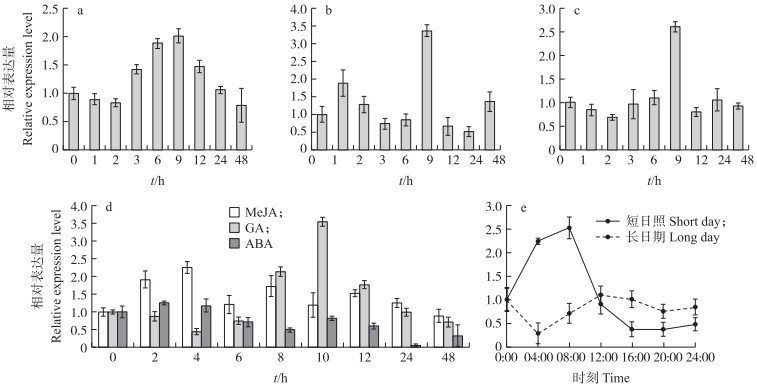
由图 4-a可见: 经过4 ℃低温处理的'苏州青', BcMDHAR2基因表达量呈先上升后下降的趋势, 在9 h时表达量达到最大值, 其相对表达量为对照的2倍。由图 4-b、c可见: 盐胁迫和重金属离子Cu2+处理下, 该基因表达量均在处理9 h时达到峰值, 随后基因表达量下降。由图 4-d可见: 1 mmol · L-1 MeJA处理后BcMDHAR2基因表达量呈先上升后下降波动变化; 100 μmol · L-1 GA处理后, BcMDHAR2的表达量在4~48 h总体呈先上升再下降的趋势, 10 h时达到最大值; 100 μmol · L-1 ABA处理后, 0~2 h基因表达量升高, 之后2~8 h呈下降趋势, 处理24 h时基因表达量达到最低。由图 4-e可见: 短日照条件下, BcMDHAR2的表达量变化显著, 在光照下先上升, 转为黑暗后基因表达量急剧下降, 黑暗时间延长, 变化趋于平稳; 而长日照条件下, 0~4 h表达量显著下降, 在光照4~12 h基因表达量呈现上升趋势, 12 h时达到最大值, 黑暗后持续下降。与短日照相比, 长日照下BcMDHAR2基因表达量变化趋势平缓, 说明该基因对光照较敏感。
|
图 4 不同胁迫及激素处理下BcMDHAR2基因表达量 Fig. 4 Expression level of BcMDHAR2 gene under different stress and hormone treatments a. 4 ℃低温处理; b.盐处理; c. 重金属离子(Cu2+)处理; d. 激素处理(1 mmol · L-1 MeJA, 100 μmol · L-1 GA, 100 μmol · L-1 ABA); e. 光照处理(短日照和长日照)。 a. Low temperature treatment at 4 ℃; b. Salt treatment; c. Heavy metal ion(Cu2+)treatment; d. Hormone treatments(1 mmol · L-1 MeJA, 100 μmol · L-1 GA, 100 μmol · L-1 ABA); e. Light treatment(short day and long day). |
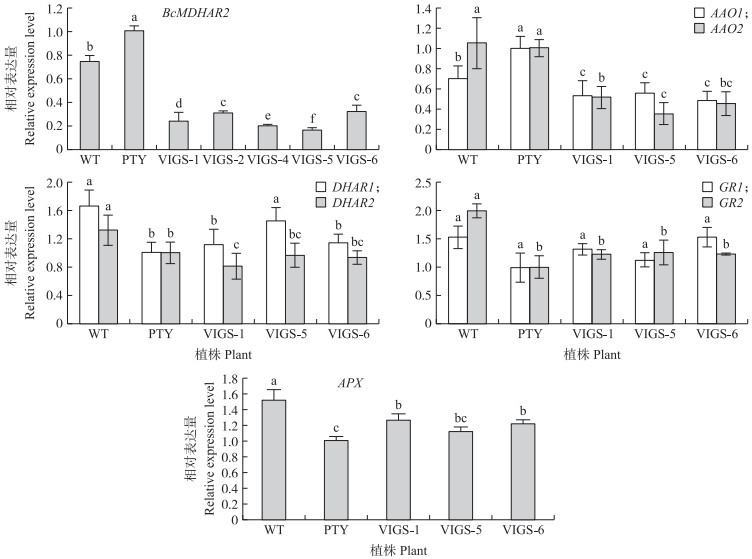
由图 5可见: 对'苏州青'的BcMDHAR2基因进行沉默后, 叶片呈发病状态, 出现严重花叶病斑, 叶片颜色变浅。由图 6可见: 与pTY空载相比, BcMDHAR2基因的表达量明显下调, 证明BcMDHAR2被沉默。对沉默后的植株AsA-GSH循环途径相关基因表达量进行分析, 发现基因沉默后, 植株中AAO1、AAO2较空载植株表达量下调, 其中AAO2表达量约为空载的1/2。DHAR1表达量在基因沉默株系中与空载植株相比上调, 而DHAR2呈相反变化, 但与野生型相比, 表达量均下降。GR1、GR2基因在沉默植株中的表达量较空载植株呈现上调变化, 但与野生型相比, 表达量下降; APX表达量也呈现类似的趋势。

|
图 5 BcMDHAR2基因沉默后的叶片表型 Fig. 5 Leaf phenotype after BcMDHAR2 gene silencing WT: 野生型; PTY: pTY空载; VIGS-1、VIGS-4:BcMDHAR 2 基因沉默后的植株。下同。 WT: Wild type; PTY: pTY empty carrier; VIGS-1, VIGS-4:The plant after BcMDHAR2 gene silencing. The same as follows. |
|
图 6 AsA-GSH循环相关基因在基因沉默植株中的表达量 Fig. 6 Expression level of AsA-GSH cycle related genes in gene silenced plants 不同字母表示在不同株系中基因表达量差异显著(P<0.05)。下同。 The different letters mean significant difference of gene expression level among different lines(P < 0.05). The same below. |
由图 7可见: 与空载对照相比, 沉默BcMDHAR2后的植株中AsA含量下降了70%;DHA含量也呈下降趋势, 证明沉默BcMDHAR2后降低了不结球白菜中AsA含量。沉默BcMDHAR2的植株中SOD活性显著升高, 说明MDHAR2表达量降低后, 不结球白菜体内SOD活性被激活, 表达上升。
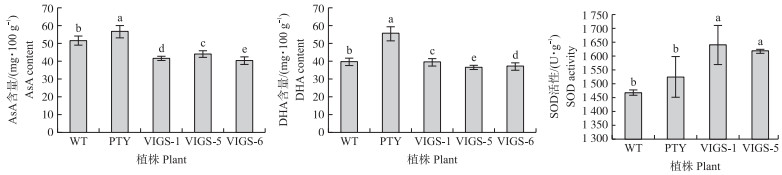
|
图 7 基因沉默植株中AsA、DHA含量和SOD活性 Fig. 7 The content of AsA, DHA and SOD activity in gene silenced plants |
不结球白菜中AsA含量丰富, 但也存在着较大的品种差异[28]。AsA作为一种抗氧化剂, 在体内不停被转换, 这种转换通过AsA-GSH循环途径实现。AsA-GSH循环对清除植物中的活性氧等有害物质起着关键作用, 调节该途径相关酶的表达量对提高植物抗氧化以及抗逆性十分重要[18-20]。
本研究从不结球白菜中克隆得到BcMDHAR2基因, 同源性分析发现该基因较为保守, 尤其是与芜菁、拟南芥等十字花科植物相似性很高。因此, 在拟南芥等植物中该基因的研究具有较高的参考性。在植物细胞中, 已报道的一些物种的MDHAR在叶绿体、细胞质、线粒体、过氧化物酶体、质膜等位置表达[21]。本研究亚细胞定位结果表明, BcMDHAR2在烟草中定位除细胞质、细胞膜外, 还在细胞核上表达。推测BcMDHAR2在植物生长发育过程中起到一定作用。Ying等[29]和Ren等[30]在洋葱细胞以及拟南芥定位中也发现这3个部位均有荧光现象, 分析认为在细胞核、细胞质、细胞膜部位表达的基因可能参与植物生长发育、响应非生物胁迫。
AsA含量和环境因素有关, 当植物受到伤害时, 可以通过调节AsA含量来抵抗逆境下产生的活性氧。Liu等[31]研究表明, OsMDHAR4通过调节H2O2诱导的水稻气孔关闭对热应激耐受性具有负调节作用。过表达MDHAR烟草增强了对非生物胁迫耐受性[18]。本研究发现, 在低温、盐、重金属离子以及外源ABA、GA、MeJA处理下BcMDHAR2均有一定的响应。在低温、盐、Cu2+处理下, 基因表达量均呈先上升再下降的趋势, 可能是植物响应非生物胁迫提高了BcMDHAR2表达量从而增强植物的耐受性。外源GA、MeJA处理下, 该基因表达量呈现先上升后下降变化, 而在外源ABA处理下, 基因表达量总体呈现下降趋势, 表明激素信号途径可能影响该基因表达量进而对活性氧清除产生一定影响。AsA-GSH循环中各抗氧化物酶共同维持AsA氧化还原比值[1]。本研究中, 通过VIGS沉默BcMDHAR2基因, 发现在沉默株系中AsA循环路径其他相关基因表达量也发生了一定变化, AAO与BcMDHAR2表达量均下调; DHAR1、APX与之相反, 表达量均上调, GR表达量无显著性变化。同时, 研究发现沉默株系中的AsA含量降低, 即BcMDHAR2对不结球白菜的AsA积累具有正向调控作用。
MDHA在非酶作用下可生成氧化型抗坏血酸(DHA), 而这个过程的场所是在胞质中[32], 因此猜测位于细胞核、膜和细胞质的BcMDHAR2基因对胞质中DHA的还原起到一定作用。本研究发现BcMDHAR2基因沉默后, 沉默株系中AsA含量降低, 而SOD活性升高, 说明AsA含量降低可以激活不结球白菜体内SOD活性, 来清除活性氧以维持植物生长。
综上所述, BcMDHAR2响应非生物胁迫以及激素处理; BcMDHAR2基因沉默后, 不结球白菜中AsA含量降低, 抗氧化物相关酶SOD活性上升, 对植物中活性氧清除产生一定影响。推测BcMDHAR2的合成变化可能影响了植物体内AsA的氧化还原比值以及通路中各类酶表达量, 当有外界刺激时, 使MDHAR协同通路中其他抗氧化物相关酶通过AsA代谢以及其他方式共同将植物体内活性氧等物质清除。关于该基因对AsA含量具体调控机制以及对代谢途径相关基因作用关系还有待进一步研究。
| [1] |
Noctor G, Foyer C H. ASCORBATE AND GLUTATHIONE: keeping active oxygen under control[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49: 249-279. DOI:10.1146/annurev.arplant.49.1.249 |
| [2] |
Hidalgo A, Gonzalez-Reyes J A, Navas P. Ascorbate free radical enhances vacuolization in onion root meristems[J]. Plant, Cell & Environment, 1989, 12(4): 455-460. |
| [3] |
Chen Z, Gallie D R. Increasing tolerance to ozone by elevating foliar ascorbic acid confers greater protection against ozone than increasing avoidance[J]. Plant Physiology, 2005, 138(3): 1673-1689. DOI:10.1104/pp.105.062000 |
| [4] |
Wang X H, Zhang S, Hu D, et al. BcPMI2, isolated from non-heading Chinese cabbage encoding phosphomannose isomerase, improves stress tolerance in transgenic tobacco[J]. Molecular Biology Reports, 2014, 41(4): 2207-2216. DOI:10.1007/s11033-014-3072-2 |
| [5] |
Lorence A, Chevone B I, Mendes P, et al. Myo-inositol oxygenase offers a possible entry point into plant ascorbate biosynthesis[J]. Plant Physiology, 2004, 134(3): 1200-1205. DOI:10.1104/pp.103.033936 |
| [6] |
Wolucka B A, van Montagu M. GDP-mannose 3', 5'-epimerase forms GDP-L-gulose, a putative intermediate for the de novo biosynthesis of vitamin C in plants[J]. Journal of Biological Chemistry, 2003, 278(48): 47483-47490. DOI:10.1074/jbc.M309135200 |
| [7] |
Wheeler G L, Jones M A, Smirnoff N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature, 1998, 393(6683): 365-369. DOI:10.1038/30728 |
| [8] |
Agius F, González-Lamothe R, Caballero J L, et al. Engineering increased vitamin C levels in plants by overexpression of a D-galacturonic acid reductase[J]. Nature Biotechnology, 2003, 21(2): 177-181. DOI:10.1038/nbt777 |
| [9] |
Nishikawa F, Kato M, Hyodo H, et al. Ascorbate metabolism in harvested broccoli[J]. Journal of Experimental Botany, 2003, 54(392): 2439-2448. DOI:10.1093/jxb/erg283 |
| [10] |
Ren J, Chen Z W, Duan W K, et al. Comparison of ascorbic acid biosynthesis in different tissues of three non-heading Chinese cabbage cultivars[J]. Plant Physiology and Biochemistry, 2013, 73: 229-236. DOI:10.1016/j.plaphy.2013.10.005 |
| [11] |
Li F, Wu Q Y, Sun Y L, et al. Overexpression of chloroplastic monodehydroascorbate reductase enhanced tolerance to temperature and methyl viologen-mediated oxidative stresses[J]. Physiologia Plantarum, 2010, 139(4): 421-434. |
| [12] |
Smirnoff N, Wheeler G L. Ascorbic acid in plants: biosynthesis and function[J]. Critical Reviews in Biochemistry and Molecular Biology, 2000, 35(4): 291-314. DOI:10.1080/10409230008984166 |
| [13] |
Li Y, Liu G F, Ma L M, et al. A chromosome-level reference genome of non-heading Chinese cabbage[Brassica campestris(syn.Brassica rapa) ssp. chinensis][J]. Horticulture Research, 2020, 7(1): 212. DOI:10.1038/s41438-020-00449-z |
| [14] |
宋玉萍, 李英, 高红亮, 等. 不结球白菜维生素C积累与相关酶活性研究[J]. 西北植物学报, 2007, 27(11): 2240-2244. Song Y P, Li Y, Gao H L, et al. Ascorbic acid accumulation and related enzyme activities in leaves of non-heading Chinese cabbage[J]. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(11): 2240-2244 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-4025.2007.11.016 |
| [15] |
Zhang Y, Li Z, Peng Y, et al. Clones of FeSOD, MDHAR, DHAR genes from white clover and gene expression analysis of ROS-scavenging enzymes during abiotic stress and hormone treatments[J]. Molecules, 2015, 20(11): 20939-20954. DOI:10.3390/molecules201119741 |
| [16] |
Agarwal S, Sairam R K, Srivastava G C, et al. Role of ABA, salicylic acid, calcium and hydrogen peroxide on antioxidant enzymes induction in wheat seedlings[J]. Plant Science, 2005, 169(3): 559-570. DOI:10.1016/j.plantsci.2005.05.004 |
| [17] |
Eltayeb A E, Kawano N, Badawi G H, et al. Overexpression of monodehydroascorbate reductase in transgenic tobacco confers enhanced tolerance to ozone, salt and polyethylene glycol stresses[J]. Planta, 2007, 225(5): 1255-1264. DOI:10.1007/s00425-006-0417-7 |
| [18] |
Ren J, Duan W K, Chen Z W, et al. Overexpression of the monodehydroascorbate reductase gene from non-heading Chinese cabbage reduces ascorbate level and growth in transgenic tobacco[J]. Plant Molecular Biology Reporter, 2015, 33(4): 881-892. DOI:10.1007/s11105-014-0797-y |
| [19] |
Stevens R, Page D, Gouble B, et al. Tomato fruit ascorbic acid content is linked with monodehydroascorbate reductase activity and tolerance to chilling stress[J]. Plant, Cell & Environment, 2008, 31(8): 1086-1096. |
| [20] |
Gest N, Garchery C, Gautier H, et al. Light-dependent regulation of ascorbate in tomato by a monodehydroascorbate reductase localized in peroxisomes and the cytosol[J]. Plant Biotechnology Journal, 2013, 11(3): 344-354. DOI:10.1111/pbi.12020 |
| [21] |
Sano S. Molecular and functional characterization of monodehydro-ascorbate and dehydroascorbate reductases[M]//Hossain M A, Munné-Boschs S, David J, et al. Ascorbic Acid in Plant Growth, Development and Stress Tolerance. Cham, Switzerland: Springer, 2017.
|
| [22] |
Liu Y L, Schiff M, Dinesh-Kumar S P. Virus-induced gene silencing in tomato[J]. The Plant Journal, 2002, 31(6): 777-786. DOI:10.1046/j.1365-313X.2002.01394.x |
| [23] |
王玲. 利用VIGS技术对草莓FaMYB5基因功能的研究[D]. 雅安: 四川农业大学, 2015. Wang L. Virus-induced gene silencing as a tool for FaMYB5 gene functional studies in strawberry[D]. Ya'an: Sichuan Agricultural University, 2015(in Chinese with English abstract). |
| [24] |
任海波, 刘同坤, 袁敬平, 等. 不结球白菜BcICE1基因的克隆与功能分析[J]. 南京农业大学学报, 2019, 42(5): 802-810. Ren H B, Liu T K, Yuan J P, et al. Cloning and functional analysis of BcICE1 gene in non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2019, 42(5): 802-810 (in Chinese with English abstract). DOI:10.7685/jnau.201901007 |
| [25] |
杨学东, 戴薇, 张昌伟, 等. 白菜病毒诱导基因沉默技术体系的建立[J]. 园艺学报, 2012, 39(11): 2168-2174. Yang X D, Dai W, Zhang C W, et al. The technology system establishment of VIGS in non-heading Chinese cabbage[J]. Acta Horticulturae Sinica, 2012, 39(11): 2168-2174 (in Chinese with English abstract). |
| [26] |
Fontannaz P, Kilinç T, Heudi O. HPLC-UV determination of total vitamin C in a wide range of fortified food products[J]. Food Chemistry, 2006, 94(4): 626-631. |
| [27] |
Li H X, Xiao Y, Cao L L, et al. Cerebroside C increases tolerance to chilling injury and alters lipid composition in wheat roots[J]. PLoS One, 2013, 8(9): e73380. |
| [28] |
侯喜林, 李英, 黄菲艺. 不结球白菜(Brassica campestris ssp.chinensis)主要性状及育种技术的分子生物学研究新进展[J]. 园艺学报, 2020, 47(9): 1663-1677. Hou X L, Li Y, Huang F Y. New advances in molecular biology of main characters and breeding techniques of non-heading Chinese cabbage(Brassica campestris ssp. chinensis)[J]. Acta Horticulturae Sinica, 2020, 47(9): 1663-1677 (in Chinese with English abstract). |
| [29] |
Ying S, Zhang D F, Li H Y, et al. Cloning and characterization of a maize SnRK2 protein kinase gene confers enhanced salt tolerance in transgenic Arabidopsis[J]. Plant Cell Reports, 2011, 30(9): 1683-1699. |
| [30] |
Ren Y J, Liu Y, Chen H Y, et al. Type 4 metallothionein genes are involved in regulating Zn ion accumulation in late embryo and in controlling early seedling growth in Arabidopsis[J]. Plant, Cell & Environment, 2012, 35(4): 770-789. |
| [31] |
Liu J P, Sun X J, Xu F Y, et al. Suppression of OsMDHAR4 enhances heat tolerance by mediating H2O2-induced stomatal closure in rice plants[J]. Rice, 2018, 11(1): 38. DOI:10.1186/s12284-018-0230-5 |
| [32] |
Lisenbee C S, Lingard M J, Trelease R N. Arabidopsis peroxisomes possess functionally redundant membrane and matrix isoforms of monodehydroascorbate reductase[J]. The Plant Journal, 2005, 43(6): 900-914. |




