文章信息
- 訾玉祥, 陆兆新, 吕风霞, 别小妹, 张充, 赵海珍
- ZI Yuxiang, LU Zhaoxin, LÜ Fengxia, BIE Xiaomei, ZHANG Chong, ZHAO Haizhen
- 紫苏叶中甘油糖脂的抗氧化活性研究
- The study of antioxidant activities of glycoglycerolipids in leaves of Perilla frutescens
- 南京农业大学学报, 2021, 44(3): 561-567
- Journal of Nanjing Agricultural University, 2021, 44(3): 561-567.
- http://dx.doi.org/10.7685/jnau.202007033
-
文章历史
- 收稿日期: 2020-07-21
 )清除能力并测定其还原力,采用细胞氧化损伤模型研究甘油糖脂对抗氧化酶活性的影响。[结果]从紫苏叶中分离纯化获得了3种甘油糖脂单体,即MGDG(C18:3/C18:3)、DGDG(C18:3/C18:3)和DGDG(C18:3/C16:0)。MGDG(C18:3/C18:3)和DGDG(C18:3/C18:3)的抗氧化能力强于DGDG(C18:3/C16:0)。3种甘油糖脂均可抑制ABTS自由基、DPPH自由基、·OH、
)清除能力并测定其还原力,采用细胞氧化损伤模型研究甘油糖脂对抗氧化酶活性的影响。[结果]从紫苏叶中分离纯化获得了3种甘油糖脂单体,即MGDG(C18:3/C18:3)、DGDG(C18:3/C18:3)和DGDG(C18:3/C16:0)。MGDG(C18:3/C18:3)和DGDG(C18:3/C18:3)的抗氧化能力强于DGDG(C18:3/C16:0)。3种甘油糖脂均可抑制ABTS自由基、DPPH自由基、·OH、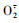 的产生及提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)的活性,且具有较强的还原力。[结论]3种甘油糖脂均具有抗氧化能力,但脂肪酰基组成不同的甘油糖脂具有不同的抗氧化能力,其中,脂酰基及糖基数量对甘油糖脂类化合物的抗氧化活性影响较大。
的产生及提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)的活性,且具有较强的还原力。[结论]3种甘油糖脂均具有抗氧化能力,但脂肪酰基组成不同的甘油糖脂具有不同的抗氧化能力,其中,脂酰基及糖基数量对甘油糖脂类化合物的抗氧化活性影响较大。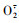 ) were measured by chemical evaluation method, and the cell oxidative damage model was used to study the effects of glycoglycerolipids on the activities of antioxidant enzymes.
[Results]
Three glycoglycerolipids monomers were separated and purified from leaves of P. frutescens, including MGDG(C18:3/C18:3), DGDG(C18:3/C18:3) and DGDG(C18:3/C16:0). The antioxidant activities of MGDG(C18:3/C18:3) and DGDG(C18:3/C18:3) were higher than that of DGDG(C18:3/C16:0). All glycoglycerolipids presented strong reducing power, and they could not only inhibit the production of ABTS, DPPH, ·OH and
) were measured by chemical evaluation method, and the cell oxidative damage model was used to study the effects of glycoglycerolipids on the activities of antioxidant enzymes.
[Results]
Three glycoglycerolipids monomers were separated and purified from leaves of P. frutescens, including MGDG(C18:3/C18:3), DGDG(C18:3/C18:3) and DGDG(C18:3/C16:0). The antioxidant activities of MGDG(C18:3/C18:3) and DGDG(C18:3/C18:3) were higher than that of DGDG(C18:3/C16:0). All glycoglycerolipids presented strong reducing power, and they could not only inhibit the production of ABTS, DPPH, ·OH and 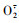 , but also significantly enhance the activities of superoxide dismutase(SOD), catalase(CAT) and glutathione peroxidase(GSH-Px).
[Conclusions]
Glycoglycerolipids with different fatty acyl composition presented different antioxidant activity, and the preliminary study of structure-activity relationship showed that the saturation degree of fatty acyl group and the number of sugar groups greatly affected the antioxidant activities of glycoglycerolipids.
, but also significantly enhance the activities of superoxide dismutase(SOD), catalase(CAT) and glutathione peroxidase(GSH-Px).
[Conclusions]
Glycoglycerolipids with different fatty acyl composition presented different antioxidant activity, and the preliminary study of structure-activity relationship showed that the saturation degree of fatty acyl group and the number of sugar groups greatly affected the antioxidant activities of glycoglycerolipids.
体内氧化反应被证明与诸多疾病的发生有关[1]。研究表明, 机体内过剩的自由基会使氧化压力升高, 进而导致细胞损伤[2-5], 而抗氧化活性物质可以起到清除体内自由基, 防止氧化反应引发的细胞损伤。因此, 从自然界中获取具有抗氧化作用的物质并探讨其活性构效关系对于防止机体氧化损伤具有重要意义。
紫苏(Perilla frutescens)属唇形科草本植物, 作为国家卫生健康委员会第一批规定的药食同用的60种作物之一, 其在食品药品领域具有重要的开发价值, 在国内外受到广泛的关注[6]。紫苏提取物具有优良的抗氧化作用[7]。Sugawara等[8]研究表明紫苏中甘油糖脂含量丰富, 是获取甘油糖脂的重要植物来源。甘油糖脂是一种天然来源的或人工合成的具有多种活性作用的脂类物质, 因其具有安全可靠、对人体无不良副作用的优点, 已广泛应用于食品、药品及保健品之中。从微杆菌Microbacterium sp. M874和棒状杆菌Corynebacterium aquaticum S365中分别分离出2种不同分子结构的甘油糖脂, 发现它们可以通过阻止叔丁基过氧化氢诱导的细胞氧化死亡、清除羟自由基及过氧化氢自由基起到优良的抗氧化作用[9-12]。已从重要经济作物紫苏中分离得到的3种不同分子结构甘油糖脂[13], 但其是否具有抗氧化作用目前仍不清楚。研究表明, 甘油糖脂的分子构成, 如糖基的类型、脂肪酰基的链长及不饱和双键的数量、脂肪酰基的连接位点等对其生物活性有着重要影响[14-19]。本试验通过化学评价法及细胞氧化损伤模型评估紫苏中3种不同分子结构甘油糖脂的抗氧化活性, 并初步探讨其分子构效与生物活性之间的关系, 旨在为开发新型抗氧化活性物质提供理论基础。
1 材料与方法 1.1 材料与试剂甘油糖脂从干制紫苏叶(产自上海)中分离所得; 巨噬细胞RAW264.7由中国疾病预防控制中心传染病预防控制所提供。
DMEM完全培养基购于美国Mediatech公司; 细胞消化液、脂多糖(LPS)、PBS缓冲液、噻唑蓝(MTT)溶液、细胞冻存液和胰蛋白酶均购于Gibco公司; 6-羟基-2, 5, 7, 8-四甲基色烷-2-羧酸(Trolox)、2, 2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、邻菲啰啉、1, 1-二苯基-2-三硝基苯肼(DPPH)、羟自由基测定试剂盒、超氧阴离子测定试剂盒以及CAT、SOD和GSH-Px检测试剂盒均购于南京建成生物技术有限公司; 过硫酸钾、三氯乙酸、铁氰化钾、三氯化铁和无水乙醇均购于国药集团化学试剂有限公司(北京)。
1.2 仪器与设备ZHJH-C1112B超净工作台购于上海智城分析仪器制造有限公司; TS100-F倒置相差显微镜购于日本Nikon公司; HFU 586 Basic二氧化碳培养箱购于美国Thermo公司; LDZX-50KB立式压力蒸汽灭菌器购于上海申安医疗器械厂; TDL-50C低速台式离心机购于上海安亭科学仪器厂; TS-200振荡仪购于海门市其林贝尔仪器制造有限公司; HH-2恒温水浴锅购于海门市其林贝尔仪器制造有限公司。
1.3 试验方法 1.3.1 紫苏叶中甘油糖脂的提取及鉴定通过硅胶柱层析、薄层色谱、半制备液相色谱等分离纯化方法从紫苏叶中获取甘油糖脂。主要提取步骤: 利用氯仿/甲醇混合液对紫苏叶中的总脂进行提取, 将总脂施加到硅胶柱中, 通过硅胶柱层析梯度洗脱法分离甘油糖脂单体, 使用薄层色谱对甘油糖脂进行定性分析, 最后利用半制备液相色谱对甘油糖脂进行二次纯化, 最终获得高纯度的甘油糖脂单体。采用质谱法、核磁波谱法对甘油糖脂的分子结构进行鉴定。
1.3.2 甘油糖脂的DPPH清除能力测定采用Oliveira Neto等[20]的方法并略作修改。准确配制0.08 mmol·L-1 DPPH储备液, 置于4 ℃冰箱中备用。使用无水乙醇配制不同质量浓度梯度(125、250、500、1 000和2 000 μg·mL-1)的甘油糖脂样品, 取100 μL甘油糖脂样品和100 μL DPPH储备液混匀, 避光反应30 min, 于517 nm处测定其吸光值记为A1; 空白对照组为不含有甘油糖脂的DPPH乙醇液(100 μL乙醇+100 μL DPPH), 吸光值记为A0; 以对应质量浓度的Trolox(125、250、500、1 000和2 000 μg·mL-1)作为阳性对照。每组设置3个平行试验。DPPH自由基清除率=(A0-A1)/A0×100%。
1.3.3 甘油糖脂的ABTS清除能力测定采用Zheng等[21]的方法并略作修改。将过硫酸钾储备液(2.45 mmol·L-1)与ABTS储备液(7 mmol·L-1)按1∶1体积比配制ABTS预备液, 用0.1 mol·L-1 PBS缓冲液稀释ABTS预备液至734 nm处吸光值为0.7, 获得ABTS工作液。配制甘油糖脂样品质量浓度为16、32、64、128、256和512 μg·mL-1; 取50 μL甘油糖脂样品液与150 μL ABTS工作液混匀, 避光反应30 min, 于734 nm处测定其吸光值, 记为A1; 空白对照组为不含有甘油糖脂ABTS工作液(50 mL PBS+150 μL ABTS), 吸光值记为A0; 以Trolox(16、32、64、128、256和512 μg·mL-1)作为阳性对照。每组设置3个平行试验。ABTS自由基清除率=(1-A1/A0)×100%。
1.3.4 羟自由基和超氧阴离子清除能力测定配制不同质量浓度(125、250、500、1 000和2 000 μg·mL-1)甘油糖脂样品溶液, 以对应质量浓度的Trolox(125、250、500、1 000和2 000 μg·mL-1)溶液作为阳性对照。按照南京建成生物技术有限公司提供的试剂盒操作说明书, 测定管吸光值, 记为Ai, 对照管记为Aj, 空白管记为A0。每组设置3个平行试验。羟自由基清除率或超氧阴离子自由基清除率=(Ai-Aj)/(A0-Aj)×100%。
1.3.5 甘油糖脂还原力测定采用李慧[22]的方法并略有修改。取50 μL不同质量浓度(125、250、500、1 000和2 000 μg·mL-1)甘油糖脂样品液、50 μL 0.2 mol·L-1 PBS缓冲液(pH7.0)和50 μL 10 g·L-1铁氰化钾溶液于50 ℃水浴锅中加热20 min。反应结束后室温冷却, 加入50 μL 100 g·L-1三氯乙酸室温反应15 min, 最后加入50 μL ddH2O和50 μL 1 g·L-1三氯化铁溶液, 静置10 min, 于700 nm处测定其吸光值。以PBS缓冲液作为空白对照, 以Trolox(125、250、500、1 000、2 000 μg·mL-1)作为阳性对照。每组设置3个平行试验。
1.3.6 超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性测定细胞培养参考Li[23]的方法并略作修改。采用LPS作为刺激小鼠巨噬细胞RAW264.7发生氧化损伤的诱导剂。取细胞(1×105mL-1)于24孔板中, 置于37 ℃、5% CO2的培养箱中培养12 h; 弃去培养上清液, 加入1 μg·mL-1LPS和不同质量浓度(10、500、1 000 μg·mL-1)的甘油糖脂样品于细胞培养箱中, 培养24 h。以Trolox(500 μg·mL-1)作为阳性对照, 以DMEM细胞培养基为空白对照。每组设置5个平行。培养结束后, 使用PBS清洗板孔, 再向内加入胰蛋白酶液、细胞组织快速裂解液, 4 ℃, 14 000 g离心10 min, 收集上清液, 按照试剂盒操作方法测定细胞中超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶相对活性, 测定管吸光值记为A1, 空白管记为A0。酶相对活性=A1/A0。
1.4 统计学分析应用SAS system V8对测定结果进行单因素方差分析(One-Way ANOVA)和t测验, 比较0.05水平的差异显著性。
2 结果与分析 2.1 紫苏叶中甘油糖脂的分子结构通过硅胶柱层析及半制备液相色谱法从紫苏叶中分离纯化获得3种甘油糖脂单体: 1个单半乳糖基甘油二酯MGDG(C18∶3/C18∶3), 2个双半乳糖基甘油二酯DGDG(C18∶3/C18∶3)和DGDG(C18∶3/C16∶0), 经质谱及核磁波谱法分析鉴定结构见图 1。
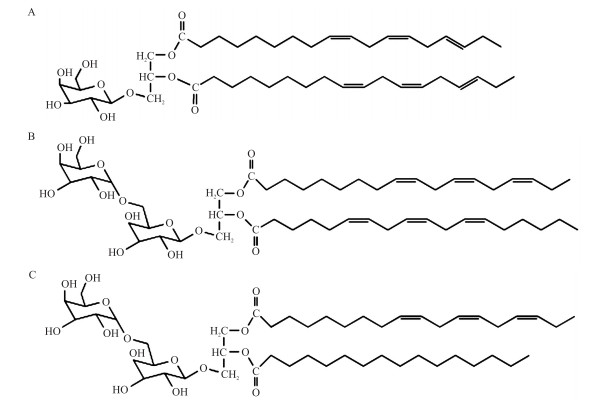
|
图 1 紫苏叶中甘油糖脂的分子结构 Fig. 1 Molecular structure of glycoglycerolipids from perilla leaves A. MGDG(C18∶3/C18∶3): 1, 2-2-O-(9, 12, 15-亚麻酰基)-3-O-(β-D-半乳糖基)-sn-甘油1, 2-2-O-(9Z, 12Z, 15Z-octadecatrienoyl)-3-O-(β-D-galactopyranosy)-sn-glycerol; B. DGDG(C18∶3/C18∶3): 1-O-(9, 12, 15-亚麻酰基)-2-O-(6, 9, 12-亚麻酰基)-3-O-[β-D-半乳糖基-α-D-半乳糖基]-sn-甘油1-O-(9Z, 12Z, 15Z-octadecatrienoyl)-2-O-(6Z, 9Z, 12Z-octadecatrienoyl)-3-O-[β-D-galactopyranosyl-(1'→6')-α-D-galactopyranosyl]-sn-glycerol; C. DGDG(C18∶3/C16∶0): 1-O-(9, 12, 15-亚麻酰基)-2-O-软脂酰基-3-O-[β-D-半乳糖基-α-D-半乳糖基]-sn-甘油1-O-(9Z, 12Z, 15Z-octadecatrienoyl)-2-O-hexadecanoyl-3-O-[β-D-galactopyranosyl-(1'→6')-α-D-galactopyranosyl]-sn-glycerol. |
由图 2可见: 随着甘油糖脂质量浓度的增加, 对自由基的清除能力也随之增加, 呈良好的量效关系。MGDG(C18∶3/C18∶3)、DGDG(C18∶3/C18∶3)和DGDG(C18∶3/C16∶0)对DPPH自由基最大清除率分别为63.06%、60.63%和30.36%, 对ABTS自由基最大清除率分别为85.10%、80.21%和72.36%。相同质量浓度下, MGDG(C18∶3/C18∶3)的清除能力明显高于其他单体。
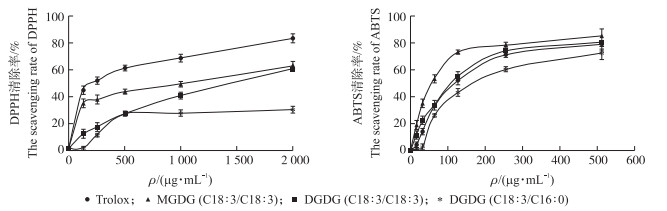
|
图 2 不同质量浓度甘油糖脂的DPPH和ABTS自由基清除率 Fig. 2 The scavenging rate of different concentrations of glycoglycerolipids on DPPH and ABTS |
如图 3所示: 随着甘油糖脂质量浓度的逐渐增加, 清除率逐渐增加直至趋于平缓, 在高质量浓度(2 000 μg·mL-1)下, MGDG(C18∶3/C18∶3)、DGDG(C18∶3/C18∶3)和DGDG(C18∶3/C16∶0)的·OH最大清除率分别为22.31%、19.01%和17.71%, 对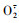
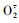

|
图 3 不同质量浓度甘油糖脂的羟自由基和超氧阴离子自由基清除率
Fig. 3 The scavenging rate of different concentrations of glycoglycerolipids on ·OH and 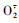 |
如图 4所示: 3种甘油糖脂均具有较强的还原能力, 且还原能力随着甘油糖脂质量浓度的增加而不断升高。同等质量浓度下, 不同分子结构甘油糖脂的还原能力也有所不同。当甘油糖脂为125~250 μg·mL-1时, MGDG的还原能力与DGDG差异显著(P < 0.05), 而不同脂肪酰基构成的DGDG之间的还原能力无显著差异(P>0.05);当甘油糖脂为500~2 000 μg·mL-1时, 3种甘油糖脂之间的还原能力差异显著。当甘油糖脂为2 000 μg·mL-1时, MGDG(C18∶3/C18∶3)、DGDG(C18∶3/C18∶3)和DGDG(C18∶3/C16∶0)的最大吸光值分别达到1.01、0.54和0.27, 由此可知, 还原能力最强的为MGDG(C18∶3/C18∶3), 但显著低于阳性对照Trolox。
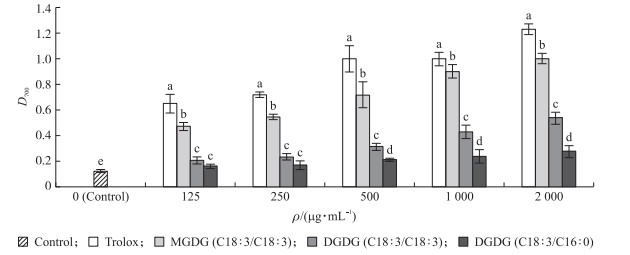
|
图 4 紫苏叶中不同质量浓度甘油糖脂的总还原力 Fig. 4 Total reducing power of different concentrations of glycoglycerolipids in perilla leaves 不同小写字母表示不同甘油糖脂间差异显著(P < 0.05)。下同。 Different lowercase letters above the bars represent the tested values are significantly different(P < 0.05)in different glycoglycerolipids. The same as follows. |
通过建立细胞氧化损伤模型考察甘油糖脂对抗氧化酶活性的影响, 进一步判断紫苏叶中甘油糖脂的抗氧化能力。如图 5所示: 与空白对照组相比, 脂多糖(LPS)诱导组明显降低了细胞的3种抗氧化酶活性。3种抗氧化酶活性随着甘油糖脂质量浓度的增加而提高, 并具有一定的质量浓度相关性。与LPS诱导组相比, 中质量浓度(500 μg·mL-1)和高质量浓度(1 000 μg·mL-1)的3种甘油糖脂均显著提高了细胞的抗氧化酶活性; 低质量浓度(10 μg·mL-1)中, MGDG(C18∶3/C18∶3)处理组的3种细胞抗氧化酶活性显著提高。低质量浓度DGDG(C18∶3/C18∶3)可以有效抵御由LPS诱导的细胞SOD活性的下降, 而对CAT及GSH-Px活性无显著提高作用; 低质量浓度DGDG(C18∶3/C16∶0)对由LPS诱导的细胞SOD及GSH-Px活性降低有显著改善作用, 但未能抵抗细胞氧化损伤所导致的CAT活性下降。相同质量浓度(500 μg·mL-1)的3种甘油糖脂对抗氧化酶活性的提升作用均显著低于Trolox, 其中MGDG(C18∶3/C18∶3)单体的活性最强。
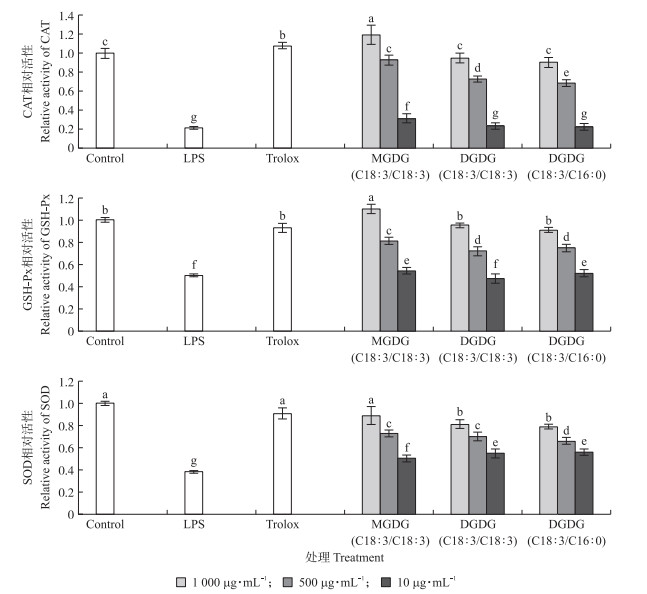
|
图 5 不同质量浓度甘油糖脂对抗氧化酶活性的影响 Fig. 5 Effects of different concentrations of glycoglycerolipids on antioxidant enzyme activity |
本研究中, 3种不同分子结构的甘油糖脂可以有效清除ABTS、DPPH、·OH和
由上述研究结果表明, 随着糖基数量的增加, 甘油糖脂的抗氧化活性减弱;而糖基数量一定时, 脂酰基为双亚麻酰基(C18∶3/C18∶3)的甘油糖脂的抗氧化活性大于脂酰基为亚麻酰基/软脂酰基(C18∶3/C16∶0)的甘油糖脂, 说明脂酰基及糖基数量对甘油糖脂类化合物的抗氧化活性影响比较大。Matsufuji等[12]分别研究了由1个半乳糖基和2个半乳糖基组成的甘油糖脂单体的抗氧化活性, 它们的脂酰基部分均为长链饱和脂肪酸, 结果发现2种糖脂单体均能保护细胞免受环境中氧自由基的入侵, 防止细胞因氧化损伤导致的细胞分化, 且单个半乳糖组成的甘油糖脂的抗氧化活性强于2个半乳糖组成的甘油糖脂单体, 本研究结果与之相一致。蒋志国[24]对南瓜中的6种甘油糖脂的抗氧化活性及构效关系进行研究, 发现6种不同糖基及脂酰基组成的糖脂单体均具有清除DPPH自由基的能力; 构效关系研究表明糖基构型(α, β构型)及脂酰基的不饱和度对抗氧化活性影响较大, 如果分子中仅存在α及β构型半乳糖, 糖基数量一定时, 脂酰基为亚麻酸(C18∶3)的甘油糖脂抗氧化活性强于脂酰基为亚油酸(C18∶2)的甘油糖脂, 本试验中不饱和度较高的DGDG(C18∶3/C18∶3)的抗氧化活性也高于不饱和度相对较低的DGDG(C18∶3/C16∶0)。另外, 研究人员也对甘油糖脂的抗病毒、免疫抑制及抗肿瘤等活性构效关系进行了研究, 例如Pongmuangmul等[25]对MGDG和DGDG的抗病毒作用进行研究后发现, 具有无细胞毒性作用的MGDG分子对病毒的半抑制浓度为36.00 μg·mL-1, 低于DGDG的半抑制浓度(43.20 μg·mL-1); Dai等[26]研究结果表明, 含有硬脂酰基(C18∶0)的硫酸奎诺酮甘油二酯(SQDG)的免疫抑制作用强于含有软脂酰基(C16∶0)的SQDG, 表明脂肪酰基碳链长度对甘油糖脂的抗氧化活性可能也具有一定的影响; Colombo等[18]对甘油糖脂抗肿瘤的构效关系进行研究, 发现影响甘油糖脂的抗肿瘤活性强弱的最关键因素在于脂酰基链的长度, 而与糖基种类及脂酰基位置的关系并不是很明显。由于本文中甘油糖脂的结构仅在糖基数量及脂肪酰基不饱和度上存在差异, 而甘油糖脂中糖基的种类、构型及脂酰基与甘油基团的连接位点是否对其抗氧化活性具有影响则有待后续进一步研究。
| [1] |
Ganesan K, Xu B J. A critical review on polyphenols and health benefits of black soybeans[J]. Nutrients, 2017, 9(5): E455. DOI:10.3390/nu9050455 |
| [2] |
Xu M H, Liang R, Li Y, et al. Anti-fatigue effects of dietary nucleotides in mice[J]. Food & Nutrition Research, 2017, 61(1): 1334485. |
| [3] |
Lassoued I, Mora L, Nasri R, et al. Characterization and comparative assessment of antioxidant and ACE inhibitory activities of thornback ray gelatin hydrolysates[J]. Journal of Functional Foods, 2015, 13: 225-238. DOI:10.1016/j.jff.2014.12.042 |
| [4] |
Galano A, León-Carmona J R, Alvarez-Idaboy J R. Influence of the environment on the protective effects of guaiacol derivatives against oxidative stress: mechanisms, kinetics, and relative antioxidant activity[J]. The Journal of Physical Chemistry B, 2012, 116(24): 7129-7137. DOI:10.1021/jp302810w |
| [5] |
Buonocore G, Perrone S, Tataranno M L. Oxygen toxicity: chemistry and biology of reactive oxygen species[J]. Seminars in Fetal and Neonatal Medicine, 2010, 15(4): 186-190. DOI:10.1016/j.siny.2010.04.003 |
| [6] |
谭美莲, 严明芳, 汪磊, 等. 国内外紫苏研究进展概述[J]. 中国油料作物学报, 2012, 34(2): 225-231. Tan M L, Yan M F, Wang L, et al. Research progress on Perilla frutescens[J]. Chinese Journal of Oil Crop Sciences, 2012, 34(2): 225-231 (in Chinese with English abstract). |
| [7] |
Arya E, Saha S, Saraf S A, et al. Effect of Perilla frutescens fixed oil on experimental esophagitis in albino Wistar rats[J]. BioMed Research International, 2013, 2013: 1-6. |
| [8] |
Sugawara T, Miyazawa T. Separation and determination of glycolipids from edible plant sources by high-performance liquid chromatography and evaporative light-scattering detection[J]. Lipids, 1999, 34(11): 1231-1237. DOI:10.1007/s11745-999-0476-3 |
| [9] |
Matsufuji M, Taguchi K, Inagaki M, et al. Glyceroglycolipids preventing tert-butylhydroperoxide-induced cell death from Microbacterium sp. and Corynebacterium aquaticum strains[J]. Journal of Bioscience and Bioengineering, 2000, 89(2): 170-175. DOI:10.1016/S1389-1723(00)88732-0 |
| [10] |
Matsufuji M, Nagamatsu Y, Yoshimoto A. Protective effects of bacterial glyceroglycolipid M874B against cell death caused by exposure to heat and hydrogen peroxide[J]. Journal of Bioscience and Bioengineering, 2000, 89(4): 345-349. DOI:10.1016/S1389-1723(00)88957-4 |
| [11] |
Nakata K. High resistance to oxygen radicals and heat is caused by a galactoglycerolipid in Microbacterium sp. M874[J]. Journal of Biochemistry, 2000, 127(5): 731-737. DOI:10.1093/oxfordjournals.jbchem.a022664 |
| [12] |
Matsufuji M, Nagamatsu Y, Yoshimoto A. Effects of bacterial glyceroglycolipid M874B on growth and TPA-induced differentiation of HL60 cells[J]. Bioscience, Biotechnology, and Biochemistry, 2000, 64(6): 1302-1304. DOI:10.1271/bbb.64.1302 |
| [13] |
Zi Y X, Yao M J, Lu Z X, et al. Glycoglycerolipids from the leaves of Perilla frutescens(L.) Britton(Labiatae) and their anti-inflammatory activities in lipopolysaccharide-stimulated RAW264.7 cells[J]. Phytochemistry, 2021, 184(10): 112679. |
| [14] |
Hanashima S, Mizushina Y, Ohta K, et al. Structure-activity relationship of a novel group of mammalian DNA polymerase inhibitors, synthetic sulfoquinovosylacylglycerols[J]. Japanese Journal of Cancer Research, 2000, 91(10): 1073-1083. DOI:10.1111/j.1349-7006.2000.tb00887.x |
| [15] |
Hanashima S, Mizushina Y, Yamazaki T, et al. Synthesis of sulfoquinovosylacylglycerols, inhibitors of eukaryotic DNA polymerase α and B[J]. Bioorganic & Medicinal Chemistry, 2001, 9(2): 367-376. |
| [16] |
Loya S, Reshef V, Mizrachi E, et al. The inhibition of the reverse transcriptase of HIV-1 by the natural sulfoglycolipids from cyanobacteria: contribution of different moieties to their high potency[J]. Journal of Natural Products, 1998, 61(7): 891-895. DOI:10.1021/np970585j |
| [17] |
Nagatsu A, Watanabe M, Ikemoto K, et al. Synthesis and structure-anti-tumor-promoting activity relationship of monogalactosyl diacylglycerols[J]. Bioorganic & Medicinal Chemistry Letters, 1994, 4(13): 1619-1622. |
| [18] |
Colombo D, Compostella F, Ronchetti F, et al. Inhibitory effects of monoacylated 2-O-β-galactosylglycerols on Epstein-Barr virus activation: the significant role of the hexanoyl chain[J]. Cancer Letters, 1999, 143(1): 1-4. DOI:10.1016/S0304-3835(99)00175-5 |
| [19] |
Colombo D, Compostella F, Ronchetti F, et al. Anti-tumor-promoting effects of glycoglycerolipid analogues on two-stage mouse skin carcinogenesis[J]. Cancer Letters, 2000, 161(2): 201-205. DOI:10.1016/S0304-3835(00)00610-8 |
| [20] |
Oliveira Neto J R, de Oliveira T S, Ghedini P C, et al. Antioxidant and vasodilatory activity of commercial beers[J]. Journal of Functional Foods, 2017, 34: 130-138. DOI:10.1016/j.jff.2017.04.019 |
| [21] |
Zheng L, Zhao Y J, Dong H Z, et al. Structure-activity relationship of antioxidant dipeptides: dominant role of Tyr, Trp, Cys and Met residues[J]. Journal of Functional Foods, 2016, 21: 485-496. DOI:10.1016/j.jff.2015.12.003 |
| [22] |
李慧. 基于NF-κB信号通路调控的黄酮类化合物抗炎活性及抗炎/抗氧化联运机制[D]. 武汉: 华中农业大学, 2019: 22-23. Li H. Anti-inflammation and anti-inflammatory/antioxidant linkage mechanism of flavonoids based on NF-κB signaling pathway[D]. Wuhan: Huazhong Agricultural University, 2019: 22-23(in Chinese with English abstract). |
| [23] |
Li X C. 2-phenyl-4, 4, 5, 5-tetramethylimidazoline-1-oxyl 3-oxide(PTIO·) radical scavenging: a new and simple antioxidant assay in vitro[J]. Journal of Agricultural and Food Chemistry, 2017, 65(30): 6288-6297. DOI:10.1021/acs.jafc.7b02247 |
| [24] |
蒋志国. 甘油糖脂的分离制备及生物活性研究[D]. 杭州: 浙江工商大学, 2010: 119-120. Jiang Z G. The separation, preparation and biological activity of glyceroglycolipids[D]. Hangzhou: Zhejiang Gongshang University, 2010: 119-120(in Chinese with English abstract). |
| [25] |
Pongmuangmul S, Phumiamorn S, Sanguansermsri P, et al. Anti-herpes simplex virus activities of monogalactosyl diglyceride and digalactosyl diglyceride from Clinacanthus nutans, a traditional Thai herbal medicine[J]. Asian Pacific Journal of Tropical Biomedicine, 2016, 6(3): 192-197. DOI:10.1016/j.apjtb.2015.12.014 |
| [26] |
Dai J Q, Zhu Q X, Zhao C Y, et al. Glyceroglycolipids from Serratula strangulata[J]. Phytochemistry, 2001, 58(8): 1305-1309. DOI:10.1016/S0031-9422(01)00308-9 |




