文章信息
- 王智博, 姚晓磊, 张红琳, 张艳丽
- WANG Zhibo, YAO Xiaolei, ZHANG Honglin, ZHANG Yanli
- 不同产羔数和发情时期湖羊代谢产物及肠道菌群结构的差异分析研究
- Changes of rectal contents microbiota and their metabolites associated with prolificacy and estrus cycle in Hu sheep
- 南京农业大学学报, 2021, 44(3): 548-553
- Journal of Nanjing Agricultural University, 2021, 44(3): 548-553.
- http://dx.doi.org/10.7685/jnau.202003019
-
文章历史
- 收稿日期: 2020-03-09
2. 南京晓庄学院食品科学学院, 江苏 南京 211171
2. School of Food Science, Nanjing Xiaozhuang University, Nanjing 211171, China
动物胃肠道微生物区系平衡直接关系宿主(动物)的健康状况和生产性能, 当外界环境、日粮或应激状态改变时, 微生物区系平衡会受到冲击, 进而影响机体生理状态[1-3]。有报道, 肠道微生物与机体内生殖激素的浓度有关[4-5], 其中肠道菌群结构的变化是调节机体雌激素水平的重要方式[6]。人类医学研究也表明, 肠道微生物会参与调节机体雌激素的代谢和卵巢发育。Kritas等[7]报道在日粮中添加益生菌后可以缩短母猪的繁殖周期。唐义梅[8]通过对梅山猪进行粪菌移植, 发现肠道微生物可以提早母猪初情日龄, 影响发情周期激素水平, 促进卵泡发育。这些已有的研究提示: 肠道微生物结构与动物繁殖力可能存在一定的相关性。繁殖性能作为动物重要的生产性能指标, 也可能与肠道微生物息息相关[7]。然而, 目前关于肠道微生物的研究主要集中在动物营养、免疫和生理等方面, 而有关肠道菌群与繁殖性能之间的相关研究很少。
湖羊作为我国特有的高繁殖力绵羊品种, 产羔率达220%以上。排卵率和产羔数是高繁殖性能绵羊的重要经济性状, 而繁殖作为一个复杂的生理过程, 其是否与肠道微生物存在相关性尚未见报道。此外, 乙酸、丙酸、丁酸和异戊酸等挥发性脂肪酸(volatile fatty acid, VFA)是消化道内生物代谢的产物, 其浓度对动物的肠道健康具有影响[9]。因此, 本试验首次尝试以单、多羔湖羊为研究对象, 分别在发情前(撤栓时)和发情时2个阶段采集粪样, 测定其VFA浓度, 并进行高通量测序分析, 探究不同繁殖力、不同发情时期湖羊的肠道菌群及VFA变化规律, 为利用肠道微生物调控母羊繁殖性能提供理论依据和新的思路。
1 材料与方法 1.1 试验动物及处理试验在泰州海伦国家级湖羊种羊场进行, 依据生产记录选取体重40~50 kg, 年龄2~3岁, 连续三胎产三羔(高繁组, high prolificacy, HP组)和产单羔(低繁组, low prolificacy, LP组)的健康空怀母羊12只, 进行检疫消毒驱虫防疫。试验羊舍通风良好, 自然光照, 试验前用消毒剂对羊舍地面、墙壁和羊栏等进行彻底消毒, 预饲期间对试验羊进行健康检查、驱虫和健胃。试验羊采用分栏饲养, 试验开始第1天对试验羊进行放栓处理, 同时注射氯前列烯醇, 11 d后撤栓, 注射氯前列烯醇, 次日用试情公羊开始试情(早晨、中午、傍晚各1次), 母羊接受公羊爬跨视为发情。
每只羊采集5粒直肠内容物(在落地污染前用20 mL固定管直接从羊肛门中取出), 分别在撤栓时和发情时采集, 采集后样品于-80 ℃保存。具体试验设计见表 1。
| 发情期 Estrus stage |
低繁组 Low prolificacy(LP) |
高繁组 High prolificacy(HP) |
| 发情前Before estrus | LP1 | HP1 |
| 发情时During estrus | LP2 | HP2 |
参照刘文涛等[10]的方法, 其中气相色谱仪测定改为采用毛细吸管柱, 柱温120 ℃, 汽化温度180 ℃, 采用氢离子火焰检测器, 检测温度180 ℃, 载气为氦气, 压力60 kPa, 氢气压力50 kPa。
1.2.2 生物信息学分析将样品送至百迈客生物科技有限公司的Illumina MiSeq平台进行高通量测序。利用双末端测序的方法, 构建小片段文库进行测序。通过对reads拼接过滤, 进行操作分类单元(operational taxonomic units, OTU)聚类和物种分类分析, 并将序列相似度≥97%聚类同一OTU。同时使用Mothur(v.1.30)软件, 对样品α多样性指数进行评估, 得到稀释度曲线, 香农指数(Shannon)、CHAO、ACE和Simpon指数用来评估样品的测序深度、菌群多样性。使用QIIME软件进行β多样性分析, 得到β距离箱线图, 并进行UPGMA(unweighted pair-group method with arithmetic mean)分析和主坐标分析(principal coordinates analysis, PCoA)。
1.3 数据处理VFA含量及测序数据用Excel 2019进行初步整理, 采用SPSS 25.0软件进行统计分析, 结果数据均以“平均数±标准差(x±SD)”表示, 差异显著水平设为0.05。
2 结果与分析 2.1 单羔和多羔湖羊直肠内容物中VFA含量的差异分析各组直肠内容物中VFA水平如表 2所示。发情前, 各组直肠内容物中丙酸、丁酸、异戊酸含量均无显著差异(P>0.05), 但LP组直肠内容物中乙酸含量显著低于HP组(P < 0.05)。发情时各组直肠内容物中乙酸、丙酸、丁酸及异戊酸含量均无显著差异(P>0.05)。对于LP组湖羊, 发情时直肠内容物中丙酸及丁酸含量显著高于发情前(P < 0.05)。发情时, HP组乙酸、丙酸及丁酸含量较发情前显著提高(P < 0.05), 但异戊酸含量在各组间差异不显著(P>0.05)。
| 组别 Group |
乙酸 Acetic Acid |
丙酸 Propionic acid |
丁酸 Butyric acid |
异戊酸 Isovaleric acid |
| LP1 | 6.08±0.51a | 4.02±0.22A | 1.27±0.23A | 0.86±0.15 |
| HP1 | 8.81±1.11bA | 5.56±1.08A | 1.81±0.61A | 0.90±0.24 |
| LP2 | 14.51±2.80 | 10.92±3.70B | 2.91±0.27B | 0.84±0.14 |
| HP2 | 18.78±4.74B | 9.94±2.72B | 2.50±0.15B | 0.84±0.24 |
| 注: 不同字母表示差异显著(P < 0.05), 小写字母为相同时期不同繁殖力间的比较, 大写字母为相同繁殖力不同发情时期的比较。 Note: Different letters indicate significant difference(P < 0.05), lowercase letters are the comparison of different prolificacy in the same period, and uppercase letters are the caparison of the same prolificacy in the different eatrus periods. | ||||
如图 1所示: 测序共获得OUT 928条, 通过微生物α多样性分析发现各组等级丰度曲线、稀释性曲线和香农指数均逐渐趋于平缓, 说明样品的测序深度已满足试验要求。通过计算Shannon、CHAO、Simpson和ACE指数, 不同发情时期及不同产羔数对肠道菌群构成有一定的影响。
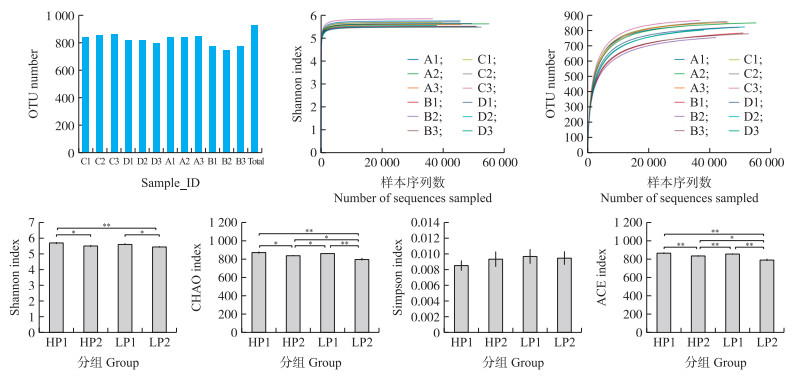
|
图 1 不同繁殖力及发情期对湖羊肠道微生物菌群多样性指数的影响 Fig. 1 Effect of protificacy and estrus stage on intestinal microflora diversity index of Hu sheep *P < 0.05, **P < 0.01. |
测序结果表明, 在门水平共测得15种菌群, 属水平上发现172个。湖羊直肠内容物中主要菌群构成为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和变形菌门(Proteobacteria)。微生物菌群门水平分析表明(图 2-A, 表 3), HP组和LP组湖羊发情时, 直肠内容物中厚壁菌门和蓝藻门菌群的比例均低于发情前, 而拟杆菌门占比则均有所上升, 且厚壁菌门和拟杆菌门与未发情组存在显著差异。为进一分析样品菌群的差异, 本研究又进行了属水平的分析(图 2-B, 表 4)。结果显示, 湖羊发情后, LP2组和HP2组的[Eubacterium]_coprostanoligenes_group和Akkermansia丰度均显著下降(P < 0.05), Rikenellaceae_RC9_gut_group和拟杆菌属(Bacteroides)丰度显著提高(P < 0.05)。
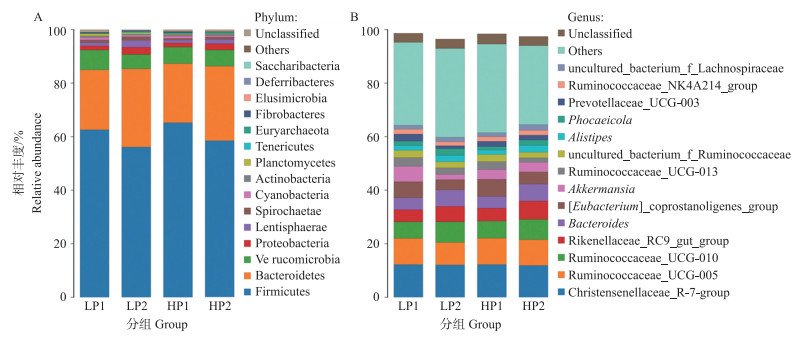
|
图 2 不同发情期和繁殖力湖羊肠道微生物区系中门(A)和属(B)水平的相对丰度差异 Fig. 2 Relative abundance of phylum(A)and genus(B)of gut microflora of Hu sheep with different estrou periods and fecundity |
| 门Phylum | 丰度/% Abundance | P值P-value | |||||||
| LP1 | LP2 | HP1 | HP2 | LP | HP | 发情前 | 发情时 | ||
| Firmicutes | 62.45 | 56.19 | 65.97 | 58.34 | 0.10 | 0.01 | 0.21 | 0.41 | |
| Bacteroidetes | 22.39 | 28.85 | 22.15 | 27.95 | 0.16 | 0.00 | 0.79 | 0.79 | |
| Verrucomicrobia | 7.46 | 5.57 | 6.26 | 5.88 | 0.34 | 0.81 | 0.35 | 0.88 | |
| Proteobacteria | 1.53 | 2.66 | 1.52 | 2.42 | 0.14 | 0.46 | 0.99 | 0.83 | |
| Lentisphaerae | 1.23 | 2.63 | 1.01 | 1.74 | 0.09 | 0.30 | 0.37 | 0.36 | |
| Cyanobacteria | 0.99 | 0.59 | 0.89 | 0.49 | 0.32 | 0.84 | 0.67 | 0.77 | |
| Spirochaetae | 1.04 | 1.37 | 0.65 | 0.94 | 0.67 | 0.13 | 0.20 | 0.60 | |
| Planctomycetes | 0.85 | 0.60 | 0.29 | 0.18 | 0.54 | 0.30 | 0.07 | 0.33 | |
| Actinobacteria | 0.50 | 0.28 | 0.56 | 0.55 | 0.07 | 0.94 | 0.49 | 0.19 | |
| Tenericutes | 0.21 | 0.60 | 0.20 | 0.21 | 0.34 | 0.94 | 0.51 | 0.36 | |
| 属Genus | 丰度/% Abundance | P值P-value | |||||||
| LP1 | LP2 | HP1 | HP2 | LP | HP | 发情前 | 发情时 | ||
| Christensenellaceae_R-7_group | 12.09 | 12.12 | 12.04 | 11.70 | 0.99 | 0.86 | 0.98 | 0.72 | |
| Ruminococcaceae_UCG-005 | 9.79 | 8.37 | 9.88 | 9.58 | 0.46 | 0.71 | 0.91 | 0.53 | |
| Ruminococcaceae_UCG-010 | 6.14 | 7.62 | 6.42 | 7.88 | 0.48 | 0.43 | 0.67 | 0.92 | |
| Rikenellaceae_RC9_gut_group | 4.55 | 5.76 | 4.83 | 6.83 | 0.06 | 0.03 | 0.45 | 0.19 | |
| [Eubacterium]_coprostanoligenes_group | 6.02 | 3.83 | 6.40 | 4.56 | 0.05 | 0.01 | 0.52 | 0.35 | |
| Bacteroides | 4.47 | 6.13 | 4.36 | 7.61 | 0.01 | 0.02 | 0.82 | 0.97 | |
| Akkermansia | 5.85 | 2.03 | 3.71 | 2.06 | 0.01 | 0.02 | 0.15 | 0.39 | |
| Ruminococcaceae_UCG-013 | 3.21 | 2.39 | 3.03 | 1.67 | 0.25 | 0.02 | 0.80 | 0.04 | |
| uncultured_bacterium_f_Ruminococcaceae | 2.73 | 2.29 | 2.58 | 2.14 | 0.22 | 0.07 | 0.62 | 0.54 | |
| Alistipes | 1.85 | 2.35 | 1.70 | 2.56 | 0.42 | 0.01 | 0.62 | 0.71 | |
| Prevotellaceae_UCG-003 | 2.58 | 1.01 | 1.91 | 1.80 | 0.08 | 0.80 | 0.37 | 0.13 | |
| Phocaeicola | 1.72 | 2.47 | 1.36 | 2.02 | 0.41 | 0.17 | 0.39 | 0.62 | |
| uncultured_bacterium_f_Lachnospiraceae | 1.42 | 1.63 | 1.49 | 2.10 | 0.75 | 0.25 | 0.71 | 0.55 | |
基于Weighted UniFrac距离的组间β多样性分析表明: 与发情前相比, HP组和LP组湖羊在发情时微生物群落构成差异均极显著(P < 0.01);与LP2组相比, HP2组的菌群结构也有显著差异(P < 0.05)(图 3-A)。基于Weighted UniFrac的UPGMA聚类树显示: 样品菌群基于是否发情大致聚集成2类, LP1组和HP1组间距离较近, 而LP2组和HP2组则距离较远(图 3-B), 证明发情期对肠道菌群具有较大的影响。用PCoA分析肠道微生物菌群结构变化, 发现HP2组和LP2组呈现区域性聚集, HP1组和LP1组所处区域距离较远(图 3-C), 与UPGMA结果一致。证明繁殖力和发情期对肠道菌群均具有较大的影响。

|
图 3 发情周期对胡羊母羊肠道微生物多样性组成的影响 Fig. 3 Effect of estrous cycle on microbial diversity in the intestine of Hu sheep A. 基于β多样性箱型图β diversity box plot; B. UPGMA聚类树UPGMA clustering tree; C. 多样本主坐标分析(n=3)Multi-sample principal coordinate analysis(PCoA). |
动物生殖与肠道微生物关系密切, 越来越多的研究发现, 肠道中栖息着庞杂繁多的微生物菌群, 发挥着动物第二“大脑”的作用, 不仅调控着宿主营养吸收、能量供应和疾病的发生与发展, 而且影响着动物的情绪、行为、生理状态等, 其肠道菌群与动物生殖生理密切相关[11-14], 可能会影响到动物的繁殖性能。饮食诱导的代谢紊乱绵羊模型中, 肠道菌群失调与胆汁酸水平降低影响脂溶性维生素A在肠-睾轴的运输, 睾丸中维生素A缺乏导致精子发生异常[15]。肠道微生物可以通过代谢生物体内雌激素以调控雌激素功能活性[4]。湖羊因其多胎性能而倍受关注, 在繁殖、营养、生理等方面已有较多研究[16-17], 但有关其繁殖性能与肠道菌群结构的相关性研究未见报道。本研究结果显示, 不同繁殖力湖羊的肠道微生物存在差异, 提示肠道微生物对动物的繁殖力有一定影响。研究表明机体雌激素的代谢与肠道菌群有关[6, 18-19]。据此推测微生物可能通过影响激素代谢进而影响动物繁殖力, 但是具体机制尚需进一步研究。
本试验结果显示, 在门水平上, 湖羊发情时, 厚壁菌门和蓝藻菌门丰度会显著降低; 在属水平上, 湖羊发情后, 高繁组和低繁组中Ruminococcaceae-UGG-013丰度均显著下降, Rikenellaceae_RC9_gut_group和拟杆菌属Bacteroides丰度显著提高。另外, 雌激素也会影响肠道菌群中Ruminococcaceae科的丰度[20]; Kwa研究发现, Bacteroides和Ruminococcaceae参与人体雌激素代谢[5]。而雌激素与动物的生殖系统发育以及发情周期的调控密切相关[21-22]。本试验基于UPGMA聚类树和PCoA结果可以看出, 发情时, 高繁组和低繁组湖羊直肠菌群结构差异明显, 提示湖羊繁殖力的高低与菌群结构可能存在一定关联。
VFA作为肠道微生物的代谢产物, 对动物发情周期有影响。田鼠发情会改变其胃肠道中VFA含量[23]; 动物肠道中VFA含量与直肠内容物总菌数、肠杆菌数、乳酸杆菌数有关, 妊娠动物直肠内容物中VFA与对照组差异显著时, 肠道菌群也差异显著[24]。本研究中, 在低繁组和高繁组中, 未发情时丙酸及丁酸含量均显著低于发情组; 在高繁组中, 未发情时直肠内容物中乙酸含量显著低于发情组。由于乙酸及丙酸是肠道菌群主要的代谢产物, 这同样说明不同发情时期湖羊的肠道菌群结构呈现不同变化。
总之, 本试验通过VFA含量的测定和对菌群结构分析, 发现不同繁殖力和发情时期的湖羊在肠道菌群结构上均存在差异。表明湖羊繁殖性能与肠道微生物变化可能存在一定的相关性, 但具体的调控机制还有待进一步研究。本试验结果为利用肠道微生物调控母羊繁殖性提供了理论依据和新思路。
| [1] |
Andreas K. 影响猪的肠道菌群的日粮营养策略[J]. 中国畜牧兽医, 2006, 33(4): 63-65. AndreasK. Dietary nutrition strategies affecting pig intestinal flora[J]. China Animal Husbandry & Veterinary Medicine, 2006, 33(4): 63-65 (in Chinese). |
| [2] |
赵桂英, 杨亮宇, 段纲, 等. 断奶仔猪胃肠道正常菌群的数量和分区[J]. 黑龙江畜牧兽医, 2003(9): 26-27. Zhao G Y, Yang L Y, Duan G, et al. Number and division of normal bacterial flora in weaning piglets[J]. Heilongjiang Journal of Animal Science and Veterinary Medicine, 2003(9): 26-27 (in Chinese). |
| [3] |
Hang S Q, Zhu W Y. Gut bacterial and lactobacilli communities of weaning piglets in response to mannan oligosaccharide and sugar beet pulp in vitro fermentation[J]. Journal of Integrative Agriculture, 2012, 11(1): 122-133. DOI:10.1016/S1671-2927(12)60790-1 |
| [4] |
Kwa M, Plottel C S, Blaser M J, et al. The intestinal microbiome and estrogen receptor-positive female breast cancer[J]. JNCI: Journal of the National Cancer Institute, 2016, 108(8): djw029. |
| [5] |
Moreno-Indias I, Sánchez-Alcoholado L, Sánchez-Garrido Má, et al. Neonatal androgen exposure causes persistent gut microbiota dysbiosis related to metabolic disease in adult female rats[J]. Endocrinology, 2016, 157(12): 4888-4898. DOI:10.1210/en.2016-1317 |
| [6] |
Baker J M, Al-Nakkash L, Herbst-Kralovetz M M. Estrogen-gut microbiome axis: physiological and clinical implications[J]. Maturitas, 2017, 103: 45-53. DOI:10.1016/j.maturitas.2017.06.025 |
| [7] |
Kritas S K, Marubashi T, Filioussis G, et al. Reproductive performance of sows was improved by administration of a sporing bacillary probiotic(Bacillus subtilis C-3102)[J]. Journal of Animal Science, 2015, 93(1): 405-413. DOI:10.2527/jas.2014-7651 |
| [8] |
唐义梅. 梅山猪粪便微生物移植对长×大后备母猪卵泡发育的影响[D]. 武汉: 华中农业大学, 2019. Tang Y M. Effect of fecal microbiota transplantation of Meishanpig on follicle development in Landrace×Yorkshire gilts[D]. Wuhan: Huazhong Agricultural University, 2019(in Chinese with English abstract). |
| [9] |
Yu L, Williams B A, Tamminga S, et al. In vitro fermentation kinetics of some non-digestible carbohydrates by the caecal microbial community of broilers[J]. Animal Feed Science and Technology, 2005, 123/124: 687-702. DOI:10.1016/j.anifeedsci.2005.04.027 |
| [10] |
刘文涛, 李晓斌, 臧长江, 等. 饲喂不同结构性与非结构性碳水化合物比例日粮对绵羊瘤胃发酵参数的影响[J]. 饲料工业, 2019, 40(24): 18-24. Liu W T, Li X B, Zang C J, et al. Effects of dietary diets with different ratios of structural and non-structural carbohydrates on rumen fermentation parameters in sheep[J]. Feed Industry, 2019, 40(24): 18-24 (in Chinese with English abstract). |
| [11] |
Olszak T, An D, Zeissig S, et al. Microbial exposure during early life has persistent effects on natural killer T cell function[J]. Science, 2012, 336(6080): 489-93. DOI:10.1126/science.1219328 |
| [12] |
Su Y, Yao W, Perez-Gutierrez O N, et al. 16S ribosomal RNA-based methods to monitor changes in the hindgut bacterial community of piglets after oral administration of Lactobacillus sobrius S1[J]. Anaerobe, 2008, 14(2): 78-86. DOI:10.1016/j.anaerobe.2007.12.004 |
| [13] |
王欢, 杨密, 蒲广, 等. 日粮纤维水平对苏淮猪直肠中氮、磷含量及结肠菌群数量的影响[J]. 畜牧与兽医, 2020, 52(6): 45-49. Wang H, Yang M, Pu G, et al. Effects of fiber levels in diet on rectal nitrogen and phosphorus contents and colonic bacteria number in Suhuaipigs[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(6): 45-49 (in Chinese with English abstract). |
| [14] |
韦玥瑞, 杨硕, 王月, 等. 季节对内蒙古白绒山羊瘤胃甲烷产生量及相关微生物数量的影响[J]. 畜牧与兽医, 2020, 52(4): 24-30. Wei Y R, Yang S, Wang Y, et al. Effects of seasons on methane production and related microbial quantity in the rumen of Inner Mongolia White Cashmere goats[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(4): 24-30 (in Chinese with English abstract). |
| [15] |
Ding N, Zhang X, Zhang X D, et al. Impairment of spermatogenesis and sperm motility by the high-fat diet-induced dysbiosis of gut microbes[J]. Gut, 2020, 69(9): 1608-1619. DOI:10.1136/gutjnl-2019-319127 |
| [16] |
Gao X X, Yao X L, Yang H, et al. Role of FGF9 in sheep testis steroidogenesis during sexual maturation[J]. Animal Reproduction Science, 2018, 197: 177-184. DOI:10.1016/j.anireprosci.2018.08.026 |
| [17] |
Zhou J W, Ji K X, Liu H, et al. Effect of air temperature on growth performance, apparent digestibilities, rumen fermentation and serum metabolites in Altay and Hu lambs[J]. Journal of Animal Physiology and Animal Nutrition, 2020, 104(4): 1024-1033. DOI:10.1111/jpn.13318 |
| [18] |
李宗凯, 陆扬, 刘家俊, 等. 益生菌对生长育肥猪生长性能、肉品质和结肠菌群的影响[J]. 南京农业大学学报, 2020, 43(3): 523-528. Li Z K, Lu Y, Liu J J, et al. Effects of probiotics on the growth performance, meat quality and colonic microflora of growing and finishingpigs[J]. Journal of Nanjing Agricultural University, 2020, 43(3): 523-528 (in Chinese with English abstract). DOI:10.7685/jnau.201906025 |
| [19] |
Ervin S M, Li H, Lim L, et al. Gut microbial β-glucuronidases reactivate estrogens as components of the estrobolome that reactivate estrogens[J]. Journal of Biological Chemistry, 2019, 294(49): 18586-18599. DOI:10.1074/jbc.RA119.010950 |
| [20] |
Acharya K D, Gao X, Bless E P, et al. Estradiol and high fat diet associate with changes in gut microbiota in female ob/obmice[J]. Scientific Reports, 2019, 9: 20192. DOI:10.1038/s41598-019-56723-1 |
| [21] |
Kaczynski P, Bauersachs S, Baryla M, et al. Estradiol-17β-induced changes in the porcine endometrial transcriptome in vivo[J]. International Journal of Molecular Sciences, 2020, 21(3): 890. DOI:10.3390/ijms21030890 |
| [22] |
张金璧, 林飞, 潘增祥, 等. 猪不同程度闭锁卵泡判定方法的比较研究[J]. 南京农业大学学报, 2013, 36(1): 115-119. Zhang J B, Lin F, Pan Z X, et al. Comparative study of methods to determine the follicular atresia extent in pigs[J]. Journal of Nanjing Agricultural University, 2013, 36(1): 115-119 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2013.01.020 |
| [23] |
Kudo H, Oki Y. Microtus species as new herbivorous laboratory animals: Reproduction; Bacterial flora and fermentation in the digestive tracts; And nutritional physiology[J]. Veterinary Research Communications, 1984, 8(1): 77-91. DOI:10.1007/BF02214700 |
| [24] |
邹冰洁. 粗纤维对母猪产仔性能的影响[D]. 南京: 南京农业大学, 2014. Zou B J. Effects of dietary fiber on the farrowing performance of sows[D]. Nanjing: Nanjing Agricultural University, 2014(in Chinese with English abstract). |




