文章信息
- 冯丹, 张民扬, 田时祎, 汪晶, 朱伟云
- FENG Dan, ZHANG Minyang, TIAN Shiyi, WANG Jing, ZHU Weiyun
- 日粮添加壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠形态结构及屏障功能的影响
- The effects of dietary supplementation with chitosan-chelated zinc on the ileal morphology and barrier function in weaned rats challenged with Escherichia coli
- 南京农业大学学报, 2021, 44(3): 541-547
- Journal of Nanjing Agricultural University, 2021, 44(3): 541-547.
- http://dx.doi.org/10.7685/jnau.202002024
-
文章历史
- 收稿日期: 2020-02-22
肠黏膜上皮屏障是肠道抵御病原微生物和有害物质侵入机体的第一道防线, 主要由肠上皮细胞和黏液层组成[1-2]。肠上皮细胞间通过紧密连接形成一个完整的物理屏障, 抵御各类细菌性肠道病原体[3]。然而, 幼龄动物肠道上皮屏障尚未发育完善, 对外界的抵抗能力较低, 容易遭受病原微生物感染。锌作为动物所必需的微量元素, 参与机体许多生物功能, 如促进生长、免疫和氧化应激等, 在营养代谢和生长发育过程中起着重要作用[4]。而生产中添加高剂量无机锌(主要是硫酸锌、氧化锌)会引起锌源浪费和环境污染, 影响动物和人类健康。因此, 开发新型安全锌源是微量元素营养研究的热点之一。
壳聚糖与无机锌的螯合物壳聚糖螯合锌(CS-Zn)是本课题组前期自制的一种新型锌制剂。壳聚糖因其无毒和良好的生物黏附性和生物活性, 被广泛应用于医学、化工、食品等领域[5-6]。已有报道, 壳聚糖螯合锌可以提高断奶仔猪生长性能, 降低腹泻率, 改善肠道微生物及肠道黏膜形态[7-10], 但目前对于壳聚糖螯合锌对炎症反应调控作用的研究较少。本文旨在研究壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠黏膜上皮屏障的影响, 并阐述其潜在抗炎机制, 为研究壳聚糖螯合锌对幼龄动物肠道健康的调控作用提供理论依据。
1 材料与方法 1.1 试验材料硫酸锌(ZnSO4·7H2O), 分析纯。壳聚糖螯合锌纳米颗粒由本课题组研制(已申请发明专利)。试验攻毒用菌种大肠杆菌(E.coli)O157:H7在液体LB(Luria-Bertani)培养基中220 r·min-1、37 ℃振荡培养12 h复苏, 在麦康凯琼脂培养基上划线37 ℃培养18 h, 挑取单个菌落进行E.coli单克隆培养, 制备菌悬液并采用平板活菌计数法计算菌液浓度, 并使用液体LB培养基调整菌液浓度为1×1010 CFU·mL-1。
1.2 试验动物及设计试验选用无特定病原体(SPF)级SD断奶大鼠48只(雌、雄各半), 平均体重(55.65±2.18)g, 购自南京市青龙山动物繁殖场。经过3 d的适应期后, 根据体重及性别将大鼠随机分为空白对照组(N-CON)、攻毒对照组(CON)、硫酸锌组(ZnSO4)和壳聚糖螯合锌组(CS-Zn)4组, 每组12只大鼠(雌、雄各半)。试验开始空白对照组和攻毒对照组大鼠饲喂基础日粮; 硫酸锌组大鼠饲喂添加含50 mg·kg-1锌的硫酸锌日粮; 螯合锌组大鼠饲喂添加640 mg·kg-1壳聚糖螯合锌颗粒(含锌50 mg·kg-1)的日粮。试验期14 d。试验第9~12天, 攻毒对照组、硫酸锌组和壳聚糖螯合锌组每天灌胃4 mL总菌数量为1×1010 CFU·mL-1的大肠杆菌菌悬液, 空白对照组灌胃等体积的无菌培养基溶液, 连续灌胃3 d。再经2 d的观察期后, 乙醚致晕大鼠, 屠宰全部大鼠。饲养试验在南京农业大学实验动物中心进行, 单笼饲养, 温度维持在25 ℃, 相对湿度70%, 12 h/12 h光暗周期, 自由采食和饮水。
1.3 测定指标和方法 1.3.1 样品采集试验结束当天, 屠宰大鼠后立即采集回肠中段组织放入预先配制好的体积分数为4%多聚甲醛溶液中固定, 用于观察肠道形态变化; 采集回肠黏膜保存于液氮中, 用于测定相关基因和蛋白的表达; 采集回肠食糜保存于-20 ℃, 用于菌群定量分析。
1.3.2 回肠黏膜形态的观察按常规方法对回肠中段组织制作石蜡切片并HE染色, 利用Image-Pro Plus图像分析系统对绒毛高度和隐窝深度进行测量。每张切片中至少选取6个视野进行计量观察并拍照。
1.3.3 回肠黏膜MPO活性的测定用髓过氧化物酶(MPO)试剂盒(南京建成生物研究所)检测攻毒后大鼠回肠黏膜MPO活性。
1.3.4 回肠黏膜基因表达量的测定参照刘壮等[11]的方法提取回肠黏膜总RNA, 置于-80 ℃保存备用。使用Nano-Drop微量分光光度计(Thermo Fisher Scientific, 美国)测定RNA浓度, 然后稀释至1 g·L-1, 用反转录试剂盒(Vazyme, 中国)反转录成cDNA。利用StepOne-Plus定量PCR仪及StepOne软件(Applied Biosystems, 美国)进行实时荧光定量PCR(qPCR)。qPCR反应体系(20 μL): 10 μL SYBR qPCR Master Mix, 0.4 μL上游引物, 0.4 μL下游引物, 0.4 μL ROX Reference Dye(50×), 2 μL cDNA和6.8 μL ddH2O。反应条件: 95 ℃ 30 s; 95 ℃ 10 s, 60 ℃ 30 s, 共40个循环。熔解曲线测定程序: 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。主要测定肠道屏障相关基因(ZO-1、Occludin、Claudin-1)和细胞因子相关基因(TLR-4、MyD88、IRAK1、TRAF6)mRNA的表达量。使用2-ΔΔCT方法计算目的基因的相对表达量。所用引物序列见表 1。
| 目的基因 Target gene name |
引物序列 Primer pairs sequence(5′→3′) |
产物长度/bp Product length |
登录号 GenBank accession No. |
| ZO-1 | CTGAGCCCCCTAGTGATGTG/TCACAGTGTGGCAAGCGTAG | 77 | XM_017588934.1 |
| Occludin | GGATTGAGCCCGAGTGGAAAG/AAGGACTTCCCAGAGTGCAGA | 90 | NM_031329.2 |
| Claudin-1 | AAACTCCGCTTTCTGCACCT/GTGCTGACGATAGAGCCGAT | 118 | NM_031699.2 |
| TLR-4 | AGGCAGCAGGTCGAATTGTA/AGAAGATGTGCCTCCCCAGA | 85 | NM_019178.1 |
| MyD88 | TCGACGCCTTCATCTGCTAC/CCATGCGACGACACCTTTTC | 177 | XM_006244087.3 |
| IRAK1 | CTCCTCCATCAAGCCAAGCC/CACACCCAAAACCACCCTCT | 149 | NM_001127555.1 |
| TRAF6 | CGCCAAAATGGAAACGCAGA/TGCTTCCATCTCGGCAACTT | 88 | NM_001107754.2 |
| β-actin | GGTGTGATGGTGGGTATGGG/CAGTTGGTGACAATGCCGTG | 113 | NM_031144.3 |
| 注: ZO-1: 闭锁小带蛋白1基因Zonula occludens 1 gene; Occludin: 闭锁蛋白基因Occludin gene; Claudin-1; 紧密连接蛋白1基因Claudin-1 gene; TLR-4: Toll样受体4基因Toll-like receptor 4 gene; MyD88: 髓样分化因子基因Myeloid differentiation factor 88 gene; IRAK1: 白细胞介素1受体相关激酶基因IL-1 receptor associated kinase 1 gene; TRAF6: 肿瘤坏死因子受体相关蛋白6基因Tumor necrosis factor receptor-associated factor 6 gene; β-actin : β肌动蛋白基因β-actin gene. | |||
取回肠组织加入蛋白裂解液提取回肠总蛋白, 肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、白细胞介素10(IL-10)的浓度采用南京建成生物研究所ELISA试剂盒测定。
1.3.6 回肠黏膜紧密连接蛋白和TLR-4的Western blot检测取回肠组织加入蛋白裂解液和蛋白酶抑制剂或磷酸酶抑制剂提取回肠黏膜总蛋白, 使用BCA蛋白浓度测定试剂盒(Solarbio, 中国)测定蛋白浓度。按照5×上样缓冲液制备上样蛋白质样品。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)胶, 每孔加入30 μg蛋白样品进行电泳分离后, 用聚偏氟乙烯(PVDF)膜冰水转膜, 再室温下用TBST封闭1 h, 加一抗, 4 ℃摇床上过夜。经过3次洗膜后加入二抗室温孵育1 h, 使用化学发光剂ECL显影并于AlphaImager 2200(Alpha Innotech, 美国)系统中进行曝光、拍照。利用Image J软件分析蛋白条带灰度值。
1.3.7 回肠食糜菌群荧光定量PCR参照田时祎等[12]的方法, 对回肠食糜中总菌、乳酸杆菌和大肠杆菌进行荧光定量PCR。16S rRNA引物序列如下: 总菌, 5′-GTGSTGCAYGGYYGTCGTCA-3′/5′-ACGTCRTCCMCNCCTTCCTC-3′; 乳酸杆菌(Lactobacillus), 5′-AGCAGTAGGGAATCTTCCA-3′/5′-ATTCCACCGCTACACATG-3′; 大肠杆菌(E.coli), 5′-CATGCCGCGTGTATGAAGAA-3′/5′-CGGGTAACGTCAATGAGCAAA-3′。计算梯度稀释各已知目的基因的拷贝数并制作标准曲线。最终结果表示为基因拷贝数的对数值lg[c/(copies·g-1)]。
1.4 数据处理与分析试验数据以x±SE表示, 利用Excel 2010将数据初步整理后, 使用SPSS 22.0统计软件进行单因素方差分析, 有显著差异时, 采用Tukey法进行多重比较。
2 结果与分析 2.1 壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠黏膜形态结构和MPO活性的影响如图 1和表 2所示: 与空白对照组相比, 大肠杆菌攻毒极显著降低了大鼠回肠黏膜的绒毛高度和绒毛高度/隐窝深度(P < 0.05), 显著增加了回肠黏膜的隐窝深度(P < 0.05);与攻毒对照组相比, 添加壳聚糖螯合锌显著提高了回肠黏膜的绒毛高度和绒毛高度/隐窝深度(P < 0.05), 同时显著降低回肠黏膜隐窝深度(P < 0.05)。

|
图 1 壳聚糖螯合锌对大肠杆菌攻毒大鼠回肠形态结构的影响 Fig. 1 Effects of CS-Zn on ileal morphology of rats challenged with E.coli N-CON: 空白对照组Blank control group; CON: 攻毒对照组Challenge control group; ZnSO4: 硫酸锌组Zinc sulfate group; CS-Zn: 壳聚糖螯合锌组Chitosan-chelated zinc group。下同The same below. |
| 项目Items | 空白对照组N-CON | 攻毒对照组CON | 硫酸锌组ZnSO4 | 壳聚糖螯合锌组CS-Zn |
| 绒毛高度/μmVillus height(V) | 395.74a | 267.54c | 286.65bc | 291.70b |
| 隐窝深度/μmCrypt depth(C) | 101.74b | 122.70a | 110.89ab | 106.22b |
| 绒毛高度/隐窝深度V/C | 4.10a | 2.22c | 2.62bc | 2.78b |
| MPO活性/(U·g-1) MPO activity | 3.25b | 4.79a | 4.58ab | 3.19b |
| 注: 同行肩标不同小写字母表示差异显著(P < 0.05)。Means within a row with different superscripts significantly differ at 0.05 level. | ||||
由表 2可知, 与空白对照组相比, 大肠杆菌攻毒之后, 攻毒对照组大鼠回肠组织中MPO的活性极显著增加(P < 0.05)。与攻毒对照组相比, 壳聚糖螯合锌处理组回肠组织中MPO活性显著降低(P < 0.05)。
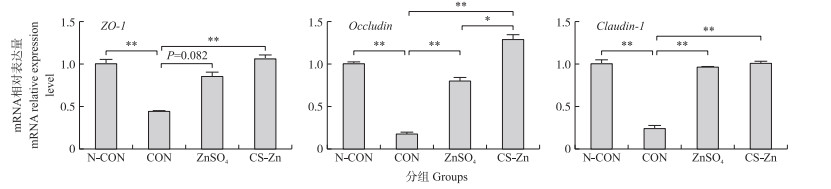
2.2 壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠黏膜屏障功能相关基因和蛋白表达的影响大鼠回肠上皮细胞间紧密连接蛋白基因表达如图 2所示。大肠杆菌攻毒极显著降低了断奶大鼠回肠黏膜中紧密连接蛋白基因ZO-1、Occludin、Claudin-1 mRNA表达量(P < 0.01)。与攻毒对照组相比, 添加壳聚糖螯合锌极显著提高了攻毒大鼠ZO-1、Occludin、Claudin-1 mRNA的表达量(P < 0.01)。此外, 与攻毒对照组相比, 添加硫酸锌可极显著提高Occludin、Claudin-1 mRNA的表达量(P < 0.01), 有上调ZO-1 mRNA表达的趋势(P=0.082);与硫酸锌组相比, 壳聚糖螯合锌显著上调Occludin mRNA的表达(P < 0.05)。
|
图 2 壳聚糖螯合锌对大肠杆菌攻毒大鼠回肠黏膜紧密连接蛋白基因表达的影响 Fig. 2 Effects of CS-Zn on mRNA relative expression of tight junction proteins genesin the ileum tissue of rats challenged with E.coli *P < 0.05;**P < 0.01. The same below. |
如图 3所示: 与空白对照组相比, 大肠杆菌攻毒显著降低回肠黏膜中紧密连接蛋白ZO-1、Occludin和Claudin-1的相对表达量(P < 0.05);与攻毒对照组相比, 添加壳聚糖螯合锌可以显著增加回肠黏膜Occludin和Claudin-1的相对表达量(P < 0.05)。

|
图 3 壳聚糖螯合锌对大肠杆菌攻毒大鼠回肠黏膜紧密连接蛋白表达的影响 Fig. 3 Effects of CS-Zn on protein relative expression of tight junction proteins genesin the ileum tissue of rats challenged with E.coli |
由表 3可知, 与空白对照组相比, 攻毒对照组大鼠炎症因子TNF-α、IL-6和IL-1β水平均显著增加(P < 0.05), IL-10水平显著降低(P < 0.05)。而相比攻毒对照组, 添加壳聚糖螯合锌显著下调攻毒大鼠回肠黏膜促炎因子TNF-α、IL-6水平, 而上调了抑炎因子IL-10的水平(P < 0.05), 对IL-1β水平没有显著影响(P>0.05)。此外, 硫酸锌组大鼠回肠黏膜IL-10水平显著高于攻毒对照组(P < 0.05)。
| 项目 Items |
空白对照组 N-CON |
攻毒对照组 CON |
硫酸锌组 ZnSO4 |
壳聚糖螯合锌组 CS-Zn |
| TNF-α | 27.39c | 44.27a | 39.60ab | 31.68bc |
| IL-1β | 3.29b | 7.09a | 5.89a | 5.57a |
| IL-6 | 14.49c | 31.80a | 25.16ab | 22.44bc |
| IL-10 | 9.76a | 5.89b | 8.25a | 9.63a |
荧光定量PCR结果如表 4所示: 与攻毒对照组相比, 壳聚糖螯合锌组可显著降低攻毒大鼠回肠黏膜MyD88、IRAK1、TRAF6 mRNA相对表达量(P < 0.05), 同时有降低TLR-4 mRNA表达的趋势(P=0.059)。
| 项目 Items |
攻毒对照组 CON |
硫酸锌组 ZnSO4 |
壳聚糖螯合锌组 CS-Zn |
| TLR-4 | 1.00 | 0.68 | 0.61 |
| MyD88 | 1.00a | 0.65ab | 0.44b |
| IRAK1 | 1.00a | 0.62ab | 0.49b |
| TRAF6 | 1.00a | 0.80b | 0.60c |
Western blot蛋白定量检测结果如图 4所示: 与攻毒对照组相比, 添加壳聚糖螯合锌可显著降低攻毒大鼠回肠黏膜MyD88蛋白相对表达量(P < 0.05), 而对TLR-4蛋白表达没有显著影响(P>0.05), 但壳聚糖螯合锌组的TLR-4表达量低于攻毒对照组。

|
图 4 壳聚糖螯合锌对大肠杆菌攻毒大鼠回肠TLR-4和MyD88蛋白表达的影响 Fig. 4 Effects of CS-Zn on the protein expression of TLR-4 and MyD88 in the ileum tissue ofrats challenged with E.coli |
由表 5可知: 与攻毒对照组大鼠相比, 添加壳聚糖螯合锌显著增加了大鼠回肠食糜中乳酸杆菌的数(P < 0.05), 总菌和大肠杆菌数没有显著变化(P>0.05)。
| 项目 Items |
攻毒对照组 CON |
硫酸锌组 ZnSO4 |
壳聚糖螯合锌组 CS-Zn |
| 总菌Total bacteria | 9.42 | 9.37 | 9.48 |
| 乳酸杆菌Lactobacillus | 9.02b | 9.08ab | 9.34a |
| 大肠杆菌Escherichia coli | 7.06 | 7.03 | 6.90 |
肠道黏膜形态结构作为肠道物理屏障功能的重要组成部分, 与营养物质的消化吸收密切相关, 而绒毛和隐窝作为肠黏膜形态的重要组成部分, 在营养物质的消化吸收过程中起到关键作用。绒毛长度与隐窝深度反映了肠道的功能状况。绒毛高度增加, 绒毛单位面积的细胞数多, 消化吸收功能强; 隐窝深度反映了细胞的生成率, 隐窝变浅, 表明细胞成熟率上升, 肠绒毛上皮细胞的分化程度相应增加, 消化吸收功能加强[13]。绒毛高度/隐窝深度(V/C)则综合反映小肠的功能状态, 比值下降表示肠道黏膜受损, 消化吸收功能降低。本试验结果显示, 壳聚糖螯合锌可提高攻毒大鼠回肠绒毛高度和V/C值, 并降低隐窝深度, 表明壳聚糖螯合锌能够改善攻毒大鼠回肠黏膜形态结构, 促进肠道的消化吸收功能。髓过氧化物酶(MPO)是中性粒细胞的活化标志物, 其水平及活性变化代表着嗜中性多形核白细胞的功能和活性状态[14]。本试验结果显示, 与空白对照组相比, 攻毒对照组大鼠回肠黏膜中MPO活性显著上升, 而壳聚糖螯合锌组MPO活性相比攻毒对照组显著下降, 表明在大肠杆菌攻毒之后中性粒细胞得到活化, 从而加剧了炎症反应; 而壳聚糖螯合锌抑制了中性粒细胞的活化状态, 从而缓解炎症反应。
3.2 壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠黏膜紧密连接蛋白的影响肠黏膜屏障完整性对维持正常肠道功能具有重要作用, 而肠上皮紧密连接是维持黏膜上皮细胞之间的重要连接体, 与肠道营养物质的吸收和微生物的黏附关系密切, 对屏障功能具有重要调节作用。ZO-1、Claudin-1和Occludin蛋白常被作为检验肠道紧密连接功能的指标[15]。本试验发现, 壳聚糖螯合锌可以极显著增加紧密连接蛋白基因ZO-1、Occludin和Claudin-1 mRNA表达量。表明壳聚糖螯合锌调节了肠道上皮之间的紧密连接, 提高了上皮屏障功能。
3.3 壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠黏膜免疫屏障的影响细胞因子也参与调节肠道屏障功能[16]。促炎细胞因子IL-1β、IL-6和TNF-α通过促进炎症应答反应而提高机体抗感染作用。TNF-α是最早产生的炎性细胞因子, 它的产生可以诱导其他炎性细胞因子如IL-1β和IL-6的级联反应, 通过启动这些细胞因子, 可以放大及延续炎症反应, 使炎症反应持续扩散, 从而对机体造成严重损伤[17]。研究显示, 炎症反应和促炎因子的过量产生会导致肠道屏障功能障碍[18]。本试验结果显示, 壳聚糖螯合锌可显著降低攻毒大鼠促炎细胞因子TNF-α和IL-6水平。IL-10是一种重要的抗炎细胞因子和免疫抑制因子, 具有很强的抗炎作用, 可以限制由病毒和细菌感染所造成的损害[19]。本试验结果显示, 壳聚糖螯合锌显著上调了攻毒大鼠回肠抑炎细胞因子IL-10的水平表明, 壳聚糖螯合锌能够减轻大肠杆菌攻毒诱导的回肠组织炎性损伤, 这也可能是肠道屏障功能改善的原因之一。
Toll-like受体家族(TLR)是一类模式识别受体, 在识别微生物病原体和调节先天免疫系统中起着重要作用, 其中, 成员TLR-4研究最为广泛。TLR信号传递的途径分为骨髓分化因子88(MyD88)依赖途径和TRIF依赖途径[20]。MyD88依赖途径主要负责细胞因子的表达, 而TRIF依赖途径主要介导Ⅰ型干扰素及其诱导的基因表达。当TLR识别病原体后, 与下游接头分子MyD88结合, 通过一系列信号分子如IRAK和TRAF6传递, 激活NF-κB转录因子, 进而调控促炎因子的产生, 抑制病原体的侵入[21]。本试验结果显示, 添加壳聚糖螯合锌可以显著降低MyD88、IRAK1和TRAF6的表达量, 并有降低TLR-4表达的趋势, 此结果表明, 壳聚糖螯合锌可能是通过抑制TLR-4信号通路来减少促炎因子TNF-α和IL-6的表达, 降低炎症反应, 从而缓解攻毒大鼠肠道屏障功能。
3.4 壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠食糜微生物的影响肠道菌群对机体免疫系统有重要影响, 对宿主的肠道功能和健康更发挥着至关重要作用。乳酸菌是肠道正常菌群中重要的优势菌群, 对改善肠道内环境、维持正常的微生态平衡具有重要的意义; 大肠杆菌也是肠道内固有的正常菌群, 如果大肠杆菌在肠道内异常增殖, 则会引起机体发病。谢正军等[8]报道壳聚糖螯合锌可以降低断奶仔猪盲肠和结肠内容物中大肠杆菌的数量, 显著提高乳酸菌的数量。在本试验中, 壳聚糖螯合锌显著提高了攻毒大鼠回肠乳酸杆菌的数量, 说明壳聚糖螯合锌可以增加肠道有益菌的数量, 改善肠道内环境, 进而保护肠道黏膜屏障。
综上所述, 壳聚糖螯合锌可显著改善大肠杆菌感染引发的回肠形态结构变化, 调节肠道菌群平衡。此外, 壳聚糖螯合锌可能是通过抑制TLR-4信号通路, 降低细胞因子水平, 从而降低炎症反应, 保护肠黏膜屏障功能。
| [1] |
Turner J R. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application[J]. The American Journal of Pathology, 2006, 169(6): 1901-1909. DOI:10.2353/ajpath.2006.060681 |
| [2] |
Turner J R. Intestinal mucosal barrier function in health and disease[J]. Nature Reviews Immunology, 2009, 9(11): 799-809. DOI:10.1038/nri2653 |
| [3] |
Zhang B K, Shao Y X, Liu D, et al. Zinc prevents Salmonella enterica serovar typhimurium-induced loss of intestinal mucosal barrier function in broiler chickens[J]. Avian Pathology, 2012, 41(4): 361-367. DOI:10.1080/03079457.2012.692155 |
| [4] |
Wong C P, Ho E. Zinc and its role in age-related inflammation and immune dysfunction[J]. Molecular Nutrition & Food Research, 2012, 56(1): 77-87. |
| [5] |
Yin H, Du Y G, Zhang J Z. Low molecular weight and oligomeric chitosans and their bioactivities[J]. Current Topics in Medicinal Chemistry, 2009, 9(16): 1546-1559. DOI:10.2174/156802609789909795 |
| [6] |
Goiri I, Oregui L M, Garcia-Rodriguez A. Use of chitosans to modulate ruminal fermentation of a 50:50 forage-to-concentrate diet in sheep[J]. Journal of Animal Science, 2010, 88(2): 749-755. DOI:10.2527/jas.2009-2377 |
| [7] |
谢正军, 朱叶萌, 杜美丹, 等. 壳聚糖锌对断奶仔猪生长性能、血清激素和生化指标的影响[J]. 动物营养学报, 2010, 22(5): 1355-1360. Xie Z J, Zhu Y M, Du M D, et al. Effects of chitosan-zinc on growth performance, serum hormone and biochemical indices of weanling piglets[J]. Chinese Journal of Animal Nutrition, 2010, 22(5): 1355-1360 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2010.05.034 |
| [8] |
谢正军, 刘国花, 李云涛, 等. 壳聚糖锌对断奶仔猪小肠组织学形态与功能的影响[J]. 中国畜牧杂志, 2012, 48(1): 32-37. Xie Z J, Liu G H, Li Y T, et al. Effects of CS-Zn on histological morphology and function of small intestine in piglets[J]. Chinese Journal of Animal Science, 2012, 48(1): 32-37 (in Chinese with English abstract). DOI:10.3969/j.issn.0258-7033.2012.01.009 |
| [9] |
Han X Y, Ma Y F, Lv M Y, et al. Chitosan-zinc chelate improves intestinal structure and mucosal function and decreases apoptosis in ileal mucosal epithelial cells in weaned pigs[J]. The British Journal of Nutrition, 2014, 111(8): 1405-1411. DOI:10.1017/S0007114513004042 |
| [10] |
Hu L S, Cheng S S, Li Y, et al. Chitosan-Zn chelate downregulates TLR4-NF-κB signal pathway of inflammatory response and cell death-associated proteins compared to inorganic zinc[J]. Biological Trace Element Research, 2018, 184(1): 92-98. DOI:10.1007/s12011-017-1174-0 |
| [11] |
刘壮, 慕春龙, 彭宇, 等. 极低蛋白日粮补充不同形式氮营养素对生长猪回肠食糜菌群、代谢产物和屏障功能的影响[J]. 南京农业大学学报, 2019, 42(3): 526-534. Liu Z, Mu C L, Peng Y, et al. Effects of extremely-low-protein diets supplemented with different nitrogen source on ileal microbial communities, metabolites profiles and barrier function of growing pigs[J]. Journal of Nanjing Agricultural University, 2019, 42(3): 526-534 (in Chinese with English abstract). DOI:10.7685/jnau.201806015 |
| [12] |
田时祎, 王珏, 汪晶, 等. 早期低聚半乳糖干预对哺乳仔猪回肠形态、功能发育相关基因及回肠菌群的影响[J]. 南京农业大学学报, 2018, 41(5): 917-924. Tian S Y, Wang J, Wang J, et al. The effect of early intervention with galacto-oligosaccharides on the morphological structure, functional development, and microbial community in ileum of suckling piglets[J]. Journal of Nanjing Agricultural University, 2018, 41(5): 917-924 (in Chinese with English abstract). DOI:10.7685/jnau.201711031 |
| [13] |
Montagne L, Pluske J R, Hampson D J. A review of interactions between dietary fibre and the intestinal mucosa, and their consequences on digestive health in young non-ruminant animals[J]. Animal Feed Science and Technology, 2003, 108(1/2/3/4): 95-117. |
| [14] |
da Silva M S, Sánchez-Fidalgo S, Talero E, et al. Anti-inflammatory intestinal activity of Abarema cochliacarpos(Gomes) barneby & grimes in TNBS colitis model[J]. Journal of Ethnopharmacology, 2010, 128(2): 467-475. DOI:10.1016/j.jep.2010.01.024 |
| [15] |
Berkes J, Viswanathan V K, Savkovic S D, et al. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation[J]. Gut, 2003, 52(3): 439-451. DOI:10.1136/gut.52.3.439 |
| [16] |
崔君, 傅春妮, 李留安, 等. 褐藻多糖对仔猪抗氧化能力、肠道菌群和细胞因子的影响[J]. 畜牧与兽医, 2019, 51(12): 66-69. Cui J, Fu C N, Li L A, et al. Effects of brown algae polysaccharide on growth, antioxidantcapacity, intestinal flora and cytokines in piglets[J]. Animal Husbandry and Veterinary Medicine, 2019, 51(12): 66-69. |
| [17] |
厉成敏, 朱乐乐, 李莲, 等. 重组牛脂多糖结合蛋白对脂多糖诱导的奶牛乳腺炎症反应指标的影响[J]. 南京农业大学学报, 2018, 41(4): 715-721. Li C M, Zhu L L, Li L, et al. Effect of recombinant bovine lipopolysaccharide(rbLBP) on indicators of inflammation in lipopolysaccharide induced dairy cows[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 715-721 (in Chinese with English abstract). DOI:10.7685/jnau.201711022 |
| [18] |
Long L N, Chen J S, Zhang Y G, et al. Comparison of porous and nano zinc oxide for replacing high-dose dietary regular zinc oxide in weaning piglets[J]. PLoS One, 2017, 12(8): e0182550. DOI:10.1371/journal.pone.0182550 |
| [19] |
张丽娜. PRRSV感染激活IL-10产生的信号通路[D]. 武汉: 华中农业大学, 2012. Zhang L N. Signaling pathway of IL-10 production actived by PRRSV infection[D]. Wuhan: Huazhong Agricultural University, 2012(in Chinese with English abstract). |
| [20] |
Wan Y, Fu Y Q, Wang F L, et al. Protective effects of a lipid extract from hard-shelled mussel(Mytilus coruscus) on intestinal integrity after lipopolysaccharide challenge in mice[J]. Nutrients, 2018, 10(7): 860. DOI:10.3390/nu10070860 |
| [21] |
Lu Y C, Yeh W C, Ohashi P S. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42(2): 145-151. DOI:10.1016/j.cyto.2008.01.006 |




