文章信息
- 王秋实, 汪琴, 韦伟, 张鑫宝, 夏梦圆, 张立凡, 陈杰
- WANG Qiushi, WANG Qin, WEI Wei, ZHANG Xinbao, XIA Mengyuan, ZHANG Lifan, CHEN Jie
- ACSF2启动子区c.-751 A>C突变影响扬州鹅产蛋性能作用机制研究
- The research on the mechanism of the effect of c.-751 A>C mutation in ACSF2 promoter on egg-laying performance of Yangzhou goose
- 南京农业大学学报, 2021, 44(3): 533-540
- Journal of Nanjing Agricultural University, 2021, 44(3): 533-540.
- http://dx.doi.org/10.7685/jnau.202002028
-
文章历史
- 收稿日期: 2020-02-25
鹅的产蛋性能是重要经济性状, 提高鹅的产蛋能力对促进养鹅业的发展、提高生产效益具有重要意义。ATP是细胞的主要能量“货币”, 细胞内ATP水平降低可导致包括细胞凋亡级联反应等在内的多种细胞生物学过程紊乱[1-3]。颗粒细胞的能量代谢和线粒体功能对于卵泡发育和卵母细胞生长至关重要[4-7]。因此, 颗粒细胞中线粒体ATP合成水平的高低是影响其细胞凋亡和进一步影响鹅产蛋性能的重要因素。
产蛋能力属于低遗传力性状, 开发有效的分子标记并进行分子育种可以有效提高鹅的产蛋能力。本实验室前期通过简化基因组测序, 筛选出多个与鹅产蛋性能相关的突变位点[8]。通过反向PCR, 我们发现一个SNP Record-106582(rs1714766364)位于鹅酰基辅酶A合成酶家族成员2(ACSF2)基因起始密码子上游751 bp(c.-751)处。ACSF2蛋白属于酰基辅酶A合成酶(ACS)家族的成员, 通过与辅酶A(CoA)形成硫酯键激活脂肪酸[9]。ACS能够催化醋酸盐、CoA和ATP生成乙酰辅酶A, 参与脂肪酸和胆固醇合成、三羧酸循环等各种代谢途径[10]。但是, 目前有关ACSF2对颗粒细胞ATP合成活性及鹅产蛋性能影响的研究鲜有报道。
鉴于ACSF2在ATP合成中的潜在作用, 本试验在扬州鹅群体中验证ACSF2突变位点与扬州鹅产蛋性能的相关性, 检测该位点对基因表达活性的影响, 探究ACSF2在颗粒细胞能量代谢过程中作用, 以揭示ACSF2及其突变位点对鹅产蛋性能的影响, 为扬州鹅的分子选育提供有效分子标记, 为鹅产蛋性能的研究提供理论依据。
1 材料与方法 1.1 试验样品采集及处理343只扬州母鹅用于基因分型和产蛋性能关联分析, 其产蛋记录均由江苏立华牧业股份有限公司(江苏)育种场提供。鹅的饲养条件按照该育种场种鹅饲养方法及饲养标准进行: 自由采食, 白天在自然光照下室外散养。于产蛋末期, 采集鹅翅静脉全血, 加柠檬酸葡萄糖抗凝, -20 ℃保存, 用于鹅基因组DNA提取。
用于基因表达试验的鹅组织样品采集于产蛋高峰期, AA型和CC型母鹅各6只。鹅卵巢用液氮速冻及保存, 用于后续RNA提取; 采集卵泡颗粒细胞[11-12], 用于基因功能研究等细胞生物学试验。
1.2 卵巢和颗粒细胞中RNA的提取及cDNA合成卵巢和颗粒细胞的总RNA采用Trizol试剂(Invitrogen, USA)提取, 并且用DNaseⅠ(Invitrogen, USA)处理以防DNA污染。各RNA样品由琼脂糖凝胶电泳和分光光度计检测质量和浓度。采用ProtoScript First Strand cDNA Synthesis Kit(NEB, 北京)进行cDNA的合成。反转录体系包含1 μg总RNA、2 μL d(T)23 VN primer(50 μmol·L-1)、10 μL M-Mulv reaction mix和2 μL M-Mulv enzyme mix, 用无核酸酶水补齐至20 μL。反转录过程中, 首先将总RNA、d(T)23 VN primer和无核酸酶水充分混匀, 70 ℃变性5 min; 短暂离心后立即置于冰上。向体系中加入M-Mulv reaction mix和M-Mulv enzyme混匀, 42 ℃孵育1 h, 80 ℃ 5 min。向反转录产物中加入80 μL无核酸酶水稀释至100 μL, 即可用于PCR反应或-20 ℃保存。
1.3 实时荧光定量PCR(qPCR)检测卵巢和颗粒细胞中ACSF2和能量代谢相关基因的表达量采用qPCR检测AA和CC基因型个体卵巢中ACSF2基因的表达量, 以及在颗粒细胞中过表达ACSF2后检测ACSF2和能量代谢相关基因的表达量。各定量引物序列见表 1。qPCR反应试剂采用SYBRⓇ Green Master Mix(Vazyme, 南京), 检测仪器为StepOne Plus Real-Time PCR system(Applied Biosystems, USA)。PCR反应体系(20 μL): 2 μL cDNA, 上游和下游引物(10 μmol·L-1)各0.4 μL, 0.4 μL ROX Reference Dye, 10 μL SYBR Green Master Mix和6.8 μL无核酸酶水。反应条件: 95 ℃ 5 min; 95 ℃ 10 s, 60 ℃ 30 s, 40个循环。从60 ℃上升至95 ℃每隔0.1 ℃读板1次, 获取PCR产物熔解曲线。每个样品重复测量3次。用GAPDH作为内参基因, 采用2-ΔΔCT的方法计算基因相对表达水平。
| 引物名称 Primername |
引物对序列 Primer pairs sequence(5′→3′) |
功能 Function |
长度 /bpSize |
退火温度 /℃Annealing temperature |
| S1 | TTCAGGGAACTCAAACTATAA/GCTCATTCTCACAAGTCCC | AS-PCR | 188 | 54 |
| S2 | TTCAGGGAACTCAAACTATAC/GCTCATTCTCACAAGTCCC | AS-PCR | ||
| P1 | CATCGCAAGCCTGGATGAGC/AACCTTGGGATGGGTGTGGAG | qPCR | 127 | 60 |
| P2 | CGGGGTACCGGGGATAAATGGTTACACTGA/TCCCCCGGGCAAGGGAAGCGTTACTA | 1 740 | 58 | |
| P3 | CGGGGTACCGGGCTCCCAGGGCTTC/TCCCCCGGGCAAGGGAAGCGTTACTA | 962 | 60 | |
| P4 | CGGGGTACCGGAGGAGCCGTTGTTTG/TCCCCCGGGCAAGGGAAGCGTTACTA | 505 | 58 | |
| P5 | ACTCAAACTAAACGGCTGCTGTGAATTTTGCTTCTTTAATGTT/CAGCAGCCGTTTAGTTTGAGTTCCCTGAATTCCAGTCTGATGT | 定点突变Site-directed mutation | 62 | |
| P6 | GGGTACCACGCATGGCCACCGCCG/GGAATTCATTCTGCCTTCCTGAGC | ACSF2表达载体ACSF2 expression vector | 1 791 | 60 |
| CS | TGGTCCCACAACTTCACCAACA/GCGAGGTACGGGTCCGAGA | qPCR | 158 | 60 |
| IDH3A | GGAACATTGGTGCTAATGGAGTTG/TCAGAAGAAGGGCAGTTGGATTT | qPCR | 102 | 60 |
| ND-1 | TCAATAATCATACTAAGCGGAAGC/GGAAGAATAAGGCGAAGGGT | qPCR | 220 | 60 |
| ATP5F1α | TTCTACAAAGGTATCCGTCCAGC/GCATCCAGATCAGACCCAAACT | qPCR | 165 | 60 |
| COX1 | ACATAGCATTCCCGCGAATAAA/GGAGTGAGAAGATAGCCAGGTC | qPCR | 180 | 60 |
| SDHB | GAAACAGGGCAAGGAGCAGT/TCAATCATCCAGCGATAGGC | qPCR | 174 | 60 |
| GAPDH | GCTGATGCTCCCATGTTCGTGAT/GTGGTGCAAGAGGCATTGCTGAC | qPCR | 86 | 60 |
| 注: CS: 柠檬酸合酶基因Citrate synthase gene; IDH3A: 异柠檬酸脱氢酶3α基因Isocitrate dehydrogenase 3(NAD+)alpha gene; ND-1: NADH脱氢酶亚单位1基因NADH Dehydrogenase subunit-1 gene; ATP5F1α: ATP合酶F1亚基α基因ATP synthase F1 subunit alpha gene; COX1: 细胞色素c氧化酶第1亚基基因Cytochrome c oxidase subunit 1 gene; SDHB: 琥珀酸脱氢酶复合物铁硫亚基B基因Succinate dehydrogenase complex iron sulfur subunit B gene; GAPDH: 甘油醛-3-磷酸脱氢酶基因Glyceraldehyde-3-phosphate dehydrogenase gene. | ||||
采用等位基因特异PCR(AS-PCR)[13]对343只扬州鹅ACSF2基因c.-751 A>C位点进行基因型检测。引物S1和S2的序列见表 1, 每对引物的上游引物为等位基因特异性引物, 下游引物为通用引物。分型样品为DNA, 每个样品的AS-PCR扩增体系均为20 μL, 包括10 μL r-taq Mix、上游和下游引物各1 μL、1 μL DNA模板(50 ng·μL-1)和7 μL无核酸酶水。PCR反应程序: 94 ℃ 5 min; 94 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 15 s, 32个循环; 72 ℃ 7 min。PCR产物经由25 g·L-1琼脂糖凝胶电泳及凝胶成像系统检测。选取10个PCR产物送至测序公司(南京擎科生物科技有限公司)测序验证。
1.5 ACSF2基因不同长度启动子系列删除载体的构建根据NCBI数据库中鹅ACSF2基因序列(NCBI ID: 106034658), 以鹅基因组DNA为模板, 设计3对引物P2、P3、P4, 分别扩增起始密码子上游1 665、887、430 bp至起始密码子下游75 bp的序列, 得到3条含有ACSF2基因启动子片段的PCR产物。每对引物两端包括KpnⅠ和SmaⅠ限制性内切酶的酶切位点和保护碱基。具体引物序列见表 1。PCR产物和pGL3-basic载体分别用KpnⅠ和SmaⅠ消化, 产物经切胶回收, 然后将PCR酶切产物和pGL3-basic片段化载体连接、转化, 经过菌液PCR鉴定、双酶切鉴定、测序验证, 最后获得3个含有不同鹅ACSF2基因启动子长度的荧光素酶报告基因载体, 分别命名为pGL3-1665、pGL3-887、pGL3-430。
1.6 不同基因型启动子荧光素酶报告基因载体的构建以c.-751 A>C SNP位点AA型个体基因组为模板, 使用P3引物扩增获得鹅ACSF2基因翻译起始位点-887 bp至+75 bp、含SNP位点(c.-751 A>C)的一段长962 bp序列。利用KpnⅠ和SmaⅠ两个酶切位点, 构建AA型荧光素酶报告基因载体pGL3-A。以pGL3-A载体为模板, 以P5作为突变引物, 利用点突变试剂盒Mut ExpressⓇ Ⅱ Fast Mutagenesis Kit(Vazyme, 南京), 构建SNP位点为C的突变载体pGL3-C。pGL3-A和pGL3-C均经测序公司(南京擎科生物科技有限公司)测序验证。
1.7 细胞转染及双荧光素酶活性鉴定将293T细胞以每孔2×104个细胞接种于十二孔板, 培养24 h, 至细胞汇合度达70%~80%时, 进行荧光素酶报告基因载体转染。利用转染试剂Lipofectamine 3000(Invitrogen, USA)转染含有启动子片段的重组载体或pGL3-basic阴性对照质粒1.5 μg、pRL-TK内参质粒0.03 μg。转染24 h后收集细胞, 用于荧光素酶活性测定。测定试剂采用Dual-Luciferase Reporter Assay System(Promega, USA)。重组载体上Firefly(萤火虫)荧光素酶的发光值记为F, 内参基因的Renilla(海肾)荧光素酶发光值记为R, 样品F/R值即为启动子的相对转录活性。
1.8 ACSF2基因过表达载体的构建及转染以鹅卵巢RNA反转录得到的cDNA为模板, 利用P6引物(两端含有KpnⅠ和EcoRⅠ的限制性内切酶酶切位点)扩增得到一段长度为1 791 bp的ACSF2 CDS序列, 酶切后连接至pcDNA3.1, 构建ACSF2过表达载体pcDNA3.1-ACSF2, 并经测序公司进行测序验证。
鹅卵巢颗粒细胞以5×105 mL-1接种于6孔板, 培养24 h, 至细胞汇合度达70%~80%, 进行ACSF2过表达载体转染。细胞分为2组, 每组3个重复: 一组用Lipofectamine 3000转染pcDNA3.1, 作为对照组; 一组用Lipofectamine 3000转染pcDNA3.1-ACSF2, 作为试验组。转染24 h后收集细胞, 用于RNA提取及ATP水平测定。
1.9 细胞ATP水平测定使用碧云天ATP检测试剂盒对细胞ATP水平进行检测。检测结果用总蛋白浓度进行校正, 以消除样品误差。细胞总蛋白浓度测定利用增强型BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)进行测定。
1.10 ACSF2基因的生物信息学分析通过NCBI数据库下载鹅ACSF2基因组信息, 通过核心启动子区在线预测软件Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/)预测ACSF2基因的核心启动子区域。
1.11 数据的统计与分析基因型频率(P)和基因频率(p)计算公式如下:
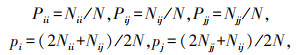
|
式中: Pii、Pij、Pjj分别为基因型ii、ij、jj个体的基因型频率; pi为i基因的基因频率; pj为j基因的基因频率; i、j为某基因座上共同控制某一性状的1对等位基因; Nii、Nij、Njj分别为基因型ii、ij和jj的个体数; N为群体总数。
产蛋性能关联分析采用Duncan’s的多范围检验; 数据表示为平均数±标准误(x±SE); 样本间平均值比较采用独立性t测验。所有试验最少重复3次。
2 结果与分析 2.1 ACSF2 c.-751 A>C位点在扬州鹅群体中的基因分型及基因频率的统计通过AS-PCR, 我们以血液DNA为样本, 对343只扬州鹅的ACSF2 c.-751 A>C位点进行基因分型, 结果检测到3种基因型: AA、AC和CC型(图 1-A)。为了验证分型结果的准确性, 本试验分别选择AA、AC和CC基因型个体DNA的扩增产物进行测序。测序结果(图 1-B)与AS-PCR判定结果一致。
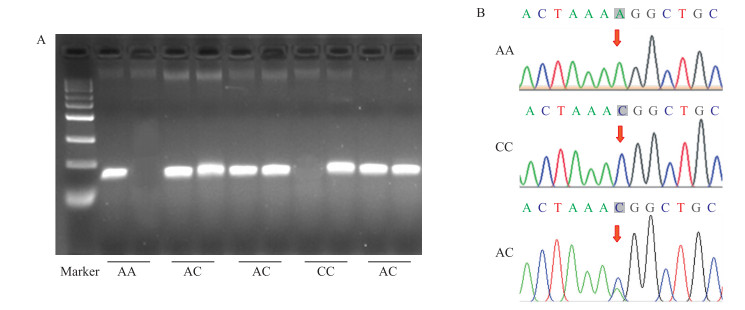
|
图 1 SNP c.-751 A>C的等位基因特异PCR(AS-PCR)分型结果 Fig. 1 The results of allele specific PCR(AS-PCR) for SNP c.-751 A>C A. 部分样品的AS-PCR分型结果The result of AS-PCR genotyping; B. 3种基因型的测序峰图The sequencing result of three kinds of genotypes. |
根据AS-PCR分型结果, 扬州鹅群体的基因频率及基因型频率统计见表 2。AC基因型频率最高, AA基因型频率次之, CC基因型频率最低。
| 等位基因Allele | 基因频率Gene frequency | 基因型Genotype | 数量Number | 基因型频率Genotype frequency |
| A | 0.577 3 | AA | 102 | 0.297 4 |
| AC | 192 | 0.559 8 | ||
| C | 0.422 7 | CC | 49 | 0.142 8 |
将343只产蛋母鹅ACSF2 c.-751 A>C位点的基因型与其34周产蛋量进行关联分析。结果显示, AA基因型产蛋量均值为81.40枚, AC基因型个体的平均产蛋量为77.91枚, CC基因型的平均产蛋量为72.69枚。AA基因型个体的平均产蛋量与CC基因型个体的平均产蛋量差异显著(P < 0.05), AA与AC基因型间产蛋量差异不显著(表 3)。
| 基因型Genotype | 样本量Number | 34周总产蛋量Egg production |
| AA | 102 | 81.40±10.37a |
| AC | 192 | 77.91±13.63ab |
| CC | 49 | 72.69±17.97b |
| 注: 不同小写字母表示差异显著(P < 0.05)。 Note: Different lowercases mean significant difference(P < 0.05). | ||
选取6个AA型和CC型个体, 采用qPCR对其卵巢中ACSF2 mRNA表达水平进行检测。结果显示(图 2), AA基因型个体卵巢组织中ACSF2 mRNA的相对表达量显著低于CC基因型个体(P < 0.01)。
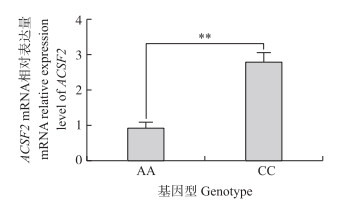
|
图 2 ACSF2基因在不同基因型鹅个体卵巢组织中的表达(n=6) Fig. 2 The mRNA expression level of ACSF2 genein the ovary of geese between differentgenotypes *P < 0.05, **P < 0.01. The same as follows. |
qPCR试验结果显示: 在鹅颗粒细胞中转入ACSF2基因过表达载体24 h后, ACSF2 mRNA的表达水平显著高于空载体pcDNA3.1对照组(图 3-A), 表明该载体具有较高的过表达效率。ACSF2基因过表达后, 颗粒细胞内的ATP水平显著升高(图 3-B)。ACSF2基因过表达以后糖代谢标志基因柠檬酸合酶基因(CS)表达量显著降低, 异柠檬酸脱氢酶3α基因(IDH3A)表达量显著升高, 氧化磷酸化标志基因ATP合酶F1亚基α基因(ATP5F1α)和琥珀酸脱氢酶复合物铁硫亚基B基因(SDHB)表达水平显著升高(P < 0.05), 而NADH脱氢酶亚单位-1基因(ND-1)和细胞色素c氧化酶第1亚基基因(COX1)表达量没有显著变化(图 3-B)。以上结果表明, ACSF2可以通过三羧酸循环和氧化磷酸化途径影响颗粒细胞内的ATP水平。
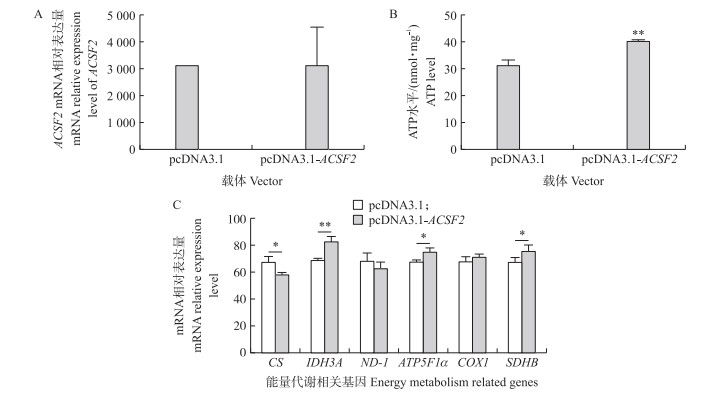
|
图 3 ACSF2基因的过表达对鹅颗粒细胞能量代谢途径的影响(n=3) Fig. 3 ACSF2 affected energy metabolism in the granulosa cells of goose from follicles(n=3) 分别转染ACSF2过表达载体(pcDNA3.1-ACSF2)和pcDNA3.1空载体24 h后, 颗粒细胞中ACSF2 mRNA的表达量(A)、ATP水平(B)和能量代谢相关基因mRNA的表达量(C)。 The mRNA relative expression level of ACSF2(A), the ATP levels(B), and the mRNA relative expression level of energy metabolism related genes(C)in granulosa cells of Yangzhou goose after respectively transfected with pcDNA3.1-ACSF2 and pcDNA3.1 plasmid for 24 h. |
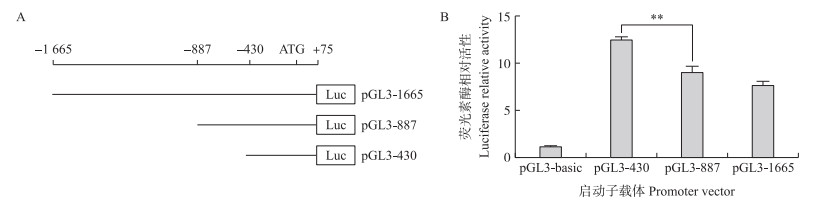
从NCBI数据库获得鹅ACSF2基因的基因组序列, 通过核心启动子区域预测网站Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/)预测ACSF2基因的核心启动子区域, 结果显示TATA BOX位于ACSF2翻译起始位点ATG上游的1 300 bp和800 bp附近。据此对其启动子区进行分段扩增。设计引物, 以AA基因型个体DNA为模板, 扩增鹅ACSF2启动子区-1665~+75 bp、-887~+75 bp、-430~+75 bp 3段序列, 构建ACSF2基因启动子系列, 删除载体pGL3-1665、pGL3-887和pGL3-430(图 4-A)。
|
图 4 ACSF2基因不同长度启动子的荧光素酶报告基因载体(A)和活性分析(B)(n=3) Fig. 4 The diagram(A)and activity analysis(B)of the luciferase reporter gene vector with differentlengths of ACSF2 gene promoter |
pGL3-1665、pGL3-887、pGL3-430分别与pRL-TK共转染293T细胞, 同时共转染pGL3-basic与pRL-TK作为阴性对照组。荧光素酶活性分析结果(图 4-B)显示: pGL3-430相对荧光活性显著高于阴性对照, 约12倍(P < 0.01);pGL3-887比pGL3-430显著降低(P < 0.01), pGL3-1665比pGL3-887稍低, 但是相对荧光素酶活性差异不显著。这些结果表明ACSF2基因核心启动子区位于-1~-430 bp, 而-430~-887 bp可能存在沉默子的结合位点。
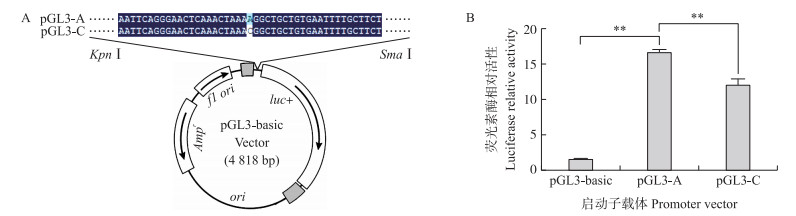
2.6 ACSF2基因不同基因型启动子活性分析构建了ACSF2 c.-751A>C位点为AA型和CC型的荧光素酶报告载体pGL3-A和pGL3-C(图 5-A), 再将2个不同基因型的荧光素酶报告载体pGL3-A和pGL3-C分别转染293T细胞, 培养24 h后检测其荧光素酶活性。结果表明(图 5-B): 载体pGL3-A(AA型)的启动子活性显著低于pGL3-C(CC型)的启动子活性(P < 0.01), 说明该位点的突变能够影响ACSF2基因的启动子活性。
|
图 5 pGL3-A和pGL3-C两种基因型启动子载体的测序验证(A)和在293T细胞中的活性分析(B)(n=3) Fig. 5 Sequencing verification(A)and transcription activity analysis(B)of the pGL3-Aand pGL3-C vectors in 293T cells |
鹅的产蛋能力属于低遗传力性状, 开发有效的分子标记进行分子育种可以有效提高鹅的产蛋能力。目前已发现一些SNP与鹅的产蛋性能显著相关, 如在催乳素受体基因(PRL)的5′端调控序列发现3个SNP与皖西白鹅产蛋性能显著相关, 在促性腺激素释放激素基因(GnRH)5′调控区发现3个SNP与皖西白鹅产蛋性能显著相关[14], 在促卵泡激素基因(FSHβ)的第3外显子有与皖西白鹅和莱茵鹅产蛋性能显著相关的SNP[15], 在促性腺激素抑制激素基因(GnIH)的内含子和外显子上发现与四川白鹅产蛋性能相关的SNP[16]。多个分子标记的综合应用将有助于提高鹅的产蛋性能, 产蛋相关的分子标记还有待进一步发掘, 其作用机制也有待进一步阐明。
本实验室前期通过简化基因组测序筛选与扬州鹅产蛋性能相关的突变位点[8], 并对关键候选SNP进行深入研究, 发现位于MAGI1内含子的SNP影响该基因的表达量, 进而通过调节颗粒细胞的凋亡影响扬州鹅产蛋性能[17]; 在KIAA1462启动子区和内含子区存在完全连锁的SNP, 能够调节转录因子GR对KIAA1462启动子的结合活性, 调节该基因的表达量和颗粒细胞凋亡, 调控扬州鹅产蛋性能[18]。本试验针对位于ACSF2基因翻译起始位点上游751 bp的SNP Record-106582(rs1714766364), 即c.-751 A>C变异进行进一步验证, 即验证该SNP位点在扬州鹅群体中与产蛋性能的相关性, 结果显示AA基因型个体的平均产蛋量均显著高于CC基因型个体。由此可见, 在鹅的选育工作中可以通过人为选择AA基因型个体提高A等位基因频率, 降低C等位基因的频率, 来提高鹅群体的平均产蛋性能。
由于c.-751 A>C突变影响卵巢组织中ACSF2基因的mRNA相对表达量, 且位于ACSF2启动子区, 我们推测该突变通过调节启动子的活性从而发挥作用。荧光素酶相对活性表明ACSF2核心启动子区位于-1~-430 bp, 在-430~-887 bp可能存在一个负调控转录因子的结合位点。而c.-751 A>C恰好落在-430~-887 bp区间。因此, 结合AA型启动子活性显著低于CC型、以及AA型个体卵巢组织中ACSF2基因表达显著低于CC型的试验结果, 本研究可得出结论: c.-751 A突变为C以后, -430~-887 bp区域沉默子的作用减弱, 启动子活性增强, ACSF2基因表达量上升。
上述研究结果确认了SNP位点对ACSF2基因表达量的影响, ACSF2在鹅产蛋性能的作用是我们关注的下一目标。ACSF2是乙酰辅酶A合成酶ACS家族中的一员。ACS催化醋酸盐、CoA和ATP生成乙酰辅酶A, 参与脂肪酸和胆固醇合成、三羧酸循环等各种代谢途径[10], 增加ATP的释放[19]。已有研究表明, ACS家族成员ACS-4能够通过MAPK通路调节脂肪酸的水平, 从而调控动物的生殖发育[20]。而ACSF2作为线粒体基质酶的一员, 能够参与线粒体的运作, 影响线粒体的功能。研究表明线粒体功能与卵泡发育[4]以及卵母细胞的生长有着密切关系[6]。生发泡期卵母细胞中线粒体功能失调, 氧化磷酸化和ATP生成相关基因表达发生变化, 可能是导致卵巢老化、繁殖机能下降的重要原因[21]。因此, 添加AMP[22]、CoQ10[23]、acetyl-L-carnitine[24]和Melatonin[25]等可以促进线粒体功能和ATP水平恢复正常, 促进卵母细胞的体外成熟, 有助于提高人和绵羊、牛、水牛等动物的繁殖性能。本研究结果表明, 过表达ACSF2促进ATP浓度显著升高, 这与ACSF2过表达以后酿酒酵母ATP水平显著升高的结果一致[26]; 由于糖代谢标志基因异柠檬酸脱氢酶3α(IDH3A)基因表达量显著升高, 氧化磷酸化标志基因ATP合酶F1亚基α基因(ATP5F1α)和琥珀酸脱氢酶复合物铁硫亚基B基因(SDHB)表达水平也显著升高, 我们推测ACSF2可以通过促进三羧酸循环和氧化磷酸化途径提高颗粒细胞内的ATP水平。柠檬酸合酶(CS)基因表达量显著降低, 可能是由于三羧酸循环被激活后, 柠檬酸合酶产物增多, 对柠檬酸合酶活性产生抑制作用导致的。
Alonso-Pozos等[27]的研究表明能量代谢可以引起颗粒细胞凋亡。也有研究报道高浓度的ATP可以激活Caspase-3, 导致人颗粒黄体细胞的凋亡[28]。线粒体在人颗粒黄体细胞的细胞凋亡级联反应中发挥着重要作用, ATP是细胞程序性死亡的诱因, 也是启动细胞凋亡级联反应的必要成分[29]。我们前期研究发现ACSF2影响颗粒细胞的Caspase-3表达水平[30]。以上结果表明ACSF2能够影响鹅颗粒细胞的能量代谢途径, 促进颗粒细胞凋亡, 进而影响扬州鹅的产蛋量。
总之, 本研究表明ACSF2启动子区c.-751 A>C突变能够改变该基因的转录活性, 通过改变细胞中能量代谢水平影响颗粒细胞凋亡, 从而对鹅的产蛋性能产生影响。该突变位点有望成为扬州鹅产蛋性能选育的分子标记。
致谢: 感谢江苏立华牧业股份有限公司为本研究提供扬州鹅的血液、卵巢样品和产蛋记录。
| [1] |
Atlante A, de Bari L, Bobba A, et al. Cytochrome c, released from cerebellar granule cells undergoing apoptosis or excytotoxic death, can generate protonmotive force and drive ATP synthesis in isolated mitochondria[J]. J Neurochem, 2003, 86(3): 591-604. DOI:10.1046/j.1471-4159.2003.01863.x |
| [2] |
Ferrari D, Stepczynska A, Los M, et al. Differential regulation and ATP requirement for caspase-8 and caspase-3 activation during CD95- and anticancer drug-induced apoptosis[J]. The Journal of Experimental Medicine, 1998, 188(5): 979-984. DOI:10.1084/jem.188.5.979 |
| [3] |
Hu Y, Benedict M A, Ding L, et al. Role of cytochrome c and dATP/ATP hydrolysis in Apaf-1-mediated caspase-9 activation and apoptosis[J]. The EMBO Journal, 1999, 18(13): 3586-3595. DOI:10.1093/emboj/18.13.3586 |
| [4] |
Alonso-Pozos I, Rosales-Torres A M, Ávalos-Rodríguez A, et al. Mechanism of granulosa cell death during follicular atresia depends on follicular size[J]. Theriogenology, 2003, 60(6): 1071-1081. DOI:10.1016/S0093-691X(03)00123-7 |
| [5] |
Eppig J J, Chesnel F, Hirao Y, et al. Oocyte control of granulosa cell development: how and why[J]. Human Reproduction(Oxford, England), 1997, 12(Suppl 11): 127-132. |
| [6] |
Peluso J J, Liu X F, Romak J. Progesterone maintains basal intracellular adenosine triphosphate levels and viability of spontaneously immortalized granulosa cells by promoting an interaction between 14-3-3σ and ATP synthaseβ/precursor through a protein kinase G-dependent mechanism[J]. Endocrinology, 2007, 148(5): 2037-2044. DOI:10.1210/en.2006-1603 |
| [7] |
Su Y Q, Sugiura K, Eppig J J. Mouse oocyte control of granulosa cell development and function: paracrine regulation of cumulus cell metabolism[J]. Seminars in Reproductive Medicine, 2009, 27(1): 32-42. DOI:10.1055/s-0028-1108008 |
| [8] |
Yu S G, Chu W W, Zhang L F, et al. Identification of laying-related SNP markers in geese using RAD sequencing[J]. PLoS One, 2015, 10(7): e0131572. DOI:10.1371/journal.pone.0131572 |
| [9] |
Watkins P A, Maiguel D, Jia Z Z, et al. Evidence for 26 distinct acyl-coenzyme A synthetase genes in the human genome[J]. Journal of Lipid Research, 2007, 48(12): 2736-2750. DOI:10.1194/jlr.M700378-JLR200 |
| [10] |
Fujino T, Kondo J, Ishikawa M, et al. Acetyl-CoA synthetase 2, a mitochondrial matrix enzyme involved in the oxidation of acetate[J]. Journal of Biological Chemistry, 2001, 276(14): 11420-11426. DOI:10.1074/jbc.M008782200 |
| [11] |
Gilbert A B, Evans A J, Perry M M, et al. A method for separating the granulosa cells, the basal Lamina and the theca of the preovulatory ovarian follicle of the domestic fowl(Gallus domesticus)[J]. Journal of Reproduction and Fertility, 1977, 50(1): 179-181. DOI:10.1530/jrf.0.0500179 |
| [12] |
Hu S Q, Liu H H, Pan Z X, et al. Molecular cloning, expression profile and transcriptional modulation of two splice variants of very low density lipoprotein receptor during ovarian follicle development in geese(Anser cygnoide)[J]. Animal Reproduction Science, 2014, 149(3/4): 281-296. |
| [13] |
Cosenza G, Pauciullo A, Gallo D, et al. Genotyping at the CSN1S1 locus by PCR-RFLP and AS-PCR in a Neapolitan goat population[J]. Small Ruminant Research, 2008, 74(1/2/3): 84-90. |
| [14] |
杨涛. 鹅GnRH基因5'端调控区和外显子1 SNPs检测及与产蛋量的关系[D]. 合肥: 安徽农业大学, 2007, 16-29. Yang T. SNPs in geese GnRH gene 5'-flank region and exon 1 and association with egg production[D]. Hefei: Anhui Agricultural University, 2007: 16-29(in Chinese with English abstract). |
| [15] |
牛晓童. 鹅FSHβ基因部分序列克隆及外显子3 SNPs与产蛋性能相关性研究[D]. 合肥: 安徽农业大学, 2008, 16-24. Niu X T. Cloning of partial sequence of FSHβ gene and exon3 association of SNPs with egg production in goose[D]. Hefei: Anhui Agricultural University, 2008: 16-24(in Chinese with English abstract). |
| [16] |
胡彦竞科. 四川白鹅GnRH、GnIH基因克隆、多态性及其与产蛋量的关联性研究[D]. 重庆: 西南大学, 2017, 23-45. HU Y J K. Cloning, polymorphism of GnRH and GnIH genes and their association with egg production in Sichuan white goose[D]. Chongqing: Southwest University, 2017: 23-45(in Chinese with English abstract). |
| [17] |
Yu S, Xia M, Alsiddig M A, et al. Molecular cloning, alternative splicing and mRNA expression analysis of MAGI1 and its correlation with laying performance in geese[J]. British Poultry Science, 2017, 58(2): 158-165. DOI:10.1080/00071668.2016.1268251 |
| [18] |
Xia M Y, Wei W, Jiang Z H, et al. A functional mutation in KIAA1462 promoter decreases glucocorticoid receptor affinity and affects egg-laying performance in Yangzhou geese[J]. International Journal of Molecular Sciences, 2018, 19(5): 1531. DOI:10.3390/ijms19051531 |
| [19] |
Glasemacher J, Bock A K, Schmid R, et al. Purification and properties of acetyl-CoA synthetase(ADP-forming), an archaeal enzyme of acetate formation and ATP synthesis, from the hyperthermophile Pyrococcus furiosus[J]. European Journal of Biochemistry, 1997, 244(2): 561-567. DOI:10.1111/j.1432-1033.1997.00561.x |
| [20] |
Tang H Y, Han M. Fatty acids regulate germline sex determination through ACS-4-dependent myristoylation[J]. Cell, 2017, 169(3): 457-469. DOI:10.1016/j.cell.2017.03.049 |
| [21] |
Zhang T, Xi Q S, Wang D, et al. Mitochondrial dysfunction and endoplasmic Reticulum stress involved in oocyte aging: an analysis using single-cell RNA-sequencing of mouse oocytes[J]. Journal of Ovarian Research, 2019, 12(1): 1-9. DOI:10.1186/s13048-018-0475-z |
| [22] |
Hashimoto S, Yamanaka M, Yamochi T, et al. Mitochondrial function in immature bovine oocytes is improved by an increase of cellular cyclic AMP[J]. Scientific Reports, 2019, 9: 5167. DOI:10.1038/s41598-019-41610-6 |
| [23] |
Heydarnejad A, Ostadhosseini S, Varnosfaderani S R, et al. Supplementation of maturation medium with CoQ10 enhances developmental competence of ovine oocytes through improvement of mitochondrial function[J]. Molecular Reproduction and Development, 2019, 86(7): 812-824. DOI:10.1002/mrd.23159 |
| [24] |
Xu H Y, Geng S S, Li T T, et al. Maturation of buffalo oocytes in vitro with acetyl-L-carnitine improves cryotolerance due to changes in mitochondrial function and the membrane lipid profile[J]. Reproduction, Fertility, and Development, 2019, 31(2): 386-394. DOI:10.1071/RD18102 |
| [25] |
Zou H J, Chen B L, Ding D, et al. Melatonin promotes the development of immature oocytes from the COH cycle into healthy offspring by protecting mitochondrial function[J]. Journal of Pineal Research, 2020, 68(1): e12621. |
| [26] |
陈孚江, 周景文, 史仲平, 等. 乙酰辅酶A合成代谢对酿酒酵母生理功能的影响[J]. 微生物学报, 2010, 50(9): 1172-1179. Chen F J, Zhou J W, Shi Z P, et al. Effect of acetyl-CoA synthase gene overexpression on physiological function of Saccharomyces cerevisiae[J]. Acta Microbiologica Sinica, 2010, 50(9): 1172-1179 (in Chinese with English abstract). |
| [27] |
Alonso-Pozos I, Rosales-Torres A M, Ávalos-Rodríguez A, et al. Mechanism of granulosa cell death during follicular atresia depends on follicular size[J]. Theriogenology, 2003, 60(6): 1071-1081. DOI:10.1016/S0093-691X(03)00123-7 |
| [28] |
Tai C J, Chang S J, Chien L Y, et al. Adenosine triphosphate induces activation of Caspase-3 in apoptosis of human granulosa-luteal cells[J]. Endocrine Journal, 2005, 52(3): 327-335. DOI:10.1507/endocrj.52.327 |
| [29] |
Park D W, Cho T, Kim M R, et al. ATP-induced apoptosis of human granulosa luteal cells cultured in vitro[J]. Fertility and Sterility, 2003, 80(4): 993-1002. DOI:10.1016/S0015-0282(03)01118-X |
| [30] |
Yu S, Wei W, Xia M, et al. Molecular characterization, alternative splicing and expression analysis of ACSF2 and its correlation with egg-laying performance in geese[J]. Animal Genetics, 2016, 47(4): 451-462. DOI:10.1111/age.12435 |




