文章信息
- 朱晓峰, 张桢, 丁立人, 李东颖, 毛嘉妮, 杭苏琴
- ZHU Xiaofeng, ZHANG Zhen, DING Liren, LI Dongying, MAO Jiani, HANG Suqin
- 乳酸杆菌固态发酵降低菜籽粕硫代葡萄糖苷的研究
- Solid state fermentation of rapeseed meal with Lactobacillus to degrade glucosinolate
- 南京农业大学学报, 2021, 44(3): 526-532
- Journal of Nanjing Agricultural University, 2021, 44(3): 526-532.
- http://dx.doi.org/10.7685/jnau.202007036
-
文章历史
- 收稿日期: 2020-07-23
菜籽粕(rapeseed meal, RSM)是油菜籽榨油之后的副产品, 其粗蛋白含量(32%~40%)较高, 氨基酸组成平衡[1], 碳水化合物、维生素和矿物质丰富[2], 是一种极具开发价值的饲料资源。然而, 由于硫代葡萄糖苷(glucosinolate, 又称硫苷, 菜籽粕中含量为125~207 μmol·g-1)、粗纤维和植酸等抗营养因子的存在, 降低了菜籽粕的营养价值, 极大地限制了菜籽粕在畜禽饲料中的应用[3-4]。常见的脱毒方法包括热处理法、机械破碎法等, 但这些方法脱毒效果有限, 成本较高, 还会造成营养物质流失[5]。微生物发酵菜籽粕能有效降低其抗营养因子, 提高其营养价值, 用于猪饲料能够改善生长猪的肉品质, 提高生长性能[6-7]。乳酸杆菌能产生乳酸, 抑制病原菌生长, 常用于饲料发酵[8]。据报道, 植物乳杆菌发酵能够降解豆粕中难以消化的寡糖和大豆球蛋白等抗营养因子[9]; 唾液乳杆菌和植物乳杆菌已证明能分别降低菜籽粕和芥兰中硫代葡萄糖苷含量[8, 10]; 罗伊氏乳杆菌、约氏乳杆菌、嗜酸乳杆菌等能提高饲料的营养物质利用率[11]。由于不同菌株所分泌的硫苷降解酶不同, 复合乳酸杆菌发酵对硫苷的降解比单一菌株更具优势[12]。因此, 利用复合乳酸杆菌制剂对菜籽粕进行发酵, 能够有效降低菜籽粕硫苷含量, 提高其在畜禽饲料中的应用潜力。
影响发酵效率的因素较多, 如底物组成、发酵时间、接种量和料水比等[5]。由于菌株的特异性, 不同菌株发挥作用所需条件不尽相同, 传统发酵条件优化每次只涉及单个变量, 正交试验设计可以评价一组可控的试验因素与观测变量之间的关系, 优化试验条件, 已成功应用于发酵条件的研究[13]。
本试验的目的是研究复合乳酸杆菌发酵剂(罗伊氏乳杆菌L45、植物乳杆菌L47和约氏乳杆菌L63)在菜籽粕中的生长情况; 通过正交试验, 优化乳酸杆菌发酵菜籽粕的条件, 评价固态发酵对菜籽粕营养成分及硫代葡萄糖苷含量的影响。
1 材料与方法 1.1 试验材料 1.1.1 试验原料菜籽(Brassica napus, 甘蓝型油菜籽)粕、麸皮均由江苏海普瑞饲料有限公司提供, 粉碎过380 μm筛备用。
1.1.2 试验菌种罗伊氏乳杆菌(Lactobacillus reuteri)L45、植物乳杆菌(L.plantarum)L47和约氏乳杆菌(L.johnsonii)L63均由本课题组分离自健康猪的胃肠道。3株菌均可在体外快速生长, 且具有良好的产酸特性以及抗逆性[14]。其中L47能够耐受pH2.5的酸性环境和0.5%的胆盐环境[15]。所有菌种于含20%甘油的MRS培养基(乳酸菌选择性培养基)中-20 ℃冷冻保存。
1.2 乳酸杆菌在菜籽粕中的生长特性和对可溶性碳、氮源的利用将3株乳酸杆菌分别在MRS培养基中37 ℃活化24 h, 离心后将各菌株重悬于无菌水中, 等比例混合, 制备乳酸杆菌接种液。试验共分为2组: 1)处理组: 将30 g菜籽粕、30 mL水加入160 mL发酵瓶中, 混匀后121 ℃高压灭菌15 min, 作为菜籽粕培养基。将乳酸杆菌接种液以0.5 mL·kg-1(108 CFU·mL-1)的接种量接种至菜籽粕培养基中; 2)对照组: 以60 mL MRS培养基替代菜籽粕培养基。接种后的菜籽粕于37 ℃恒温培养箱中发酵48 h, 分别于0、6、12、18、24和48 h取样并检测产气量的变化。每个时间点设3个重复。发酵结束后置于2~8 ℃冰盒上, 检测培养基上清液中乳酸杆菌活菌数、pH值和乳酸、可溶性还原糖和游离氨基氮含量。
1.3 正交试验优化菜籽粕发酵条件本课题组前期研究发现对菜籽粕硫苷降解率影响较大的4个因素为: 麸皮添加量、料水比、接种量和发酵时间。各因素选取3个水平(表 1), 利用SPSS 22.0软件设计L9(34)正交试验, 优化乳酸杆菌发酵菜籽粕的条件。利用最优发酵条件, 验证发酵对菜籽粕营养物质的影响。试验共分为3组: 1)发酵组: 利用优化后的条件进行发酵; 2)对照组: 为了消除高压灭菌(121 ℃, 15 min)对菜籽粕的影响, 以等量的无菌生理盐水替代乳酸杆菌发酵液; 3)空白组: 菜籽粕原料, 未经任何处理。每组3个重复。试验结束后检测菜籽粕的营养成分和抗营养因子含量。
| 因素Factors | 水平Levels | ||
| 1 | 2 | 3 | |
| 麸皮添加量(A)/% Wheat bran addition | 0 | 5 | 10 |
| 料水比(B) Rapeseedmeal to water ratio | 1∶1.1 | 1∶1.2 | 1∶1.3 |
| 接种量(C)/(mL·kg-1) Inoculum volume | 50 | 70 | 90 |
| 发酵时间(D)/hFermentation time | 36 | 48 | 60 |
乳酸含量使用乳酸试剂盒(南京建成生物试剂公司)测定; 用pH检测仪测定pH值; 参考Theodorou等[16]的方法, 使用气压转换器(ANKOM RFS型, 上海瑞望仪器设备有限公司)测定每个时间点的产气量, 再将不同时间点的产气量进行累加, 得到累计产气量(mL); 稀释涂布平板法检测乳酸杆菌活菌数[17], 结果以lg[c/(CFU·g-1)]或者lg[c/(CFU·mL-1)]表示。
1.4.2 可溶性还原糖和游离氨基氮含量的测定将1 g菜籽粕与9 mL去离子水于均质器中混匀5 min, 7 000 r·min-1离心10 min, 取上清液进行检测。使用二硝基水杨酸法检测可溶性还原糖含量[18]。DNS试剂配方如下: 10 g 3, 5-硝基水杨酸、16 g NaOH和300 g酒石酸钠钾溶解后定容至1 L。将3 mL DNS试剂与1 mL样品混合后沸水加热5 min, 然后加入去离子水至25 mL, 冷却后用分光光度计测量540 nm处吸光值(A540)。参考Abernathy等[19]的方法, 使用茚三酮法检测游离氨基氮(free amino nitrogen, FAN)。
1.4.3 菜籽粕营养成分及抗营养因子含量的测定使用凯氏定氮法检测粗蛋白含量[20]; 参考Ovissipour等[21]的方法检测样品中三氯乙酸可溶性蛋白(trichloroacetic acid soluble protein, TCA-SP)含量; 粗纤维、中性洗涤纤维和酸性洗涤纤维含量使用滤袋法进行测定[22]; 采用氯化钯法测定硫苷含量[23]; 参考Nair等[24]的方法检测植酸含量。
1.5 统计分析数据均以“平均值±标准差(x±SD)”表示, 采用GraphPad Prism 7.0软件作图, SPSS 20.0统计软件进行单因素方差分析(Oneway-ANOVA), 用Duncan’s法进行多重比较。
2 结果与分析 2.1 乳酸杆菌在菜籽粕中的发酵特性如图 1所示: 在菜籽粕和MRS培养基中, 乳酸杆菌0~24 h的生长曲线相似, 在0~12 h呈指数生长, 在24 h前达到生长平台期。在2种培养基中, 0~24 h的乳酸含量相似, 但在48 h时, 菜籽粕中的乳酸含量显著高于MRS(P < 0.05), 这与乳酸杆菌活菌数结果一致。开始发酵时, MRS中的pH值在48 h时降至4.06;而菜籽粕中pH值降低速度较为平缓, 在48 h时降低至5.03, 显著高于MRS(P < 0.05)。乳酸杆菌在发酵菜籽粕中的累积产气量持续升高, 而在MRS中无明显产气, 说明乳酸杆菌在2种底物中发酵的代谢产物不同。
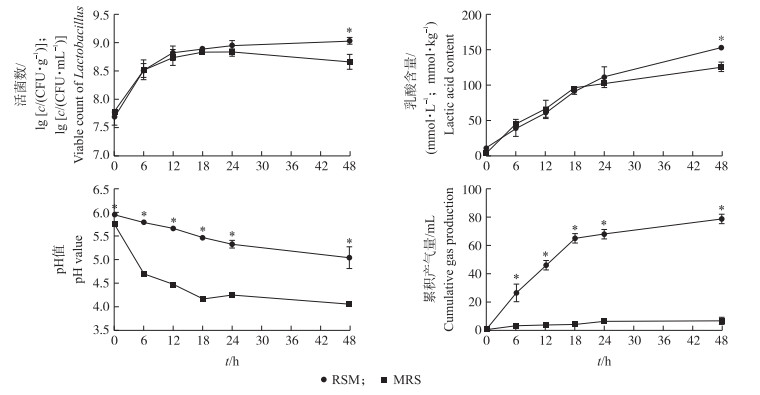
|
图 1 乳酸杆菌在MRS培养基和菜籽粕中发酵的有效活菌数、乳酸、pH值和累积产气量 Fig. 1 Viable count of Lactobacillus, lactic acid, pH value and cumulative gas production ofMRS medium and rapeseed meal(RSM)fermented by Lactobacillus *表示两组间在同一时间点时具有显著差异(P < 0.05)。下同。 * means significant difference between the two groups at the same time point(P < 0.05). The same as follows. |
在0~18 h时, 可溶性还原糖含量随着发酵时间的增加而降低(图 2-A), 而游离氨基氮(FAN)含量则在12 h后才开始下降(图 2-B), 说明乳酸杆菌在MRS中发酵时优先利用碳源, 再利用氮源; 与MRS培养基相比, 菜籽粕培养基中初始可溶性还原糖和游离氨基氮含量较低(P < 0.05), 虽然菜籽粕中可溶性还原糖含量在发酵时显著降低(P < 0.05), 但降低幅度较小; 与24 h相比, 2种培养基中游离氨基氮含量在48 h均出现略微升高。
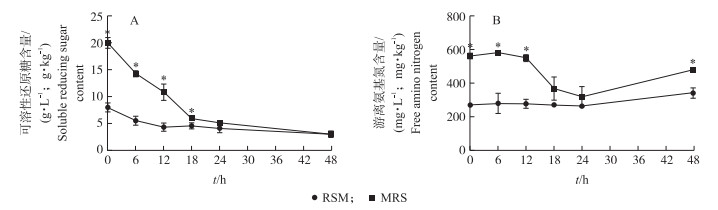
|
图 2 乳酸杆菌在MRS培养基和菜籽粕发酵的可溶性还原糖(A)和游离氨基氮(B)含量 Fig. 2 Content of soluble reducing sugar and free amino nitrogen(B)in MRS medium and RSMfermented by Lactobacillus |
正交试验结果如表 2所示, 根据极差分析(R值)结果, 影响硫苷降解率4个因素的主次顺序依次是: 接种量、发酵时间、料水比和麸皮添加量。正交试验结果的方差分析如表 3所示, 除麸皮添加量外, 其余3个因素对硫苷降解率的影响均显著(P < 0.05)。结合极差分析结果, 乳酸杆菌发酵菜籽粕的最优条件为A1B1C2D1, 即麸皮添加量(A)0, 料水比(B)1∶1.1, 接种量(C)70 mL·kg-1, 发酵时间(D)60 h。为了节约时间成本, 选择48 h为最优发酵时间。
| 序号Number | 因素Factors | 硫苷降解率/%Degradation of Gls | |||
| A | B | C | D | ||
| 1 | 1(0) | 2(1∶1.2) | 3(90 mL·kg-1) | 3(36 h) | 29.03 |
| 2 | 3(10%) | 3(1∶1.3) | 1(50 mL·kg-1) | 3 | 31.81 |
| 3 | 3 | 2 | 2(70 mL·kg-1) | 1(60 h) | 37.58 |
| 4 | 2(5%) | 1(1∶1.1) | 2 | 3 | 38.90 |
| 5 | 3 | 1 | 3 | 2(48 h) | 35.05 |
| 6 | 1 | 3 | 2 | 2 | 41.03 |
| 7 | 1 | 1 | 1 | 1 | 41.43 |
| 8 | 2 | 2 | 1 | 2 | 34.83 |
| 9 | 2 | 3 | 3 | 1 | 35.96 |
| k1 | 37.16 | 38.46 | 36.02 | 38.32 | |
| k2 | 36.57 | 33.82 | 39.17 | 36.97 | |
| k3 | 34.81 | 36.26 | 33.34 | 33.25 | |
| R | 2.35 | 4.64 | 5.83 | 5.08 | |
| 注: 1)因素编码A、B、C、D分别代表麸皮添加量、料水比、接种量和发酵时间, 括号内为各因素的3个水平; 2)k值表示各因子各水平的硫苷降解率均值, R(极值)=kmax-kmin。 Note: 1)The factor codes A, B, C, D refer to wheat bran addition, rapeseed meal to water ratio, inoculum volume, and fermentation time; 2)k: the mean value of every factor and level, R=kmax-kmin. | |||||
| 因素 Factors |
平方和 Square of deviance |
自由度 Degree of free |
F值 F-value |
F临界值 F critical value |
P值 P-value |
| A | 26.82 | 2 | 13.41 | 1.01 | 0.38 |
| B | 97.12 | 2 | 48.56 | 3.66 | 0.04 |
| C | 153.16 | 2 | 76.58 | 5.77 | 0.01 |
| D | 124.42 | 2 | 62.21 | 4.69 | 0.02 |
| 标准误Standard error(SE) | 238.85 | 18 | 13.27 | ||
| 注: P < 0.05表示对结果影响显著。P < 0.05 means significant difference. | |||||
如表 4所示: 在最优发酵条件下, 与空白组(菜籽粕原料)相比, 对照组中粗蛋白含量显著升高, 硫苷和植酸含量显著降低(P < 0.05), 说明除发酵外, 高压灭菌等处理会对菜籽粕化学成分造成一定的影响; 与空白组相比, 发酵组粗纤维含量显著下降(P < 0.05), 但3组之间的中性洗涤纤维和酸性洗涤纤维含量差异不显著(P>0.05);与对照组相比, 发酵对菜籽粕粗纤维、中性洗涤纤维和酸性洗涤纤维含量均无显著影响(P>0.05)。此外, 发酵分别将硫苷和植酸含量由107.44 μmol·g-1和29.18 mg·g-1降低至60.78 μmol·g-1和26.44 mg·g-1; 发酵组的乳酸杆菌活菌数和乳酸含量显著升高, pH值显著降低(P < 0.05)。
| 项目Items | 空白组Blank | 对照组Control | 发酵组FRSM |
| 粗蛋白含量①/% Crude protein content | 38.41±0.11c | 39.61±0.29b | 42.15±0.41a |
| 三氯乙酸可溶蛋白含量①/% TCA-SP content | 7.89±0.54b | 8.40±0.29b | 14.99±0.71a |
| 粗纤维含量①/% Crude fiber content | 13.28±0.12a | 13.02±0.08ab | 12.92±0.19b |
| 中性洗涤纤维含量①/% NDF content | 39.00±3.31 | 37.82±0.37 | 35.63±1.98 |
| 酸性洗涤纤维含量①/% ADF content | 24.01±5.02 | 19.53±2.13 | 20.08±1.56 |
| 硫苷含量①/(μmol·g-1) Glucosinolate content | 122.92±6.38a | 107.44±5.31b | 60.78±1.75c |
| 植酸含量①/(mg·g-1) Phytic acid content | 30.97±0.30a | 29.18±0.54b | 26.44±0.48c |
| pH值pH value | 6.02±0.04a | 5.93±0.02b | 5.12±0.02c |
| 乳酸含量/(mmol·kg-1) Lactic acid content | 1.73±1.13b | 1.86±0.50b | 146.42±6.62a |
| 总乳酸杆菌活菌数/lg[c/(CFU·g-1)] Viable count of Lactobacillus | 8.23±0.13 | ||
| 注: ①均以干物质计Dry matte basis. 同行数据后不同字母表示差异显著(P < 0.05)。Different letters in the same row mean significant difference between the treatments(P < 0.05). FRSM: Fermented rapeseed meal; TCA-SP: Trichloroacetic acid soluble protein; NDF: Neutral detergent fiber; ADF: Acid detergent fiber. | |||
乳酸杆菌能发酵碳水化合物产生乳酸, 降低发酵液的pH值。但这类细菌是异养型微生物, 缺乏生长因子生物合成的能力, 通常需要复杂的营养素才能正常生长。本试验中, 菜籽粕组发酵48 h后的乳酸杆菌活菌数和乳酸含量均高于MRS组, 说明3株混合菌能利用菜籽粕中的营养物质生长增殖, 且能利用菜籽粕发酵产酸。据报道, 乳酸杆菌能通过糖酵解途径发酵己糖, 通过戊糖磷酸途径发酵戊糖产生乳酸和CO2[25]。MRS中的主要碳源是葡萄糖(己糖), 而菜籽粕中除葡萄糖外, 还含有木糖、阿拉伯糖等戊糖[26], 这可能是菜籽粕发酵时累积产气量随发酵时间的增加而升高, 而MRS中无明显产气的原因。菜籽粕中初始可溶性还原糖和游离氨基氮(主要为游离态的氨基酸)含量较低, 说明菜籽粕中营养物质主要以不可溶的形式被乳酸杆菌利用; 而发酵48 h时游离氨基氮在菜籽粕和MRS中均升高, 而经过发酵前的高压灭菌, 菜籽粕中内源性蛋白酶已失活, 说明乳酸杆菌在发酵过程中可将大分子蛋白分解为小分子含氮物。
3.2 影响乳酸杆菌发酵菜籽粕的条件麸皮能够疏松发酵培养基, 减少底物成团[27]。Shi等[5]指出, 菜籽饼中添加30%的麸皮促进了黑曲霉菌的硫苷降解率, 而本试验中麸皮添加量对硫苷降解率无显著促进作用, 这可能是黑曲霉菌和乳酸杆菌对底物利用的优先性以及分泌硫苷降解酶能力不同所致。Roland等[28]报道, 麸皮中约20%的碳水化合物具有可溶性, 而乳酸杆菌更倾向于利用可溶性碳源, 这可能导致乳酸杆菌对麸皮优先利用, 使其对菜籽粕硫苷降解减少。培养基中的料水比是影响固态发酵的关键因素之一, 本试验结果表明, 料水比在1∶1.1时硫苷降解率最高, 进一步升高料水比导致硫苷降解率下降, 其原因可能是基质中水分的降低使养分溶解度降低, 从而影响细菌的生长; 而料水比降低也会导致基质间的孔隙缩小, 从而降低气体和热量的传递[29]。接种量是决定发酵过程中微生物生长的重要因素, 本试验结果显示, 最适接种量为7%, 此时发酵培养基中初始有效活菌数约为70 mL·kg-1, 当有效活菌数不足时, 会使微生物生长的滞后期延长[30], 而过高的活菌数会导致菌体聚集成团, 从而影响细菌对营养物质的利用及微生物酶的释放[31]。发酵时间与微生物的生长阶段密切相关。研究表明, 使用黑曲霉菌发酵菜籽粕48 h, 硫苷降解率最高[5]。本试验中, 乳酸杆菌发酵菜籽粕48 h将硫苷由107.44 μmol·g-1降低至60.78 μmol·g-1, 这与乳酸杆菌能够在短时间内(18~24 h)进入平台期, 且在48 h时还能够保持一定的活性有关。经过正交试验优化以上条件, 硫苷降解率达到了43.43%, 优于正交试验各组中最高水平(41.43%)。
3.3 最优条件发酵菜籽粕对其营养成分的影响有研究表明, 生长猪最多能耐受日粮中2.0~2.5 μmol·g-1的硫苷[32], 说明硫苷限制了菜籽粕在猪日粮中的添加量。硫苷的主要结构包含1个葡萄糖分子和1个含硫基团[33], 乳酸杆菌固态发酵降低了菜籽粕中硫苷含量, 其含量的降低可能是微生物酶对硫苷中葡萄糖的利用引起的。Palop等[34]报道称, Lactobacillus agilis R16能够降解硫苷产生葡萄糖, 进一步将其发酵产生乳酸。本试验中, 乳酸杆菌发酵使菜籽粕的硫苷含量降低43.43%。这与前人的研究结果相似, Weng等[27]使用Candida tropicalis发酵菜籽粕48 h, 硫苷含量降低52.61%。Tang等[35]发现, 乳酸杆菌还能产生植酸酶, 降解植酸中的磷酸, 最终形成肌醇。本试验中, 与未发酵组相比, 乳酸杆菌发酵菜籽粕中的植酸降低了9.39%。饲料中的植酸(Myo-inositol hexakisphosphate, 肌醇六磷酸)是一种矿物质吸收抑制剂, 它能够与带正电的二价阳离子包括铁、锌、钙等结合, 形成稳定的植酸复合物, 从而抑制肠道对矿物质的吸收[36], 说明植酸的降低能够改善菜籽粕中矿物质的利用率。
与未发酵组相比, 乳酸杆菌发酵菜籽粕的粗蛋白含量提高了6.41%, 三氯乙酸可溶蛋白含量提高78.45%。粗蛋白含量的提高可能与乳酸杆菌对菜籽粕中其他营养物质利用有关, 导致氮元素相对含量升高。Shi等[5]研究表明, 粗蛋白的增加与发酵基质中碳水化合物的减少密切相关。乳酸杆菌具有分泌蛋白水解酶的能力[37-38], 可将大分子蛋白质水解为小分子肽和氨基酸。三氯乙酸可溶蛋白主要由小肽和游离氨基酸组成, 其含量增加可能是由于乳酸杆菌发酵过程中产生的酶将大分子蛋白降解所致, 这有利于动物对菜籽粕蛋白的利用, 说明乳酸杆菌发酵改善了菜籽粕蛋白品质。发酵对菜籽粕中纤维(粗纤维、中性洗涤纤维和酸性洗涤纤维)的降解均无显著作用, 这可能是由于本试验所用菌株分泌纤维降解酶的能力有限。
综上, 3株混合乳酸杆菌可利用菜籽粕生长, 具有发酵潜力; 通过正交试验, 优化了乳酸杆菌发酵菜籽粕的条件: 麸皮添加量0%, 料水比1∶1.1, 接种量70 mL·kg-1, 发酵时间48 h; 在最优条件下, 乳酸杆菌能显著降低菜籽粕中硫苷含量, 改善其营养价值, 但对纤维的降解能力有限。
| [1] |
Wang X, Jin Q, Wang T, et al. Screening of glucosinolate-degrading strains and its application in improving the quality of rapeseed meal[J]. Annals of Microbiology, 2012, 62(3): 1013-1020. DOI:10.1007/s13213-011-0341-3 |
| [2] |
Li Z, Li Y, Lv Z, et al. Net energy of corn, soybean meal and rapeseed meal in growing pigs[J]. Journal of Animal Science and Biotechnology, 2017, 8(1): 1-10. DOI:10.1186/s40104-016-0130-8 |
| [3] |
Kocher A, Choct M, Porter M, et al. The effects of enzyme addition to broiler diets containing high concentrations of canola or sunflower meal[J]. Poultry Science, 2000, 79(12): 1767-1774. DOI:10.1093/ps/79.12.1767 |
| [4] |
Hansen J, Øverland M, Skrede A, et al. A meta-analysis of the effects of dietary canola/double low rapeseed meal on growth performance of weanling and growing-finishing pigs[J]. Animal Feed Science and Technology, 2020, 259: 114302. DOI:10.1016/j.anifeedsci.2019.114302 |
| [5] |
Shi C, He J, Yu J, et al. Solid state fermentation of rapeseed cake with Aspergillus niger for degrading glucosinolates and upgrading nutritional value[J]. Journal of Animal Science and Biotechnology, 2015, 6(1): 1-7. DOI:10.1186/2049-1891-6-1 |
| [6] |
Shi C, Zhang Y, Lu Z, et al. Solid-state fermentation of corn-soybean meal mixed feed with Bacillus subtilis and Enterococcus faecium for degrading antinutritional factors and enhancing nutritional value[J]. Journal of Animal Science and Biotechnology, 2017, 8(1): 1-9. DOI:10.1186/s40104-016-0130-8 |
| [7] |
丁鹏, 丁亚南, 曾青华, 等. 发酵饲料桑粉对宁乡花猪抗氧化性能和肠道功能的影响[J]. 动物营养学报, 2019, 31(9): 4303-4313. Ding P, Ding Y N, Zeng Q H, et al. Effects of fermented forage mulberry powder on antioxidant performance and intestinal function of Ningxiang pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(9): 4303-4313 (in Chinese with English abstract). |
| [8] |
Aljuobori A, Abdullah N, Zulkifli I, et al. Lactobacillus salivarius fermentation reduced glucosinolate and fibre in canola meal[J]. Journal of Food Research, 2014, 3(5): 95. DOI:10.5539/jfr.v3n5p95 |
| [9] |
Wang L, Zhou H, He R, et al. Effects of soybean meal fermentation by Lactobacillus plantarum P8 on growth, immune responses, and intestinal morphology in juvenile turbot(Scophthalmus maximus L.)[J]. Aquaculture, 2016, 464: 87-94. DOI:10.1016/j.aquaculture.2016.06.026 |
| [10] |
Mullaney J A, Kelly W J, McGhie T K, et al. Lactic acid bacteria convert glucosinolates to nitriles efficiently yet differently from Enterobacteriaceae[J]. Journal of Agricultural and Food Chemistry, 2013, 61(12): 3039-3046. DOI:10.1021/jf305442j |
| [11] |
Hole A S, Rud I, Grimmer S, et al. Improved bioavailability of dietary phenolic acids in whole grain barley and oat groat following fermentation with probiotic Lactobacillus acidophilus, Lactobacillus johnsonii, and Lactobacillus reuteri[J]. Journal of Agricultural and Food Chemistry, 2012, 60(25): 6369-6375. DOI:10.1021/jf300410h |
| [12] |
Gao Y, Qian Z, Jiang L, et al. Microbe selection and optimizing process parameters for degradation of glucosinolates in rapeseed meal by box-behnken design[J]. Agricultural Science, 2015, 3(2): 1-12. DOI:10.12735/as.v3i2p01 |
| [13] |
Zhang J, Yang Q. Optimization of solid-state fermentation conditions for Trichoderma harzianum using an orthogonal test[J]. Genetics and Molecular Research, 2015, 14(1): 1771-1781. DOI:10.4238/2015.March.13.4 |
| [14] |
张桢, 朱晓峰, 崔雷鸿, 等. 猪源乳酸杆菌的安全性及抗逆性评价[J]. 畜牧与兽医, 2021, 53(1): 31-35. Zhang Z, Zhu X F, Cui L H, et al. Evaluation of safety and stress resistance of L.ctobacilli isolated from swine[J]. Animal Husbandry and Veterinary Medicine, 2021, 53(1): 31-35 (in Chinese with English abstract). |
| [15] |
李雪莉, 王超, 虞德夫, 等. 猪源乳酸菌的分离、鉴定及其生物学特性[J]. 微生物学报, 2017, 57(12): 1879-1887. Li X L, Wang C, Yu D F, et al. Isolation, identification and characterization of lactic acid bacteria from swine[J]. Acta Microbiologica Sinica, 2017, 57(12): 1879-1887 (in Chinese with English abstract). |
| [16] |
Theodorou M, Williams B, Dhanoa M, et al. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds[J]. Animal Feed Science and Technology, 1994, 48(3/4): 185-197. |
| [17] |
叶磊, 杨学敏. 微生物检测技术[M]. 北京: 化学工业出版社, 2009: 191-192. Ye L, Yang X M. Microbiological Detection Technology[M]. Beijing: Chemical Industry Press, 2009: 191-192 (in Chinese). |
| [18] |
Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428. DOI:10.1021/ac60147a030 |
| [19] |
Abernathy D G, Spedding G, Starcher B. Analysis of protein and total usable nitrogen in beer and wine using a microwell ninhydrin assay[J]. Journal of the Institute of Brewing, 2009, 115(2): 122-127. DOI:10.1002/j.2050-0416.2009.tb00356.x |
| [20] |
Bradstreet R B. Kjeldahl method for organic nitrogen[J]. Analytical Chemistry, 1954, 26(1): 185-187. DOI:10.1021/ac60085a028 |
| [21] |
Ovissipour M, Abedian A, Motamedzadegan A, et al. The effect of enzymatic hydrolysis time and temperature on the properties of protein hydrolysates from Persian sturgeon(Acipenser persicus) viscera[J]. Food Chemistry, 2009, 115(1): 238-242. DOI:10.1016/j.foodchem.2008.12.013 |
| [22] |
张丽英. 饲料分析及饲料质量检测技术[M]. 2版. 北京: 中国农业大学出版社, 2003: 15-21. Zhang L Y. Feed Analysis and Feed Quality Testing Technology[M]. 2nd ed. Beijing: China Agricultural University Press, 2003: 15-21 (in Chinese). |
| [23] |
Wang X, Jin Q, Tong W, et al. Screening of glucosinolate-degrading strains and its application in improving the quality of rapeseed meal[J]. Annals of Microbiology, 2012, 62(3): 1013-1020. DOI:10.1007/s13213-011-0341-3 |
| [24] |
Nair V, Laflamme J, Duvnjak Z. Production of phytase by Aspergillus ficuum and reduction of phytic acid content in canola meal[J]. Journal of the Science of Food and Agriculture, 1991, 54(3): 355-365. DOI:10.1002/jsfa.2740540306 |
| [25] |
Reddy G, Altaf M, Naveena B J, et al. Amylolytic bacterial lactic acid fermentation: a review[J]. Biotechnology Advances, 2008, 26(1): 22-34. DOI:10.1016/j.biotechadv.2007.07.004 |
| [26] |
Pustjens A M, de Vries S, Gerrits W J J, et al. Residual carbohydrates from in vitro digested processed rapeseed(Brassica napus) meal[J]. Journal of Agricultural and Food Chemistry, 2012, 60(34): 8257-8263. DOI:10.1021/jf301160m |
| [27] |
Weng X, Sun J. Biodegradation of free gossypol by a new strain of Candida tropicalis under solid state fermentation: effects of fermentation parameters[J]. Process Biochemistry, 2006, 41(7): 1663-1668. DOI:10.1016/j.procbio.2006.03.015 |
| [28] |
Roland N, Nugon-Baudon L, Andrieux C, et al. Comparative study of the fermentative characteristics of inulin and different types of fibre in rats inoculated with a human whole faecal flora[J]. The British Journal of Nutrition, 1995, 74(2): 239-249. DOI:10.1079/BJN19950127 |
| [29] |
Bansal N, Tewari R, Soni R, et al. Production of cellulases from Aspergillus niger NS-2 in solid state fermentation on agricultural and kitchen waste residues[J]. Waste Management, 2012, 32(7): 1341-1346. DOI:10.1016/j.wasman.2012.03.006 |
| [30] |
Sharma D K, Tiwari M, Behera B K. Solid-state fermentation of new substrates for production of cellulase and other biopolymer-hydrolyzing enzymes[J]. Applied Biochemistry and Biotechnology, 1995, 51/52(1): 495-500. DOI:10.1007/BF02933450 |
| [31] |
Omojasola P F, Jilani O P. Cellulase production by Trichoderma longi, Aspergillus niger and Saccharomyces cerevisae cultured on waste materials from orange[J]. Pakistan Journal of Biological Sciences, 2008, 11(20): 2382-2388. DOI:10.3923/pjbs.2008.2382.2388 |
| [32] |
Bell J M. Factors affecting the nutritional value of canola meal: a review[J]. Canadian Journal of Animal Science, 1993, 73(4): 689-697. DOI:10.4141/cjas93-075 |
| [33] |
Hanschen F S, Lamy E, Schreiner M, et al. Reactivity and stability of glucosinolates and their breakdown products in foods[J]. Angewandte Chemie International Edition, 2014, 53(43): 11430-11450. DOI:10.1002/anie.201402639 |
| [34] |
Palop M L, Smiths J P, Brink B T. Degradation of sinigrin by Lactobacillus agilis strain R16[J]. International Journal of Food Microbiology, 1995, 26(2): 219-229. DOI:10.1016/0168-1605(95)00123-2 |
| [35] |
Tang A L, Wilcox G, Walker K Z, et al. Phytase activity from Lactobacillus spp. in calcium-fortified soymilk[J]. Journal of Food Science, 2010, 75(6): M373-M376. DOI:10.1111/j.1750-3841.2010.01663.x |
| [36] |
Humer E, Schwarz C, Schedle K. Phytate in pig and poultry nutrition[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(4): 605-625. DOI:10.1111/jpn.12258 |
| [37] |
Yin Y, Wang J, Yang S, et al. Protein degradation in wheat sourdough fermentation with Lactobacillus plantarum M616[J]. Interdisciplinary Sciences: Computational Life Sciences, 2015, 7(2): 205-210. DOI:10.1007/s12539-015-0262-0 |
| [38] |
Solieri L, de Vero L, de Tagliazucchi D. Peptidomic study of casein proteolysis in bovine milk by Lactobacillus casei PRA205 and Lactobacillus rhamnosus PRA331[J]. International Dairy Journal, 2018, 85: 237-246. DOI:10.1016/j.idairyj.2018.06.010 |




