文章信息
- 廉乐乐, 薛娇, 李婉君, 任建鸾, 诸葛祥凯, 汤芳, 薛峰, 戴建君
- LIAN Lele, XUE Jiao, LI Wanjun, REN Jianluan, ZHUGE Xiangkai, TANG Fang, XUE Feng, DAI Jianjun
- 副溶血弧菌Ⅲ型分泌系统1内杆状蛋白基因vscI的功能分析
- Functional analysis of the inner rod protein gene vscI in Vibrio parahaemolyticus Type Ⅲ secretion system 1
- 南京农业大学学报, 2021, 44(3): 506-513
- Journal of Nanjing Agricultural University, 2021, 44(3): 506-513.
- http://dx.doi.org/10.7685/jnau.202003056
-
文章历史
- 收稿日期: 2020-03-27
2. 中国药科大学, 江苏 南京 211199
2. China Pharmaceutical University, Nanjing 211199, China
副溶血弧菌(Vibrio parahemolyticus)属于革兰阴性致病菌, 常在沿海地区引发食物中毒而导致胃肠炎和败血症[1]。随着人民生活水平的提高和海产品消费的增加, 副溶血性弧菌已经成为主要食源性致病菌之一[2]。Ⅲ型分泌系统(Type Ⅲ secretion systems, T3SS)作为该菌的重要毒力因子由高度组织化的多种蛋白组成, 位于1号(T3SS1)与2号(T3SS2)染色体, 分别表现为细胞毒性与肠毒性[3]。T3SS1由vp1656至vp1702基因簇编码, 主要由结构蛋白、效应蛋白、输出装置蛋白以及伴侣蛋白组成。
在一些革兰阴性菌中, 已有相关研究报道T3SS内杆状蛋白的生物学功能[4-6]。肠道致病性大肠杆菌内杆状蛋白EscI与EcsU通过互作共同控制T3SS装置基底座结构(substrate), 调控效应子的分泌, 同时与外膜分泌素EscC结合后增强其支持功能[5]。在小鼠感染模型上, 表达融合有EcsI效应蛋白的肠致病性大肠杆菌进入巨噬细胞后, 通过激活核效应蛋白(NLRC4)炎性小体可限制该菌在小鼠脾脏和肝脏中的定殖, 为大肠杆菌疫苗的研制提供理论支持[7]。在鼠伤寒沙门菌中, 内杆状蛋白PrgI通过控制基底座来调控效应子的分泌以及胞外针状结构长度[6]。在耶尔森菌T3SS1中发现内杆状蛋白YscI与针状蛋白YscF存在互作, 参与组装针状结构[4], 且YscP和YscU会切换分泌系统的底物特异性, 便于在针头达到适当长度后即可输出易位蛋白Yop, 内杆状蛋白YscI在底物特异性切换中起关键作用[8]。对于副溶血弧菌T3SS1的研究表明, VP1656、VP1657作为输出装置蛋白, 保证效应蛋白正常易位至宿主细胞胞浆内[9]; VP1680、VP1683、VP1686以及VPA0450效应蛋白作为毒力因子干扰宿主细胞正常生理活动[10-13]; VPA0451为VPA0450的伴侣蛋白[14]。然而, vscI编码的内杆状蛋白VscI功能未见相关报道。
研究vscI基因在菌体细胞毒性中发挥的作用, 对于阐明副溶血弧菌T3SS1的致病机制很重要。本研究通过生物学分析发现, 副溶血弧菌的VscI与沙门菌的EscI、耶尔森氏菌的YscI同源, 故以vscI为研究对象, 挖掘其在感染宿主细胞时所扮演的生物学角色, 为内杆状蛋白VscI在T3SS1中的作用提供支持。
1 材料与方法 1.1 材料、试剂及仪器副溶血弧菌参考菌株RIMD2210633、tdhAS缺陷菌株POR-1以及其他菌株和HeLa细胞均由本实验室保存(表 1)。质粒pYAK1等信息见表 1。
| 菌株/质粒 Strains/plasmids |
特性 Characteristics |
来源/参考文献 Sources/references |
| 菌株Strains | ||
| Escherichia coli SM10 λpir | Thi Thr Leu tonA lacy supE recA: RP4-2-Tc: Mu λpir, OriT of RP4 Kmr; conjugational donor | [15] |
| Vibrio parahaemolyticus | ||
| KXV237 | RIMD 2210633(KP positive, serotype O3∶K6) | [16] |
| POR-1 | tdhAS derivative of KXV237 | [17] |
| ΔvscI | POR-1 knockout of vscI gene | This study |
| CΔvscI | vscI complementation studies | This study |
| POR-1/VP1683-CyaA | POR-1 containing pMMB207-vp1683-CyaA | This study |
| ΔvscI/VP1683-CyaA | ΔvscI containing pMMB207-vp1683-CyaA | This study |
| CΔvscI/VP1683-CyaA | CΔvscI containing pMMB207-vp1683-CyaA | This study |
| POR-1/VP1686-CyaA | POR-1 containing pMMB207-vp1686-CyaA | This study |
| ΔvscI/VP1686-CyaA | ΔvscI containing pMMB207-vp1686-CyaA | This study |
| CΔvscI/VP1686-CyaA | CΔvscI containing pMMB207-vp1686-CyaA | This study |
| 质粒Plasmids | ||
| pYAK1 | R6K-ori suicide vector containing sacB gene | [18] |
| pYAK1-ΔvscI | Suicide vector pYAK1 for generating the vscI deletion mutants | This study |
| pYAK1-CΔvscI | Suicide vector pYAK1 for generating the vscI complementation mutants | This study |
| pMMB207 | Expression vector for V. parahaemolyticus, Cmr | [19] |
| pMMB207-vp1683-CyaA | Derivative of pMMB207, encoding a fusion of vp1683 with the catalytic domain of adenylate cyclase(CyaA)at C-terminus from Bordetella pertussis | This study |
| pMMB207-vp1686-CyaA | Derivative of pMMB207, encoding a fusion of vp1686 with the catalytic domain of adenylate cyclase(CyaA)at C-terminus from Bordetella pertussis | This study |
乳酸脱氢酶(LDH)细胞毒性检测试剂盒、细胞微管红色荧光探针(Tubulin-Tracker Red)和GreenNucTM活细胞Caspase-3酶活性检测试剂盒, 均购自碧云天生物技术有限公司(Beyotime); DAPI细胞核荧光染料、PI染色液和蛋白提取试剂盒, 均购自南京凯基生物科技有限公司; cAMP检测试剂盒(KGE002B)购自R & D System生物科技有限公司; CyaA抗体购自圣克鲁斯生物技术有限公司; ECL化学发光液购自美国通用(GE)公司; 同源重组试剂盒购自南京诺唯赞生物科技有限公司。
仪器: 赛默飞世尔科技(中国)有限公司的细胞培养箱(培养条件5% CO2, 37 ℃); 德国卡尔·蔡司公司的荧光倒置显微镜(ZEISS Oxio Observer); 美国BD公司的流式细胞仪; 上海天能科技有限公司的曝光仪; 瑞士TECAN公司的多功能酶标仪。
1.2 方法 1.2.1 VscI蛋白的结构分析vscI(NP_798070.1)ORF长度345 bp, 编码VscI蛋白共115个氨基酸。为了全面研究VscI蛋白, 通过BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线数据库工具查找VscI蛋白进化树, 利用Phyre2(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index)检索并预测该蛋白的二级结构。
1.2.2 vscI缺失株及回补株的构建vscI基因ORF总长345 bp, 共编码115个氨基酸。tdhAS作为副溶血弧菌RIMD2210633重要毒力因子, 其缺失株POR-1作为T3SS1研究的基础菌株[17, 19]。本试验在POR-1基础上构建缺失株ΔvscI, 方法参照文献[3]。选择基因组回补构建回补株CΔvscI, 将回补区域内的CAA同义突变成CAG(用来区分野生株与回补株), 两者均编码谷氨酰胺。将上述构建DNA片段与自杀质粒pYAK1连接转入大肠杆菌SM10λpir宿主菌, 通过接合转移最终将其转入POR-1菌株。经氯霉素与TCBS双筛选后, 菌株通过不断传代诱导其发生二次同源重组, 蔗糖负压筛选结合内部/外部PCR扩增方法对缺失株进行筛选鉴定。在缺失菌株的基础上, 将构建好的含有单核苷酸突变ORF与pYAK1载体连接, 以相同的方法对vscI基因进行基因组回补。所用引物已上传NCBI的Probe数据库(登录号: BankIt2344979 NC_004603.1:c1803498—1803154 MT475884)。具体序列见表 2。
| 引物名称 Primer name |
引物序列 Primer sequence(5′→ 3′) |
引物名称 Primer name |
引物序列 Primer sequence(5′→ 3′) |
|
| vscI-1 | CAGGTCGACTCTAGAGGATCCGTATGCGTCGATCAAGGA | C-vscI-2 | ATCTTGCAACTTCTCAAGGTTGGTTTGCAT | |
| vscI-2 | TTATTCTTCATTCTCAAGGTTGGTTTGC | C-vscI-3 | ACCTTGAGAAGTTGCAAGATGCTCAAGTCG | |
| vscI-3 | ACCTTGAGAATGAAGAATAAAATGCGCACG | C-vscI-4 | CGAGCTCGGTACCCGGGGATCCGATGCCGAAGCAGGAGTC | |
| vscI-4 | CGAGCTCGGTACCCGGGGATCCGATGCCGAAGCAGGAGTC | vscI-NF | TGCAAGATGCTCAAGTCG | |
| C-vscI-1 | CAGGTCGACTCTAGAGGATCCGTATGCGTCGATCAAGGA | vscI-NR | TGTGGTTTTACCCACGGT | |
| 注: 下划线表示pYAK1载体同源臂。The homology arm of pYAK1 vectors that were introduced in primers are underlined. | ||||
过夜培养野生株POR-1、缺失株ΔvscI、CΔvscI, 按1∶100比例分别接入50 mL LB液体培养基中, 37 ℃摇床220 r·min-1培养, 每隔1 h取样1次, 测D600值。进行3次平行试验。统计数据后使用GraphPad Prism绘制生长曲线, 并进行方差分析和差异显著性分析。
1.2.4 细胞毒性测定HeLa、Caco-2和Raw264.7细胞均匀铺于96孔板, 用含有体积分数为10%胎牛血清的DMEM培养至80%~90%。POR-1、ΔvscI以及CΔvscI等菌株用普通LB培养至对数期。用PBS洗涤细胞后与PBS洗涤后的细菌以1∶10的感染复数(MOI), 在含1%血清的DMEM共培养3 h左右。依据LDH细胞毒性测定试剂盒说明书定量各试验组细胞向培养基释放的LDH量。试验重复3次。另外, 用相同MOI感染的HeLa细胞与微管红色荧光探针(Tubulin-Tracker Red)(5% BSA、0.1% Trition X-100)共孵育1 h后, 在37 ℃恒温箱与DAPI共孵育15 min, 进行复染。将试验样品用PBS洗涤3次, 用蔡司Oxio倒置显微镜10倍放大观察上述试验组的细胞形态变化。
1.2.5 细胞黏附率测定细胞黏附率测定的感染方法参考上述细胞毒性测定, 不同的是HeLa细胞铺于12孔板。感染3 h后用灭菌PBS轻轻洗涤3次(除去未黏附的细菌), 每孔加入500 μL体积分数为0.01% TritonX-100, 室温作用10 min。收集上述样品, 用PBS倍比稀释, 每个稀释度3次重复。在合适的稀释度取10 μL滴加于15 g·L-1的普通固体平板。选择菌落数为30~300的平板进行计数, 再计算细菌黏附率。正常细菌作为阳性对照。计算公式如下:

|
利用DNA螯合荧光染料碘化丙啶(PI)和Caspase-3/7绿色荧光底物检测不同感染组细胞当中凋亡细胞数所占比例。采用上述相同的感染方法, 2.5 g·L-1胰蛋白酶消化细胞, 600 g离心5 min, 收集细胞, 用PBS洗涤3次。用Caspase-3活细胞检测试剂盒(5 μmol·L-1)与PI(10 μmol·L-1)室温条件下染色30 min。用FACS检测荧光信号。以PBS处理HeLa细胞作为空白细胞对照并设为物理门, 以2种染料分别单染以设立化学门, 分析试验数据。同一样本设3个重复。
1.2.7 腺苷酸环化酶报告载体的构建通过腺苷酸环化酶报告载体研究真核细胞内原核细菌效应子的易位量。VP1683和VP1686属于副溶血弧菌T3SS1效应蛋白。首先利用下列引物A1/A2扩增vp1683与vp1686片段, A3/A4扩增腺苷酸环化酶催化结构域(CyaA)DNA片段, 用融合PCR技术将上述扩增片段连接, 同源重组试剂盒与BamHⅠ线性化pMMB207载体连接并转化大肠杆菌SM10λpir, 经氯霉素抗性平板筛选后挑取单菌落进行PCR鉴定。选择PCR鉴定阳性菌落进行测序, 测序正确的即为成功构建的pMMB207-vp1683-CyaA和pMMB207-vp1686-CyaA载体。
| 引物名称 Primer name |
引物序列 Primer sequence(5′→ 3′) |
引物名称 Primer name |
引物序列 Primer sequence(5′→ 3′) |
|
| pMMB207-vp1683-CyaA 1 | GAGCTCGGTACCCGGGGATCCATGGTTAATATCAATACGTC | pMMB207-vp1686-CyaA 1 | GAGCTCGGTACCCGGGGATCCATGATCAGTTTTGGAAATGT | |
| pMMB207-vp1683-CyaA 2 | GCGATTGCTGACCAAGTTTGTGGCTAT | pMMB207-vp1686-CyaA 2 | GCGATTGCTGTTTGATACCGTGAAGGCTAT | |
| pMMB207-vp1683-CyaA 3 | CAAACTTGGTCAGCAATCGCATCAGGCTGG | pMMB207-vp1686-CyaA 3 | CGGTATCAAACAGCAATCGCATCAGGCTGG | |
| pMMB207-vp1683-CyaA 4 | CAGGTCGACTCTAGAGGATCCTTATGTCATAGCCGGAATCC | pMMB207-vp1686-CyaA 4 | CAGGTCGACTCTAGAGGATCCTTATGTCATA GCCGGAATCC | |
| 注: 下划线表示pMMB207载体同源臂。The homology arms of pMMB207 vectors that were introduced in primers are underlined. | ||||
含有pMMB207-vp1683-CyaA和pMMB207-vp1686-CyaA的大肠杆菌SM10λpir与POR-1、ΔvscI以及CΔvscI菌株分别以1∶1比例混合并接合转移, 将上述载体转入副溶血弧菌; 用相同方式感染HeLa细胞2~3 h后, 用cAMP assay ELISA试剂盒检测细胞内cAMP的产生量。
为了对上述结果进行双重验证, 用Western blot对HeLa细胞内CyaA进行定量。用含有上述过表达载体的菌株感染HeLa细胞2~3 h后按照说明使用试剂盒(KeyGEN BioTECH)提取HeLa细胞全蛋白, 5×SDS Loading Buffer收样, 沸水煮10 min, 120 g·L-1 SDS-PAGE分离胶分离蛋白, 转至聚偏二氟乙烯膜(PVDF, Millipore), CyaA抗体(Santa Cruz)孵育, ECL化学发光液显色并拍照。利用ImageJ进行相对灰度值分析(CyaA/Loading), 用GraphPad Prism绘制结果并进行差异显著性分析。
2 结果与分析 2.1 缺失株及回补株的构建从含有氯霉素的TCBS平板挑取单菌落, 用内部引物vscI-NF/R及外部引物vscI-1/4进行PCR鉴定。鉴定结果(图 1)显示: 与POR-1相比, 缺失株ΔvscI经内部引物鉴定无条带, 经外部引物扩增片段偏小, 回补株CΔvscI的内、外部引物扩增条带与POR-1一致。表明ΔvscI与CΔvscI均构建成功。

|
图 1 vscI缺失株及回补株的PCR鉴定结果 Fig. 1 PCR identification results of the ΔvscI and CΔvscI M. DL2000 DNA标准; 1.RIMD 2210633内部引物; 2. POR-1内部引物; 3. ΔvscI内部引物; 4. CΔvscI内部引物; 5、11. 阳性对照; 6、12. 阴性对照; 7. RIMD 2210633外部引物; 8. POR-1外部引物; 9. ΔvscI外部引物; 10. CΔvscI外部引物。 M. DL2000 DNA marker; 1. RIMD 2210633 internal primer; 2. POR-1 internal primer; 3. ΔvscI internal primer; 4. CΔvscI internal primer; 5, 11. Positive control; 6, 12. Negative control; 7. RIMD 2210633 external primer; 8. POR-1 external primer; 9. ΔvscI external primer; 10. CΔvscI external primer. |
BLAST分析结果显示: VscI与加勒比海弧菌(Vibrio caribbeanicus)的TS33内杆状组分(the inner rod subunit)来自同一祖先, 属于YscI/HrpB家族。Phyre2预测的二级结构显示为α螺旋, 这种二级结构稳定, 对于一些蛋白质的整体构象起支撑作用(图 2)。
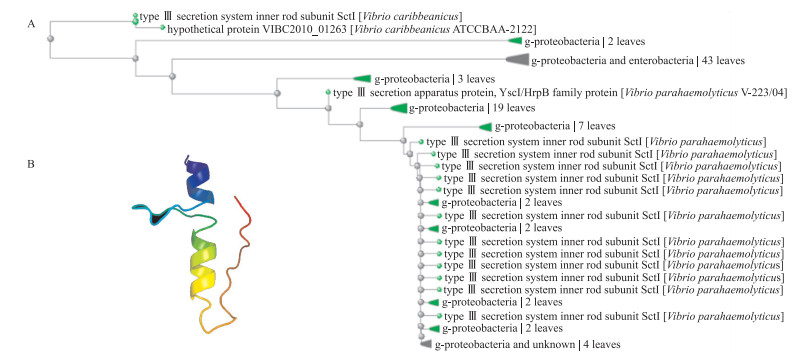
|
图 2 VscI的进化树分析(A)与二级结构预测(B) Fig. 2 Phylogenetic tree construction(A)and secondary prediction(B)of VscI |
从图 3可见: 野生株、回补株、缺失株间的生长情况并无显著差异(P>0.05), 表明vscI基因的缺失对副溶血弧菌的生长并无影响。
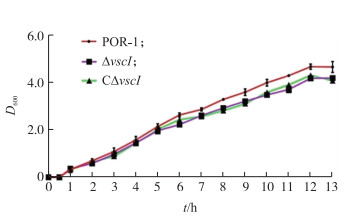
|
图 3 不同菌株的生长曲线 Fig. 3 Growth curve of different strains |
菌株POR-1、ΔvscI与CΔvscI分别感染HeLa细胞, 结果显示: 野生株POR-1与回补株CΔvscI感染组细胞圆形化, 细胞骨架受损, 荧光染色聚集胞核周边; 而缺失株ΔvscI感染组细胞基本保持正常形态, 胞内黑色颗粒均匀分布, 骨架呈放射状分布, 细胞核形态正常, 核边缘光滑整齐(图 4)。表明vscI缺失降低了菌株对HeLa细胞的损伤。

|
图 4 不同菌株感染下HeLa细胞的形态(左)和细胞微管蛋白荧光染色(红色)及细胞核染色(蓝色)(右)观察 Fig. 4 Cell morphological changes(left)infected by different strains, cells stained for Tubulin-Track(red)and cells stained with DAPI(blue)(right) |
细胞毒性结果显示: POR-1与ΔvscI存在极显著差异(P < 0.001), ΔvscI LDH检出量下降了60%(图 5-A)。黏附结果显示: POR-1与ΔvscI黏附率存在极显著差异(P < 0.001), ΔvscI的黏附率下降了85%(图 5-B)。回补株的细胞毒性与黏附性均得到恢复。
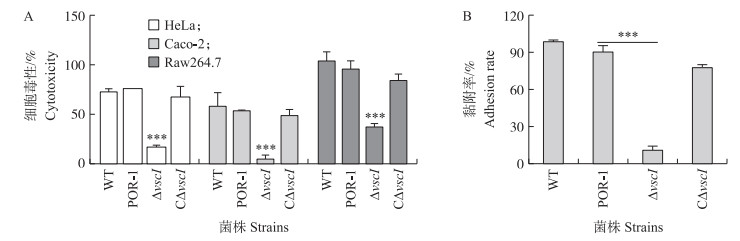
|
图 5 不同菌株感染对细胞毒性(A)和黏附率(B)的影响 Fig. 5 Effects of cytotoxicity(A)and adhesion rate(B)in HeLa cellsinfected by different strains |
Caspase-3染色荧光检测结果显示: 缺失株试验组与POR-1试验组相比, Casepase-3的荧光从89.3%显著下降至8.9%, 回补株从8.9%升高至72.1%(图 6-A)。缺失株试验组PI染色结果显示: 红色荧光细胞数量从97.2%显著下降至1.7%, 回补株从1.7%升高至75.4%(图 6-B), 表明vscI的缺失降低副溶血弧菌对HeLa细胞的损伤, 直接或间接参与细胞凋亡。
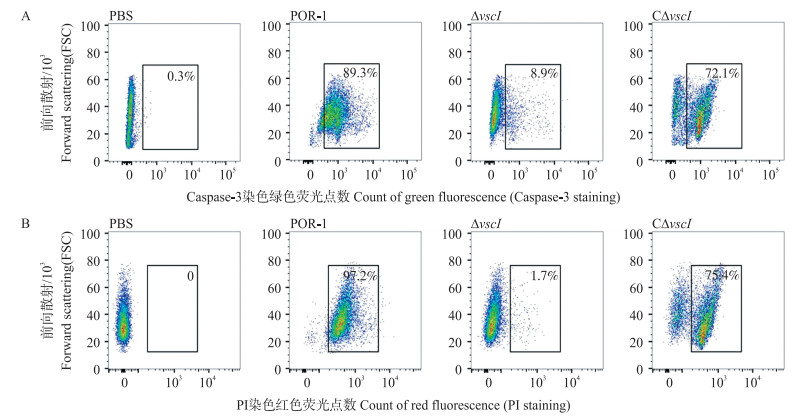
|
图 6 Caspase-3染色(A)和PI染色(B)检测不同菌株感染对HeLa细胞凋亡的影响 Fig. 6 Detection of apoptosis caused by different strains usingCaspase-3 staining(A)and PI staining(B) |
cAMP试剂盒检测结果显示, 与含有过表达载体的POR-1感染细胞组相比, ΔvscI感染HeLa细胞内cAMP含量显著或极显著下降(P < 0.05或P < 0.01)(图 7-A)。同时, CyaA抗体检测显示, 缺失菌株感染细胞内的CyaA量显著下降, 并在回补菌株中恢复(图 7-B), 灰度分析结果显示存在显著差异(P < 0.001或P < 0.05)。表明vscI缺失减少了T3SS1效应蛋白的易位量。
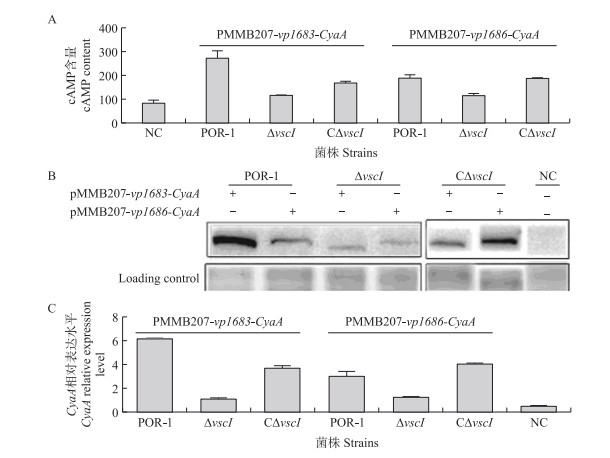
|
图 7 vscI对T3SS1效应蛋白易位的影响 Fig. 7 The effect of vscI on the translocation of the T3SS1 effector protein ELISA试剂盒检测HeLa细胞内cAMP产生量(A), Western-blot检测HeLa细胞内CyaA产生量(B)和灰度值分析(C)。 Intracellular cAMP levels were quantified by ELISA(A); The whole cell lysis CyaA protein of the above groups was quantified by Western blot analysis(B), and Grayscale analysis(C). |
T3SS1各结构组分间相互协调配合有序才能将效应子注入宿主胞质内, 发挥生物学功能[20]。本试验以T3SS1编码簇中vscI基因为研究对象, 发现vscI缺失减弱菌体对宿主细胞的感染, 引起细胞形态变化、损伤以及凋亡等, 进一步佐证T3SS1结构完整的重要性。黏附是细菌感染宿主的第一步, 与致病性存在紧密联系[21]。已有文献报道副溶血弧菌黏附相关因子主要包括黏附因子、血凝素、烯醇酶和T6SS2[22]。本试验结果显示, 副溶血弧菌T3SS1结构蛋白基因vscI能够增加菌体的黏附, 说明T3SS1与菌体黏附也相关。但此处仅分析了黏附性状表型, 对于T3SS1调控菌体黏附的机制仍需深入研究。
T3SS1主要通过效应子发挥细胞毒性, 例如效应蛋白VPA0450属于5-磷酸肌醇酶, 通过水解磷脂酰肌醇的4, 5-磷酸二酯键, 来破坏宿主细胞膜内表面的细胞骨架结合位点, 导致细胞骨架与膜间的连接受损, 最终膜稳态被破坏[13]。VP1686通过NF-κB抑制作用诱导巨噬细胞发生非依赖性Toll样受体细胞凋亡[23]。另外有研究发现沙门菌等革兰阴性菌T3SS1内杆状结构蛋白有助于支持注射装置的基底座结构, 调控效应蛋白分泌[5, 8]。本研究中Phyre2结构预测显示, vscI基因编码T3SS1内杆状蛋白VscI的二级结构由α螺旋构成, 该二级结构有助于稳定输出装置[24]。Sory等[25]最早用腺苷酸环化酶报告载体系统来检测耶尔森菌真核效应子易位, 随后用于副溶血弧菌中[9]。报告载体腺苷酸环化酶催化结构域可催化真核胞质内ATP环化成cAMP。本研究利用该系统检测vscI缺失对T3SS1已知效应蛋白易位量的影响, 结果显示vscI缺失导致VP1683与VP1686在HeLa细胞内易位量显著下降, 表明副溶血弧菌T3SS1 vscI基因对于T3SS1效应蛋白易位是必需的。由此推测, vscI基因缺失导致T3SS1分泌装置的基底座结构无法正常组装, 效应蛋白易位受阻, 菌体对细胞感染能力下降。
综上, 本研究证实副溶血弧菌内杆状蛋白基因vscI与该菌的细胞黏附能力和毒力密切相关, 且对于T3SS1效应子的易位是必需的。
| [1] |
Daniels N A, Mackinnon L, Bishop R, et al. Vibrio parahaemolyticus infections in the United States, 1973-1998[J]. J Infect Dis, 2000, 181(5): 1661-1666. DOI:10.1086/315459 |
| [2] |
付萍, 王连森, 陈江, 等. 2015年中国大陆食源性疾病暴发事件监测资料分析[J]. 中国食品卫生杂志, 2019, 31(1): 64-70. Fu P, Wang L S, Chen J, et al. Analysis of surveillance data of foodborne disease outbreaks in mainland China in 2015[J]. Chinese Journal of Food Hygiene, 2019, 31(1): 64-70 (in Chinese with English abstract). |
| [3] |
Park K S, Ono T, Rokuda M, et al. Functional characterization of two type Ⅲ secretion systems of Vibrio parahaemolyticus[J]. Infect Immun, 2004, 72(11): 6659-6665. DOI:10.1128/IAI.72.11.6659-6665.2004 |
| [4] |
Cao S Y, Liu W B, Tan Y F, et al. An interaction between the inner rod protein YscI and the needle protein YscF is required to assemble the needle structure of the Yersinia type three secretion system[J]. Journal of Biological Chemistry, 2017, 292(13): 5488-5498. DOI:10.1074/jbc.M116.743591 |
| [5] |
Sal-Man N, Deng W, Finlay B B. EscI: a crucial component of the type Ⅲ secretion system forms the inner rod structure in enteropathogenic Escherichia coli[J]. Biochem J, 2012, 442(1): 119-125. DOI:10.1042/BJ20111620 |
| [6] |
Lefebre M D, Galan J E. The inner rod protein controls substrate switching and needle length in a Salmonella type Ⅲ secretion system[J]. Proc Natl Acad Sci USA, 2014, 111(2): 817-822. DOI:10.1073/pnas.1319698111 |
| [7] |
Hu M, Zhao W, Li H, et al. Immunization with recombinant Salmonella expressing SspH2-EscI protects mice against wild type Salmonella infection[J]. BMC Vet Res, 2018, 14(1): 79. DOI:10.1186/s12917-018-1404-5 |
| [8] |
Wood S E, Jin J, Lloyd S A. YscP and YscU switch the substrate specificity of the Yersinia type Ⅲ secretion system by regulating export of the inner rod protein YscI[J]. Journal of Bacteriology, 2008, 190(12): 4252-4262. DOI:10.1128/JB.00328-08 |
| [9] |
Shimohata T, Mawatari K, Iba H, et al. VopB1 and VopD1 are essential for translocation of type Ⅲ secretion system 1 effectors of Vibrio parahaemolyticus[J]. Can J Microbiol, 2012, 58(8): 1002-1007. DOI:10.1139/w2012-081 |
| [10] |
Sreelatha A, Bennett T L, Zheng H, et al. Vibrio effector protein, VopQ, forms a lysosomal gated channel that disrupts host ion homeostasis and autophagic flux[J]. Proc Natl Acad Sci USA, 2013, 110(28): 11559-11564. DOI:10.1073/pnas.1307032110 |
| [11] |
Sreelatha A, Bennett T L, Carpinone E M, et al. Vibrio effector protein VopQ inhibits fusion of V-ATPase-containing membranes[J]. Proc Natl Acad Sci USA, 2015, 112(1): 100-105. DOI:10.1073/pnas.1413764111 |
| [12] |
Yarbrough M L, Li Y, Kinch L N, et al. AMPylation of Rho GTPases by Vibrio VopS disrupts effector binding and downstream signaling[J]. Science, 2009, 323(5911): 269-272. DOI:10.1126/science.1166382 |
| [13] |
Broberg C A, Zhang L, Gonzalez H, et al. A Vibrio effector protein is an inositol phosphatase and disrupts host cell membrane integrity[J]. Science, 2010, 329(5999): 1660-1662. DOI:10.1126/science.1192850 |
| [14] |
Waddell B, Southward C M, Mckenna N, et al. Identification of VPA0451 as the specific chaperone for the Vibrio parahaemolyticus chromosome 1 type Ⅲ-secreted effector VPA0450[J]. FEMS Microbiol Lett, 2014, 353(2): 141-150. DOI:10.1111/1574-6968.12416 |
| [15] |
Miller V L, Mekalanos J J. A novel suicide vector and its use in construction of insertion mutations-osmoregulation of outer-membrane proteins and virulence determinants in Vibrio-Cholerae requires toxr[J]. Journal of Bacteriology, 1988, 170(6): 2575-2583. DOI:10.1128/JB.170.6.2575-2583.1988 |
| [16] |
Makino K, Oshima K, Kurokawa K, et al. Genome sequence of Vibrio parahaemolyticus: a pathogenic mechanism distinct from that of V cholerae[J]. Lancet, 2003, 361(9359): 743-749. DOI:10.1016/S0140-6736(03)12659-1 |
| [17] |
Park K S, Ono T, Rokuda M, et al. Cytotoxicity and enterotoxicity of the thermostable direct hemolysin-deletion mutants of Vibrio parahaemolyticus[J]. Microbiology and Immunology, 2004, 48(4): 313-318. DOI:10.1111/j.1348-0421.2004.tb03512.x |
| [18] |
Kodama T, Akeda Y, Kono G, et al. The EspB protein of enterohaemorrhagic Escherichia coli interacts directly with alpha-catenin[J]. Cellular Microbiology, 2002, 4(4): 213-222. DOI:10.1046/j.1462-5822.2002.00176.x |
| [19] |
Ono T, Park K S, Ueta M, et al. Identification of proteins secreted via Vibrio parahaemolyticus type Ⅲ secretion system 1[J]. Infection and Immunity, 2006, 74(2): 1032-1042. DOI:10.1128/IAI.74.2.1032-1042.2006 |
| [20] |
Hueck C J. Type Ⅲ protein secretion systems in bacterial pathogens of animals and plants[J]. Microbiol Mol Biol Rev, 1998, 62(2): 379-433. DOI:10.1128/MMBR.62.2.379-433.1998 |
| [21] |
Navarre W W, Schneewind O. Surface proteins of gram-positive bacteria and mechanisms of their targeting to the cell wall envelope[J]. Microbiol Mol Biol Rev, 1999, 63(1): 174-229. DOI:10.1128/MMBR.63.1.174-229.1999 |
| [22] |
Jiang W, Han X, Wang Q, et al. Vibrio parahaemolyticus enolase is an adhesion-related factor that binds plasminogen and functions as a protective antigen[J]. Appl Microbiol Biotechnol, 2014, 98(11): 4937-4948. DOI:10.1007/s00253-013-5471-z |
| [23] |
Bhattacharjee R N, Park K S, Kumagai Y, et al. VP1686, a Vibrio type Ⅲ secretion protein, induces toll-like receptor-independent apoptosis in macrophage through NF-kappaB inhibition[J]. J Biol Chem, 2006, 281(48): 36897-36904. DOI:10.1074/jbc.M605493200 |
| [24] |
Marlovits T C, Kubori T, Lara-Tejero M, et al. Assembly of the inner rod determines needle length in the type Ⅲ secretion injectisome[J]. Nature, 2006, 441(7093): 637-640. DOI:10.1038/nature04822 |
| [25] |
Sory M P, Cornelis G R. Translocation of a hybrid YopE-adenylate cyclase from Yersinia enterocolitica into HeLa cells[J]. Mol Microbiol, 1994, 14(3): 583-594. DOI:10.1111/j.1365-2958.1994.tb02191.x |




