文章信息
- 陈淋, 王兴红, 刘云鹏
- CHEN Lin, WANG Xinghong, LIU Yunpeng
- 增强贝莱斯芽胞杆菌CLA178根际定殖的蔷薇根系分泌组分鉴定
- Root exudates in Rosa-microbe interaction contribute to the increased colonization of Bacillus velezensis CLA178
- 南京农业大学学报, 2021, 44(3): 497-505
- Journal of Nanjing Agricultural University, 2021, 44(3): 497-505.
- http://dx.doi.org/10.7685/jnau.202008004
-
文章历史
- 收稿日期: 2020-08-04
2. 中国农业科学院农业资源与农业区化研究所, 北京 100081
2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
根癌农杆菌(Agrobacterium tumefaciens)可以通过侵染多种植物的根、茎, 导致植物患根癌病(冠瘿病), 其中蔷薇科植物患病较为严重, 根癌病的发生不仅会影响植物的生长, 甚至会造成植物的死亡, 根癌病在全球范围内已造成包含蔷薇在内的蔷薇科植物严重的经济损失[1-2]。根癌农杆菌通过吸附并定殖在植物上, 将T-DNA片段转移并整合至植物的基因组上, 从而调控植物的生理代谢, 使植物形成冠瘿。
目前防治植物病害的方法有多种, 包括化学防治、转基因植物和生物防控等[3-5]。在这些方法中, 利用根际促生菌(plant growth-promoting rhizobacteria, PGPR)进行的生物防控是一种对环境友好且可持续发展的方法。PGPR是一类能在植物根际存活和定殖并能提高植物养分吸收、促进植物生长、防控土传病害和增强植物抗逆的有益微生物[6-7]。
根际定殖对PGPR发挥促生和抗胁迫作用至关重要, 也是PGPR有效防控土传病害的重要前提, 该过程主要包括细菌向根际的趋化和生物膜的形成。植物可以通过调控根系分泌物组分影响根际微生物的生长、趋化和生物膜的形成[8]。据报道, 有20%~80%的光合作用产物会以根系分泌物的形式释放到根际[9]。根系分泌物主要分成2大类: 小分子化合物和大分子化合物。很多小分子化合物可以与根际微生物相互作用, 例如作为微生物的趋化物、趋避物、生物膜形成诱导因子、抑制因子等[10-11]。根系分泌物组分会随环境因子的改变而产生变化, 益生菌和病原菌的定殖都可以诱导植物通过调控根系分泌物构建更加健康的微生物群落[12-13]。目前这方面的研究主要还是集中在模式植物和农作物上[9, 14], 木本植物如何通过调控根系分泌物来影响根际微生物定殖的研究仍较少。
贝莱斯芽胞杆菌(Bacillus velezensis)CLA178是从蔷薇根际分离得到的1株对植物有显著促生效果和生防特性的PGPR。根癌病是一种宿主广泛的病害, 蔷薇植物易感染此病, 而CLA178可诱导植物系统抗性, 有效减少植物根癌病的发病情况。本研究利用水培分根系统将植物根系分开, 使后接种的CLA178不受预接种菌株的直接干扰, 同时也避免收集的根系分泌物受到预接种菌株的直接影响。本研究通过分析根系分泌物组分与CLA178定殖的相关性筛选潜在的信号物质, 通过分析不同物质与菌株趋化性、生物膜形成和生长的关系确定调控CLA178根际定殖的信号物质。
1 材料与方法 1.1 供试材料贝莱斯芽胞杆菌(Bacillus velezensis)CLA178是本实验中心从蔷薇根际土壤分离到的1株PGPR。根癌农杆菌(Agrobacterium tumefaciens)C58是1株根癌病(冠瘿病)的致病菌, 其菌株保藏编号是ATCC 33970T/ACCC 10055T。将2株菌分别在LB液体培养基中170 r·min-1振荡培养8~10 h, 培养温度为30 ℃。将菌液进行离心后收集, 用无菌的磷酸缓冲液(PBS, pH 7.0)重悬至D600值为1。
用无刺野蔷薇(Rosa multiflora ‘innermis’)当年生的枝条进行扦插苗培育: 将枝条进行表面消毒, 剪成相同长度的枝段(15 cm), 将其扦插于含有生根溶液的无菌蛭石中。将扦插苗置于25 ℃人工气候室内培育8周, 光照/黑暗培养时间为14 h/10 h。
1.2 根系分泌物的收集与分析将生根的扦插苗转移至装有无菌的150 mL 1/4 MS培养液的三角瓶中[15], 每个三角瓶中移入1棵扦插苗, 50 r·min-1振荡培养2 h, 培养液每2 d换1次。扦插幼苗于25 ℃人工气候室内继续培育3周, 以获得更强壮的根系。将三角瓶中无菌幼苗转移至分根盒中(图 1), 将根等分至根盒两侧, 每侧加入1/4 MS培养液, 使根部浸没于培养液中, 分根盒两侧的培养液每2 d更换1次, 继续培养1周后进行试验处理。
|
图 1 分根盒试验设计示意图 Fig. 1 Split-root experimental design |
将CLA178和C58的菌悬液分别接种至分根盒左侧根室内至D600值为0.01, 无菌的PBS作为对照处理。2 d后, 在检测完右侧根室的无菌度后, 将右侧根室的营养液更换成无菌水, 每天收集右侧的根系分泌物并添加无菌水, 连续收集3 d(每个分根盒装有6棵苗, 每个处理设置3个生物学重复)。将收集的溶液经0.22 μm滤膜过滤后进行冻干, 同时对浸没于培养液中的根部称重。将冻干好的根系分泌物送至北京奥维森进行GC-MS分析。取10 mg样本, 进行代谢物提取后, 通过Agilent 7890气象色谱-飞行时间质谱联用仪(GC-TOF-MS, J & W Scientific, USA)进行组分分析, 毛细管柱为Agilent DB-5MS(30 m×250 μm×0.25 μm)。
1.3 相关性分析在分根盒左侧预接种不同菌株2 d后, 右侧接种CLA178菌株, 2 d后测定右侧的CLA178定殖数, 通过根重进行标准化。将不同处理的CLA178的根部定殖数与对应的根系分泌物组分进行Pearson相关性分析, 分析根系分泌物中调控CLA178定殖的潜在物质。通过P值排序, 选择P值最低的10个物质作为潜在信号物质进行进一步分析。
1.4 趋化性分析采用微流控芯片技术检测菌株CLA178的趋化性[16]。在体式显微镜下组装干净的芯片, 用白枪头蘸取5% 9, 9-二辛基聚芴(FC-40 oil), 用油将2层芯片周围的缝隙封上, 孔道中的油用移液枪吹出。将1 mg·mL-1牛血清白蛋白(BSA)加入孔道中, 随后用移液枪打出。分别将溶于PBS的物质、溶于PBS的菌液和PBS加入芯片的上、中、下孔道。在体式显微镜下滑动芯片使菌液能自由游动至趋化物或PBS的方向, 随后将其置于室温且避光的条件下, 静置30 min。静置结束后的芯片即可在倒置荧光显微镜(Ti-Eclipse, 200 Nikon, Tokyo Metropolis, Japan)下观察。分别统计含有物质小孔中的细菌数(Ne)和含有PBS对照小孔中的细菌数(Nc), 计算趋化指数(It), It=Ne/(Ne+Nc), 式中: t代表时间。理论上, It大于0.5时代表该物质是趋化物, It小于0.5时代表该物质是趋避物, It等于0.5时代表该物质没有趋化性。本研究中, 为了获得更可靠的结果, 设定It大于0.55时代表该物质是趋化物, It小于0.45时代表该物质是趋避物, It大于0.45并小于0.55时代表该物质没有趋化性。
1.5 生物膜形成分析将CLA178在LB培养液中30 ℃、170 r·min-1振荡培养9 h, 将菌液离心收集后重悬于MSgg培养液[5]中至D600值为0.1。将150 μL菌悬液加入无菌的96孔板中, 再将无菌的钉盖插入96孔板中, 置于30 ℃培养箱培养24 h。在2个新的96孔板中每个孔加入200 μL PBS, 分别作为冲洗板和回收板。将钉盖转移到第2个冲洗板中, 放置1 min, 随后将钉盖转移到第3个回收板中, 将已经装有钉盖的回收板放入超声波清洗仪中进行超声处理10 min。超声结束后, 附在钉盖上的生物膜就会溶于回收液中, 将回收液在LB平板上稀释涂布, 30 ℃培养24~48 h后, 进行单菌落计数。
1.6 菌株根际定殖的定量检测在含有1/4 MS的三角瓶中, 加入不同浓度的GLcA、T6P、DOP, 将表面消毒的蔷薇扦插幼苗放入三角瓶中, 使根浸没于培养液中, 随后加入D600值为0.01的CLA178菌悬液, 在细菌定殖2 d后, 对根部定殖的细菌进行定量测定。
将根用无菌水振荡清洗30 s, 去除未定殖在根部的菌, 称取1 g根, 用液氮研磨后, 用细菌DNA试剂盒(Omega)提取CLA178的DNA。通过ABI QuantstudioTM 3D digital PCR仪(Life Technologies, Carlsbad, CA)对细菌进行定量。CLA178的特异性引物见表 1。通过熔解曲线和凝胶电泳验证引物的特异性, 对含有目标基因的质粒进行梯度稀释并制作标准曲线, 根据标准曲线将CT值转化成拷贝数。
| 基因Gene | 序列Sequence(5′→3′) | 功能Function |
| recA | recA-F: AAAAAACAAAGTCGCTCCTCCG/recA-R: CGATATCCAGTTCAGTTCCAAG | 重组酶A(内参) Recombinase A(Internal reference) |
| epsD | epsD-F: CAGGACAACGGCTACGACATGA/epsD-R: AGAGGCGCTCCGTCACAGAAGT | 胞外多糖合成蛋白DCapsular polysaccharide biosynthesis protein D |
| yqxM | yqxM-F: AGATTTTCAATATACGGATGAC/yqxM-R: GTCCGCTCTTTTCCCTTATTCT | TasA蛋白合成的操纵子Operon of TasA production |
| sinI | sinI-F: TAGATAAGGAATGGGTTGAGC/sinI-R: GATTTACGGTATGACTTCTGG | 调控蛋白SinI Regulator SinI |
| kinC | kinC-F: AGAAATTTGTCGGAAGCCTGGG/kinC-R: ATATGGTTGAGATGATGAGCGG | 产孢激酶CSporulation kinase C |
| CLA178 | CLA178-F: TGACGGTAGTTTCCCTCGGTGAA/CLA178-R: CTACAAAGACATCCCG-CTCGCATT | CLA178的定量Quantification of CLA178 |
将LB中30 ℃培养9 h的CLA178离心, 重悬于PBS后, 以1%(体积分数)的接种量加入含有不同浓度GLcA、FAD、T6P、HYA、DOP的无机盐培养基中(1 g·L-1 NH4NO3, 0.5 g·L-1 KH2PO4, 1.5 g·L-1 Na2HPO4, 1 g·L-1 NaCl, 0.2 g·L-1 MgSO4, 5 g·L-1葡萄糖), 以每孔300 μL加入生长曲线测定微孔板中, 置于全自动生长曲线分析仪(Bioscreen Cpro, Finland)中, 测量30 ℃下细菌的生长曲线, 每个处理设置6个生物学重复。
1.8 细菌RNA提取和转录分析将重悬于PBS中的CLA178菌液加入至无机盐培养基中至D600值为0.5, 并在培养液中分别加入GLcA、FAD、T6P、HYA、DOP, 置于摇床上, 30 ℃、170 r·min-1培养9 h。将菌液离心收集后通过细菌RNA试剂盒(Omega)提取细菌的RNA。采用试剂盒(PrimeScriptRT Reagent Kit, TaKaRa)将RNA反转录成cDNA, 采用试剂盒TB Green RT Premix EX TaqTM(TaKaRa)和定量PCR仪(ABI QuantstudioTM 3D digital PCR system, Life Technologies, CA)对目标基因进行定量PCR, 以recA基因作为内参。定量PCR所用的基因引物见表 1。每个样品设置3个生物学重复。
1.9 数据统计与分析利用SPSS 25.0软件进行不同处理的方差分析和差异显著性分析(Duncan’s multiple range tests), 利用t测验分析2个样本之间的差异显著性(P < 0.05), 用R语言和Prism 8绘图。
2 结果与分析 2.1 菌株CLA178对蔷薇根癌病的影响在蔷薇根部预接种CLA178或PBS(CK)1 d后, 在蔷薇的茎段接种根癌农杆菌C58, 经过14 d培养后, 对照组(CK-C58)形成明显的冠瘿瘤, 而处理组(CLA178-C58)则没有形成明显的瘤(图 2-A), CLA178显著减少冠瘿瘤的鲜重(图 2-B), 该结果说明CLA178诱导蔷薇植物系统抗性以抵抗冠瘿病。

|
图 2 菌株CLA178对蔷薇根癌病的作用 Fig. 2 The effect of CLA178 on rose crown gall disease CK-C58代表预接种PBS 1 d后接种C58;CLA178-C58代表预接种CLA178 1 d后接种C58。不同小写字母代表不同处理之间显著差异(P < 0.05)。下同。 CK-C58 indicates plants inoculated with C58 after pre-inoculation with PBS for 1 d. CLA178-C58 indicates plants inoculated with C58 after pre-inoculation CLA178 for 1 d. Different lowercase letters indicate significant difference among different treatments(P < 0.05). The same as follows. |
Chen等[17]研究发现, 在分根盒左侧预接种PGPR CLA178或病原菌C58 2 d后, 随后在根盒右侧接种的CLA178根际定殖数分别是(13.02±7.88)×106、(26.30±7.38)×105 copies·g-1, 显著高于左侧未预接种菌株的对照组(1.74±1.22)×103 copies·g-1。为了进一步分析影响CLA178根际定殖的根系分泌物中的潜在信号物质, 通过GC-MS分析CK、C58、CLA178处理蔷薇根系分泌物组分, 并将不同处理CLA178的根际定殖数与不同处理的根系分泌物组分进行相关性分析(图 3-A), 根据相关性的P值选出可信度最高的10个物质进行分析。在10个物质中, 葡萄糖酸(gluconic acid, GLcA)、黄素腺嘌呤二核苷酸二钠(flavin adenine dinucleotide disodium, FAD)和海藻糖-6-磷酸(trehalose-6-phosphate, T6P)的含量与CLA178根际定殖数呈正相关关系, 且在2个预接种的根系分泌物中其含量均显著高于对照组; 2-羟基丁酸(2-hydroxybutanoic acid, HYA)和邻苯二甲酸二辛酯(dioctyl phthalate, DOP)的含量与CLA178定殖数呈负相关关系, 且2个预接种的根系分泌物中其含量均显著低于对照组(图 3-B)。因此, 推测GLcA、FAD、T6P、HYA、DOP可能是调控CLA178根际定殖的信号物质, 对这5种根系分泌物进行进一步分析。

|
图 3 根系分泌物组分和CLA178根际定殖数的相关性 Fig. 3 Correlation of root exudates and number of CLA178 root colonization A. 根系分泌物中各物质与CLA178定殖数的相关性; B. 5个潜在的信号物质在不同处理中的相对含量(GLcA: 葡萄糖酸; FAD: 黄素腺嘌呤二核苷酸二钠; T6P: 海藻糖-6-磷酸; HYA: 2-羟基丁酸; DOP: 邻苯二甲酸二辛酯)。*P < 0.05;**P < 0.01。下同。 A. The correlation between root colonization of CLA178 and each compound in the root exudates was shown in heatmap. B. The relative content of five potential signal compounds in each treatments(GLcA: Gluconic acid; FAD: Flavin adenine dinucleotide disodium; T6P: Trehalose-6-phosphate; HYA: 2-hydroxybutanoic acid; DOP: Dioctyl phthalate). *P < 0.05;**P < 0.01. The same as follows. |
为了鉴定CLA178对不同根系分泌物的趋化反应, 通过微流控芯片技术进行趋化性研究。当处理30 min时, 趋化指数It大于0.55代表具有趋化性, 小于0.45代表具有趋避性, 0.45~0.55代表无趋化作用。结果显示, 20~100 μmol·L-1 GLcA、1 μmol·L-1 FAD、10~100 μmol·L-1 T6P和1 μmol·L-1 HYA对CLA178的趋化指数均高于0.55, 50~100 μmol·L-1 HYA的趋化指数小于0.45(图 4-A、B、C、D)。随GLcA和T6P浓度的增加, CLA178对这2种根系分泌物的趋化性增加(图 4-A、C); 随HYA浓度的增加, CLA178对HYA的趋化性减弱, 而趋避性增强(图 4-D)。CLA178仅对1 μmol·L-1 FAD有一定的趋化性, 对10~100 μmol·L-1 FAD无趋化反应(图 4-B); 随浓度改变, CLA178对DOP也无趋化反应(图 4-E)。上述结果显示, 仅GLcA和T6P的浓度变化与CLA178趋化呈正相关, HYA的浓度变化与CLA178趋化性呈负相关, 这与3种物质在根系分泌物中含量与CLA178定殖数的相关性一致(图 3、4)。

|
图 4 CLA178对不同浓度根系分泌物的趋化响应 Fig. 4 Effect of root exudates with different concentrations on chemotaxis of CLA178 |
从图 5-A可知: GLcA和T6P在50~100 μmol·L-1时显著促进CLA178生物膜的形成, 100 μmol·L-1 HYA显著促进CLA178生物膜的形成, 而不同浓度的FAD对CLA178生物膜的形成无显著影响, 20~100 μmol·L-1 DOP显著抑制CLA178生物膜的形成。整体而言, 随GLcA、T6P、HYA浓度的增加, CLA178生物膜形成也逐渐增加; 而随DOP浓度增加, CLA178生物膜形成逐渐减弱。此外, 我们也检测了不同浓度的物质对CLA178生长曲线的影响, 仅DOP对CLA178生长产生显著影响(图 5-B), 其他4个物质并未对CLA178的生长产生显著影响(未提供无差异数据)。10~100 μmol·L-1 DOP显著抑制CLA178的生长, 因此DOP对CLA178生物膜的抑制作用可能是其抑制CLA178生长而引起。HYA随浓度增加促进生物膜形成的结果与根系分泌物中HYA含量和CLA178定殖的负相关关系相矛盾, 而在CLA178对FAD的趋化响应研究和FAD对CLA178生物膜形成分析中均没有显著影响, 因此排除HYA和FAD是蔷薇根系调控CLA178定殖的潜在物质的可能性。GLcA、T6P和DOP的浓度变化与CLA178生物膜形成或生长的相关性是与这3种物质在根系分泌物中含量和CLA178定殖的相关性一致。这说明GLcA、T6P和DOP可能是调控CLA178定殖根系分泌物质, 可用于进一步分析。
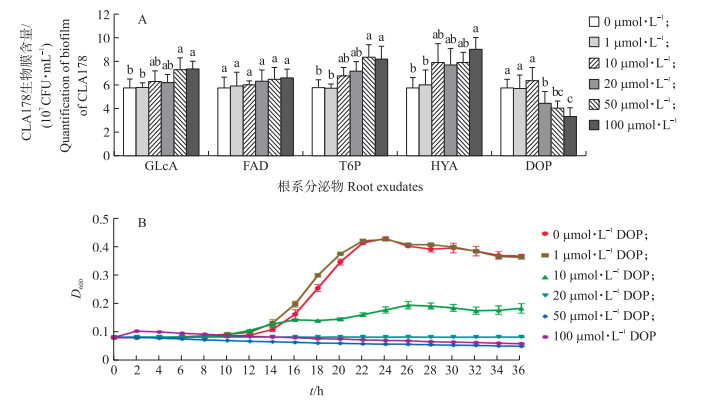
|
图 5 不同浓度根系分泌物对CLA178生物膜和生长的影响 Fig. 5 Effect of root exudates with different concentrationson biofilm formation and growth of CLA178 A. 不同物质对CLA178生物膜的影响; B. 不同浓度DOP处理下CLA178的生长曲线。不同小写字母代表同一物质不同浓度之间显著差异(P < 0.05)。 A. Effect of root exudates with different concentrations on biofilm formation of CLA178. B. Effect of DOP with different concentrations on growth of CLA178. Different lowercase letters indicate significant difference among different concentration(P < 0.05). |
基因表达结果显示: 100 μmol·L-1 GLcA显著上调epsD基因的表达; 20~100 μmol·L-1 GLcA显著上调yqxM基因表达; 1~100 μmol·L-1 GLcA显著上调sinI和kinC基因的表达(图 6-A)。随GLcA浓度的增加, 这4个基因的转录水平也增加, 该基因定量结果与生物膜结果相一致。20~100 μmol·L-1 T6P显著上调epsD基因的表达; 1 μmol·L-1 T6P下调yqxM基因的表达, 在100 μmol·L-1时显著上调yqxM基因的表达; 1~100 μmol·L-1 T6P对sinI基因的表达没有显著调控作用, 但是显著上调kinC基因的表达(图 6-B)。除了sinI基因, 其他3个基因的表达量随T6P浓度的增加而增加, 该基因定量结果与生物膜结果相一致。20 μmol·L-1 DOP显著上调epsD基因表达; 1~20 μmol·L-1 DOP显著上调yqxM基因表达; 100 μmol·L-1 DOP则显著下调yqxM和sinI基因的表达; 20~100 μmol·L-1 DOP显著上调kinC基因的表达(图 6-C)。随着DOP浓度的增加, 这4个基因的表达水平没有呈现一致的变化趋势, 该基因表达定量结果与生物膜结果存在差异。

|
图 6 不同根系分泌物对CLA178菌株epsD、yqxM、sinI、kinC基因表达水平的影响 Fig. 6 Effect of different root exudates on epsD, yqxM, sinI and kinC transcript levels in B. velezensis CLA178 |
从图 7可知: 随GLcA或T6P浓度的增加, CLA178的根际定殖数也逐渐增加; 随DOP浓度增加, CLA178的根际定殖数逐渐减少。这些结果表明, 预接种CLA178或C58后, GLcA和T6P含量增加, 以及DOP含量减少, 均促进蔷薇根际CLA178的定殖。

|
图 7 不同浓度的根系分泌物对CLA178根际定殖的影响 Fig. 7 Effect of root exudates with different concentrationson CLA178 root colonization |
微生物根际定殖是根际微生物生态位竞争的关键, 也是其发挥益生作用的重要条件[18]。植物和微生物的根际互作是复杂的, 受到多种环境因素的影响。根系分泌物是植物与根际微生物互作的重要媒介, 植物与微生物互作可以通过调控根系分泌物来募集和排斥特异的微生物, 并有助于防控植物病害[8, 12]。很多植物均易受根癌病的侵染, 本研究发现菌株CLA178可有效抑制蔷薇根癌病的发生, 且预接种病原菌C58和益生菌CLA178均可促进蔷薇根部CLA178的定殖。通过对根系分泌物的变化与CLA178根际定殖相关性的进一步研究, 初步确定根系分泌物中调控CLA178定殖的信号物质, 并通过分析不同信号物质与CLA178菌株趋化性、生物膜形成和定殖的关系, 确定预接种菌株蔷薇的根系分泌物中促进CLA178定殖的3种信号物质为GLcA、T6P和DOP。蔷薇可能是通过增加根系分泌物中GLcA和T6P的含量, 以及降低DOP的含量来增加益生菌CLA178的定殖, 从而增强蔷薇植物自身的抗病能力。本研究为植物-根际微生物互作提供了新的证据, 并为通过调控根际环境增强蔷薇抗根癌病提供了理论基础。
已报道有多种菌株可以抑制其他植物根癌病的发生, 例如发根农杆菌(Agrobacterium rhizogenes)K84、葡萄土壤杆菌(Agrobacterium vitis)E26、VAR03-1、水生拉恩菌(Rahnella aquatilis)HX2等, 但是大多数已知防控根癌病的生防菌都与致病的根癌农杆菌(Agrobacterium)是近源关系, 由于微生物之间基因的水平转移非常普遍, 这导致使用这类生防农杆菌存在潜在风险[19]。而我们发现防控根癌病的益生菌CLA178是芽胞杆菌属, 相对于其他具有生防作用的农杆菌近源微生物更加安全。
根系分泌物不仅为根际微生物提供碳源和能量, 还是植物-微生物根际互作的重要信号物质[8]。目前, 已有多篇关于根系分泌物中影响微生物生理物质的报道[20-22], 枯草芽胞杆菌(B.subtilis)NCD-2对棉花根系分泌物中精氨酸、丙氨酸和赖氨酸有较强的趋化性[21]; 多黏类芽胞杆菌(Paenibacillus polymyxa)SQR-21对西瓜根系分泌物中精氨酸、组氨酸和苯丙氨酸有显著的趋化性, 并促进SQR-21的根际定殖[22]; 在黄瓜-解淀粉芽胞杆菌(B.amyloliquefaciens)SQR9-尖饱镰刀菌(Fusarium oxysporum)FOC三方互作的研究中发现, 接种解淀粉芽胞杆菌SQR9可使黄瓜根系分泌物中的色氨酸含量增加, 促进SQR9定殖, 而接种病原菌FOC则会降低黄瓜根系分泌物中的棉籽糖含量, 进一步减少FOC的定殖[14]。本研究发现预接种CLA178可以通过增加蔷薇根系分泌物中GLcA和T6P的含量与减少DOP的含量来促进CLA178的根际定殖。
菌株的趋化性和生物膜形成对菌株根际定殖有重要作用。本研究发现CLA178对GLcA和T6P有趋化性, GLcA和T6P对菌株CLA178有促进生物膜形成作用, 外源分别添加GLcA和T6P也促进CLA178的根际定殖。此外, PGPR菌株SQR9对黄瓜根系分泌物产生趋化响应时, SQR9对GLcA有显著的趋化性, 该菌株对GLcA响应的主要趋化蛋白是McpC[23]。T6P是植物各个阶段生长和发展的重要信号代谢物质, 是植物碳水化合物变化的信号物质和调控因子[24-25]。对于植物共生菌根瘤菌而言, 菌株内T6P合成酶的过表达可以增强共生植物抗干旱胁迫能力[26]。本研究植物根系分泌物中的T6P含量与CLA178的趋化性、生物膜形成和根际定殖正相关。有研究表明DOP对细菌有一定的抑菌作用[27-28], 本研究中DOP对CLA178生物膜形成有抑制效果, 且10~100 μmol·L-1 DOP对CLA178生长有显著抑制作用。此外, 生物膜形成相关基因的定量PCR结果显示, 20 μmol·L-1 DOP对生物膜形成相关基因epsD、yqxM和kinC显著上调, 这说明DOP对CLA178生物膜的抑制作用可能是由于其抑制菌株生长引起的。
植物根际是一个复杂的环境, 植物可以发出“求救”信号来“招募”益生菌来排斥土传病原菌, 从而营造一个相对健康的微生物群落环境, “招募”而来的益生菌可以进一步促进植物生长, 协助植物抗病等[29]。这个理论对病原菌的防控有指导意义, 然而植物-微生物之间互作的具体信号机制仍有待进一步研究。
| [1] |
Gohlke J, Deeken R. Plant responses to Agrobacterium tumefaciens and crown gall development[J]. Frontiers in Plant Science, 2014, 5: 1-11. |
| [2] |
Kawaguchi A, Inoue K, Ichinose Y. Biological control of crown gall of grapevine, rose, and tomato by nonpathogenic Agrobacterium vitis strain VAR03-1[J]. Phytopathology, 2008, 98(11): 1218-1225. DOI:10.1094/PHYTO-98-11-1218 |
| [3] |
Waard M A, Georgopoulos S G, Hollomon D W, et al. Chemical control of plant diseases: problems and prospects[J]. Annual Review of Phytopathology, 1993, 31(1): 403-421. DOI:10.1146/annurev.py.31.090193.002155 |
| [4] |
Dong S J, Tredway L P, Shew H D, et al. Resistance of transgenic tall fescue to two major fungal diseases[J]. Plant Science, 2007, 173(5): 501-509. DOI:10.1016/j.plantsci.2007.08.002 |
| [5] |
Xu Z H, Zhang R F, Wang D D, et al. Enhanced control of cucumber wilt disease by Bacillus amyloliquefaciens SQR9 by altering the regulation of its DegU phosphorylation[J]. Applied and Environmental Microbiology, 2014, 80(9): 2941-2950. DOI:10.1128/AEM.03943-13 |
| [6] |
Stringlis I A, Proietti S, Hickman R, et al. Root transcriptional dynamics induced by beneficial rhizobacteria and microbial immune elicitors reveal signatures of adaptation to mutualists[J]. The Plant Journal, 2018, 93(1): 166-180. DOI:10.1111/tpj.13741 |
| [7] |
Pascale A, Proietti S, Pantelides I S, et al. Modulation of the root microbiome by plant molecules: the basis for targeted disease suppression and plant growth promotion[J]. Frontiers in Plant Science, 2020, 10: 1741. DOI:10.3389/fpls.2019.01741 |
| [8] |
Venturi V, Keel C. Signaling in the rhizosphere[J]. Trends in Plant Science, 2016, 21(3): 187-198. DOI:10.1016/j.tplants.2016.01.005 |
| [9] |
Rasmann S, Turlings T C. Root signals that mediate mutualistic interactions in the rhizosphere[J]. Current Opinion in Plant Biology, 2016, 32: 62-68. DOI:10.1016/j.pbi.2016.06.017 |
| [10] |
Badri D V, Vivanco J M. Regulation and function of root exudates[J]. Plant, Cell & Environment, 2009, 32(6): 666-681. |
| [11] |
Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57: 233-266. DOI:10.1146/annurev.arplant.57.032905.105159 |
| [12] |
Hu L F, Robert C A M, Cadot S, et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota[J]. Nature Communications, 2018, 9: 2738. DOI:10.1038/s41467-018-05122-7 |
| [13] |
Berendsen R L, Vismans G, Yu K, et al. Disease-induced assemblage of a plant-beneficial bacterial consortium[J]. The ISME Journal, 2018, 12(6): 1496-1507. DOI:10.1038/s41396-018-0093-1 |
| [14] |
Liu Y P, Chen L, Wu G W, et al. Identification of root-secreted compounds involved in the communication between cucumber, the beneficial Bacillus amyloliquefaciens, and the soil-borne pathogen Fusarium oxysporum[J]. Molecular Plant-Microbe Interactions, 2017, 30(1): 53-62. DOI:10.1094/MPMI-07-16-0131-R |
| [15] |
Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum, 1962, 15(3): 473-497. DOI:10.1111/j.1399-3054.1962.tb08052.x |
| [16] |
Shen C H, Xu P, Huang Z, et al. Bacterial chemotaxis on SlipChip[J]. Lab Chip, 2014, 14(16): 3074-3080. DOI:10.1039/C4LC00213J |
| [17] |
Chen L, Ma Q H, Liu H H, et al. Reduced root secretion of valine in Rosa-microbe interaction contributes to the decreased colonization of pathogenic Agrobacterium tumefaciens[J]. Plant Disease, 2021, PDIS-06-20-1179. |
| [18] |
Lugtenberg B, Kamilova F. Plant-growth-promoting rhizobacteria[J]. Annual Review of Microbiology, 2009, 63: 541-556. DOI:10.1146/annurev.micro.62.081307.162918 |
| [19] |
Mauck K E, de Moraes C M, Mescher M C. Deceptive chemical signals induced by a plant virus attract insect vectors to inferior hosts[J]. Proc Natl Acad Sci USA, 2010, 107(8): 3600-3605. DOI:10.1073/pnas.0907191107 |
| [20] |
罗兴, 冯海超, 夏丽明, 等. 根际促生解淀粉芽胞杆菌SQR9对香蕉根系分泌物响应的转录组分析[J]. 南京农业大学学报, 2019, 42(1): 102-110. Luo X, Feng H C, Xia L M, et al. Transcriptomic profiling of plant growth-promoting rhizobacteria Bacillus amyloliquefaciens SQR9 in response to banana root exudates[J]. Journal of Nanjing Agricultural University, 2019, 42(1): 102-110 (in Chinese with English abstract). DOI:10.7685/jnau.201804025 |
| [21] |
董丽红, 郭庆港, 张晓云, 等. 棉花根系分泌物对枯草芽胞杆菌NCD-2菌株趋化性的影响[J]. 植物病理学报, 2019, 49(3): 399-407. Dong L H, Guo Q G, Zhang X Y, et al. Effect of cotton root exudates on the chemotaxis of Bacillus subtilis strain NCD-2[J]. Acta Phytopathologica Sinica, 2019, 49(3): 399-407 (in Chinese with English abstract). |
| [22] |
沈怡斐, 鄂垚瑶, 阳芳, 等. 西瓜根系分泌物中氨基酸组分对多黏类芽胞杆菌SQR-21趋化性及根际定殖的影响[J]. 南京农业大学学报, 2017, 40(1): 101-108. Shen Y F, E Y Y, Yang F, et al. Effects of amino acids in root exudates of watermelon on the chemotactic reaction and root colonization of Paenibacillus polymyxa SQR-21[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 101-108 (in Chinese with English abstract). DOI:10.7685/jnau.201603051 |
| [23] |
Feng H C, Zhang N, Du W B, et al. Identification of chemotaxis compounds in root exudates and their sensing chemoreceptors in plant-growth-promoting rhizobacteria Bacillus amyloliquefaciens SQR9[J]. Molecular Plant-Microbe Interactions, 2018, 31(10): 995-1005. DOI:10.1094/MPMI-01-18-0003-R |
| [24] |
Figueroa C M, Lunn J E. A tale of two sugars: trehalose 6-phosphate and sucrose[J]. Plant Physiology, 2016, 172(1): 7-27. DOI:10.1104/pp.16.00417 |
| [25] |
Nardozza S, Boldingh H L, Kashuba M P, et al. Carbon starvation reduces carbohydrate and anthocyanin accumulation in red-fleshed fruit via trehalose 6-phosphate and MYB27[J]. Plant, Cell & Environment, 2020, 43(4): 819-835. |
| [26] |
Suárez R, Wong A, Ramírez M, et al. Improvement of drought tolerance and grain yield in common bean by overexpressing trehalose-6-phosphate synthase in rhizobia[J]. Molecular Plant-Microbe Interactions, 2008, 21(7): 958-966. DOI:10.1094/MPMI-21-7-0958 |
| [27] |
Sastry V M V S, Rao G R K. Dioctyl phthalate, and antibacterial compound from the marine brown alga-Sargassum wightii[J]. Journal of Applied Phycology, 1995, 7(2): 185-186. DOI:10.1007/BF00693066 |
| [28] |
Bazes A, Silkina A, Douzenel P, et al. Investigation of the antifouling constituents from the brown alga Sargassum muticum(Yendo) Fensholt[J]. Journal of Applied Phycology, 2009, 21(4): 395-403. DOI:10.1007/s10811-008-9382-9 |
| [29] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100. DOI:10.1126/science.1203980 |




