文章信息
- 郭新亚, 章文华, 林峰
- GUO Xinya, ZHANG Wenhua, LIN Feng
- 大豆油体蛋白基因GmOLE2的功能分析
- Functional analysis of soybean oleosin gene GmOLE2
- 南京农业大学学报, 2021, 44(3): 477-486
- Journal of Nanjing Agricultural University, 2021, 44(3): 477-486.
- http://dx.doi.org/10.7685/jnau.202008027
-
文章历史
- 收稿日期: 2020-08-23
中国是食用植物油的消费大国, 每年自产的植物油都不足以满足需求, 产生很大的供给缺口, 对外进口依赖性大。因此, 除了增加油料作物的种植面积外, 提高油料作物种子的含油量是提高产量、弥补缺口的关键。植物体内的油和脂肪统称为油脂, 主要以三酰甘油(triacylglycerol, TAG)的形式存在, 作为营养贮藏物质积累在种子油体中。因此, 油体能够为植物的生长和发育过程提供大量必要的能量[1]。油体发现较早, 是植物体中最小的细胞器, 直径一般为0.5~2.5 μm, 其密度较小, 可以被分离出来[2]。每一个油体被单层磷脂分子层(phospholipids, PL)和油体蛋白组成的半单位膜所包裹。
油体表面附着多种膜蛋白, 其中油体蛋白(OLE)是油体特有且含量最丰富的蛋白[3]。目前大豆(Glycine max)[4]、油菜(Brassica napus)[5]、拟南芥(Arabidopsis thaliana)[6]等物种中的OLE蛋白序列均被报道。植物细胞内的OLE蛋白相对分子质量为(15~25)×103[7], 以氨基酸序列作为参考依据, 可将蛋白结构分为3个结构域, 分别是长度不一的具有两亲性的N-末端和C-末端, 以及1个由24个氨基酸(72个残基)组成的中间疏水性结构。超长疏水结构可以形成发夹结构, 且这种结构的中间部分由3个脯氨酸和1个丝氨酸形成脯氨酸结(proline knot)[8]。近年, 研究人员将这种发夹结构概括成X30PX5SPX3PX30, 其中X代表X5和X3中大的非极性残基和X30中的非亲水性残基[9]。这样的结构对于OLE直接靶向油体与稳定细胞器有重要作用[10]。
沉默拟南芥OLE基因会引起胚胎发育异常: 油体异常膨大、蛋白含量以及脂质发生变化等[11-12]。OLE不仅可以维持油体大小和结构稳定, 还影响脂类物质的积累, 进而调节植物种子含油量。近年来, 转基因试验表明水稻中过表达大豆OLE, 使水稻种子中的含油量增加, 油体数量增多, 体积变小, 说明油体大小与总油酸水平负相关[13]。对大豆基因组分析发现, 在野生大豆中过表达GmOLE1, 过表达植株产生更多较小油体, 且与野生型相比, 过表达GmOLE1大豆种子油含量增加10%[14]。此外, 在细胞受冻害的过程中油体蛋白发挥重要作用。对拟南芥的研究发现, 拟南芥ole1、ole2、ole3、ole4的单突变体种子经过-30 ℃处理后, 相比于野生型, 萌发率明显下降, 表现为冷敏感型。而ole1ole2、ole1ole3、ole2ole3等双突拟南芥种子经过冻害处理后完全不萌发, 出现致死的表型[15]。此外, 高粱(Sorghum bicolor)中OLE蛋白能调节膜渗透性, OLE对响应ABA、高盐等胁迫具有重要作用[16]。在谷子(Setaria italica)响应干旱胁迫的研究中发现, OLE家族的基因启动子中均含有MeJA和ABA顺式响应元件, 其中Seita. 5G241900包含最多, 有14个MeJA响应元件[17]。因此, OLE基因可能受MeJA和ABA诱导表达, 参与植物对生物和非生物胁迫的响应。
目前, 大豆OLE基因(GmOLE)相关研究较少。本文以GmOLE2为研究对象, 通过生物信息学分析其蛋白结构和进化关系。以过表达GmOLE2的拟南芥为研究对象, 分析种子内脂肪酸组分变化及含油量变化, 并对其种子进行多种非生物胁迫处理, 分析GmOLE2在植物抗逆反应中的作用, 为阐明GmOLE2分子机制提供理论依据。
1 材料与方法 1.1 试验材料供试材料品种为野生型拟南芥(Columbia-0)和栽培大豆‘Williams 82’。参考宫宇等[18]的方法, 获取过表达GmOLE2拟南芥株系, 通过抗性筛选及鉴定获取纯合种子。
1.2 菌株、载体及试剂盒转基因载体为pCAMBIA1300;大肠杆菌DH5α感受态; 荧光定量反转录试剂盒(SYBR PrimeScriptTM RT reagent Kit)和荧光定量PCR试剂盒(SYBR Premix Ex TaqTM)购自TaKaRa公司; KOD plus购自TOYOBO公司; 限制性内切酶购自Thermo公司; 柱式植物总RNA试剂、质粒提取试剂盒、PCR纯化回收试剂盒以及琼脂糖凝胶纯化回收试剂盒购自上海生工生物公司; MS(Murashige and Skoog)、脂肪酸标准品(Supelco 37 Component FAME Mix)和丁基羟基甲苯(BHT)购自Sigma公司; 用氯仿/甲醇(体积比2∶1)溶解内标十七烷酸甘油三酯(C17∶0), 终浓度为5.4 mmol·L-1。
1.3 基因克隆及载体构建提取栽培大豆‘Williams 82’种子RNA, 反转录得到cDNA。以cDNA为模板, 用GmOLE2-F: TTAAATACTAGTGGATCCGGTACCATGGCGGACGCCCACAGAAC(下划线为KpnⅠ酶切位点)和GmOLE2-R: TCGGGGAAATTCGAGCTCGGTACCTCACGCGCCGGGAGCTGCAT(下划线为KpnⅠ酶切位点)扩增GmOLE2(基因号Glyma.17G122000)的编码区序列(CDS)。通过同源重组的方法, 将其CDS连接到pCAMBIA1300, 经测序验证正确后, 转入农杆菌GV3101。
1.4 实时荧光定量PCR分析利用柱式植物总RNA试剂盒提取大豆各组织以及拟南芥成熟种子RNA, 使用SYBR PrimeScriptTM RT reagent Kit将RNA反转录成cDNA。根据序列设计特异性引物(表 1)。大豆材料以GmCon4作为内参基因, 拟南芥材料以AtUBQ5作为内参基因。数据分析参考Livak等[19]和李双飞等[20]的方法。
| 引物Primer | 序列Sequence(5′→3′) |
| GmOLE2-pCAMBIA1300 | Forward: TTAAATACTAGTGGATCCGGTACCATGGCGGACGCCCACAGAAC Reverse: TCGGGGAAATTCGAGCTCGGTACCTCACGCGCCGGGAGCTGCAT |
| GmOLE2-qPCR | Forward: TAACTGCCTCCGTCTTGCTC/Reverse: TACATCCAAGACAGCACGGC |
| AtUBQ5-qPCR | Forward: CGACGCTTCATCTCGTCCTC/Reverse: CTCCACAGGTTGCGTTAGGG |
| GmCon4-qPCR | Forward: GATCAGCAATTATGCACAACG/Reverse: CCGCCACCATTCAGATTATGT |
| Note: Gm: Glycine max; At: Arabidopsis thaliana. | |
利用数据库(http://www.phytozome.com)下载大豆GmOLE2碱基序列和氨基酸序列, 通过NCBI的BLAST工具获取其他物种油体蛋白OLE序列。使用ExPASy网站在线工具Compute pI/Mw tool对蛋白基本生化特点进行分析。利用TMHMM Server和ProtScale在线分析工具对蛋白亲疏水性进行分析。利用MEGA 7软件分析蛋白保守序列, 并构建Neighbor-joining系统发生进化树。
1.6 拟南芥种子油脂提取及测定拟南芥植株种子约15 mg放置于15 mL离心管, 每个样品称3个重复, 提取操作及数据处理公式均参考Li等[21]的方法。
1.7 拟南芥种子可溶性总糖与总蛋白含量的测定拟南芥种子可溶性总糖含量测定参考逯玉等[22]的方法并稍作修改。称取干重约10 μg拟南芥种子置于研钵中, 加入少量80%乙醇溶液, 研磨充分, 转移至50 mL离心管并定容至10 mL。随后样品于80 ℃水浴10 min, 然后室温4 000 g离心5 min。取2 mL上清液于玻璃管中, 加入5 mL 15 mg·mL-1硫酸蒽酮溶液, 95 ℃水浴加热10 min, 取出样品, 冷水冲洗玻璃试管降温10 min, 室温静置10 min, 测量D625值。
拟南芥种子总蛋白含量测定参考Kim等[23]的方法。将拟南芥种子放置在80 ℃烘箱燥干处理1 d, 然后称量干重(约300粒)。取约50粒种子置于1.5 mL离心管中, 加入200 μL提取液(1% SDS+6 μmol·L-1尿素), 用研磨棒磨碎。磨碎的样品于4 ℃、1 200 g离心5 min, 然后将上清液转移至新的离心管中, 采用考马斯亮蓝法测定总蛋白的含量。
1.8 拟南芥种子冻害处理拟南芥种子冻害处理参考Shimada等[15]的方法并稍作修改。取适量的籽粒饱满种子于2 mL离心管中, 用75%乙醇消毒3~5 min, 弃去乙醇后用ddH2O洗1次; 再用5%次氯酸钠消毒10 min, 用灭菌水多次冲洗, 最后加入1 mL ddH2O进行吸胀作用, 24 h后取出。无菌条件下将种子放于灭菌的滤纸上吸干水分, -20 ℃处理12 h, 再均匀地种在MS培养基上, 于光照培养箱(光/暗培养时间16 h/8 h, 22 ℃)中生长, 每隔12 h统计1次萌发率(以种子露白为标准)。
1.9 数据处理采用Excel 2010软件和GraphPad Prism 6软件对试验数据进行统计和差异显著性分析。
2 结果与分析 2.1 GmOLE2蛋白基本性质以已经报道的拟南芥油体蛋白家族为参考, 分析GmOLE2蛋白结构。根据数据库网站中拟南芥和GmOLE2蛋白全长序列, 利用ExPASy网站在线工具Compute pI/Mw tool(https://web.expasy.org/protparam/)对蛋白进行基本生化特点分析。从表 2可知: GmOLE2蛋白与拟南芥AtOLE蛋白家族氨基酸长度较短, 约160~200个氨基酸, 其相对分子质量较小, 约(15~21)×103。除了AtOLE4等电点为7.11, GmOLE2蛋白与AtOLE蛋白等电点均在9以上。
| 基因位点Gene locus | 系统性命名Systematics name | 氨基酸长度Amino acid length | 等电点Isoelectric point | 相对分子质量/103Relative molecular weight |
| Glyma.17G122000 | GmOLE2 | 156 | 9.26 | 16.725 |
| AT4G25140 | AtOLE1 | 173 | 9.43 | 18.569 |
| AT5G40420 | AtOLE2 | 199 | 9.36 | 21.279 |
| AT5G51210 | AtOLE3 | 141 | 9.86 | 14.852 |
| AT3G01570 | AtOLE4 | 183 | 7.11 | 19.754 |
利用TMHMM 2.0在线软件分析GmOLE2氨基酸序列获取跨膜结构域预测图, 利用ExPASy在线工具分析GmOLE2氨基酸序列获取蛋白亲疏水性结构预测图。对GmOLE2蛋白结构进行分析, 发现GmOLE2蛋白两端具有亲疏域, 中间部位则是1个超长疏水性结构域(图 1-B), 且此结构域中具有3个跨膜结构(图 1-A)。在疏水结构域中发现具有高度保守性的结构——脯氨酸结, 可以简化结构为PX5SPX3P(图 1-C), 这种蛋白结构域也是油体蛋白具有的共性结构。
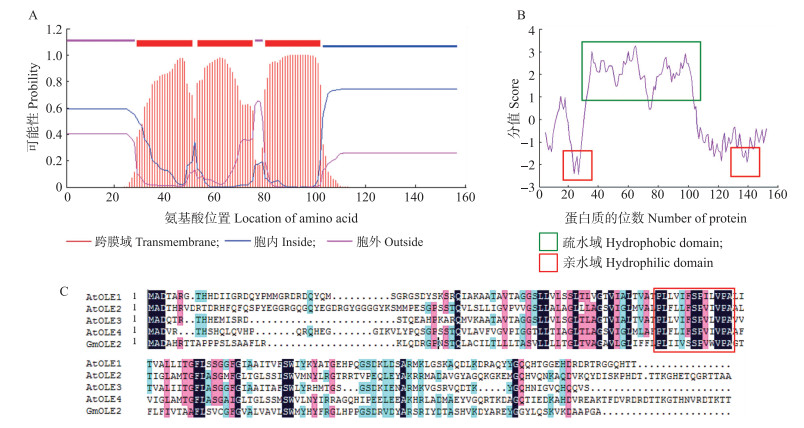
|
图 1 GmOLE2蛋白结构及功能域分析 Fig. 1 Protein structure and functional domain analysis of GmOLE2 A. GmOLE2蛋白跨膜结构预测图; B. GmOLE2蛋白亲疏水性结构预测图; C. 方框内为GmOLE2保守结构域。 A. Predicted transmembrane domain of GmOLE2;B. Prediction of hydrophilicity or hydrophobicity domain of GmOLE2;C. Protein conservation domain of GmOLE2 inside the box. |
以GmOLE2蛋白氨基酸序列为参考, 从NCBI数据库获取其他物种中油体蛋白家族序列。利用MEGA 7软件对这些序列进行分析, 并构建Neighbor-joining系统发育进化树。对Neighbor-joining系统发育进化树分析(图 2)发现, GmOLE2蛋白与大豆一个内源类油体蛋白进化亲缘最近。而GmOLE1等电点为6.9, 与GmOLE2差异较大, 导致GmOLE1和GmOLE2在进化亲缘较远, 分列2支。
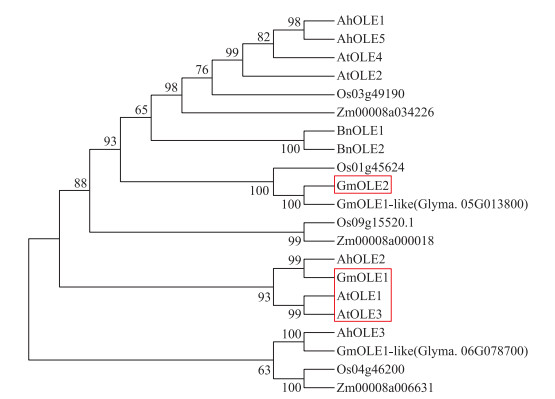
|
图 2 部分物种中油体蛋白的系统发育进化树分析 Fig. 2 Phylogenetic analysis of oleosin protein among different species 用于分析的OLE蛋白序列来自拟南芥(At)、花生(Ah)、油菜(Bn)、水稻(Os)、大豆(Gm)、玉米(Zm)。 Proteins used in the analysis were OLE sequences from Arabldopsis thaliana(At), Arachis hypogaea(Ah), Brassica napus(Bn), Oryza sativa(Os), Glycine max(Gm), Zea mays(Zm). |
对大豆根、茎、叶、花、果荚、不同成熟度的种子进行RT-qPCR分析, 结果如图 3所示: GmOLE2在种子中特异性表达, 且随种子成熟度提高表达量增加, 而GmOLE2在根、茎、叶、花中表达量极低。
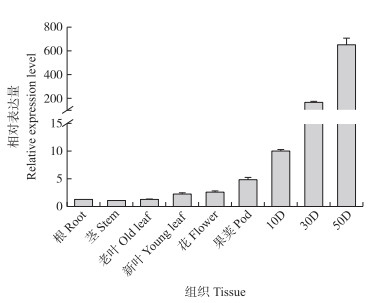
|
图 3 GmOLE2在栽培大豆不同组织的表达量 Fig. 3 The expression level of GmOLE2 in different tissues of soybean 10D. 花开后10 d种子Seeds after flower 10 days; 30D. 花开后30 d种子Seeds after flower 30 days; 50D. 花开后50 d种Seeds after flower 50 days. |
Li等[21]研究发现, 拟南芥种子油脂中主要包含C16∶0(棕榈酸)、C18∶0(硬脂酸)、C18∶1n9c(油酸)、C18∶3n3(亚麻酸)等组分。气相色谱检测结果表明, 在过表达GmOLE2的拟南芥种子脂肪酸组分中, C16∶0(棕榈酸)和C18∶3n3(亚麻酸)的含量相比于野生型显著下降, 减少约8%。而C18∶1n9c(油酸)的含量却相比于野生型显著升高, 增加约10%(图 4-A)。过表达GmOLE2可降低饱和脂肪酸和三不饱和脂肪酸含量, 单不饱和脂肪酸含量显著增加, 改变长链脂肪酸和不饱和脂肪酸在总脂中的比例(图 4-B)。此外, 过表达GmOLE2的拟南芥成熟种子油脂含量相比于野生型显著下降, 减少约10%(图 4-C)。
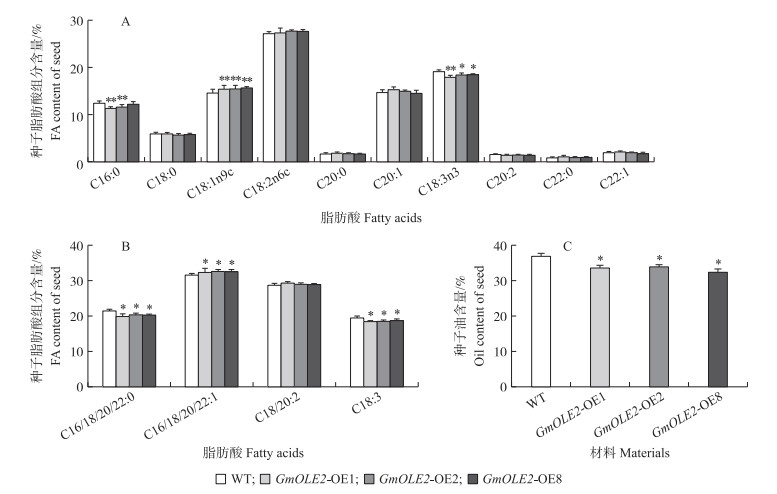
|
图 4 过表达GmOLE2拟南芥种子脂肪酸含量 Fig. 4 The content of fatty acids(FA)in seeds of overexpressing GmOLE2 A.thaliana A. 野生型(WT)和过表达GmOLE2拟南芥种子脂肪酸组分含量; B. 野生型和过表达GmOLE2拟南芥种子饱和脂肪酸及不饱和脂肪组分含量; C. 野生型(WT)和过表达GmOLE2拟南芥种子油含量。数值为x±SD(n=3)。*P < 0.05, **P < 0.01。下同。 A. Fatty acid content of wild type and overexpressing GmOLE2 Arabidopsis seeds; B. The content of Saturated and unsaturated fatty acid of wild type and overexpressing GmOLE2 Arabidopsis seeds; C. The oil content of wild type and overexpressing GmOLE2 Arabidopsis seeds. Values are means x±SD(n=3). *P < 0.05, **P < 0.01. The same as follows. |
相比于野生型拟南芥, 过表达GmOLE2拟南芥种子可溶性总糖含量显著下降, 减少约10%(图 5-A), 而种子内总蛋白含量显著升高, 增加约25%(图 5-B)。
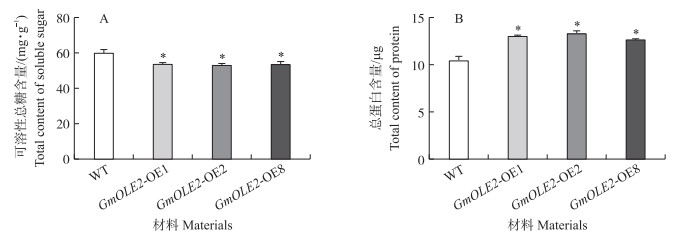
|
图 5 过表达GmOLE2拟南芥种子可溶性总糖含量及总蛋白含量 Fig. 5 The contents of total soluble sugar and total protein in seeds ofoverexpressing GmOLE2 A.thaliana |
野生型和过表达GmOLE2的拟南芥种子在4 ℃处理之后, 种子萌发并没有受到影响, 萌发正常。而-20 ℃冻害处理12 h后的种子, 在2种培养条件下萌发都显著减少, 但过表达GmOLE2的种子萌发状况较好, 并没有出现大量死亡。对上述处理进行萌发率(图 6)统计发现, 野生型和过表达GmOLE2的种子在4 ℃处理后, 萌发率无显著差异。而过表达GmOLE2的种子经过12 h的-20 ℃冻害处理后, 从36 h开始, 其种子萌发率相比于野生型显著增加。经过冻害处理的种子在含有20 g·L-1蔗糖的培养条件下的萌发率与不含蔗糖的相差不大, 表明蔗糖不影响冻害处理后种子的萌发。

|
图 6 -20 ℃冻害处理后过表达GmOLE2种子的萌发率 Fig. 6 Seed germination rate of overexpressing GmOLE2 seeds after freezing treatment |
从图 7可知:过表达GmOLE2拟南芥幼苗在含0 μmol·L-1 MeJA的MS培养基上生长和野生型并无差异; 在10 μmol·L-1 MeJA的MS培养基上生长6 d, 发现野生型和过表达GmOLE2拟南芥幼苗主根生长受到明显抑制, 但相比于野生型, 过表达GmOLE2拟南芥幼苗侧根发育良好, 侧根长度增加, 且侧根分根数显著增加; 在含20 μmol·L-1 MeJA的MS培养基上生长6 d的过表达GmOLE2拟南芥幼苗, 相比于10 μmol·L-1 MeJA处理, 主根长度减短, 侧根分根数减少, 第一侧根的长度没有显著变化(图 7-A、B)。
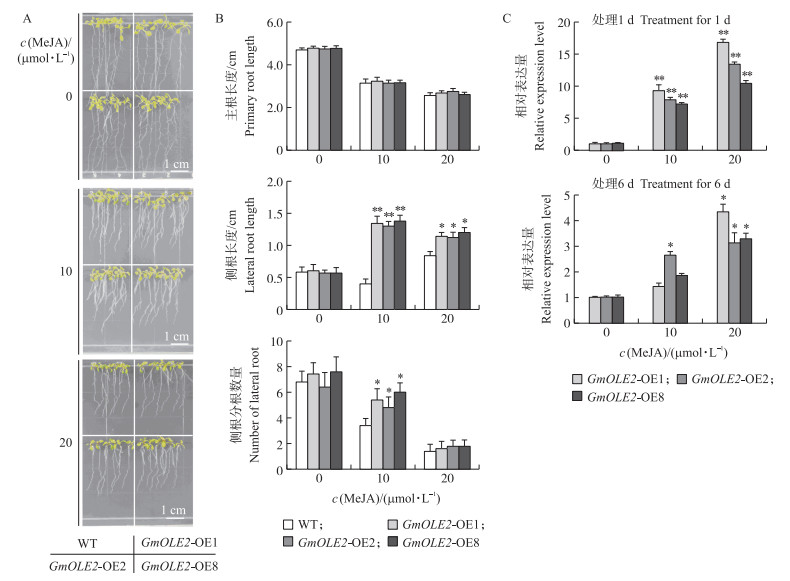
|
图 7 GmOLE2受MeJA诱导表达促进侧根发育 Fig. 7 GmOLE2 responses to MeJA promoting lateral root development A. 野生型和过表达GmOLE2拟南芥幼苗在不同浓度MeJA处理6 d生长状况; B. 不同浓度MeJA处理6 d后过表达GmOLE2拟南芥幼苗根系发育状况; C. 不同浓度MeJA处理1和6 d后GmOLE2表达量。 A. Phenotype of wild type and overexpressing GmOLE2 A.thaliana seeds after 6 d treatment with different concentrations of MeJA; B. The development of overexpressing GmOLE2 A.thaliana root GmOLE2 after 6 d treatment with different concentrations of MeJA; C. The expression level of GmOLE2 under treatment with different concentrations of MeJA for 1 and 6 d. |
提取不同浓度MeJA处理后的过表达GmOLE2幼苗的RNA, 相比于未处理, 10 μmol·L-1 MeJA处理1 d后的幼苗GmOLE2表达水平提高8~10倍, 而幼苗在20 μmol·L-1 MeJA处理1 d后GmOLE2表达水平提高12~16倍(图 7-C上图)。处理6 d后GmOLE2表达水平下降, 10 μmol·L-1 MeJA处理的幼苗GmOLE2表达量比未处理幼苗高1倍; 20 μmol·L-1 MeJA处理的幼苗GmOLE2表达量是未处理幼苗的2倍(图 7-C下图)。
2.9 GmOLE2响应ABA对种子萌发的抑制从图 8可知: 过表达GmOLE2的拟南芥种子在含0.5 μmol·L-1 ABA的MS培养基上萌发率远高于野生型(图 8-A), 统计其萌发率发现, 从萌发3 d起过表达GmOLE2的拟南芥萌发率显著高于野生型。0.5 μmol·L-1 ABA处理3 d后, 过表达GmOLE2幼苗中GmOLE2的表达量比对照组高6~8倍(图 8-C)。这说明GmOLE2的转录水平受ABA调控。
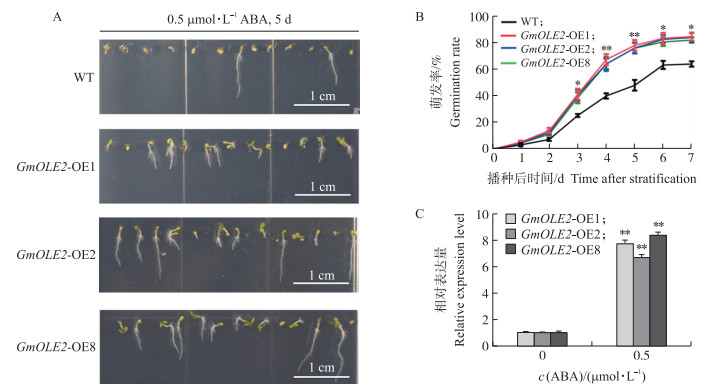
|
图 8 GmOLE2响应ABA对种子萌发的抑制 Fig. 8 GmOLE2 attenuates the inhibition of ABA on seed germination A. 野生型和过表达GmOLE2拟南芥种子在0.5 μmol·L-1 ABA条件下处理5 d萌发情况; B. 野生型和过表达GmOLE2拟南芥种子在0.5 μmol·L-1 ABA处理条件下萌发率x±SD(n=50)); C. 过表达GmOLE2拟南芥种子在0.5 μmol·L-1 ABA条件下处理3 d后GmOLE2表达量变化(x±SD(n=3)。 A. Phenotype of wild type and overexpressing GmOLE2 Arabidopsis seeds under 0.5 μmol·L-1 ABA treatment for 5 d; B. Germination rate of wild type and overexpressing GmOLE2 Arabidopsis seeds under 0.5 μmol·L-1 ABA treatment. Values are x±SD(n=50)); C. The expression level analysis of GmOLE2 under 0.5 μmol·L-1 ABA treatment for 3 d. Values are x±SD(n=3)). |
油体蛋白是一类小分子、能与油体特异性结合的结构蛋白。近年来在酵母试验中发现OLE基因参与脂肪酸合成, 酵母中过表达OLE3致使二酰甘油和三酰甘油积累[24], 当对OLE3进行磷酸化后, 检测到酵母内磷脂酶A2活性增强, 而酰基转移酶MGAT活性下降[25]。此外, 研究还发现高粱中OLE蛋白能调节膜渗透性, OLE对响应ABA、高盐等胁迫具有重要作用[16]; 对谷子研究发现OLE基因启动区包含较多MeJA和ABA响应元件, 对干旱响应[17]。
本研究利用生物信息学方法, 对大豆GmOLE2基因及蛋白结构进行分析, 发现GmOLE2蛋白具有两亲性N-端、C-端和1个超长疏水性结构, 并且在疏水结构域上具有高度保守的脯氨酸结, 符合X30PX5SPX3PX30的结构预测[9], 该结构符合油体蛋白的特征。Neighbor-joining系统发育进化树分析发现, GmOLE1和GmOLE2分列2支, 进化亲缘较远, 可能是由于2个蛋白等电点差异较大, 不同的电荷构型可能使油体蛋白具有2种异构体, 而异构体的结构差异导致进化过程中亲缘关系较远[26], 这有待进一步研究证明。
本研究利用农杆菌侵染的方式, 获得过表达GmOLE2的拟南芥纯合株系, 利用气相色谱分析拟南芥种子内脂肪酸的组分, 发现种子内C16∶0(棕榈酸)和C18∶3n3(亚麻酸)含量明显下降, 而C18∶1(油酸)含量明显上升, 以上数据都表明GmOLE2影响植株种子脂肪酸组分, 以减少饱和脂肪酸和三不饱和脂肪酸为代价, 增加单不饱和脂肪酸的含量和比例。此外, 油体蛋白是一类贮藏蛋白, 过表达GmOLE2拟南芥种子相比于野生型总油含量略有下降, 减少约10%。油含量下降可能的原因: 1)GmOLE2在种子成熟后期被磷酸化修饰, 蛋白功能产生变化使参与酰基转移过程的效率下降, 最终导致油含量下降, 类似的情况在酵母中得到验证, 如对OLE3进行磷酸化后, 检测到酵母内磷脂酶A2活性增强, 而酰基转移酶MGAT活性下降[25]。2)流向脂肪酸合成途径的碳源减少。过表达GmOLE2拟南芥种子相比于野生型总蛋白含量增加约25%, 而可溶性总糖含量减少约10%, 蛋白的大量表达, 促使合成糖及脂肪酸的碳源显著减少。在水稻中过表达油体蛋白, 不仅导致油体数量增多, 体积变小, 脂肪酸含量的增加随种子总蛋白积累减少[13], 因此根据碳源流动, 推测脂肪酸含量与蛋白含量呈负相关。
本研究中, 过表达GmOLE2的拟南芥种子在萌发阶段经过-20 ℃冻害处理12 h, 其萌发率显著高于野生型, 提高约30%, 表明过表达GmOLE2拟南芥种子较野生型对冻害具有更高的耐受性, 可增加种子萌发活力。对拟南芥的研究也有类似报道, ole1、ole2等单突变体种子在冻害处理后, 萌发率显著降低, 表现冷敏感型, 而ole1ole2、ole1ole3双突变体种子则完全不萌发, 出现致死的现象。本研究用10 μmol·L-1 MeJA处理过表达GmOLE2拟南芥幼苗, GmOLE2的表达量比未处理的幼苗在1 d内提高8~10倍。6 d后, 过表达GmOLE2拟南芥幼苗侧根发育良好, 侧根丰度及长度极显著优于野生型。而20 μmol·L-1 MeJA处理过表达GmOLE2拟南芥幼苗, 生长受到严重抑制仅第一侧根的长度略长于野生型。在含有0.5 μmol·L-1 ABA的MS培养基上生长的过表达GmOLE2拟南芥种子, 其萌发状况明显优于野生型, 且GmOLE2基因表达量相比于未处理组提高了6~8倍。因此, GmOLE2的转录水平受MeJA调控, 促进根系发育尤其是侧根的发育来响应胁迫; GmOLE2基因受ABA调控, 减弱ABA对种子萌发的抑制。类似结果也有报道, 用30 μmol·L-1 JA处理甘蓝型油菜, 其OLE基因表达量在24 h提高约20倍, 但在10 μmol·L-1 JA处理下, 油体蛋白积累量最大[27]。用0.5 μmol·L-1 ABA分别处理拟南芥sag和abi5突变体, OLE2、OLE3油体蛋白基因的表达量显著提高[28]。以上证据说明OLE基因受MeJA、ABA诱导表达, 但GmOLE2是否参与信号转导, 如何参与植物抗逆过程的分子机制尚不清楚。
综上所述, 大豆GmOLE2具有油体蛋白的特征结构, 且调控种子内脂肪酸组分构成, 以减少饱和脂肪酸和三不饱和脂肪酸为代价, 增加单不饱和脂肪酸的含量和比例。GmOLE2能提高种子冻害承受力, 受MeJA、ABA调控表达, 参与植物抗逆过程。本研究为提高大豆种子油含量、油品质及进一步研究油体蛋白及生理功能和作用机制提供一定价值的线索。
| [1] |
Slocombe S P, Cornah J, Pinfield-Wells H, et al. Oil accumulation in leaves directed by modification of fatty acid breakdown and lipid synthesis pathways[J]. Plant Biotechnology Journal, 2009, 7(7): 694-703. DOI:10.1111/j.1467-7652.2009.00435.x |
| [2] |
Murphy D J. The dynamic roles of intracellular lipid droplets: from archaea to mammals[J]. Protoplasma, 2012, 249(3): 541-585. DOI:10.1007/s00709-011-0329-7 |
| [3] |
Capuano F, Beaudoin F, Napier J A, et al. Properties and exploitation of oleosins[J]. Biotechnology Advances, 2007, 25(2): 203-206. DOI:10.1016/j.biotechadv.2006.11.006 |
| [4] |
Xu M Y, Liu D H, Li G Q, et al. Cloning of soybean 24 kDa oleosin gene and its transient expression as a carrier for foreign protein[J]. Agricultural Sciences in China, 2004, 3(5): 321-329. |
| [5] |
Keddie J S, Hübner G, Slocombe S P, et al. Cloning and characterisation of an oleosin gene from Brassica napus[J]. Plant Molecular Biology, 1992, 19(3): 443-453. DOI:10.1007/BF00023392 |
| [6] |
Roux E, Baumberger S, Axelos M A V, et al. Oleosins of Arabidopsis thaliana: expression in Escherichia coli, purification, and functional properties[J]. Journal of Agricultural and Food Chemistry, 2004, 52(16): 5245-5249. DOI:10.1021/jf0355046 |
| [7] |
Huang M D, Huang A H. Bioinformatics reveal five lineages of oleosins and the mechanism of lineage evolution related to structure/function from green algae to seed plants[J]. Plant Physiology, 2015, 169(1): 453-470. DOI:10.1104/pp.15.00634 |
| [8] |
Abell B M, Holbrook L A, Abenes M, et al. Role of the proline knot motif in oleosin endoplasmic Reticulum topology and oil body targeting[J]. The Plant Cell, 1997, 9(8): 1481-1493. |
| [9] |
Huang A H C. Plant lipid droplets and their associated proteins: potential for rapid advances[J]. Plant Physiology, 2018, 176(3): 1894-1918. DOI:10.1104/pp.17.01677 |
| [10] |
Wu Y Y, Chou Y R, Wang C S, et al. Different effects on triacylglycerol packaging to oil bodies in transgenic rice seeds by specifically eliminating one of their two oleosin isoforms[J]. Plant Physiology and Biochemistry, 2010, 48(2/3): 81-89. |
| [11] |
Siloto R M, Findlay K, Lopez-Villalobos A, et al. The accumulation of oleosins determines the size of seed oilbodies in Arabidopsis[J]. The Plant Cell, 2006, 18(8): 1961-1974. DOI:10.1105/tpc.106.041269 |
| [12] |
Shimada T L, Hara-Nishimura I. Oil-body-membrane proteins and their physiological functions in plants[J]. Biological and Pharmaceutical Bulletin, 2010, 33(3): 360-363. DOI:10.1248/bpb.33.360 |
| [13] |
Liu W X, Liu H L, Qu L Q. Embryo-specific expression of soybean oleosin altered oil body morphogenesis and increased lipid content in transgenic rice seeds[J]. Theoretical and Applied Genetics, 2013, 126(9): 2289-2297. DOI:10.1007/s00122-013-2135-4 |
| [14] |
Zhang D, Zhang H, Hu Z, et al. Artificial selection on GmOLEO1 contributes to the increase in seed oil during soybean domestication[J]. PLoS Genetics, 2019, 15(7): e1008267. DOI:10.1371/journal.pgen.1008267 |
| [15] |
Shimada T L, Shimada T, Takahashi H, et al. A novel role for oleosins in freezing tolerance of oilseeds in Arabidopsis thaliana[J]. The Plant Journal, 2008, 55(5): 798-809. DOI:10.1111/j.1365-313X.2008.03553.x |
| [16] |
Buchanan C D, Lim S, Salzman R A, et al. Sorghum bicolor's transcriptome response to dehydration, high salinity and ABA[J]. Plant Molecular Biology, 2005, 58(5): 699-720. DOI:10.1007/s11103-005-7876-2 |
| [17] |
蒋茂双, 元香梅, 刘晓东, 等. 谷子Oleosin基因家族及其对干旱响应的分析[J]. 山西农业大学学报(自然科学版), 2018, 38(1): 16-20. Jiang M S, Yuan X M, Liu X D, et al. Analysis of oleosingene family and its response to drought in foxtail millet[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2018, 38(1): 16-20 (in Chinese with English abstract). |
| [18] |
宫宇, 毛卓卓, 史贵霞, 等. 大豆E3泛素连接酶基因GmPUB1的克隆及功能研究[J]. 南京农业大学学报, 2020, 43(5): 820-828. Gong Y, Mao Z Z, Shi G X, et al. Cloning and functional analysis of soybean E3 ubiquitin ligase gene GmPUB1[J]. Journal of Nanjing Agricultural University, 2020, 43(5): 820-828 (in Chinese with English abstract). DOI:10.7685/jnau.201912063 |
| [19] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [20] |
李双飞, 黄颜众, 轩慧冬, 等. 大豆GmTIP1-1基因克隆及功能研究[J]. 南京农业大学学报, 2019, 42(5): 793-801. Li S F, Huang Y Z, Xuan H D, et al. Cloning and function study of soybean GmTIP1-1 gene[J]. Journal of Nanjing Agricultural University, 2019, 42(5): 793-801 (in Chinese with English abstract). DOI:10.7685/jnau.201901024 |
| [21] |
Li Y, Beisson F, Pollard M, et al. Oil content of Arabidopsis seeds: the influence of seed anatomy, light and plant-to-plant variation[J]. Phytochemistry, 2006, 67(9): 904-915. DOI:10.1016/j.phytochem.2006.02.015 |
| [22] |
逯玉, 谭建宁, 杨蕊娟, 等. 蒽酮比色法测定油菜籽中硫代葡萄糖苷条件优化[J]. 中兽医医药杂志, 2014, 33(4): 60-61. Lu Y, Tan J N, Yang R J, et al. Optimization on the determination of glucosinolates in rapeseed with anthrone colorimetry[J]. Journal of Traditional Chinese Veterinary Medicine, 2014, 33(4): 60-61 (in Chinese with English abstract). |
| [23] |
Kim S, Yamaoka Y, Ono H, et al. AtABCA9 transporter supplies fatty acids for lipid synthesis to the endoplasmic reticulum[J]. Proc Natl Acad Sci USA, 2013, 110(2): 773-778. DOI:10.1073/pnas.1214159110 |
| [24] |
Parthibane V, Iyappan R, Vijayakumar A, et al. Serine/threonine/tyrosine protein kinase phosphorylates oleosin, a regulator of lipid metabolic functions[J]. Plant Physiol, 2012, 159: 95-104. DOI:10.1104/pp.112.197194 |
| [25] |
Parthibane V, Rajakumari S, Venkateshwari V, et al. Oleosin is bifunctional enzyme that has both monoacylglycerol acyltransferase and phospholipase activities[J]. Plant Physiology, 2012, 159(1): 95-104. DOI:10.1104/pp.112.197194 |
| [26] |
Tzen J T C, Chuang R L C, Chen J C F, et al. Coexistence of both oleosin isoforms on the surface of seed oil bodies and their individual stabilization to the organelles[J]. Journal of Biochemistry, 1998, 123(2): 318-323. DOI:10.1093/oxfordjournals.jbchem.a021939 |
| [27] |
Hays D B, Wilen R W, Sheng C, et al. Embryo-specific gene expression in microspore-derived embryos of Brassica napus. An interaction between abscisic acid and jasmonic acid1, 2[J]. Plant Physiology, 1999, 119(3): 1065-1072. DOI:10.1104/pp.119.3.1065 |
| [28] |
Chen C, Wu C, Miao J, et al. Arabidopsis SAG protein containing the MDN1 domain participates in seed germination and seedling development by negatively regulating ABI3 and ABI5[J]. Journal of Experimental Botany, 2014, 65(1): 35-45. DOI:10.1093/jxb/ert343 |




