文章信息
- 马稳霞, 冯升来, 涂艺馨, 令利军
- MA Wenxia, FENG Shenglai, TU Yixin, LING Lijun
- 黄花蒿精油及其活性成分1, 8-cineole对兰州百合采后病害的体外防治
- In vitro prevention and cure of essential oil from Artemisia annua L. and its active ingredient 1, 8-cineole on postharvest diseases of Lilium davidii var. unicolor
- 南京农业大学学报, 2021, 44(3): 447-456
- Journal of Nanjing Agricultural University, 2021, 44(3): 447-456.
- http://dx.doi.org/10.7685/jnau.202010027
-
文章历史
- 收稿日期: 2020-10-22
兰州百合为百合科多年生植物, 是中国国家地理标志产品, 甘肃省名优特农产品及世界上唯一的药膳两用甜百合, 在国内外享有盛名[1]。兰州百合富含人体所需的糖、蛋白质、维生素、矿物质元素和氨基酸等营养物质, 具有促进胃肠功能、降低血糖、调节血脂的作用, 被誉为“蔬菜人参”, 在中药中以新鲜的鳞茎、干燥的鳞片和粉末等不同的形式出现, 主要用于心肺疾病治疗[2]。2016年, 兰州百合种植面积达到7 133 hm2, 年产量3 000~4 000万kg[3]。近年来, 兰州百合产业得到迅猛发展, 但品种退化和严重的采后病害问题一直困扰着兰州百合产业的健康发展[4]。研究表明, 百合的采后病害主要由机械损伤和致病菌侵染所致, 机械损伤发生在采收、储藏和运输等环节中, 机械损伤同时为致病菌侵染提供了机会[5]。
目前, 关于兰州百合采后病害的研究鲜有报道。巩慧玲等[6]发现黄曲霉和米曲霉可以引起兰州百合采后病害。本课题组已从采后低温贮藏腐败的兰州百合中分离到嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)、沙福芽胞杆菌(Bacillus safensis)和2株美极梅奇酵母(Metschnikowia pulcherrima)4种采后致病菌。细菌性病害主要包括细菌性软腐病和细菌性枯萎病, 仅次于真菌性病害[2]。
黄花蒿(Artemisia annua)是我国传统中草药, 具有清热、解暑和截疟之功效, 同时可作为香料用于酿酒和酱油等领域。我国西北地区野生黄花蒿资源丰富, 同时具有悠久的栽培历史。黄花蒿精油主要产生于叶和花中的毛状体, 富含单萜和倍半萜, 主要成分包括石竹烯、异木酚酮和1, 8-cineole等[7]。1, 8-cineole作为黄花蒿精油主要活性成分, 具有抗炎和抗氧化活性, 可控制全身炎症、延缓疾病进展和恶化速度, 还对肺气肿具有潜在的缓解作用, 因此, 黄花蒿在医学领域常用作辅助治疗慢性阻塞性肺疾病、哮喘和鼻窦炎等[8]。
本研究以自然腐败的兰州百合采后鳞茎为研究材料, 分离纯化致病菌, 并通过形态学及分子生物学方法对分离到的致病菌进行鉴定; 利用黄花蒿精油及其主要活性成分1, 8-cineole对采后致病菌进行体外防治试验, 为兰州百合采后病害的防治提供理论依据和技术指导, 并为减少兰州百合的经济损失和延长保质期及为兰州百合产业健康可持续发展奠定理论基础。
1 材料与方法 1.1 材料与仪器材料: 采后病变和新鲜兰州百合样品均于2019年6月由兰州市七里河区农业技术推广站提供, 试验中所用兰州百合均属于同一基因型。
Luria-Bertani(LB)固体及液体(不加琼脂粉)培养基: 胰蛋白胨10 g·L-1, 酵母提取物5 g·L-1, NaCl 10 g·L-1, 琼脂粉14~16 g·L-1; 马铃薯葡萄糖琼脂培养基(PDA): 马铃薯浸粉3 g·L-1, 葡糖糖20 g·L-1, 琼脂粉14~16 g·L-1, 氯霉素0.2 g·L-1; 酵母浸出粉胨葡萄糖琼脂培养基(YPD): 酵母粉10 g·L-1, 蛋白胨20 g·L-1, 葡萄糖20 g·L-1, 琼脂14~16 g·L-1, pH7.0。
仪器: BSC-1300ⅡA2生物安全柜(苏州, 安泰); 生化培养箱(上海, 一恒); T100TMThermal cycler PCR仪、721BR02621凝胶成像仪(美国, Bio-Rad)。
1.2 兰州百合采后病害致病菌的分离与纯化参考文献[9-10]的方法对兰州百合灭菌处理后, 采用无菌手术刀切取病-健相间的百合样品分别置于LB培养基、PDA培养基及YPD培养基, 分别于37、28和28 ℃培养48~72 h。待菌落形成后, 根据颜色和形态进行初次分离纯化, 然后将分离到的菌体转移到相应培养基上, 划线培养48~72 h。依次纯化2~3次获得菌株并于20%的甘油中-80 ℃下保存备用。
1.3 致病性验证根据柯赫氏法则, 取分离纯化得到的病原菌活化于无菌的培养基上, 培养48~72 h以获得每个分离物的活化培养物[11]。将成熟健康的兰州百合灭菌处理后, 用无菌手术刀将表面无菌的百合切成同样大小的百合块(1.5 cm×1.5 cm)后分为2部分, 一部分直接接种病原菌, 另一部分用灭菌后的接种针, 在中间的位置扎孔致伤后接种病原菌, 并以等量的无菌水作为对照。7 d后根据百合块腐烂变质的症状以确定所接病原菌是否能使兰州百合腐烂, 从腐烂的伤口处分离病原菌观察是否为接种的病原菌, 从而确定该菌是否为兰州百合采后腐烂的致病菌[12-13]。所有试验设置3组平行。
1.4 病原菌的鉴定 1.4.1 形态学鉴定细菌: 用接种针挑取少许保藏的菌种于LB固体培养基上, 在37 ℃培养1~2 d, 观察单菌落大小、形状、高度、边缘、颜色、表面状态、密度、硬度等形态学特征, 再通过显微镜观察单个菌体的形态。真菌: 打取菌饼接种于PDA培养基, 28 ℃培养3~4 d, 参考文献[14]观察并记录菌落形态, 再通过显微镜观察其孢子形态。
1.4.2 分子生物学鉴定细菌: 采用煮沸裂解法提取基因组DNA, -20 ℃保存备用。PCR扩增反应体系(25 μL): 模板1 μL, 引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)及1492R(5′-TACGGCTACCTTGTTACG-ACTT-3′)各0.1 μL, Taq酶1 U, 10×PCR缓冲液2.5 μL, ddH2O补充至25 μL。参考夏乐先等[15]的方法进行PCR扩增。真菌: 通过CTAB法提取真菌DNA, -20 ℃保存备用[16-17]。PCR扩增反应体系(25 μL): 模板1 μL, 引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)及ITS4(5′-TCCTCCGCTTATTGATATGC-3′)各0.1 μL, Taq酶1 U, 10×PCR缓冲液2.5 μL, ddH2O补充至25 μL, 参考刘瑞玲等[10]的方法进行PCR扩增。
10 g·L-1的琼脂糖凝胶电泳检测PCR产物后, 将有效产物送到华大基因公司测序。测序结果提交GenBank数据库并通过MEGA 6软件绘制系统发育树[18]。
1.5 黄花蒿精油成分的GC-MS分析GC-MS条件参考文献[19]稍作修改: 初始温度设定为60 ℃保持1 min, 10 ℃·min-1上升至180 ℃保持1 min, 然后以20 ℃·min-1升至280 ℃保持15 min。喷射器温度保持在270 ℃, 载气为高纯氦气, 将样品(1 μL, 用己烷稀释至1%)以10∶1的分流比注入, 流速为1.0 mL·min-1。在相同的操作条件下使用同系列的正构烷烃(C5—C36)计算保留指数(RI)。比较它们的质谱并计算它们的RI, 与NIST 05数据库比对并结合相关文献鉴定成分, 通过平均GC-FID峰面积报告获得精油各成分的相对百分比。
1.6 熏蒸法测定黄花蒿精油及1, 8-cineole的体外抑菌活性 1.6.1 黄花蒿精油及1, 8-cineole对细菌抑菌活性的测定将分离到的病原细菌B-6活化至对数期后稀释至106 CFU·mL-1, 取0.1 mL于新鲜的LB固体培养基上涂布均匀。不同浓度(0.1、0.2、0.4、0.6和0.7 mL·L-1)的精油及1, 8-cineole加到4张无菌的滤纸片(直径6 mm)上, 以相同体积的无菌水作为对照, 置于培养皿盖子中央, 于37 ℃倒置培养24 h, 每组试验3个重复。菌落计数后按如下公式计算精油的抑菌率。
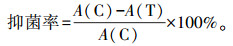
|
式中: A(C)为对照组菌落数; A(T)为试验组菌落数。
1.6.2 黄花蒿精油及1, 8-cineole对真菌抑菌活性用无菌打孔器取菌饼置于PDA固体培养基中央, 不同浓度的精油(0.02、0.06、0.10、0.14、0.18、0.22、0.28、0.34、0.40和0.46 mL·L-1)及1, 8-cineole(0.02、0.06、0.10、0.14、0.18、0.30、0.40和0.60 mL·L-1)加到4张无菌滤纸片(直径6 mm)上, 将滤纸片置于培养皿盖子中央, 密封培养48 h后测量菌落大小, 每组试验3组重复。按如下公式计算抑菌率。
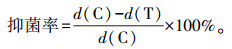
|
式中: d(C)为对照组菌落直径; d(T)为试验组菌落直径[20]。
1.7 直接接触法测定黄花蒿精油及1, 8-cineole的体外抑菌活性 1.7.1 黄花蒿精油及1, 8-cineole对细菌的抑菌活性通过倍比稀释法测定黄花蒿精油及单体1, 8-cineole的最低抑菌浓度(minimum inhibitory concentration, MIC)和最低杀菌浓度(minimum bactericide concentration, MBC)。MIC被确定为没有明显细菌增长的精油及1, 8-cineole的最低浓度, 此浓度下具有不可见(无浊度)的细菌生长, MBC浓度下初始接种细菌(106 CFU·mL-1)被全部杀死[21]。
1.7.2 黄花蒿精油及1, 8-cineole对真菌的抑菌活性测定黄花蒿精油及1, 8-cineole的MIC和最低杀真菌浓度(minimum fungal concentration, MFC)。通过微量稀释法得到含不同浓度黄花蒿精油及1, 8-cineole的PDB培养液, 取不同浓度的含药培养液0.2 mL于2 mL离心管中。无菌打孔器打取菌饼, 用无菌牙签挑取菌饼分别置于相应的离心管中, 28 ℃、170 r·min-1摇床培养24 h。挑取液体培养基中的菌饼, 接种于新鲜的PDA培养基上, 置于28 ℃培养48 h。以在离心管中无菌丝生长的黄花蒿精油及1, 8-cineole浓度为MIC, 将无可见菌丝生长的菌饼接种于PDA固体培养基上, 28 ℃下培养24 h后, 以无菌丝生长的浓度为MFC。
1.8 数据分析将病原菌的核苷酸序列与GenBank数据库中相关微生物物种的序列进行比对。系统发育关系使用MEGA 6.0软件通过邻接法结合p-距离分析确定, 对系统进化树内部分支的强度采用1 000次引导复制进行统计分析。数据统计分析采用Excel 2019和SPSS 20.0软件, 采用Origin 8.0软件作图。
2 结果与分析 2.1 致病性检测从腐烂的百合鳞茎中共分离纯化到6株真菌(F-1—F-6)和9株细菌(B-1—B-9), 经过柯赫氏回接试验(图 1)表明: 菌株B-6、F-2、F-3及F-6为兰州百合采后病害致病菌, 且致病性存在差异。

|
图 1 柯赫氏回接试验结果 Fig. 1 Experimental results of Koch's Back Connection CK. 对照Control; B-1—B-9. 细菌Bacteria; F-1—F-6. 真菌Fungus. 下同。The same as follows. |
将得到的4株病原菌接种于无致伤的兰州百合鳞片上, 结果(图 2)显示: 菌株B-6对无致伤的兰州百合无侵染现象, 菌株F-2、F-3及F-6引起兰州百合病变, 并在无致伤的兰州百合表面生长繁殖。但是, 无致伤情况下, 病原真菌侵染速度较慢, 说明致伤会促进病原菌对兰州百合的侵染从而导致其快速腐烂。

|
图 2 无致伤回接试验结果 Fig. 2 Experimental results of injury-free test |
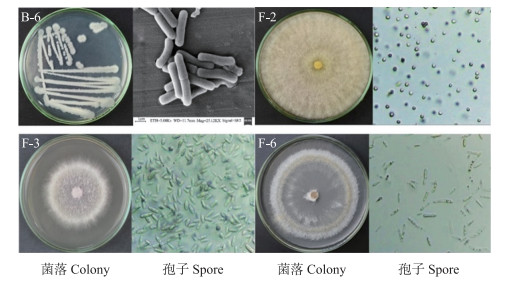
形态学观察结果(图 3)表明: B-6菌落不规则, 乳白色, 表面粗糙且不透明, 单个菌体形态呈杆状; F-2菌落呈广铺的棉絮状, 起初为白色致密的平坦菌丝, 而后边缘出现浅绿色的孢子丛束, 反面呈白色, 孢子呈圆形; F-3菌落呈广铺毛毡状, 外圈白色, 内圈及反面呈淡紫色, 孢子椭圆形; F-6菌落呈广铺絮状, 白色, 孢子呈长椭圆镰刀型。
|
图 3 兰州百合采后病害致病菌形态 Fig. 3 Morphology of postharvest diseases pathogens isolated from Lilium davidii |
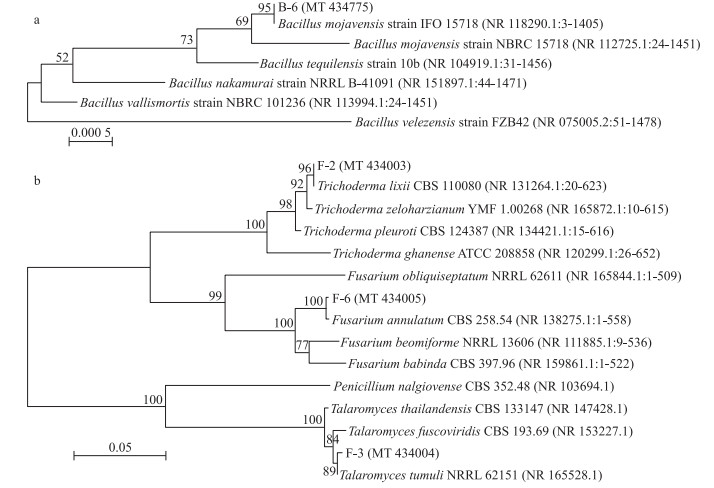
分子生物学分析(图 4)表明: 致病菌B-6与摩加夫芽胞杆菌(Bacillus mojavensis)位于同一分支, 序列同源性达到99.86%;F-2与李氏木霉(Trichoderma lixii)位于同一分支, 序列同源性达到99.34%;F-3与篮状菌(Talaromyces tumuli)位于同一分支, 序列同源性达到99.25%;F-6与镰刀菌(Fusarium annulatum)位于同一分支, 序列同源性达到99.46%。各分支的自展值均高于50%, 结合形态学与分子生物学分析, B-6为摩加夫芽胞杆菌, F-2为李氏木霉, F-3为篮状菌, F-6为镰刀菌。
|
图 4 兰州百合采后病原菌分离株及其近缘种的系统进化树
Fig. 4 Molecular phylogenetic tree of the pathogens isolates from postharvest L.davidii and their closely related species
a. 基于16S rDNA基因序列构建的致病细菌B-6的系统发育树Phylogenetic tree of pathogenic bacteria B-6 constructed based on 16S rDNA gene sequences; b. 基于18S rDNA基因序列构建的致病真菌F-2、F-3及F-6的系统发育树Phylogenetic tree of pathogenic fungi F-2, F-3 and F-6 constructed based on 18S rDNA gene sequences. Bacillus mojavensis: 摩加夫芽胞杆菌; Bacillus tequilensis: 特基拉芽胞杆菌; Bacillus nakamurai: 中村芽胞杆菌; Bacillus vallismortis: 死谷芽胞杆菌; Bacillus velezensis: 贝莱斯芽胞杆菌; Trichoderma lixii: 李氏木霉; Trichoderma zeloharzianum: 希罗哈茨木霉; Trichoderma pleuroti: 胸膜木霉; Trichoderma ghanense: 甘南木霉; Fusarium obliquiseptatum: 斜皮镰刀菌; Fusarium annulatum: 镰刀菌; Fusarium beomiforme: 镰形镰刀菌; Fusarium babinda: 镰刀菌巴宾达; Penicillium nalgiovense: 纳地青霉; Talaromyces thailandensis: 泰国芳香菌; Talaromyces fuscoviridis: 褐绿色芳香菌; Talaromyces tumuli: 篮状菌。 |
GC-MS分析结果(表 1)显示: 黄花蒿精油中共有30种化合物, 主要成分为α-愈创木烯(41.36%)、β-石竹烯(13.73%)、木罗烯(12.28%)以及1, 8-桉叶素(1, 8-cineole)等活性成分。黄花蒿精油中萜烯类化合物根据结构的不同可分为单萜衍生物(5.38%)和倍半萜衍生物(94.62%)。
| 序号 No. |
化学成分 Compounds |
保留时间/min Retention time |
分子式 Molecular formula |
含量/% Content |
| 1 | 1, 8-桉叶素1, 8-cineole | 4.493 | C10H18O | 0.47 |
| 2 | 蒿酮Artemisia | 4.822 | C10H16O | 2.78 |
| 3 | 侧柏酮Thujone | 5.466 | C10H16O | 0.35 |
| 4 | 樟脑Camphor | 6.003 | C10H16O | 1.44 |
| 5 | 松香芹酮Pinocarvone | 6.254 | C10H14O | 0.34 |
| 6 | 古巴烯Copaene | 9.076 | C15H24 | 2.57 |
| 7 | 异戊酸苄酯Benzyl isovalerate | 9.190 | C12H16O2 | 1.16 |
| 8 | 白菖烯Calarene | 9.249 | C15H24 | 0.55 |
| 9 | β-石竹烯β-caryophyllene | 9.679 | C15H24 | 13.73 |
| 10 | β-法尼烯β-farnesene | 10.031 | C15H24 | 3.48 |
| 11 | α-石竹烯α-caryophyllene | 10.085 | C15H24 | 0.94 |
| 12 | 花柏烯Chamigren | 10.138 | C15H24 | 0.67 |
| 13 | α-雪松烯α-himachalene | 10.347 | C15H24 | 1.68 |
| 14 | 木罗烯Muurolene | 10.449 | C15H24 | 12.28 |
| 15 | α-愈创木烯α-guaiene | 10.562 | C15H24 | 41.36 |
| 16 | α-紫穗槐烯α-amorphene | 10.622 | C15H24 | 1.50 |
| 17 | γ-杜松烯γ-cadinene | 10.807 | C15H24 | 0.47 |
| 18 | δ-杜松烯δ-cadinene | 10.896 | C15H24 | 1.89 |
| 19 | 喇叭烯Varidiflorene | 11.051 | C15H24 | 0.40 |
| 20 | 甲苯, 对-(1, 2-二甲基-3-甲基亚苯基环戊基) Toluene, p-(1, 2-dimethyl-3-methylenecyclopentyl) |
11.099 | C15H20 | 0.47 |
| 21 | 长叶松香芹酮Longipinocarvone | 11.511 | C15H22O | 1.96 |
| 22 | 乙酸4a-甲基-2, 3, 4, 4a, 5, 6, 7, 8-八氢萘-2-基酯 Acetic acid, 4a-methyl-2, 3, 4, 4a, 5, 6, 7, 8-octahydronaphthalen-2-yl ester |
11.618 | C13H20O2 | 0.69 |
| 23 | 氧化石竹烯Caryophyllene oxide | 11.672 | C15H24O | 1.29 |
| 24 | 长叶榧醇Torreyol | 12.245 | C15H26O | 2.82 |
| 25 | 2, 3, 3-三甲基-2-(3-甲基丁-1, 3-二烯基)-6-亚甲基环己酮 2, 3, 3-trimethyl-2-(3-methylbuta-1, 3-dienyl)-6-methylenecyclohexanone |
12.591 | C15H22O | 0.78 |
| 26 | 桉油烯醇Spathulenol | 12.639 | C15H24O | 0.41 |
| 27 | 愈创兰油烃Eucazulen | 13.062 | C15H18 | 0.49 |
| 28 | 1.3, 8-二甲基-4-(1-甲基亚乙基)-2, 4, 6, 7, 8, 8a- 六氢-5(1H)-氮杂烯酮 1.3, 8-dimethyl-4-(1-methylethylidene)-2, 4, 6, 7, 8, 8a- hexahydro-5(1H)-azulenone |
13.182 | C15H22O | 1.34 |
| 29 | β-新丁香三环烯β-neoclovene | 15.348 | C15H24 | 1.32 |
| 30 | 1.2-异丙基-4a-甲基-8-亚甲基八氢-1, 5-萘二酮1.2 -isopropyl-4a-methyl-8-methyleneoctahydro-1, 5-naphthalenedione | 16.094 | C15H22O2 | 0.39 |
| 总计Total | 100 |
黄花蒿精油及1, 8-cineole对致病细菌B-6具有良好的抑菌活性, 当黄花蒿精油及1, 8-cineole的浓度为0.7 mL·L-1时, 抑菌率达到100%(图 5-a)。低浓度的1, 8-cineole对B-6的抑菌活性高于黄花蒿精油, 当其浓度为0.1 mL·L-1时, 其抑菌率达到90%以上。黄花蒿精油和1, 8-cineole对3种兰州百合采后致病真菌均有抑菌活性(图 5-b, c及表 2)。低浓度的黄花蒿精油对F-3和F-6的抑菌活性高于F-2, 但高浓度时, 对F-2的抑菌活性明显高于F-3和F-6;1, 8-cineole高浓度时, 对F-2和F-3的抑菌活性高于F-6, 且具有剂量依赖性, 浓度越大, 抑菌活性越强。黄花蒿精油对F-2、F-3、F-6的EC50范围为0.314~0.357 mL·L-1, 1, 8-cineole对F-2、F-3、F-6的EC50范围为0.280~0.420 mL·L-1。
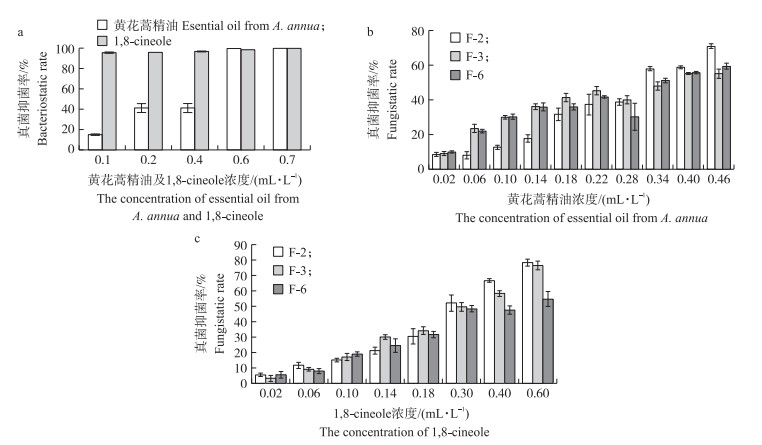
|
图 5 黄花蒿精油及1, 8-cineole对兰州百合采后病原菌的抑菌率 Fig. 5 Inhibitory rate on pathogenic bacteria B-6 in postharvest L.davidii with essential oil from A.annua and 1, 8-cineole a. 黄花蒿精油及1, 8-cineole对B-6抑菌率Bacteriostatic rate of essential oil from A.annua and 1, 8-cineole on B-6;b. 黄花蒿精油对F-2、F-3及F-6抑菌率Fungistatic rate of essential oil from A.annua on F-2, F-3 and F-6;c. 1, 8-cineole对F-2、F-3及F-6抑菌率Fungistatic rate of 1, 8-cineole on F-2, F-3 and F-6. |
| 抗菌材料 Antibacterial material |
病原菌 Pathogenic fungi |
斜率±标准误 Slope±SE |
卡方 (X2) |
自由度 DF |
EC50/(mL·L-1) | 95%置信区间 95% confidence interval |
| 黄花蒿精油 Essential oil from A.annua |
F-2 | 3.154±0.280 | 29.328 | 8 | 0.314 | 0.247~0.445 |
| F-3 | 1.672±0.201 | 3.501 | 8 | 0.336 | 0.275~0.438 | |
| F-6 | 1.704±0.205 | 11.689 | 8 | 0.357 | 0.291~0.469 | |
| 1, 8-cineole | F-2 | 3.367±0.276 | 10.285 | 6 | 0.28 | 0.231~0.351 |
| F-3 | 3.200±0.268 | 1.989 | 6 | 0.289 | 0.255~0.332 | |
| F-6 | 2.322±0.240 | 4.922 | 6 | 0.42 | 0.348~0.537 |
直接接触法检测结果(表 3, 图 6及图 7)表明: 黄花蒿精油和1, 8-cineole对B-6的MIC值均为1.25 mL·L-1, MBC值分别为1.25和5.00 mL·L-1, 因此, 菌株B-6对黄花蒿精油更加敏感。黄花蒿精油和1, 8-cineole对病原真菌F-2的MFC分别为10.00和20.00 mL·L-1, 说明黄花蒿精油比1, 8-cineole对F-2具有更好的抑菌活性。黄花蒿精油对病原真菌F-3及F-6的MFC均为40.00 mL·L-1, 1, 8-cineole对病原真菌F-3及F-6的MFC均为20.00 mL·L-1, 说明病原真菌F-3和F-6对1, 8-cineole更加敏感, 同种病原菌对不同抗菌材料的敏感度不同。此外, 黄花蒿精油对病原菌B-6、F-2、F-3及F-6的杀菌浓度分别为1.25、10.00、40.00和40.00 mL·L-1, 说明不同菌株对同一抗菌材料的敏感度不同。相对于黄花蒿精油, 1, 8-cineole具有更好的体外抗真菌活性。
| 抗菌材料 Antibacterial material |
病原菌 Pathogenic bacteria and fungi |
MIC/(mL·L-1) | MBC(MFC)/(mL·L-1) |
| 黄花蒿精油 Essential oil of A.annua |
B-6 F-2 F-3 F-6 |
1.25 5.00 10.00 10.00 |
1.25 10.00 40.00 40.00 |
| 1, 8-cineole | B-6 F-2 F-3 F-6 |
1.25 5.00 5.00 2.50 |
5.00 20.00 20.00 20.00 |
| 注: MIC: 最低抑菌浓度Minimum inhibitory concentration; MBC: 最低杀菌浓度Minimum bactericidal concentration; MFC: 最低杀真菌浓度Minimum fungicidal concentration. | |||
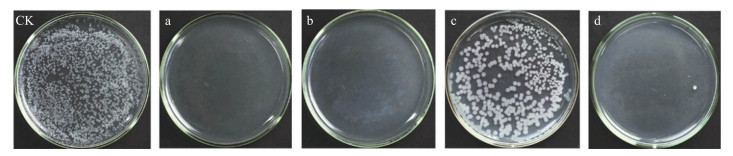
|
图 6 黄花蒿精油及1, 8-cineole对B-6抑菌及杀菌浓度 Fig. 6 Antibacterial and bactericidal concentration of essential oil from A.annua and 1, 8-cineole on B-6 CK. 对照Control; a. 1.25 mL·L-1黄花蒿精油处理Treated with 1.25 mL·L-1 essential oil from A.annua; b. 2.5 mL·L-1黄花蒿精油处理Treated with 2.5 mL·L-1 essential oil from A.annua; c. 1.25 mL·L-1 1, 8-cineole处理Treated with 1.25 mL·L-1 of 1, 8-cineole; d. 2.5 mL·L-1 1, 8-cineole处理Treated with 2.5 mL·L-1 of 1, 8-cineole. |
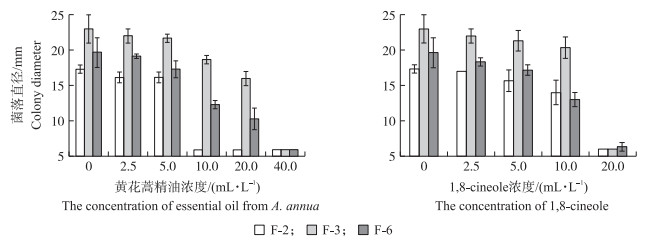
|
图 7 黄花蒿精油及1, 8-cineole对兰州百合采后病原真菌的抑制作用 Fig. 7 Inhibitory effects on pathogenic fungi in postharvest L.davidii with essential oil from A.annua and 1, 8-cineole |
摩加夫芽胞杆菌能够有效防治马铃薯坏疽病[22], 但有研究表明摩加夫芽胞杆菌能够产生有毒成分, 该成分经鉴定为3种不同表面活性素类似物的复合物, 具有细胞毒性, 可以引起食物中毒[23]。李氏木霉可引起三七等植物的采后腐烂[24], 其产生的胞壁降解酶——纤维素酶, 可能是引起兰州百合采后病害的原因之一[25]。然而对于篮状菌(Talaromyces tumuli)研究较少。镰刀菌是常见的植物病害致病菌, 可引起辣椒[26]等常见果蔬的采后病害。本研究中分离得到的4株采后病害致病菌可导致兰州百合腐烂, 产生毒素, 对人体健康构成威胁。因此, 亟需对兰州百合采后病害致病菌进行防治。
黄花蒿精油对常见的病原细菌大肠杆菌及金黄色葡萄球菌具有良好的抑菌活性[27], 对常见的病原真菌如黑曲霉、啤酒酵母菌、产黄青霉、马青霉、毛霉、青霉和根霉也具有较强的抑菌活性。黄花蒿精油中成分复杂, 其中萜类化合物在生活中常被用作医药、农药、食品添加剂和动物饲料添加剂等[28]。研究表明, 1, 8-cineole是多种具有抗菌活性精油的主要活性成分之一, 并且对痤疮丙酸杆菌具有体外抑菌活性[29]。
本研究发现, 黄花蒿精油及其活性成分1, 8-cineole对兰州百合采后病害致病菌均具有抑菌活性, 同一菌株对黄花蒿精油和1, 8-cineole敏感程度不同, 且不同菌对同一抗菌材料的敏感程度也不同。采用熏蒸法和直接接触法研究黄花蒿精油及1, 8-cineole对兰州百合采后病害致病菌的体外活性, 结果表明, 熏蒸法相比直接接触法需要的最低抑菌浓度及杀菌浓度更小, 这可能与黄花蒿精油及1, 8-cineole的挥发性有关。已有研究表明, 蒿属植物精油和香薷精油会导致流感嗜血杆菌细胞壁损伤、细胞变形及皱缩, 还会导致DNA损伤[30], 从而抑制病原菌的生长甚至杀死病原菌。黄花蒿精油及1, 8-cineole的抑菌机制尚未有明确的报道, 因此其抑菌机制有待进一步的研究。
兰州百合在采后贮藏运输过程中会不可避免地引起表面创伤, 导致致病菌侵染而腐烂, 在造成严重经济损失的同时也严重威胁着人体健康。本研究从腐烂的兰州百合中分离得到1株采后病害致病细菌及3株采后病害致病丝状真菌, 研究显示黄花蒿精油以及1, 8-cineole对获得的4种采后病害致病菌均有良好的体外抑菌活性, 并且熏蒸法优于直接接触法。该结论为黄花蒿精油及1, 8-cineole用于兰州百合采后保鲜提供了理论基础。
| [1] |
杨雨华. 半干旱地区兰州百合对地膜覆盖和施肥的生态学效应研究[D]. 兰州: 兰州大学, 2011. Yang Y H. Research on ecological effect of Lilium davidii var. unicolor under film mulches and fertilization[D]. Lanzhou: Lanzhou University, 2011(in Chinese with English abstract). |
| [2] |
Ling L J, Jiao Z L, Ma W X, et al. Preliminary report on the study of postharvest fruit rot bacteria and yeasts in Lanzhou lily(Lilium davidii var. unicolor) in China[J]. Journal of Phytopathology, 2019, 167(3): 135-145. DOI:10.1111/jph.12777 |
| [3] |
赵银彦, 谢忠奎, 胡秉安, 等. 兰州百合生产现状与效益分析[J]. 中国蔬菜, 2018(2): 71-75. Zhao Y Y, Xie Z K, Hu B A, et al. Production status and benefit analysis of Lanzhou lily[J]. China Vegetables, 2018(2): 71-75 (in Chinese with English abstract). |
| [4] |
赵丽君. 临洮县百合产业发展现状及对策[J]. 农业科技与信息, 2019(11): 62-63. Zhao L J. Development status and countermeasures of lily industry in Lintao County[J]. Agricultural Science and Technology and Information, 2019(11): 62-63 (in Chinese). DOI:10.3969/j.issn.1003-6997.2019.11.024 |
| [5] |
Janisiewicz W J, Conway W S. Combining biological control with physical and chemical treatments to control fruit decay after harvest[J]. Stewart Postharvest Review, 2010, 6(1): 1-16. |
| [6] |
巩慧玲, 孙爱洁, 李茜, 等. 兰州百合鳞茎贮藏腐烂病原菌的鉴定及生物学特性[J]. 食品工业科技, 2015, 36(20): 97-101, 106. Gong H L, Sun A J, Li X, et al. Identification of the pathogen from stored Lanzhou lily bulb rot disease and biological characteristics[J]. Science and Technology of Food Industry, 2015, 36(20): 97-101, 106 (in Chinese with English abstract). |
| [7] |
Malik A A, Ahmad J, Mir S R, et al. Influence of chemical and biological treatments on volatile oil composition of Artemisia annua Linn[J]. Industrial Crops & Products, 2009, 30(3): 380-383. |
| [8] |
Juergens L J, Worth H, Juergens U R. New perspectives for mucolytic, anti-inflammatory and adjunctive therapy with 1, 8-cineole in COPD and asthma: review on the new therapeutic approach[J]. Advances in Therapy, 2020, 37(5): 1737-1753. DOI:10.1007/s12325-020-01279-0 |
| [9] |
Mollaei S, Khanehbarndaz O, Gerami-Khashal Z, et al. Molecular identification and phytochemical screening of endophytic fungi isolated from Lithospermum officinale L. roots: a new source of shikonin[J]. Phytochemistry, 2019, 168: 112116. DOI:10.1016/j.phytochem.2019.112116 |
| [10] |
刘瑞玲, 郜海燕, 陈杭君, 等. 红肉火龙果采后病原菌分离鉴定与植物精油抑菌研究[J]. 农业机械学报, 2018, 49(8): 338-345. Liu R L, Gao H Y, Chen H J, et al. Isolation, identification and inhibition of pathogens from red pitaya fruit during storage[J]. Transactions of the Chinese Society for Agricultural Machinery, 2018, 49(8): 338-345 (in Chinese with English abstract). |
| [11] |
Dede A, Guven K, Sahin N. Isolation, plant growth-promoting traits, antagonistic effects on clinical and plant pathogenic organisms and identification of actinomycetes from olive rhizosphere[J]. Microbial Pathogenesis, 2020, 143: 104134. DOI:10.1016/j.micpath.2020.104134 |
| [12] |
Uwalaka E I, Kassim Z J, Abdulmumin A R, et al. Isolation and identification of antibiotic producing bacteria from soil samples of abattoir in Lapai, Niger state, Nigeria[J]. Journal of Applied Life Sciences International, 2019, 22(2): 1-8. |
| [13] |
苏静, 李双明. 土传病原真菌及其生防细菌的分离鉴定[J]. 草原与草坪, 2019, 39(3): 79-84, 91. Su J, Li S M. Isolation and identification of soil-borne pathogenic fungi and biocontrol bacteria[J]. Grassland and Turf, 2019, 39(3): 79-84, 91 (in Chinese with English abstract). DOI:10.3969/j.issn.1009-5500.2019.03.011 |
| [14] |
Vettraino A M, Natili G, Anselmi N, et al. Recovery and pathogenicity of Phytophthora species associated with a resurgence of ink disease in Castanea sativa in Italy[J]. Plant Pathology, 2001, 50(1): 90-96. DOI:10.1046/j.1365-3059.2001.00528.x |
| [15] |
夏乐先, 孙文娟, 沈振, 等. 煮沸裂解法和试剂盒法提取浸矿菌基因组DNA的比较[J]. 现代生物医学进展, 2014, 14(1): 31-35, 17. Xia L X, Sun W J, Shen Z, et al. Comparison of genomic DNA extraction from bioleaching acidophiles by two methods: boiling and kit methods[J]. Progress in Modern Biomedicine, 2014, 14(1): 31-35, 17 (in Chinese with English abstract). |
| [16] |
Hatamzadeh S, Rahnama K, Nasrollahnejad S, et al. Isolation and identification of L-asparaginase-producing endophytic fungi from the Asteraceae family plant species of Iran[J]. PeerJ, 2020, 8: e8309. DOI:10.7717/peerj.8309 |
| [17] |
Majeed H A, Seger Q J. Isolation and identification of two fungal colonies exhibiting antagonistic growth[J]. Journal of Forensic Medicine, 2019, 13(4): 303-307. |
| [18] |
Mehraban A, Nasr R, Eslami M, et al. Molecular and morphological identification of fungi isolated from sour cherry, plum and apple fruit leather in Iran[J]. Gene Reports, 2019, 17: 100500. DOI:10.1016/j.genrep.2019.100500 |
| [19] |
Kıralan S S, Toptancıİ, Öncül Abacıgil T, et al. Phthalates levels in olive oils and olive pomace oils marketed in Turkey[J]. Food Additives & Contaminants: Part A, 2020, 37(8): 1332-1338. |
| [20] |
施俊凤, 王潇冉, 孙常青, 等. 肉豆蔻精油对番茄采后病原真菌的抗菌活性研究[J]. 保鲜与加工, 2013, 13(1): 28-32. Shi J F, Wang X R, Sun C Q, et al. Studies on antifungal activities of myristica oil against pathogenic fungal strains on postharvest tomato[J]. Storage and Process, 2013, 13(1): 28-32 (in Chinese with English abstract). DOI:10.3969/j.issn.1009-6221.2013.01.006 |
| [21] |
Béjaoui A, Chaabane H, Jemli M, et al. Essential oil composition and antibacterial activity of Origanum vulgare subsp. glandulosum Desf. at different phenological stages[J]. Journal of Medicinal Food, 2013, 16(12): 1115-1120. DOI:10.1089/jmf.2013.0079 |
| [22] |
冯中红, 畅涛, 杨成德, 等. 一株抗马铃薯坏疽病莫海威芽孢杆菌(Bacillus mojavensis ZA1)培养条件的优化[J]. 草业学报, 2016, 25(2): 77-86. Feng Z H, Chang T, Yang C D, et al. Optimization of culture conditions of a biocontrol agent Bacillus mojavensis ZA1 to antagonize Phoma foveata[J]. Acta Prataculturae Sinica, 2016, 25(2): 77-86 (in Chinese with English abstract). |
| [23] |
From C, Hormazabal V, Hardy S P, et al. Cytotoxicity in Bacillus mojavensis is abolished following loss of surfactin synthesis: implications for assessment of toxicity and food poisoning potential[J]. International Journal of Food Microbiology, 2007, 117(1): 43-49. DOI:10.1016/j.ijfoodmicro.2007.01.013 |
| [24] |
金鑫, 李孝敬, 黄艺伟, 等. 不同年份三七根际土壤中真菌的分离鉴定及其多样性的比较[J]. 中药材, 2020, 43(2): 314-317. Jin X, Li X J, Huang Y W, et al. Isolation, identification and diversity comparison of rhizosphere fungi of panax notoginseng in different years[J]. Journal of Chinese Medicinal Materials, 2020, 43(2): 314-317 (in Chinese). |
| [25] |
刘小燕, 高智谋, 汪世军, 等. 油菜菌核病菌致病性分化及其与纤维素酶活性的关系[C]//中国植物病理学会2009年学术年会论文集. 昆明, 2009: 33-34. Liu X Y, Gao Z M, Wang S J, et al. Pathogenicity differentiation and its ralationship to cellulase activity of Sclerotinia sclerotiorum isolates[C]//Proceedings of the 2009 Annual Conference of the Chinese Society of Plant Pathology, Kunming, 2009: 33-34(in Chinese). |
| [26] |
张志元, 官春云. 不同栽培方式对辣椒采后病害的影响[J]. 植物病理学报, 2003, 33(2): 183-186. Zhang Z Y, Guan C Y. Effects of different cultivation methods on the pepper postharvest disease[J]. Acta Phytopathologica Sinica, 2003, 33(2): 183-186. |
| [27] |
王书平, 吴涛, 陆玉建. 几种芳香植物精油的抑菌活性研究[J]. 安徽农学通报, 2018, 24(2): 20-24. Wang S P, Wu T, Lu Y J. Study on antimicrobial activity of several kinds of aromatic essential oil[J]. Anhui Agricultural Science Bulletin, 2018, 24(2): 20-24 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-7731.2018.02.007 |
| [28] |
高志玲, 陈艳, 谢英辉. 黄花蒿挥发油的体外抑菌活性研究[J]. 食品科学, 2010, 31(19): 209-211. Gao Z L, Chen Y, Xie Y H. In vitro antimicrobial activity of essential oil from Artemisia annua[J]. Food Science, 2010, 31(19): 209-211 (in Chinese with English abstract). |
| [29] |
夏明静, 曹煜, 杨捷, 等. 22种抗菌消炎中药有效成分对痤疮丙酸杆菌的抑制作用[J]. 中华皮肤科杂志, 2001, 34(6): 435-436. Xia M J, Cao Y, Yang J, et al. Inhibition of Propionibacterium acnes by effective components of traditional Chinese medicines[J]. Chinese Journal of Dermatology, 2001, 34(6): 435-436 (in Chinese with English abstract). DOI:10.3760/j.issn:0412-4030.2001.06.008 |
| [30] |
Huang J H, Qian C, Xu H J, et al. Antibacterial activity of Artemisia asiatica essential oil against some common respiratory infection causing bacterial strains and its mechanism of action in Haemophilus influenzae[J]. Microbial Pathogenesis, 2018, 114: 470-475. DOI:10.1016/j.micpath.2017.12.032 |




