文章信息
- 潘磊庆, 方莉, 周彬静, 张斌, 彭菁, 屠康
- PAN Leiqing, FANG Li, ZHOU Binjing, ZHANG Bin, PENG Jing, TU Kang
- 光学参数测量系统和原理及其在果蔬品质检测方面的研究进展
- System and principle of optical properties measurement and advances on quality detection of fruits and vegetables
- 南京农业大学学报, 2021, 44(3): 401-411
- Journal of Nanjing Agricultural University, 2021, 44(3): 401-411.
- http://dx.doi.org/10.7685/jnau.202007009
-
文章历史
- 收稿日期: 2020-07-19
果蔬组织是复杂基质, 光与果蔬组织相互作用较为复杂, 包括全反射、漫反射、吸收、透射、散射和发射, 不同过程光的能量所占比例与组织的化学组成和物理结构密切相关[1]。近红外光谱技术(near infrared reflectance spectroscopy technology, NIRS)是基于光与果蔬组织样品相互作用时, 根据光子与组织组分的特定光能团的能量交换形成的特征光谱, 运用线性和非线性化学计量法建立样品光谱和待测量指标的关系模型, 实现对未知样品指标的定性和定量预测[2]。但近红外光谱技术所测的光谱信息是光吸收和散射的综合信息, 光与组织之间相互作用的机制不明确, 且光谱信息的分析流程复杂, 导致所建立的模型稳定性和适应性差、精度无法进一步提高。故准确获取果蔬组织的吸收和散射特性具有重要意义。
吸收和多重散射是光在果蔬组织中传播时衰减的原因, 吸收取决于果蔬组织的化学组成成分(水分、可溶性固形物、色素等), 由原子和分子(主要是与光子振动频率一致的O—H, C—H, N—H等含氢基团)不同能级间的电子跃迁产生; 而散射主要受果蔬组织微观结构和宏观折射率改变的影响[2]。光在组织内部的传输、分布情况可通过组织的光学参数变化表征。因此, 对果蔬组织的光学参数进行测量分析有助于了解光与组织的相互作用机制, 并为单独研究果蔬组织化学成分和物理结构与光学特性的关联提供契机。
20世纪70年代末, Birth[3]首次采用Monte Carlo模型探讨马铃薯、猪肉和谷物的光学吸收和散射特性。在20世纪80年代至21世纪初, 由于计算机技术的局限性, 关于农产品光学特性的研究一直处于停滞不前的状态。21世纪, 对于生物组织内部光传输规律的研究在生物医学光子学领域已经十分普遍, 研究者将其测量方法应用于果蔬品质分析领域, 使果蔬品质检测水平得到提高。目前新兴的光学特性参数测量技术有积分球(integrating sphere, IS)、空间分辨(spatial resolved, SR)、时间分辨(time resolved, TR)和频域分辨(frequency domain, FD), 并已在苹果[4]、芒果[5]、梨[6]、香蕉[7]、猕猴桃[8]、马铃薯[9]、番茄[10]等果蔬组织吸收和散射特性研究上取得了较多进展。
1 果蔬组织光学描述 1.1 光传输过程果蔬组织是由细胞和细胞外基质组成的复杂系统, 不同的成分和结构具有特定的光学特性。光与果蔬组织相互作用过程较复杂, 在研究光在组织中的传输过程时, 组织可视为由吸收粒子和散射粒子组成。光吸收可以理想化为: 将组织定义为特定的几何尺寸球体, 该球体会阻挡入射光并投射阴影, 从而构成吸收; 散射是将组织定义为具有特定几何尺寸的球形散射粒子, 该球体将入射光子重新定向到新的方向, 阻挡了光子的正向传输。光传输过程中, 吸收和散射同时存在, 且散射效应远强于吸收效应, 果蔬组织的形状、大小和空间分布及化学组成也会影响光与其互作过程。
1.2 光学特性参数表征光学特性的参数分别为吸收系数(absorption coefficient, μa)、散射系数(scattering coefficient, μs)及各向异性因子(anisotropy factor, g)[2]。μa和μs分别指在样品内单位长度上, 单位光子被吸收和折射定向到新方向而导致辐射能量损失的比率。此外, 散射到特定方向的光子的概率由g确定, g值在-1和1之间[3]。当散射占主导地位(即μs>μa)时, 常用约化散射系数(reduced scattering coefficient, μ′s)来代替μs。μ′s可减少光传输模型中的变量, 简化光传输问题。二者之间的关系公式如下:
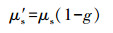
|
(1) |
朗伯比尔定律(Beer-Lambert law)只考虑光吸收, 而忽视散射的影响。对于纯吸收或组织厚度(d)小于散射平均自由程(d < 1/μs)的薄平板组织可根据朗伯比尔定律解析出μa。假设光穿过厚度为d的平板组织, 且在组织表面不发生散射和反射, 朗伯比尔定律的表达形式如下[11]:
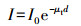
|
(2) |
式中: I为出射光强度; I0为入射光强度; μt为总衰减系数。
在忽略散射的条件下, 准直透射率Tc=I/I0, μt即为吸收系数μa, 此时朗伯比尔定律可表达如下:
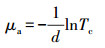
|
(3) |
果蔬组织是复杂的基质, 光与果蔬组织的互作过程需要借助更加复杂的模型来加以解释, 可用麦克斯韦理论方程[12]进行描述, 但考虑到实际样品的复杂性, 方程涉及的变量多, 该方程无法直接求解, 最终近似简化为辐射传输方程。
1.3.2 漫射近似理论果蔬组织具有高散射特点, 可应用辐射传输理论(radiative transfer theory, RTT)描述光与组织的互作过程, 用辐射传输方程(radiative transfer equation, RTE)求解, 但RTE只能在某些特殊条件下得到精确解, 于是提出了许多近似简化解法。目前, 常用且精度较高的方法为漫射近似法(diffusion approximation, DA)。DA方程中只含有μa、μs与μ′s, 是RTE的简化形式。其适用条件为[12-13]: 1)只适用于光子在散射占主导地位的介质中的传输, 一般认为μ′s是μa的10倍以上。2)辐射源各向同性, 且光源和检测器的距离(r)与传输平均自由程(mfp′)之间的关系为r>10 mfp′。3)多重散射不适用。在采用连续波或稳态点光源[14]、脉冲点光源[5]、调频点光源[15]和空间调制区域光源[11]4种光源照射的情况下DA已得到解析[16]。
由于大多数生物组织(包括果蔬组织)微观结构和组成复杂, 不能满足DA所需的解析条件。为了克服该局限性, 提出Monte Carlo仿真和反向倍加数值解析法。
1.3.3 Monte Carlo仿真Monte Carlo(MC)仿真只考虑光子的粒子性, 忽略相位和偏振特性, 是一种模拟光子在浑浊介质中传播的统计方法, 可获得RTE的精确数值解。该方法通过追踪统计大量(≥100 000)光子, 进行光子传播局部规则的描述, 可表述为: 描述光子和组织相互作用时步进大小、发生散射时光子偏转角度大小以及在边界处发生透射或反射概率的概率密度函数[16]。经过多次运行模拟, 获得组织任何位置的辐射能流率, 进而可以计算出反射、透射率等参数。经典MC仿真模型包括光子的发射、移动步长的确定、迁移、碰撞边界、吸收与散射、消亡判断等过程[17]。适用于多层、复杂的组织结构, 常被视为验证所获光学参数的标准, 但需要追踪大量光子的传输轨迹, 耗时较长, 精度依赖于时间, 运行时间越长精度越高, 不适用于快速检测。
1.3.4 倍加法倍加法(adding doubling, AD)与MC类似, 适用于平板介质对RTE的数值解。利用如下公式迭代可得到较厚组织的漫透射率(Td)、漫反射率(Rd)和准直透射率(Tc)[12]。

|
式中: v与ν′分别为光透射角和入射角的余弦值。
为了解决逆向问题, 进一步获得组织的光学特性参数, Prahl等[12]基于倍加法提出逆向倍加法(inverse adding doubling, IAD)。IAD通常结合积分球技术, 根据试验测得的Rd、Td与Tc计算样品的μa与μ′s。基本步骤: 1)预先给出初始光学参数(μa、μs、g); 2)利用IAD算法计算组织的Rd和Td; 3)将计算得到的Rd和Td和积分球系统测量得到的Rd、Td进行比较, 观察其是否在误差范围内; 4)若不在误差范围内, 则重复步骤2和3, 直至匹配。
2 光学参数测量技术 2.1 积分球技术 2.1.1 测量原理积分球(IS)技术是一种精度高、易于实现的光学参数测量方法。积分球内壁涂有高度反射涂层, 反射率高于98%。光经过积分球多次漫反射形成理想的漫反射源, 消除了被测组织以及探测器件受光面不均匀性带来的影响[18]。基于该特性, 积分球技术可在准确测量出薄片组织的Rd和Td的情况下, 结合IAD反演算出其μa与μ′s。但检测过程中光源的稳定性、周围环境的杂散光对测量的精确度存在影响。积分球技术的样品需预处理制成一定厚度的薄片样品, 故无法作为一种无损检测技术, 但其系统设置简单, 精度较高, 通常作为一种测量组织光学特性参数的参考方法。
2.1.2 仪器搭建IS系统分为单积分球(SIS)和双积分球系统(DIS)。SIS系统(图 1)包括光源、积分球、样品夹、光纤、准直器、适配器、光谱仪、光具座和计算机等[19]。而DIS系统包括2个积分球, 检测时样品位于2个积分球之间, 可同时测得Rd和Td。SIS系统分别获取Rd、Td和Tc, 结合IAD算法, 计算得到μa与μ′s。测量样品的Td时, 样品和光源在积分球的同一侧, 样品紧贴进光口, 出光口用积分球盖遮住(图 1-A)。测量样品的Rd时, 样品和光源在积分球的两侧, 样品紧贴出光口, 进光口打开(图 1-B)。Tc测量的是通过样品而不被散射的光强, 测量方式如图 1-C所示。
|
图 1 基于单积分球的农产品光学特性检测系统示意图[19] Fig. 1 Schematic of optical properties measurement system for agricultural products using integrating sphere[19] A. 漫透射率测量装置Setup for measurement on the total transmittance; B. 漫反射率测量装置Setup for measurement on the total reflectance; C. 准直透射率测量装置Setup for measurement on the collimated transmittance. |
IAD算法是结合组织Rd和Td计算组织μa与μ′s最常用的方法之一, 用积分球法测量Rd和Td是利用IAD算法的前提。积分球技术结合IAD算法对光学特性参数的测量精度较高, DIS可同时测得Rd和Td, 但存在“串音”问题, 使Rd和Td测量值比实际值偏大[20], 利用SIS可解决该问题[21]。
2.2 空间分辨技术 2.2.1 测量原理为了更好地理解复杂介质中的光传播问题, Reynolds等[14]首先提出空间分辨技术(SR)。SR采用稳态连续的点光源垂直入射到组织表面, 光子经过吸收和散射从上表面射出, 漫反射率随着入射光源距离的增加而下降, 通过在组织表面不同距离(r)放置传感器, 采集漫反射光谱Rd(r), 再将采集到的数据结合数值解析解进行拟合, 反演得到μa与μ′s。
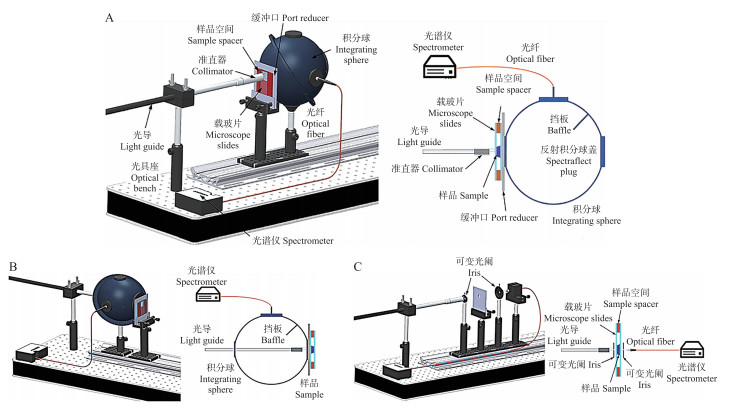
2.2.2 仪器搭建2种典型的SR传感装置为光纤阵列和非接触反射成像, 包括光纤探针(fiber optic probe, FOP)[22, 10]、单色成像(monochromatic imaging, MCI)[23]、高光谱成像(hyperspectral imaging, HSI)[24]。其中, FOP包括刚性光纤探针(图 2-A)和柔性光纤探针(图 2-B)2种, 其常与多通道高光谱成像系统耦合, 可同时采集多个空间分辨光谱, 且使用不同尺寸的探针也可有效地扩大探测范围[25]。MCI(图 2-C)利用CCD相机采集空间分辨漫反射光谱, 系统配置简单, 但像素信号很大一部分来自周围区域, 影响检测精度[23]。与FOP和MCI相比, HIS(图 2-D)能够实现对样品表面空间分辨漫反射光谱的无接触、多波长快速同时采集, 且空间分辨率最低可达0.05 mm[26]。
|
图 2 4种空间分辨系统 Fig. 2 Schematic illustrations of spatial resolved A. 带刚性板的光纤探针[22] Fiber-optic probe with a rigid plate[22]; B. 带柔性板的光纤探针[10] Fiber-optic probe with a flexible plate mounted with 30 optical fibers[10]; C. 单色成像[23] Monochromatic imaging[23]; D. 基于高光谱成像的空间分辨[24] Hyperspectral imaging-based spatially resolved systems[24]. |
SR系统可实现多波长同时测量。使用光纤作为检测器时, 由于光纤探头的位置固定, 导致检测点有限; 使用CCD成像可实现远距离、非接触性测量, 保证了样品的安全卫生, 且可以获得更多的空间和光谱信息, 适用于果蔬品质检测。但由于仪器的复杂性, 在设置SR系统时需考虑光源特性、探测器的动态范围以及光源-探测器的布置等。此外, 样品的不规则形状、不均匀介质以及数学模型求解的复杂性等因素, 都是在果蔬检测中应用SR系统需要进一步研究解决的问题。
2.2.3 数学算法分析SR基于RTT或MC模型, 结合逆算法反演得到μa与μ′s。计算精度主要取决于仪器对SR光谱的测量精度和曲线拟合精度。以下是误差主要来源[27]: 1)SR光谱的归一化预处理易受噪声影响, 缺乏稳定性; 2)曲线拟合前的平滑处理易导致有效信息缺失, 曲线趋势改变; 3)反射信号的采集位置离光源过远过近都无效, 曲线拟合前需进行光谱有效区域的选择; 4)许多样品的特定光谱区域(如700~900 nm)的吸收系数值非常小, 增加了获得精确光学参数的难度。相较于结合IAD算法反演得到光学参数的方法, Peng等[28]提出直接利用洛伦兹分布函数拟合散射光谱剖面或直接提取图像特征值(平均反射率、散射面积、像素点总数)建立模型, 模型精度得到了提高。
2.3 时间分辨技术 2.3.1 测量原理组织表面的时间分辨漫射光中含有组织的光学特征信息, 时间分辨(TR)技术通过测量组织表面某点光信号随时间变化情况, 在距离光源照射固定距离(r)的某点采集不同时间(t)漫反射光谱Rd(t), 通过不同时间点t的漫反射光谱和光传输模型拟合可反演出μa与μ′s。
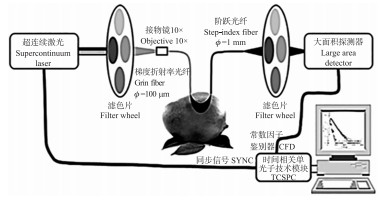
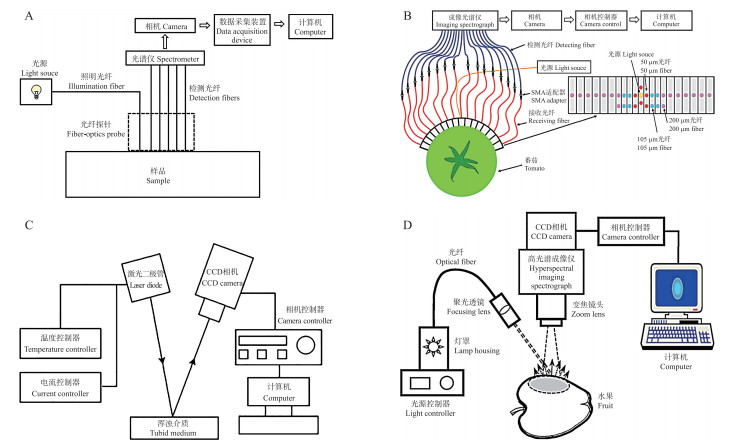
2.3.2 仪器搭建TR系统关键部位包括脉冲激光器和时间相关单光子计数模块TCSPC(图 3)。其工作流程如下: 外触发源触发脉冲激光器, 光脉冲通过光纤入射到组织, 出射的光子由探测光纤收集, 在光电倍增管PMT作用下形成光电脉冲, 经过宽带放大器放大, 作为起始信号进入TCSPC的两路常数因子鉴别器CFD通道。同时, 触发脉冲经过延迟成为参考脉冲, 作为停止信号进入另外一路CFD。光电脉冲和触发脉冲之间的时间差由TCSPC分析并记录下来[29]。TR测量精度高, 系统需要皮秒级别的激光脉冲, 精度取决于高功率的脉冲激光器和高定时精度的探测元件, 适用于单个波长的光学特性参数的测量。但系统使用光子计数技术检测信号, 设置复杂, 仪器昂贵, 导致其无法普遍适用于果蔬品质检测领域。
2.3.3 数学算法分析在距离入射光源r处可直接测得出射光子经过时间t所对应的Td和Rd, 后通过时间t内的TR光谱波形和RTE解析解或MC模拟理论曲线进行数据拟合求解光学参数[30-31]。由于存在系统响应函数, 系统所测得的是真实信号和系统响应函数卷积后得到的波形, 直接和理论曲线拟合, 会存在较大的误差。研究表明: 将理论曲线和系统响应函数卷积后再与系统测得的TR波形拟合, 此算法可行且误差较小[29]。具体的算法过程如下: 逐步改变RTE解析解或MC算法中的初始μa与μ′s, 模拟计算出理论曲线, 将实测波形与理论曲线和系统响应函数卷积后所得的波形进行比较, 当二者的均方误差最小时, 则可认为此时的理论曲线是真实信号, 该理论曲线对应的μa与μ′s, 即为组织的μa与μ′s。
2.4 频域分辨技术 2.4.1 测量原理在频域系统中, 光源经高频调制后获得不同空间相位(α)和不同空间频率(f)的稳态光源, 光源入射到组织上, 在一定距离处测量出射信号。由于介质对光的吸收和散射, 出射信号会产生振幅变化和相位延迟, 将径向位置r处的振幅变化量M和延迟角θ的信号和光传输模型逆向拟合可估算μa与μ′s[16]。
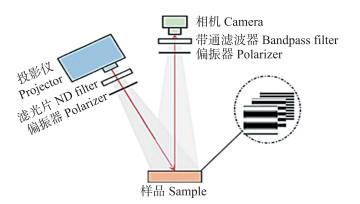
2.4.2 仪器搭建不同于SR、TR和FD, 空间频域成像(SFDI)可对复杂基质的光学特性进行广域映射, 具有对组织进行三维成像的能力[32]。SFDI使用特殊的正弦二维照明模式, 系统包括照明源、探测器和滤光片等, 如图 4所示。SFDI可通过改变调制频率获得样品组织成分和结构的深度分辨信息。此外, 类似于SR技术, 结构光反射成像(SIRI)以更高的空间分辨率和图像对比度来显示特定深度的组织光学图像特征, 才可用于检测果蔬内部病害及早期真菌侵染。不同于TR的脉冲激光光源, FD需要经过高频调制的连续激光光源, 才可实现深度范围的层析检测。在测量时要求探头和组织表面保持良好的接触, 但大部分果蔬外形结构不规则, 这将影响检测精度; 另外由于需要获取不同模式的正弦图案, 导致检测速度慢。
2.4.3 数学算法分析利用SFDI估算μa与μ′s, 需要获取3个模式图像, 对应于3个相隔120°的正弦照明模式[11]。步骤如下: 1)在每个波长处为每个空间频率获取2个或3个相移图像; 2)对获得的模式图像进行解调, 从中获得直接分量(DC)和交替分量(AC)图像; 3)进行图像解调, 获取反射率值; 4)通过模型拟合所提取的反射率分布与空间频率的关系, 利用逆算法估算每个波长的μa与μ′s。
3 光学参数测量技术的应用IS、SR、TR和FD技术可分离果蔬的吸收和散射, 获得组织的组成成分和物理结构信息, 用于果蔬的参数测量和品质检测。表 1为4种技术在预测果蔬可溶性固形物、硬度、成熟度及内外部缺陷等方面的应用。
| 技术 Technique |
产品 Product |
λ/nm | 品质参数 Quality parameter |
模型预测结果 Prediction results of model |
参考文献 References |
特点 Characteristics |
|
| TR | 苹果 Apple |
670, 740~1 100 |
硬度Firmness 细胞间隙Intercellular space volume(RISV) |
R2=0.88, RMSEC=4.5 N R2=0.87, RMSEC=1.0% |
[33] | 对深部结构敏感, 对系统的时间精度和灵敏度要求高 Sensitive to deep structure, requirements of time accuracy and sensitivity of system are high |
|
| 芒果 Mango |
540~900 | 成熟度Maturity 叶绿素Chlorophyll |
[5] | ||||
| 梨 Pear |
780~1 700 | 硬度Firmness SSC | R2=0.35 R2=0.60, RMSEP=0.44 °Brix |
[6] | |||
| 奇异果 Kiwi |
可溶性酸 Soluble acid content 硬度Firmness 可溶性糖含量 Soluble sugar content |
CA=97% CA=75% CA=60% |
[34] | ||||
| 苹果 Apple |
670, 740~1 040 | 内部褐变 Internal browning |
CA: 新鲜苹果90%, 褐心苹果71% Fresh apple 90%, heart brown apple 71% |
[35] | |||
| 油桃 Nectarine |
670 | 硬度 Firmness |
[36] | ||||
| IS | SIS | 梨 Pear |
400~1 150 | 硬度Firmness SSC | R2=0.48 R2=0.40 |
[37] | 成本低, 系统简单, 操作简单, 精确度较高, 检测速度慢 Low cost, simple system composition, easy to execute, but slow speed |
| 苹果 Apple |
400~1 150 | 擦伤程度 Bruising degree |
CA=92.5% |
[38] | |||
| 苹果 Apple |
400~1 050 | 硬度Firmness | R2=0.78 | [39] | |||
| 蓝莓 Blueberry |
400~700 | 瘀伤程度 Bruising degree |
[19] | ||||
| 猕猴桃 Kiwi |
950~1 650 | 硬度Firmness 含水率Moisture content 细胞面积和直径 Area and diameter of cells |
R2=0.74~0.87 R2=0.88 R2=0.65~0.91 |
[8] | |||
| 洋葱 Onion |
550~880 950~1 650 |
酸皮病Acid skin 颈腐病Neck rot disease |
[40] | ||||
| DIS | 马铃薯 Potato |
500~1 900 | 新鲜度Freshness | [9] | 与SIS相比, 检测速度快, 但存在光串扰, 引起误差 High speed compared to SIS, but exited crosstalk causes error |
||
| SR | HISR | 番茄 Tomato |
500~950 | 成熟度Maturity | CA=88.4% | [41] | 测量速度快、光谱范围广, 可同时获得光谱和空间信息 Fast and broad spectral range, combined spectral and spatial information |
| 番茄 Tomato |
500~1 300 | 硬度Firmness SSC pH |
R2=0.835 R2=0.623 R2=0.769 |
[10] | |||
| 苹果 Apple |
500~1 000 | 瘀伤程度 Bruising degree |
R2=0.848~0.919, RMSEP=32.4%~50.7% |
[42] | |||
| 苹果 Apple |
650, 980 | 粉质化Mealiness | CA: 新鲜苹果76%, 粉质化苹果82% Fresh apple 76%, mealy apple 82% |
[43] | |||
| MCI-SR | 香蕉 Banana |
532, 660 785, 830 1 060 |
叶绿素Chlorophyll 弹性Elasticity 成熟度Maturity SSC |
r=0.976 8~0.980 7 r=0.955 3~0.975 9 CA=97.53% r=0.964 0~0.980 1 |
[7] | 系统配置简单, 单波长采集 Simple system composition, only valid at single wavelength |
|
| 柑橘 Tangerine |
532, 785 830, 970~1 060 |
早期腐败 Early decay |
CA=96.1% |
[44] | |||
| FOP-SR | 苹果 Apple |
500~1 000 | 硬度Firmness SSC | R2=0.71, RMSEP=9.68 N R2=0.81, RMSEP=0.69 °Brix |
[45] | 高信噪比, 可同时收集多个空间分辨光谱, 测量时间长 High signal-noise ratio, but more detecting time needed, acquisition of several SR spectral |
|
| FD | SFDI | 苹果 Apple |
650~980 | 瘀伤程度 Bruising degree |
[46] | 多光谱成像, 同时表征空间和体积差异 Multispectral imaging, representted the difference between volume and space |
|
| 苹果 Apple |
460, 527, 630 | 内部褐变 Internal browning |
[47] | ||||
| 注: TR: 时间分辨Time resolved; IS: 积分球Integrating sphere; SIS: 单积分球Single integrating sphere; DIS: 双积分球Double integrating sphere; SR: 空间分辨Spatial resolved; HISR: 基于高光谱成像的空间分辨Hyperspectral imaging-based spatial resolved; MCI-SR: 基于单色成像的空间分辨Monochromatic imaging-based spatial resolved; FOP-SR: 基于光纤探针的空间分辨Fiber optic probe-based spatial resolved; FD: 空间分辨Frequency domain; SFDI: 空间频域成像Spatial-frequency domain imaging; SSC: 可溶性固形物含量Soluble solids content; r: 相关系数: Correlation coefficient; R2: 决定系数Correlation of determination; RMSEP: 预测均方根误差Root-mean-squares error of prediction; RMSEC: 校正均方根误差Root-mean-squares error of calibration; CA: 分类精度Classification accuracy. | |||||||
不同的果蔬组织具有其特定的光学特性, 且果蔬是高度散射组织, 其μ′s通常高于μa。μa取决于化学组成, 果蔬组织的吸收光谱主要是色素位于可见光区以及水分子位于近红外区的吸收峰, 如花色素苷的吸收峰约在525 nm处, 叶绿素b的吸收峰在620~630 nm处, 叶绿素a的吸收峰在670~675 nm, 水的吸收峰在750~780 nm和970 nm[48], 在1 765~1 800 nm处可观察到1个与淀粉含量有关的小峰[9]。此外, 无论是损伤还是无损伤的果肉, 都可观察到叶绿素a(678 nm)及水(970、1 200和1 450 nm)的特征吸收峰。不同的是, 损伤的果肉由于褐变产生黑色素, 在550~600 nm内产生一个较大的吸收峰[19]。其他种类的水果及蔬菜, 如苹果[48]、梨[49]、桃[50]、马铃薯[9]、番茄[10]等的吸收光谱也以水分子与叶绿素、类胡萝卜素和花青素等生色团为主。与吸收光谱相比, 散射光谱相对平坦, μ′s随波长的增加而逐渐减小, 变化趋势符合Mie散射理论, 大多数果蔬组织的散射光谱都具有该规律。根据经验公式μ′s=aλ-b, 其中a与散射粒子的密度成正比, b与颗粒大小相关, λ为波长, 可知μ′s与组织微观结构差异相关, 因此, μ′s随波长的变化规律可以提供组织的结构和物理特性信息。
相对于果肉组织, 果蔬表皮色素含量较高, 吸收更强, 且表皮的细胞结构比果肉更紧密, 散射更强。Wang等[40]测量了550~1 650 nm波长范围内洋葱新鲜组织和洋葱皮的μa与μ′s, 洋葱皮组织干燥, 细胞结构更加紧致, 散射更强, 其μ′s约为洋葱新鲜组织μ′s的18倍。这表明果皮对整果的光学特性参数检测有较大的影响。对于不同成熟阶段、不同品种的果蔬, 其光学特性也不同。随着番茄果实由绿色变为红色, 叶绿素含量下降, 花青素开始增加, 678 nm处吸收减少, 525 nm处吸收增加[10]。桃在不同成熟期的颜色和硬度有很大的变化, 其吸收和散射光谱也对应呈现较明显变化[50]。van Beers等[48]采用双积分球采集了3个品种苹果果皮及果肉的吸收和散射特性, 结果显示, 苹果的μa与μ′s不仅在果皮和果肉间体现出差异, 且不同品种间也具有差异。但同一品种苹果组织的μ′s同样存在差异, 可能由于所运用技术的差异、果蔬成熟度差异、测量部位不同等因素, 无法比较这些结果的相对准确度[38, 51-52]。今后可探究这些因素对光学特性参数测量结果的影响, 后续运用光学参数测量技术时, 应考虑到上述影响因素, 也有必要采用一个统一的标准来验证不同技术之间的差异。
3.2 果蔬品质检测及分级 3.2.1 果蔬品质预测及分类1) 果实硬度。果实硬度是评价成熟度的重要指标之一。He等[37]用IS结合IAD测得在400~1 150 nm处‘元黄’梨的μa与μ′s, 进一步利用偏最小二乘回归(partial least squares regression, PLSR)、980 nm处的μ′s建立硬度预测模型, 建模集和预测集的决定系数R2分别为0.67和0.48, 校正均方根误差(RMSEC)和预测均方根误差(RMSEP)分别为1.66和2.21 N。Vanoli等[33]利用TR基于670 nm和740~1 100 nm的光谱范围内的μa与μ′s, 建立了‘粉红女士’苹果硬度和细胞间隙率的预测模型, μa与μ′s分开建立的模型相关系数较低, 但是将二者结合后, 模型的性能得到改善。Rowe等[39]基于IS测得‘皇家嘎啦’苹果在550~900 nm的μ′s, 随着苹果的软化呈现减小的趋势。Seifert等[52]研究发现成熟过程中李和苹果的散射强度变化很大, 在670 nm处李的μ′s减小了41.7%, 苹果的μ′s减小了14.7%。值得注意的是, 随着果实的软化, μ′s可能不再满足μ′s>μa, 导致漫射近似方程失效, 无法反演出光学吸收系数。故在运用光学参数测量技术预测果实硬度时, 应考虑到该影响因素。
2) 可溶固形物含量(total soluble solids content, SSC)。SSC是果实成熟采收的决定性因素之一, 由可溶性糖、可溶性酸和其他可溶物质组成, 其中可溶性酸和可溶性糖的比率是果实口感的重要指标。由于果实中酸含量较低, 可溶性酸的预测存在精度较低的问题。Cen等[4]运用HISR测得500~1 000 nm‘金冠’和‘美味’苹果的μa与μ′s, 结合PLSR可以很好预测SSC, R2分别为0.778和0.825, RMSEP分别为0.82和0.85 °Brix。Trong等[45]利用SR并基于μa与μ′s建立‘Braeburn’苹果SSC的PLSR预测模型, 结果表明用μa建立的模型性能较好, R2为0.81, RMSEP为0.69 °Brix。Nicolaï等[6]选择对可溶性固形物含量更敏感的875~1 030 nm波长获取TRS光谱图像, 并基于PLSR获得合理的梨SSC预测模型, R2为0.60, RMSEP为0.44 °Brix。
3) 颜色。光学测量技术可对多种果蔬的多种指标进行预测, 同时从波长范围也可以看出, 有些研究已经将可见光波段与近红外光波段一同对果蔬品质进行预测, 所以果蔬的颜色也是影响检测结果的重要因素, 如成熟度(一般与叶绿素含量有关)的检测等。Zerbini等[5]利用TR在类胡萝卜素和叶绿素区域的吸收光谱, 建立了芒果成熟软化的数学模型。Adebayo等[7]将香蕉分为6个成熟期, 可见光波段的分类准确率高达97.53%, 而近红外波段830和1 060 nm的分类准确率为95.06%~96.30%, 且可见光波段的μa与μ′s可以较好地预测叶绿素含量和硬度。由于叶绿素及其他色素含量和成熟度相关, 利用可见波段色素的吸收光谱测量可指示成熟度, 便于分级和货架期评估。特别注意的是, 通过测量色素的吸收光谱来表征果蔬成熟度应关注果蔬的品种差异带来的影响。
4) 硬度、SSC与光学特性参数关联机制。马晨等[53]分析了光学特性与‘朝晖八号’水蜜桃的硬度和果胶的关系, 贮藏过程中桃果实的μ′s随着原果胶含量及原果胶指数(PI)呈显著下降趋势(P < 0.05), 但μa无明显变化。硬度和PI与μ′s的相关性较高(r≥0.965), 且两者基于μ′s构建的预测模型结果也较优(Rp2≥0.751)。说明光学性质能够预测果实硬度的原因可能是因为果胶物质(尤其是PI)与散射性质高度相关。Wei等[54]定量分析0和25 ℃贮藏的‘富士’苹果的SSC、可溶性糖与光学特性之间的变化规律, 结果显示SSC和可溶性糖与μa相关性更高; SSC与蔗糖之间的相关性最高, 两者与光学特性之间的相关性也高于果糖与葡萄糖; 且SSC和蔗糖的PLSR预测模型也较优(Rp2为0.731~0.804), 进一步说明了光学性质能够较准确地预测可溶性固形物含量可能是因为蔗糖与吸收性质高度相关。这些研究结果为光学特性可无损检测果实的硬度和SSC提供了理论依据。
5) 组织微观形态结构与光学特性参数关联机制。目前已有一些学者对果蔬贮藏期间微观结构变化进行研究, 以期理解果蔬生理特性演变的机制, 开发有效的光学技术用于果实发育过程中的品质监测和控制。Liu等[8]在950~1 650 nm采用IS结合IAD技术, 研究了猕猴桃成熟过程中的μa与μ′s与微观结构参数(细胞面积和直径)的关系, 猕猴桃组织细胞的面积和直径在这个波长范围内与μ′s高度相关, r分别为0.65和0.91。Wang等[55]首次提出影响贮藏中果蔬气体交换的微观结构与果蔬光学特性间存在联系, 将4个品种苹果的μ′s和组织微观结构参数(细胞等效球径、球形度、孔隙率和孔表面密度)建立联系, 结果表明μ′s和孔隙率及孔表面密度存在正相关关系, R2均为0.89。未来可利用光学技术来预测果蔬组织的孔隙率, 为果蔬贮藏策略调节提供依据。Ma等[56]的研究中定量分析了桃果实的μa与μ′s与硬度、等效直径、圆度、细胞壁厚度和细胞空隙率的关系, 发现硬度与细胞壁厚度和细胞空隙率较相关(r≥0.750), 而且与μ′s也具有良好的相关性, 基于μ′s建立的预测模型结果也较优。这些结果进一步验证组织微观结构参数和散射特性之间具有高度相关性, 为光学特性预测果实硬度提供了理论依据。上述研究结果均从果蔬自身角度阐明了光学特性检测果蔬品质的机制, 完善了光谱技术无损检测果蔬品质的理论, 促进光学技术改进、仪器开发和应用拓展。
3.2.2 果蔬缺陷品质检测果蔬成熟后, 在采摘、运输、贮藏过程中可能发生挤压、碰撞等机械损伤; 在果蔬生长或者采后贮藏过程中由于水分、营养、微生物或害虫的作用会产生不同的病虫害, 严重影响果蔬品质, 损耗经济效益。而利用光学参数测量技术, 可实现果蔬内、外部品质缺陷的快速无损检测。
1) 表面机械损伤。在表面损伤检测方面, Zhang等[38]和Zhu等[42]利用HISR系统结合平均相对反射率法提取‘金冠’苹果在波长500~1 000 nm的散射特征, 结合PLSR模型, 对3个不同擦伤程度果实的表面擦伤进行预测, Rp2为0.848~0.919, RMSEP为32.4~50.7。HISR系统对于果蔬早期小面积擦伤准确检测分类的效果并未达到理想效果, 而Zhang等[38]利用IS技术和IAD算法, 获得了‘富士’苹果果肉在400~1 050 nm不同程度早期擦伤的光学特性。采用主成分分析(PCA)和支持向量机(SVM)方法建立模型, 对苹果的损伤程度进行预测和分类, 测试集模型的分类精度可达92.7%。Zhang等[19]进一步利用IS系统对3个不同擦伤时间(未损伤、损伤后30 min及损伤后24 h)蓝莓果肉的光学特性进行检测, 在930~1 400 nm, 损伤和未损伤果肉样品之间的μa没有显著差异; 在500~800 nm和930~1 400 nm, 损伤和未损伤的果肉的μ′s和g差异显著, 且MC多层模拟结果表明, 相较于500~800 nm, 在930~1 400 nm检测蓝莓擦伤的潜力较大。
2) 内部病虫害。果蔬在生长、贮藏过程中, 常发生各种类别的病害, 这些内部病害往往通过破坏性的视觉、图像分析等进行检测。粉质化苹果由于其疏松干燥的口感而遭到消费者的拒绝, 苹果粉质化是一种内部病害, 无任何明显的外部特征。Mollazade等[43]基于SR技术采集‘富士’苹果在650和980 nm处的散射图像, 当苹果粉质化时, 在650 nm处的μa由于内部褐变损伤的出现而增加, 而碳水化合物的分解导致980 nm处的μa减小; 且粉质化苹果的果肉更疏松, 在650 nm处的μ′s显著减小, 由于更多的细胞间隙充满空气, 在980 nm处的μ′s增大; 利用人工神经网络分类模型(ANN)进行分类, 基于650和980 nm处的μ′s模型分类准确率分别为76%和82%。Vanoli等[35]利用TR技术发现内部褐变的苹果在750 nm处的μa较大; 而μ′s较小, 而Hu等[47]利用SRFD技术发现内部褐变的苹果在460、527、630 nm处的μa远大于新鲜苹果。Wang等[40]研究发现, 新鲜洋葱与感染洋葱布克氏菌及葱腐葡萄孢霉菌的洋葱在500~1 000 nm的μa及550~1 650 nm的μ′s具有显著差异, 证明利用光学特性参数检测病害洋葱是可行的。
4 总结光吸收和散射特性参数取决于果蔬的化学组分和物理结构特性, 应用光学参数测量技术评价果蔬品质可基于光学特性参数获得化学和物理信息, 从而通过线性/非线性算法建立果蔬品质预测和分级模型, 对评价果蔬品质具有重要意义。
IS、SR、TR和FD作为光学参数测量技术已被广泛应用于果蔬品质评估及光学性质与品质指标变化关联研究中, 且为无损检测(除IS外)。IS技术操作简单, 检测精度相对较高, 但对样品准备要求高, 耗时长。其中DIS相较于SIS, 测量速度更快, 但存在的“串音”问题。TR系统包括光子计数器等精密仪器, 价格昂贵, 但检测速度快, 精度高。SR利用稳态连续光源照射组织, 测量组织表面多点的漫反射信号, 可得到不同位置点的信息。基于空间调制光照的FD技术可在一定深度范围内对组织的光学特性进行表征。这4种技术在数据采集、仪器定标和数学解析算法等方面易出现误差, 准确率有待提高。此外, 果蔬结构多样性和不均匀性给光学测量带来了极大的挑战, 因此, 需要进一步探究果蔬化学组分和物理结构对光学性质的影响, 从果蔬自身的角度阐明光学特性检测果蔬品质的机制, 进一步改进仪器, 简化光传输模型和数学解析算法。虽然目前的果蔬光学特性检测方法仍存在着一些缺陷和局限性, 但该领域的研究存在广阔的应用前景。
| [1] |
刘燕德, 陈兴苗. 光学特性参数的测量方法在水果组织中的应用[J]. 农产品加工·学刊, 2006(10): 90-94. Liu Y D, Chen X M. Application of measurement methods for optical property parameters in fruit tissue[J]. Academic Periodical of Farm Products Processing, 2006(10): 90-94 (in Chinese with English abstract). DOI:10.3969/j.issn.1671-9646-B.2006.10.023 |
| [2] |
Qin J W, Lu R F. Measurement of the optical properties of fruits and vegetables using spatially resolved hyperspectral diffuse reflectance imaging technique[J]. Postharvest Biology and Technology, 2008, 49(3): 355-365. DOI:10.1016/j.postharvbio.2008.03.010 |
| [3] |
Birth G S. The light scattering properties of foods[J]. Journal of Food Science, 1978, 43(3): 916-925. DOI:10.1111/j.1365-2621.1978.tb02455.x |
| [4] |
Cen H Y, Lu R F, Mendoza F A. Analysis of absorption and scattering spectra for assessing the internal quality of apple fruit[J]. Acta Horticulturae, 2012, 945: 181-188. |
| [5] |
Zerbini E P, Vanoli M, Rizzolo A, et al. Optical properties, ethylene production and softening in mango fruit[J]. Postharvest Biology and Technology, 2015, 101: 58-65. DOI:10.1016/j.postharvbio.2014.11.008 |
| [6] |
Nicolaï B M, Verlinden B E, Desmet M, et al. Time-resolved and continuous wave NIR reflectance spectroscopy to predict soluble solids content and firmness of pear[J]. Postharvest Biology and Technology, 2008, 47(1): 68-74. DOI:10.1016/j.postharvbio.2007.06.001 |
| [7] |
Adebayo S E, Hashim N, Abdan K, et al. Prediction of quality attributes and ripeness classification of bananas using optical properties[J]. Scientia Horticulturae, 2016, 212: 171-182. DOI:10.1016/j.scienta.2016.09.045 |
| [8] |
Liu D Y, Guo W C, Li Q Q, et al. Relationship of the bulk optical properties in 950-1650 nm wavelength range with internal quality and microstructure of kiwifruit during maturation[J]. Biosystems Engineering, 2019, 184: 45-54. DOI:10.1016/j.biosystemseng.2019.05.005 |
| [9] |
López-Maestresalas A, Aernouts B, Beers R, et al. Bulk optical properties of potato flesh in the 500-1900 nm range[J]. Food and Bioprocess Technology, 2016, 9(3): 463-470. DOI:10.1007/s11947-015-1639-0 |
| [10] |
Huang Y P, Lu R F, Hu D, et al. Quality assessment of tomato fruit by optical absorption and scattering properties[J]. Postharvest Biology and Technology, 2018, 143: 78-85. DOI:10.1016/j.postharvbio.2018.04.016 |
| [11] |
He X M, Fu X P, Li T W, et al. Spatial frequency domain imaging for detecting bruises of pears[J]. Journal of Food Measurement and Characterization, 2018, 12(2): 1266-1273. DOI:10.1007/s11694-018-9740-5 |
| [12] |
Prahl S A, van Gemert M J C, Welch A J. Determining the optical properties of turbid media by using the adding-doubling method[J]. Applied Optics, 1993, 32(4): 559-568. DOI:10.1364/AO.32.000559 |
| [13] |
胡栋. 空间频域成像技术测量单双层农产品组织光学特性的研究[D]. 杭州: 浙江大学, 2018. Hu D. Measuring optical properties of one-layer and two-layer agro-product tissues using spatial-frequency domain imaging technique[D]. Hangzhou: Zhejiang University, 2018(in Chinese with English abstract). |
| [14] |
Reynolds L, Johnson C, Ishimaru A. Diffuse reflectance from a finite blood medium: applications to the modeling of fiber optic catheters[J]. Applied Optics, 1976, 15(9): 2059-2067. DOI:10.1364/AO.15.002059 |
| [15] |
Patterson M S, Moulton J D, Wilson B C, et al. Frequency-domain reflectance for the determination of the scattering and absorption properties of tissue[J]. Applied Optics, 1991, 30(31): 4474-4476. DOI:10.1364/AO.30.004474 |
| [16] |
Lu R F, van Beers R, Saeys W, et al. Measurement of optical properties of fruits and vegetables: a review[J]. Postharvest Biology and Technology, 2020, 159: 111003. DOI:10.1016/j.postharvbio.2019.111003 |
| [17] |
Watté R, Aernouts B, van Beers R, et al. Modeling the propagation of light in realistic tissue structures with MMC-fpf: a meshed Monte Carlo method with free phase function[J]. Optics Express, 2015, 23(13): 17467-17486. DOI:10.1364/OE.23.017467 |
| [18] |
Lu R F. Light Scattering Technology for Food Property, Quality and Safety Assessment[M]. New York: CRC Press, 2017.
|
| [19] |
Zhang M Y, Li C Y, Yang F Z. Optical properties of blueberry flesh and skin and Monte Carlo multi-layered simulation of light interaction with fruit tissues[J]. Postharvest Biology and Technology, 2019, 150: 28-41. DOI:10.1016/j.postharvbio.2018.12.006 |
| [20] |
Pickering J W, Prahl S A, van Wieringen N, et al. Double-integrating-sphere system for measuring the optical properties of tissue[J]. Applied Optics, 1993, 32(4): 399-410. DOI:10.1364/AO.32.000399 |
| [21] |
方振欢. 用于水果组织光传输特性检测的单积分球系统研制及应用[D]. 杭州: 浙江大学, 2015. Fang Z H. Development and application of a single integrating sphere system for detecting optical properties of fruit tissue[D]. Hangzhou: Zhejiang University, 2015(in Chinese with English abstract). |
| [22] |
Trong N N D, Rizzolo A, Herremans E, et al. Optical properties-microstructure-texture relationships of dried apple slices: spatially resolved diffuse reflectance spectroscopy as a novel technique for analysis and process control[J]. Innovative Food Science & Emerging Technologies, 2014, 21: 160-168. |
| [23] |
Fabbri F, Franceschini M A, Fantini S. Characterization of spatial and temporal variations in the optical properties of tissuelike media with diffuse reflectance imaging[J]. Applied Optics, 2003, 42(16): 3063. DOI:10.1364/AO.42.003063 |
| [24] |
Peng Y K, Lu R F. Analysis of spatially resolved hyperspectral scattering images for assessing apple fruit firmness and soluble solids content[J]. Postharvest Biology and Technology, 2008, 48(1): 52-62. DOI:10.1016/j.postharvbio.2007.09.019 |
| [25] |
Huang Y P, Lu R F, Chen K J. Development of a multichannel hyperspectral imaging probe for property and quality assessment of horticultural products[J]. Postharvest Biology and Technology, 2017, 133: 88-97. DOI:10.1016/j.postharvbio.2017.07.009 |
| [26] |
Qin J W, Lu R F. Hyperspectral diffuse reflectance for determination of the optical properties of milk and fruit and vegetable juice[C]//Chen Y R. Optical Sensors and Sensing Systems for Natural Resources and Food Safety and Quality. San Jose, California, USA: Proc SPIE 5996, 2005: 59960Q.
|
| [27] |
王爱臣. 空间分辨高光谱成像技术测量单/双层农产品组织光学特性的研究[D]. 杭州: 浙江大学, 2017. Wang A C. Measuring the optical properties of one/two layer tissue of agro-products using hyperspectral imaging-based spatially-resolved technique[D]. Hangzhou: Zhejiang University, 2017(in Chinese with English abstract). |
| [28] |
Peng Y K, Lu R F. Improving apple fruit firmness predictions by effective correction of multispectral scattering images[J]. Postharvest Biology and Technology, 2006, 41(3): 266-274. DOI:10.1016/j.postharvbio.2006.04.005 |
| [29] |
余江胜, 骆清铭, 阮玉. 时间分辨技术测量高散射介质光学参量[J]. 光子学报, 2003, 32(7): 860-863. Yu J S, Luo Q M, Ruan Y. Optical properties measurement of diffusion media with time resolved technique[J]. Acta Photonica Sinica, 2003, 32(7): 860-863 (in Chinese with English abstract). |
| [30] |
张连顺, 张春平, 王新宇, 等. 生物组织光学特性参数无损测量实验研究[J]. 光电子·激光, 2004, 15(6): 746-749. Zhang L S, Zhang C P, Wang X Y, et al. Experiment research for non-Invasive measurement of optical parameters of biological tissues[J]. Journal of Optoelectronics·Laser, 2004, 15(6): 746-749 (in Chinese with English abstract). DOI:10.3321/j.issn:1005-0086.2004.06.029 |
| [31] |
Palmer G M, Ramanujam N. Monte Carlo-based inverse model for calculating tissue optical properties. Part I: Theory and validation on synthetic phantom[J]. Applied Optics, 2006, 45(5): 1062-1071. DOI:10.1364/AO.45.001062 |
| [32] |
Cuccia D J, Bevilacqua F, Durkin A J, et al. Quantitation and mapping of tissue optical properties using modulated imaging[J]. Journal of Biomedical Optics, 2009, 14(2): 024012. DOI:10.1117/1.3088140 |
| [33] |
Vanoli M, Rizzolo A, Grassi M, et al. Time-resolved reflectance spectroscopy nondestructively reveals structural changes in 'Pink Lady®' apples during storage[J]. Procedia Food Science, 2011, 1: 81-89. DOI:10.1016/j.profoo.2011.09.014 |
| [34] |
Valero C, Ruiz-Altisent M, Cubeddu R. Detection of internal quality in kiwi with time-domain diffuse reflectance spectroscopy[J]. Applied Engineering in Agriculture, 2004, 20(2): 223-230. DOI:10.13031/2013.15879 |
| [35] |
Vanoli M, Rizzolo A, Grassi M, et al. Studies on classification models to discriminate 'Braeburn' apples affected by internal browning using the optical properties measured by time-resolved reflectance spectroscopy[J]. Postharvest Biology and Technology, 2014, 91: 112-121. DOI:10.1016/j.postharvbio.2014.01.002 |
| [36] |
Rizzolo A, Vanoli M, Zerbini P E, et al. Influence of cold storage time on the softening prediction in 'Spring Bright' nectarines[J]. Acta Horticulturae, 2010, 877: 1395-1402. |
| [37] |
He X M, Fu X P, Rao X Q, et al. Assessing firmness and SSC of pears based on absorption and scattering properties using an automatic integrating sphere system from 400 to 1150 nm[J]. Postharvest Biology and Technology, 2016, 121: 62-70. DOI:10.1016/j.postharvbio.2016.07.013 |
| [38] |
Zhang S, Wu X H, Zhang S H, et al. An effective method to inspect and classify the bruising degree of apples based on the optical properties[J]. Postharvest Biology and Technology, 2017, 127: 44-52. DOI:10.1016/j.postharvbio.2016.12.008 |
| [39] |
Rowe P I, Künnemeyer R, Mcglone A, et al. Relationship between tissue firmness and optical properties of 'Royal Gala 'apples from 400 to 1050 nm[J]. Postharvest Biology and Technology, 2014, 94: 89-96. DOI:10.1016/j.postharvbio.2014.03.007 |
| [40] |
Wang W, Li C, Gitaitis R D. Optical properties of healthy and diseased onion tissues in the visible and near-infrared spectral region[J]. Transactions of the ASABE, 2014, 57(6): 1771-1782. |
| [41] |
Zhu Q B, He C L, Lu R F, et al. Ripeness evaluation of 'Sun Bright' tomato using optical absorption and scattering properties[J]. Postharvest Biology and Technology, 2015, 103: 27-34. DOI:10.1016/j.postharvbio.2015.02.007 |
| [42] |
Zhu Q B, Guan J Y, Huang M, et al. Predicting bruise susceptibility of 'Golden Delicious' apples using hyperspectral scattering technique[J]. Postharvest Biology and Technology, 2016, 114: 86-94. DOI:10.1016/j.postharvbio.2015.12.007 |
| [43] |
Mollazade K, Arefi A. Optical analysis using monochromatic imaging-based spatially-resolved technique capable of detecting mealiness in apple fruit[J]. Scientia Horticulturae, 2017, 225: 589-598. DOI:10.1016/j.scienta.2017.08.005 |
| [44] |
Lorente D, Zude M, Idler C, et al. Laser-light backscattering imaging for early decay detection in citrus fruit using both a statistical and a physical model[J]. Journal of Food Engineering, 2015, 154: 76-85. DOI:10.1016/j.jfoodeng.2015.01.004 |
| [45] |
Trong N N D, Erkinbaev C, Tsuta M, et al. Spatially resolved diffuse reflectance in the visible and near-infrared wavelength range for non-destructive quality assessment of 'Braeburn' apples[J]. Postharvest Biology and Technology, 2014, 91: 39-48. DOI:10.1016/j.postharvbio.2013.12.004 |
| [46] |
Anderson E R, Cuccia D J, Durkin A J. Detection of bruises on golden delicious apples using spatial-frequency-domain imaging[C]//Tuan V, Grundfest W S, Benaron D A. Advanced Biomedical and Clinical Diagnostic Systems Ⅴ. San Jose, California, USA: Proc SPIE 6430, 2007: 643010.
|
| [47] |
Hu D, Fu X P, He X M, et al. Noncontact and wide-field characterization of the absorption and scattering properties of apple fruit using spatial-frequency domain imaging[J]. Scientific Reports, 2016, 6(1): 37920. DOI:10.1038/srep37920 |
| [48] |
van Beers R, Aernouts B, Watté R, et al. Effect of maturation on the bulk optical properties of apple skin and cortex in the 500-1850 nm wavelength range[J]. Journal of Food Engineering, 2017, 214: 79-89. DOI:10.1016/j.jfoodeng.2017.06.013 |
| [49] |
Hu D, Fu X P, Ying Y B. Characterizing pear tissue with optical absorption and scattering properties using spatially-resolved diffuse reflectance[J]. Journal of Food Measurement and Characterization, 2017, 11(2): 930-936. DOI:10.1007/s11694-017-9465-x |
| [50] |
Cen H Y, Lu R F, Mendoza F A. Assessing multiple quality attributes of peaches using optical absorption and scattering properties[J]. Transactions of the ASABE, 2012, 55(2): 647-657. DOI:10.13031/2013.41366 |
| [51] |
Qin J W, Lu R F. Monte Carlo simulation for quantification of light transport features in apples[J]. Computers and Electronics in Agriculture, 2009, 68(1): 44-51. DOI:10.1016/j.compag.2009.04.002 |
| [52] |
Seifert B, Zude M, Spinelli L, et al. Optical properties of developing pip and stone fruit reveal underlying structural changes[J]. Physiologia Plantarum, 2015, 153(2): 327-336. DOI:10.1111/ppl.12232 |
| [53] |
马晨, 冯莉, 魏康丽, 等. 桃果实采后光学特性与硬度及果胶物质的关系[J]. 南京农业大学学报, 2020, 43(2): 347-355. Ma C, Feng L, Wei K L, et al. Relationship between the optical properties and firmness, pectin constitution in peach flesh during post-harvest storage[J]. Journal of Nanjing Agricultural University, 2020, 43(2): 347-355 (in Chinese with English abstract). DOI:10.7685/jnau.201905054 |
| [54] |
Wei K L, Ma C, Sun K, et al. Relationship between optical properties and soluble sugar contents of apple flesh during storage[J]. Postharvest Biology and Technology, 2020, 159: 111021. DOI:10.1016/j.postharvbio.2019.111021 |
| [55] |
Wang Z, van Beers R, Aernouts B, et al. Microstructure affects light scattering in apples[J]. Postharvest Biology and Technology, 2020, 159: 110996. DOI:10.1016/j.postharvbio.2019.110996 |
| [56] |
Ma C, Feng L, Pan L, et al. Relationships between optical properties of peach flesh with firmness and tissue structure during storage[J]. Postharvest Biology and Technology, 2020, 163: 111134. DOI:10.1016/j.postharvbio.2020.111134 |