文章信息
- 刘丹, 周倩, 孔祥雨, 胡春梅, 侯喜林, 王建军
- LIU Dan, ZHOU Qian, KONG Xiangyu, HU Chunmei, HOU Xilin, WANG Jianjun
- 不结球白菜花青苷合成转录因子基因BcEGL3的克隆及沉默分析
- Cloning and gene silencing of an anthocyanin synthesis regulatory gene BcEGL3 in non-heading Chinese cabbage
- 南京农业大学学报, 2021, 44(2): 249-258
- Journal of Nanjing Agricultural University, 2021, 44(2): 249-258.
- http://dx.doi.org/10.7685/jnau.202006016
-
文章历史
- 收稿日期: 2020-06-14
2. 南京农业大学 连云港新农村发展研究院, 江苏 连云港 222002
2. Lianyungang New Rural Development Institute, Nanjing Agricultural University, Lianyungang 222002, China
不结球白菜(Brassica campestris ssp. chinensis)富含对人体有利的维生素C、粗纤维和花青苷, 紫色不结球白菜中的花青苷含量尤为丰富。花青苷是糖基化的多酚类化合物, 易溶于水, 是蔬菜和水果重要的呈色物质。花青苷能够保护植物抵抗各种生物和非生物胁迫[1], 花青苷在人体中还具有抗氧化[2]、抗癌[3], 降低血压[4]和血脂[5], 减缓阿尔兹海默症[6]等功效。
EGL3(Enhancer of Glabra 3)基因属于Ⅲf亚类bHLH转录因子, 可以通过调控花青苷合成途径中某个结构基因, 实现对植物体内花青苷含量的调控作用。EGL3蛋白具有典型碱性螺旋环螺旋结构域, bHLH结构域具有2个不同的功能区域: HLH和BASIC[7], 其中HLH可以促进蛋白互作, 形成同源二聚体或异源二聚体[8]; BASIC位于bHLH结构域的N末端, 与DNA顺式元件E-box(5′-CANNTG-3′)和G-box(5′-CACGTG-3′)结合调控基因的表达[9]。DFR基因是花青苷合成途径中结构基因。二氢黄酮醇-4-还原酶(dihydrofavonol 4-reductase, DFR)是花青苷生物合成代谢中的关键酶, 影响花青苷的组成和色素沉着, 是植物呈色的关键酶, 也是花色形成的重要调控点。Danilo等[10]对缺失DFR基因的番茄纯合子的胚轴和愈伤组织进行体外培养, 之后对再生绿色小植株的胚轴和愈伤组织靶向插入DFR基因, 结果再生小植株由绿色转为紫色。于婷婷[11]在龙胆试验中检测发现, DFR基因过表达的转基因橙花龙胆与野生型相比红色更深, 花青苷含量更高。Nesi等[12]发现在过表达EGL3的转基因拟南芥植株中, DFR的表达量增加, 叶片由绿色转为紫色, 证明EGL3通过调控花青苷合成途径中DFR基因实现对花青苷的调控。EGL3基因还可与其他调控因子PAP1/2、TTG1一起形成复合体, 共同调控DFR基因的表达调控[13]。
本研究采用同源克隆方式以不结球白菜紫色自交系NJZX1-3及其绿色突变体NJZX1-0为材料克隆获得BcEGL3基因, 利用生物信息学方法分析其结构及保守域, 并预测其蛋白结构; 构建pRI101-BcEGL3载体, 对BcEGL3进行亚细胞定位分析; 构建pTY-BcEGL3沉默载体, 对BcEGL3基因进行功能验证; 对NJZX1-3进行遮光处理, 检测叶片花青苷含量以及BcEGL3基因的转录水平, 旨在为紫色不结球白菜中花青苷合成的分子调控机制奠定生物学基础。
1 材料与方法 1.1 试验材料供试材料为不结球白菜紫色材料NJZX1-3及其经过秋水仙素诱导所产生的非加倍绿色突变体NJZX1-0(图 1), 由南京农业大学白菜系统生物学实验室提供。将不结球白菜种子先用体积分数为70%的乙醇杀菌消毒后, 再用超净水冲洗, 室温催芽2 d左右, 移至穴盘, 放置在气候室(光/暗时间为16 h/8 h, 光/暗温度为22 ℃/18 ℃)。另外, 取7叶期健壮NJZX1-3材料用遮阳网进行遮光处理, 分别在处理后0、3、7、11和14 d时取样, 每个处理设3次重复。以同期自然条件下生长的健壮幼苗为对照组。

|
图 1 不结球白菜的表型 Fig. 1 The phenotype of non-heading Chinese cabbage |
取0.1 g试验材料7叶期的叶片, 置于加入锆珠的2 mL磨样管中, 液氮速冻。用磨样机(程序为45 Hz 90 s)磨样完成后, 用RNA提取试剂盒(TaKaRa)提取RNA。使用Prime Script RT Reagent Kit(TaKaRa)合成cDNA, 用于BcEGL3基因的克隆。
1.3 BcEGL3基因的克隆在大白菜数据库(BRAD, http://brassicadb.org/brad/index.php)中, 查询BcEGL3同源基因BraEGL3(Bra027796)设计特异引物(表 1), 并以反转录得到的第1链cDNA为模板, 进行cDNA克隆。PCR总体系为20 μL: 模板1 μL, 正、反引物各1 μL, I-5TtMn 2×High-Fidelity Master Mix酶(南京擎科生物科技有限公司)10 μL, ddH2O 7 μL。设3个重复。反应程序: 95 ℃ 5 min; 95 ℃ 30 s, 59.6 ℃ 30 s, 72 ℃ 2 min, 35个循环; 72 ℃ 10 min。PCR产物经15 g·L-1凝胶电泳检测后, 回收目的片段, 经大肠杆菌转化后, 挑取单菌落送南京擎科生物科技有限公司进行测序。
| 引物对名称 Primer pairs name |
引物对序列 Primer pairs sequence(5′→3′) |
用途 Usage |
| BcEGL3-F/R | CATATGATGGCTACTGGAGAAAACA/GGATCCACATATCCATGCAACTCTTTG | 扩增保守片段 The conserved fragment |
| BcEGL3.1-F/R | TTCTTCACTGTTGATACATATGATGGCTACTGGAGAAAACAGAACCGTG/ TCGCCCTTGCTCACCATGGATCCACATATCCATGCAACTCTTTGAAG |
荧光载体的构建 Construction of fluorescent vector |
| BcEGL3-A/S | CAGAACCGTGCAGGAAAATCT/TCCATCTCCCCATTCCAGCA | 检测BcEGL3的表达 The expression of BcEGL3 |
| BcDFR-A/S | CCAAGAAGATGACAGGAT/GTTACGAGTGATAGGAGAG | 检测BcDFR的表达 The expression of BcDFR |
| Actin-A/S | GTTGCTATCCAGGCTGTTCT/AGCGTGAGGAAGAGCATAAC | 内参基因 The internal gene |
利用BioXM 2.6对EGL3进行ORF查找、翻译; 利用NCBI(https://www.ncbi.nlm.nih.gov/)中的分析工具对EGL3蛋白质理化性质进行分析; 利用DNAMAN 7程序进行多重序列比对; 利用TMpred在线软件(https://www.ch.embnet.org/software/TMPRED_form.html)预测EGL3的跨膜结构; 利用MEGA 5程序构建系统进化树; 利用在线的SMART(http://smart.embl-heidelberg.de)进行结构域分析; 利用WebLogo(http://weblogo.berkeley.edu/logo.cgi)在线程序分析EGL3转录因子蛋白结构域的保守位点。
1.5 BcEGL3的亚细胞定位检测设计2条特异性引物BcEGL3.1-R和BcEGL3.1-F, 以pEASY-BcEGL3.1载体质粒为模板, 采用高保真酶扩增目标片段, 电泳检测后切胶回收。用限制性内切酶对表达载体pRI101进行双酶切。反应产物经凝胶(15 g·L-1)电泳检测后, 胶回收酶切目的片段。用ClonExpress Ⅱ One Step Cloning Kit(南京诺唯赞生物科技有限公司)同源重组上述胶回收片段, 经大肠杆菌转化后, 挑取单菌落送南京擎科生物科技有限公司进行测序, 返样后提取质粒, 于-70 ℃冰箱中保存备用。
将上述提取的质粒采用冻融法转化到农杆菌GV3101中, 均匀涂在含有卡那霉素(50 mg·L-1)和利福平(50 mg·L-1)的LB固体培养基上, 在28 ℃恒温培养箱中倒置培养。2 d后挑取单菌落于400 μL含卡那霉素和利福平的LB液体培养基的灭菌管中; 在28 ℃过夜摇菌, 将摇好的菌液转移到50 mL管中摇至菌液D600=1.0;6 000 r·min-1离心5 min, 弃上清液, 用含10 mmol·L-1 MES、10 mmol·L-1 MgCl2和150 mol·L-1的乙酰丁香酮注射缓冲液重悬菌液; 将菌液调至D600=0.8, 室温静置4 h; 将P19、RFP、EGL3基因按0.5∶1∶1的体积比混匀, 用1 mL灭菌的去掉针头的注射器, 注射种植时间为1个月的烟草叶片背面。将注射后的烟草置于气候室, 气候室条件为: 光/暗时间为16 h/8 h, 光/暗温度为22 ℃/18 ℃。3 d后利用激光共聚焦显微镜观察并拍照。
1.6 病毒诱导的基因沉默表达载体的构建pTY-BcEGL3的载体构建主要采用杨学东等[14]的方法。BcEGL3选取的40 bp序列为: 5′-TAAAGAAACACCTCGCAGTTTCAGTTCGAAACATTCAATG-3′, 在南京金斯瑞生物科技有限公司分别合成反向互补序列80 bp。pTY载体用NdeⅠ酶切后, 用T4连接酶与合成好的DNA片段过夜连接, 转化大肠杆菌, 挑取阳性单克隆, 测序验证。提取pTY-BcEGL3质粒, 用金粉包埋后, 用基因枪(1 000 psi)导入到7叶期的NJZX1-3中, 以pTY空载质粒的NJZX1-3(pTY-S)作为对照, 20 d后, 观察植株表型变化。选取pTY载体中的CP(coat protein)基因片段设计特异引物(CP-F: 5′-TCCACCCTCACCACCTTC-3′和CP-R: 5′-GGGACAGACCTCGCTAACT-3′), PCR检测转基因植株[15]。
1.7 不结球白菜总花青苷含量的测定采用董慧杰[2]的方法并稍加改动。取冷冻干燥叶片0.1 g, 用液氮研磨后, 加入1.5 mL酸化乙醇(用体积分数为5%的HCl进行酸化), 在适当摇晃、避光条件下浸提24 h。
1.8 实时荧光定量PCR表达分析根据克隆所得EGL3基因的cDNA全长序列, 采用在线软件Primer-BLAST设计正、反引物(表 1), Actin基因作为内参。试验步骤及用量参考SYBR Premix Ex Taq TMNJZX1-0Ⅱ(TaKaRa)试剂盒说明书。反应总体系20 μL: 模板1 μL, 正、反引物各0.5 μL, SYBR Premix Ex Taq 10 μL, ddH2O 8 μL。采用2-ΔΔCT法[16]计算基因的相对表达量。每个反应设3次生物学重复。程序为标准的两步法, 在7500实时荧光定量PCR仪(美国AppliedBiosystems)上进行定量分析。
2 结果与分析 2.1 不结球白菜EGL3基因的克隆及序列分析分别从NJZX1-3和NJZX1-0中分离出2个cDNA克隆片段, 测序结果(图 2)显示, 这2个片段的基因序列完全一致, 长1 821 bp, 将其命名为BcEGL3。核苷酸序列比对结果显示, BcEGL3含有1个长为1 818 bp的开放阅读框(ORF), 编码606个氨基酸, 其中含酸性氨基酸63个, 碱性氨基酸84个。

|
图 2 不结球白菜EGL3基因的核苷酸序列及其对应的氨基酸序列 Fig. 2 The nucleotide and deduced amino acids sequence of EGL3 genein Brassica campestris ssp. chinensis |
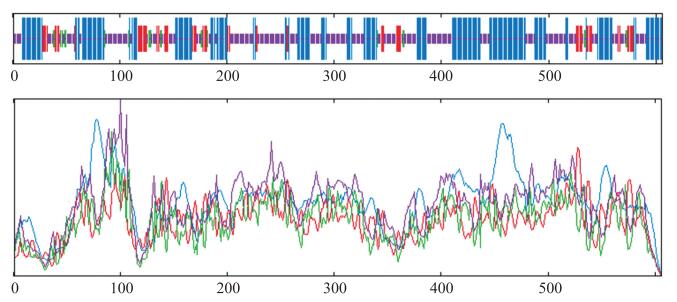
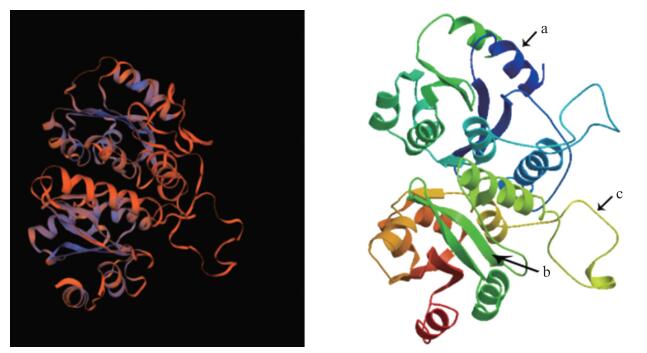
对BcEGL3蛋白结构分析显示, 该蛋白的等电点为4.98, 分子结构式为C5469H9119N1821O2289S354, 相对分子质量为6.795×104, 为亲水性蛋白。氨基酸组成中Ala(a)丙氨酸所占比例最大。保守域分析结果表明, EGL3蛋白属于bHLH-MYC-N超家族。利用在线软件SOPMA预测EGL3编码蛋白二级结构, 结果表明(图 3), EGL3含有α-螺旋236个(38.94%), 无规则卷曲281个(46.37%), 含有β-转角23个(3.80%)和延伸链66个(10.89%)。EGL3蛋白的三级结构(图 4)的预测结果与二级结构的基本相符。
|
图 3 BcEGL3蛋白的二级结构 Fig. 3 The predicted secondary structure of BcEGL3 protein 图中蓝色为α-螺旋, 红色为β-折叠, 绿色为β-转角, 紫色为无规则卷曲。 In figure, blue represents alpha helix, red represents beta folding, green represents beta corner and purple represents irregular curling. |
|
图 4 BcEGL3蛋白质三级结构 Fig. 4 The predicted tertiary structure of BcEGL3 protein a. α-螺旋α-helix; b.延伸链Extended strand; c.随机卷曲Random coils. |
利用BLASTp对BcEGL3蛋白序列进行同源检索, 并进行多重序列比对。结果(图 5)显示: 在7个物种的EGL3蛋白序列中, BcEGL3蛋白与大白菜中的EGL3同源性高达99.90%, 其次是油菜和甘蓝, 同源性分别为98.68%和98.46%。

|
图 5 BcEGL3蛋白和其他物种EGL3蛋白的同源性比较 Fig. 5 Homologous alignment of amino acid sequences of BcEGL3 and EGL3 in other species 1.不结球白菜Brassica campestris ssp. chinensis; 2.大白菜Brassica rapa ssp. pekinensis(XM_009114683.2);3.甘蓝Brassica oleracea(XM_013751484.1);4.萝卜Raphanus sativus(XM_018597840.1);5.琴叶拟南芥Arabidopsis lyrata subsp. lyrata(XM_021010124.1);6.亚麻芥Camelina sativa(XM_010475309.2);7.拟南芥Arabidopsis thaliana(NM_001198373.2). |
根据蛋白质的序列构建分子进化树, 结果(图 6)表明, EGL3蛋白的进化关系与植物学分类一致, 不同物种之间有明显的种属关系。十字花科植物归为一大类, 包括芸薹属这一小支, 属于其他科属的植物也各自分别归类。BcEGL3蛋白与欧洲油菜、大白菜、甘蓝和萝卜中的EGL3蛋白聚为同一组, 彼此亲缘关系较近, 表明BcEGL3蛋白可能具有相似的编码和调控功能。

|
图 6 BcEGL3蛋白与其他物种中EGL3蛋白的系统进化分析 Fig. 6 Phylogenetic analysis of BcEGL3 protein and EGL3 proteins in other species |
由图 7可见: pRI101-BcEGL3荧光表达载体在GFP通道下可以被激发, 发出明显的绿色荧光信号。细胞核marker用来标识细胞核的位置, 在RFP通道下发出明显的红色荧光信号。利用激光共聚焦显微镜观察注射3 d后的烟草叶片, 发现绿色荧光信号和红色荧光信号在细胞核位置重叠。表明BcEGL3蛋白定位于细胞核中。

|
图 7 BcEGL3在本氏烟叶片细胞中的定位 Fig. 7 Subcellular localization of BcEGL3 in leaves of Nicotiana benthamiana |
由图 8可见: 与NJZX1-3植株相比, 转pTY-BcEGL3或转pTY-S的植株叶片表现为紫色变浅, 并伴有斑驳的症状; 同时转pTY-BcEGL3与转pTY-S植株相比叶片颜色由紫色转为绿色。表明BcEGL3基因会影响紫色材料叶片颜色变化。

|
图 8 BcEGL3基因沉默后不结球白菜植株表型对比 Fig. 8 Phenotypic comparison of plants after BcEGL3 gene silencing in Brassica campestris ssp. chinensis pTY-S和pTY-BcEGL3分别表示转pTY-S和pTY-BcEGL3的植株。下同。 pTY-S and pTY-BcEGL3 indicate transgenic pTY-S and pTY-BcEGL3 plants, respectively. The same as follows. |
由图 9可知: 在病毒侵染20 d后, 不同植株中总花青苷含量从大到小依次为NJZX1-3、转pTY-S植株、转pTY-BcEGL3植株、NJZX1-0, 且转pTY-BcEGL3与转pTY-S植株相比总花青苷含量降低77.83%。NJZX1-0植株总叶绿素含量最高; 与NJZX1-3植株相比, 转pTY-BcEGL3和转pTY-S植株叶片的总叶绿素含量和类胡萝卜素含量分别降低21.10%、28.44%和18.44%、25.84%, 转pTY-S植株和转pTY-BcEGL3植株相比总叶绿素含量和类胡萝卜素含量无明显变化。

|
图 9 BcEGL3基因沉默后不结球白菜叶片中色素含量的变化 Fig. 9 The changes of pigment content after BcEGL3 gene silencing in Brassica campestris ssp. chinensis |
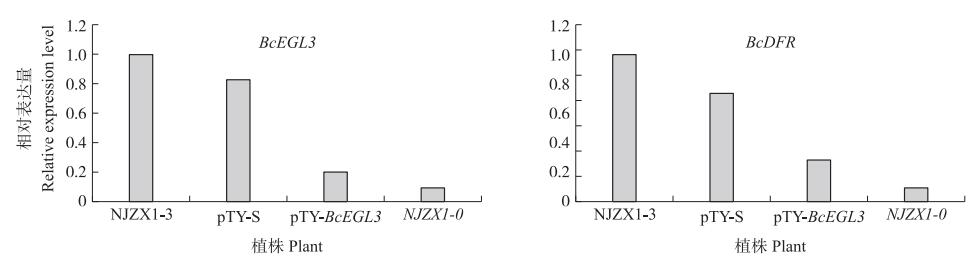
由图 10可见: 转pTY-BcEGL3植株中BcEGL3基因的相对表达量比转pTY-S降低75.64%, 且与NJZX1-0植株中表达量相接近, 表明BcEGL3基因已被沉默, 且会对叶片颜色产生影响。
|
图 10 BcEGL3基因沉默后不结球白菜BcEGL3和BcDFR基因的相对表达量 Fig. 10 Relative expression level of BcEGL3 and BcDFR genes in Brassica campestris ssp. chinensisafter BcEGL3 gene silencing |
BcDFR基因相对表达量由大到小依次为: NJZX1-3、转pTY-S植株、转pTY-BcEGL3植株、NJZX1-0, 其中转pTY-BcEGL3植株比转pTY-S植株降低61.62%, 说明BcEGL3基因的沉默会使BcDFR基因表达量下降, 进而影响不结球白菜花青苷的含量及叶片的颜色变化。
2.8 遮光后不结球白菜花青苷含量及BcEGL3基因表达分析由图 11可见: 遮光3 d后不结球白菜叶片中花青苷含量开始下降, 5 d时比对照降低68.39%;在11 d时叶片中花青苷含量下降幅度最大, 比对照降低76.04%。另外, 遮光后BcEGL3基因相对表达量呈下降—上升—下降的变化趋势, 与对照相比在3和14 d时下降幅度最为明显, 分别下降75.62%和79.24%。

|
图 11 不结球白菜花青苷含量和BcEGL3基因的相对表达量 Fig. 11 The anthocyanin content and relative expression level of BcEGL3 gene in Brassica campestris ssp. chinensis |
bHLH转录因子是真核生物中存在最广泛的一大类转录因子[17], 在植物激素响应、光形态发生和花器官发育等多种生理过程中具有重要的调控作用[18]。它可以与MYB转录因子和WD40蛋白形成三元复合体, 协同调控花青苷生物合成途径结构基因的表达, 进而调控花青苷的积累[19]。在拟南芥中bHLH类转录因子EGL3、GL3、TT8通过和TTG1以及MYB类转录因子TT2或PAP1互作来实现对花青苷结构基因的调控[20]。本研究中在NJZX1-3和NJZX1-0中克隆获得序列一致的BcEGL3基因, 序列长1 821 bp, 编码606个氨基酸。蛋白结构分析表明, EGL3蛋白属于bHLH-MYC-N超家族。进化树结果表明, BcEGL3蛋白与大白菜BraEGL3关系最近, 同源性高达99.9%。亚细胞定位结果显示, BcEGL3蛋白定位在细胞核内, 说明该蛋白在细胞核中发挥功能。据报道, 花青苷的生物合成易受光照条件的影响, 在光照条件下MS培养基上的拟南芥幼苗中花青苷的合成增加[2]。在本研究中, 遮光处理5 d后的NJZX1-3叶片中花青苷含量明显低于对照, 而BcEGL3基因在遮光处理后表达量都低于对照组。由此推断, 遮光在一定程度上抑制BcEGL3基因的表达从而抑制花青苷的合成。
调节花青苷生物合成的bHLH转录因子大多属于Ⅲf亚类, 通过抑制或者过表达花青苷合成相关的bHLH基因来影响植物体内花青苷的积累[21-22]。病毒诱导的基因沉默(VIGS)技术是转录后的基因沉默方法, 常用作对特定基因功能的研究, 现已广泛应用于反向遗传学研究[23]。目前VIGS技术已经应用到许多植物中, 例如用VIGS技术沉默小麦淀粉合成的调控转录因子基因WSR1后, 籽粒内支链淀粉、总淀粉和抗性淀粉含量显著增加, 表明WSR1基因负向调控小麦的淀粉合成[24]。用VIGS技术对‘澳洲青苹’果实Homeobox 1转录因子基因MdHB-1沉默后, 果实的呼吸强度和乙烯释放速率受到显著抑制, 果实硬度、可溶性固形物和可滴定酸质量分数的下降延缓, 证明MdHB-1基因参与果实的成熟衰老过程[25]。本试验结果显示, 在沉默转基因植株中BcEGL3基因表达量较转pTY-S植株降低75.64%, 沉默效果与杨学东等[14]沉默白菜八氢番茄红素脱氢酶基因(BcPDS)的效果基本一致。这表明在NJZX1-3材料中BcEGL3基因的表达得到有效抑制, 沉默转基因植株中花青苷的积累降低, 叶片颜色由紫色变为绿色。与NJZX1-3相比,转pTY-S植株花青苷含量降低38.11%, 由此推断, 病毒会使天然色素发生少量降解; 叶片颜色可能与花青苷和叶绿素含量的比值有关; BcEGL3基因能正向调控总花青苷的积累, 但对总叶绿素和类胡萝卜素的积累无影响。本研究还发现, 在沉默转基因植株中BcDFR基因表达量与BcEGL3基因的表达量正相关, 表明BcEGL3可能是通过调控BcDFR基因的转录水平进而影响花青苷的积累。
综上所述, 本试验通过荧光定量PCR、亚细胞定位、遮光处理及基因沉默等方法对BcEGL3基因的功能进行探索和验证, 结果表明BcEGL3位于细胞核, 遮光会抑制BcEGL3基因的转录水平。另外, BcEGL3基因沉默可以降低BcDFR基因的表达, 进而影响不结球白菜紫色材料中花青苷的积累及植株叶片紫色的呈现。下一步我们将从分子水平进一步解析花青苷的合成机制, 为改善紫色不结球白菜优良性状, 提高其品质提供理论基础。
| [1] |
Bradshaw H D, Schemske D W. Allele substitution at a flower colour locus produces a pollinator shift in monkeyflowers[J]. Nature, 2003, 426(6963): 176-178. DOI:10.1038/nature02106 |
| [2] |
董慧杰. 不结球白菜花青苷合成关键基因克隆及生物信息学分析[D]. 南京: 南京农业大学, 2018. Dong H J. Cloning and bioinformatics analysis of anthocyanins biosynthesis key genes in Bok choy[D]. Nanjing: Nanjing Agricultural University, 2018(in Chinese with English abstract). |
| [3] |
李仲叶, 韩豪, 孙茜, 等. 黑枸杞中花青苷的定性分析及主要花青苷的抗氧化活性研究[J]. 食品科技, 2019, 44(9): 216-222. Li Z Y, Han H, Sun Q, et al. Qualitative analysis and antioxidant activity of anthocyanin in Lycium ruthenicum Murr[J]. Food Science and Technology, 2019, 44(9): 216-222 (in Chinese with English abstract). |
| [4] |
何海艳, 陈雯烨, 杨爱萍, 等. 黑加仑多酚降血压的效果研究[J]. 食品与发酵工业, 2020, 46(3): 97-103. He H Y, Chen W Y, Yang A P, et al. Effect of blackcurrant polyphenols on lowering blood pressure[J]. Food and Fermentation Industries, 2020, 46(3): 97-103 (in Chinese with English abstract). |
| [5] |
陈萍, 张保石. 黑豆皮花青素降血脂及抗氧化效果[J]. 河北大学学报(自然科学版), 2016, 36(5): 524-528. Chen P, Zhang B S. Hypolipidemic and antioxidant effects of anthocyanins from black soybean skin[J]. Journal of Hebei University (Natural Science Edition), 2016, 36(5): 524-528 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-1565.2016.05.012 |
| [6] |
迪娜·吐尔洪, 刘新莲, 李建光. 花色苷抗阿尔兹海默症的研究进展[J]. 中华中医药杂志, 2019, 34(4): 1614-1617. Dina·Tuerhong, Liu X L, Li J G. Research progress on anthocyanins against Alzheimer's disease[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2019, 34(4): 1614-1617 (in Chinese with English abstract). |
| [7] |
Toledo-Ortiz G, Huq E, Quail P H. The Arabidopsis basic/helix-loop-helix transcription factor family[J]. The Plant Cell, 2003, 15(8): 1749-1770. DOI:10.1105/tpc.013839 |
| [8] |
Massari M E, Murre C. Helix-loop-helix proteins: regulators of transcription in eucaryotic organisms[J]. Molecular and Cellular Biology, 2000, 20(2): 429-440. DOI:10.1128/MCB.20.2.429-440.2000 |
| [9] |
Atchley W R, Terhalle W, Dress A. Positional dependence, cliques, and predictive motifs in the bHLH protein domain[J]. Journal of Molecular Evolution, 1999, 48(5): 501-516. DOI:10.1007/PL00006494 |
| [10] |
Danilo B, Perrot L, Botton E, et al. The DFR locus: a smart landing pad for targeted transgene insertion in tomato[J]. PLoS One, 2018, 13(12): e0208395. DOI:10.1371/journal.pone.0208395 |
| [11] |
于婷婷. 橙花龙胆二氢黄酮醇4-还原酶(DFR)基因的功能分析[D]. 长春: 长春师范大学, 2019. Yu T T. Functional analysis of dihydroflavonol 4-reductase (DFR) gene from orange-flower Gentian (Gentian lutea L. var. aurantiaca)[D]. Changchun: Changchun Normal University, 2019(in Chinese with English abstract). |
| [12] |
Nesi N, Debeaujon I, Jond C, et al. The TT8 gene encodes a basic helix-loop-helix domain protein required for expression of DFR and BAN genes in Arabidopsis siliques[J]. The Plant Cell, 2000, 12(10): 1863-1878. DOI:10.1105/tpc.12.10.1863 |
| [13] |
Feyissa D N, Løvdal T, Olsen K M, et al. The endogenous GL3, but not EGL3, gene is necessary for anthocyanin accumulation as induced by nitrogen depletion in Arabidopsis rosette stage leaves[J]. Planta, 2009, 230(4): 747-754. DOI:10.1007/s00425-009-0978-3 |
| [14] |
杨学东, 戴薇, 张昌伟, 等. 白菜病毒诱导基因沉默技术体系的建立[J]. 园艺学报, 2012, 39(11): 2168-2174. Yang X D, Dai W, Zhang C W, et al. The technology system establishment of VIGS in non-heading Chinese cabbage[J]. Acta Horticulturae Sinica, 2012, 39(11): 2168-2174 (in Chinese with English abstract). |
| [15] |
Pooma W, Gersos C, Grotewold E. Transposon insertions in the promoter of the Zea mays a1 gene differentially affect transcription by the Myb factors P and C1[J]. Genetics, 2002, 161(2): 793-801. |
| [16] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [17] |
Heim M A, Jakoby M, Werber M, et al. The basic helix-loop-helix transcription factor family in plants: a genome-wide study of protein structure and functional diversity[J]. Molecular Biology and Evolution, 2003, 20(5): 735-747. DOI:10.1093/molbev/msg088 |
| [18] |
Yang J H, Gao M, Huang L, et al. Identification and expression analysis of the apple (Malus×domestica) basic helix-loop-helix transcription factor family[J]. Scientific Reports, 2017, 7(1): 28. DOI:10.1038/s41598-017-00040-y |
| [19] |
Baudry A, Heim M A, Dubreucq B, et al. TT2, TT8, and TTG1 synergistically specify the expression of BANYULS and proanthocyanidin biosynthesis in Arabidopsis thaliana[J]. The Plant Journal, 2004, 39(3): 366-380. DOI:10.1111/j.1365-313X.2004.02138.x |
| [20] |
Nesi N, Jond C, Debeaujon I, et al. The Arabidopsis TT2 gene encodes an R2R3 MYB domain protein that acts as a key determinant for proanthocyanidin accumulation in developing seed[J]. The Plant Cell, 2001, 13(9): 2099-2114. DOI:10.1105/TPC.010098 |
| [21] |
Li Y, Shan X, Gao R, et al. Two Ⅲf clade-bHLHs from Freesia hybrida play divergent roles in flavonoid biosynthesis and trichome formation when ectopically expressed in Arabidopsis[J]. Scientific Reports, 2016, 6: 30514. DOI:10.1038/srep30514 |
| [22] |
Xu W J, Dubos C, Lepiniec L. Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J]. Trends in Plant Science, 2015, 20(3): 176-185. DOI:10.1016/j.tplants.2014.12.001 |
| [23] |
孙威, 许奕, 许桂莺, 等. 病毒诱导的基因沉默及其在植物研究中的应用[J]. 生物技术通报, 2015, 31(10): 105-110. Sun W, Xu Y, Xu G Y, et al. Virus-induced gene silencing and its application in plant research[J]. Biotechnology Bulletin, 2015, 31(10): 105-110 (in Chinese with English abstract). |
| [24] |
吕亮杰, 宿振起, 孙丽静, 等. 利用VIGS技术初步验证WSR1基因功能的研究[J]. 麦类作物学报, 2019, 39(3): 268-276. Su Z Q, Sun L J, et al. Preliminary validation of WSR1 gene function by VIGS technology[J]. Journal of Triticeae Crops, 2019, 39(3): 268-276 (in Chinese with English abstract). |
| [25] |
温小红, 姜永华, 周轲, 等. VIGS诱导MdHB-1沉默对苹果果实成熟的影响[J]. 西北农业学报, 2015, 24(11): 113-119. Wen X H, Jiang Y H, Zhou K, et al. Effect of virus-induced MdHB-1 silencing on apple fruit ripening[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2015, 24(11): 113-119 (in Chinese with English abstract). |




