文章信息
- 王威, 冯坤, 王晓萌, 王茹, 梁剑茹, 周立祥
- WANG Wei, FENG Kun, WANG Xiaomeng, WANG Ru, LIANG Jianru, ZHOU Lixiang
- 施氏矿物和水铁矿对砷(Ⅲ)吸附性能的比较研究
- Comparison of arsenite adsorption by Schwertmannite and ferrihydrite
- 南京农业大学学报, 2020, 43(6): 1116-1123
- Journal of Nanjing Agricultural University, 2020, 43(6): 1116-1123.
- http://dx.doi.org/10.7685/jnau.202002017
-
文章历史
- 收稿日期: 2020-02-17
砷(As)是一种有毒且具有强致癌性的类金属元素, 全世界大约有1.4亿人在饮用砷超标的地下水[1]。砷主要以As(Ⅲ)和As(Ⅴ)2种无机砷形式存在, 其中As(Ⅲ)毒性为As(Ⅴ)的20~60倍。在地下含水层等厌氧条件下, 砷主要以高毒性的As(Ⅲ)大量存在[2]。因此, 对As(Ⅲ)超标地下水或者饮用水的治理意义重大。
除砷技术有吸附法、混凝法、膜技术和离子交换法等, 其中吸附法具有简便快捷、成本低廉、能耗低等优点, 是目前最有应用前景的除砷技术[3]。吸附剂的种类和性能直接影响吸附效率[4]。近年来, 铁基材料由于对砷的吸附性能强、价廉易制、易于回收、环境友好等优点而广受关注[5]。
施氏矿物(Schwertmannite, Sch)是一种结晶度较差的羟基硫酸铁矿物, 其具有较大的比表面积且含有大量羟基、硫酸根等基团, 对重金属离子有良好的吸附能力[6], 其吸附性能优于许多报道的铁基材料, 如Fe2O3、Fe3O4等[7]。Liao等[8]发现生物法合成的施氏矿物在pH7.5时对As(Ⅲ)的吸附容量达到113.9 mg·g-1。水铁矿(ferrihydrite, Fh)对As(Ⅲ)也有较好的吸附能力[9]。然而, 施氏矿物和水铁矿在结构和组成方面差异明显, 在相同条件下对As(Ⅲ)吸附效果、pH影响及吸附机制的影响目前尚未有深入研究。
因此, 本研究对比施氏矿物与水铁矿对As(Ⅲ)的吸附行为及差异, 通过吸附动力学和吸附等温模型, 探讨施氏矿物和水铁矿对As(Ⅲ)的吸附机制, 同时探究pH值、共存离子对2种矿物吸附As(Ⅲ)的影响, 阐明pH值对As(Ⅲ)吸附的影响及机制, 可为含砷地下水或者饮用水的净化提供参考。
1 材料与方法 1.1 施氏矿物的制备按照Bai等[10]报道的生物矿化法合成施氏矿物。将Acidithiobacillus ferrooxidans LX5休止细胞悬浮液接种至250 mL 44.2 g·L-1 FeSO4溶液中, 调节初始pH值为2.5, 180 r·min-1、28 ℃振荡培养72 h。将生成的沉淀经0.45 μm滤膜抽滤, 用稀硫酸(pH2.0)和去离子水各清洗3次后, 放置在65 ℃烘箱中烘干至恒质量, 所得施氏矿物记为Sch。
1.2 水铁矿制备根据Schwertmann等[11]报道的方法制备水铁矿。将40 g Fe(NO3)3·9H2O溶于500 mL超纯水中, 在不断搅拌下将1.0 mol·L-1 NaOH加入到上述溶液中, 直至pH值为7~8。3 000 r·min-1离心上述混合物, 用去离子水洗涤沉淀3次以上, 最后将洗过的固体冷冻干燥待用, 并记为Fh。
1.3 矿物的鉴定与表征通过扫描电镜(SEM, Hitachi S-4800)分析样品的形貌结构, 通过X射线衍射仪(XRD, SmartLab 3KW)测定矿相, 用全自动比表面和孔隙分析仪(TriStar Ⅱ 3020)测定比表面积和孔径分布, 通过Zeta电位仪(Zetasizer Nano ZS90)测定吸附剂的等电点, 通过傅里叶红外光谱仪(FTIR, Nicolet iS50)分析吸附前、后2种矿物的表面官能团。
1.4 吸附动力学精确称量0.025 g吸附剂加入100 mL 10 mg·L-1 As(Ⅲ)溶液中, 用NaOH或HCl调节pH值为7.0, 于25 ℃、180 r·min-1的摇床中进行吸附反应。Sch的吸附过程分别于5、15、30、60、120、180和240 min取样; Fh的吸附过程分别于0.5、1、2、4、8、16、20、24、48和72 h取样。取样后用0.45 μm滤膜过滤, 酸化后用电感耦合等离子体发射光谱仪(ICP-OES, Agilent 700 Series)测定上清液中残留的As(Ⅲ)浓度。
1.5 吸附容量测定精确称量0.010 g Sch加入40 mL 1~100 mg·L-1 As(Ⅲ)溶液中, 调节溶液pH值为7.0, 于25 ℃、180 r·min-1摇床中振荡。每0.5 h监测溶液pH值并重新调节pH值为7.0。4 h后取样, 过0.45 μm滤膜后, 测定As(Ⅲ)含量; 称取0.010 g Fh加入40 mL 10~100 mg·L-1的As(Ⅲ)溶液中, 调节溶液pH值为7.0, 于25 ℃、180 r·min-1摇床中振荡。每1 h监测溶液pH值并重新调节pH值为7.0。24 h后取样, 过0.45 μm滤膜, 测定As(Ⅲ)含量。
1.6 pH值对矿物吸附As(Ⅲ)的影响分别精确称量0.025 g Sch和Fh于100 mL 10 mg·L-1 As(Ⅲ)溶液中, 维持pH值分别为2、4、6、7、8、10和12, 于25 ℃、180 r·min-1摇床中振荡反应。施氏矿物在4 h后取样, 过0.45 μm滤膜, 测定As(Ⅲ)含量; 而水铁矿在24 h后取样, 测定As(Ⅲ)含量。
1.7 共存阴离子和腐殖酸对矿物吸附As(Ⅲ)的影响精确称取0.010 g Sch或Fh于40 mL 10 mg·L-1 As(Ⅲ)溶液中, 加入竞争物或阴离子(腐殖酸、PO43-和CO32-)后调节溶液pH值为7.0, 于25 ℃、180 r·min-1摇床中振荡。Sch吸附4 h后取样, 而Fh在吸附24 h后取样。样品过0.45 μm滤膜后测定As(Ⅲ)含量。
2 结果与分析 2.1 施氏矿物和水铁矿的理化性质从图 1可知:Sch为典型的球形海胆结构(图 1-A), 表面布满针状毛刺; Fh表面粗糙, 并且颗粒明显小于Sch(图 1-B)。从XRD谱图(图 1-C)可见:合成的2种铁矿物结晶度均较差。Sch出现8个明显的特征宽峰(2θ:18.2°、26.3°、35.2°、39.5°、46.5°、55.3°、61.3°和63.7°), 与粉末衍射标准联合委员会(JCPDS)卡片(PDF#47-1775)中施氏矿物的特征峰完全吻合[8]。Fh在35°和62°有明显的宽峰, 这与2线水铁矿的XRD谱图是一致的[12]。2种矿物的N2吸附-脱附等温曲线如图 1-D所示, 根据国际纯粹与应用化学联合会(IUPAC)分类, 均符合Ⅱ型等温线, 表明2种矿物的孔洞以微孔和介孔为主[13-14]。同时, Fh的N2吸附量要远大于Sch, 说明其孔体积要大于Sch。施氏矿物和水铁矿的基本理化性质见表 1。

|
图 1 施氏矿物(A)和水铁矿(B)的扫描电镜图、X射线衍射仪谱图(C)及N2吸附-脱附等温曲线(D) Fig. 1 SEM of Sch(A), Fh(B), XRD spectra(C)and N2 adsorption-desorption isotherms(D) Sch:施氏矿物Schwertmannite; Fh:水铁矿Ferrihydrite。下同。The same as follows. |
| 材料 Material |
比表面积/(m2·g-1) Specific surface area |
孔径/nm Pore size |
孔体积/(cm3·g-1) Pore volume |
等电点 Isoelectric point |
| Sch | 172.18 | 2.62 | 0.07 | 6.4 |
| Fh | 212.15 | 2.56 | 0.14 | 5.9 |
从图 2可知:As(Ⅲ)在2种矿物上的吸附明显分为2个阶段, 即快速吸附阶段和慢速吸附阶段[15]。相比Fh, Sch对As(Ⅲ)吸附更迅速, Sch在反应前5 min内吸附完成最终平衡量的54.35%, 而Fh则在480 min内完成最终吸附平衡量的64.24%。最终, Sch和Fh平衡吸附容量分别为22.52和36.89 mg·g-1。

|
图 2 Sch(A)和Fh(B)对As(Ⅲ)的吸附动力学曲线 Fig. 2 Adsorption kinetics curve of As(Ⅲ)onto Sch(A)and Fh(B) |
为了进一步分析动力学吸附机制, 使用伪一级动力学和伪二级动力学模型拟合吸附动力学数据。模型公式(1)和公式(2)[9]如下:

|
(1) |
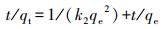
|
(2) |
式中:qe和qt分别表示吸附平衡和吸附t时刻的吸附容量(mg·g-1); t表示吸附时间(min); k1(min-1)和k2(mg·g-1·min-1)分别是伪一级动力学和伪二级动力学的吸附速率常数。拟合参数见表 2。
| 材料 Material |
伪一级动力学模型 Pseudo-first-order model | 伪二级动力学模型 Pseudo-second-order model | |||||
| qe/(mg·g-1) | k1/min-1 | R2 | qe/(mg·g-1) | k2/(mg·g-1·min-1) | R2 | ||
| Sch | 20.95 | 0.013 9 | 0.922 5 | 20.04 | 0.014 2 | 0.838 7 | |
| Fh | 35.51 | 0.001 9 | 0.922 1 | 32.29 | 0.000 4 | 0.941 3 | |
模型拟合结果表明, 伪一级动力学方程能更好拟合Sch吸附As(Ⅲ)的过程(R2=0.922 5), 其吸附速率常数k1为0.013 9 min-1, 远大于Fh的k1(0.001 9 min-1)。说明在吸附As(Ⅲ)过程中, Sch能更快吸附As(Ⅲ), 达到吸附平衡所需的反应时间更短。水铁矿吸附过程更符合伪二级动力学方程(R2=0.941 3)。这表明水铁矿对As(Ⅲ)存在多种吸附过程, 包括液膜扩散、内部扩散和物理化学吸附[9, 16]。
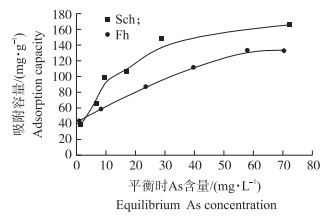
2.3 施氏矿物及水铁矿对As(Ⅲ)的吸附等温曲线在25 ℃下, 2种矿物在pH7的条件下吸附等温曲线如图 3所示。Sch和Fh的最大吸附容量分别为165.73和133.50 mg·g-1, 均符合Langmuir曲线, 说明Sch和Fh对As(Ⅲ)的吸附为均匀介质表面的单层吸附[17]。2种矿物n均大于1, 说明Sch和Fh对As(Ⅲ)均有很好的吸附[18]。
|
图 3 Sch和Fh对As(Ⅲ)的吸附等温曲线 Fig. 3 Adsorption isotherms curve of As(Ⅲ) onto Sch and Fh |
研究固液吸附时, 常用Langmiur(公式3)和Freundlich(公式4)方程来描述吸附平衡[9], 各拟合参数见表 3。
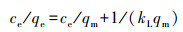
|
(3) |
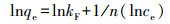
|
(4) |
| 材料 Material |
Langmuir 模型 Langmuir model | Freundlich 模型 Freundlich model | |||||
| qm/(mg·g-1) | kL/(L·mg-1) | R2 | kF/(L·mg-1) | n | R2 | ||
| Sch | 165.73 | 0.14 | 0.973 2 | 13.45 | 1.50 | 0.796 2 | |
| Fh | 133.50 | 0.10 | 0.965 0 | 41.62 | 3.81 | 0.926 8 | |
式中:qe和ce为吸附平衡时的吸附量和As的质量浓度(mg·L-1); qm是最大吸附容量(mg·g-1); kL是Langmuir吸附常数(L·mg-1), 表示吸附自由能; kF(L·mg-1)和n都是Freundlich等温吸附模型参数, 分别与吸附容量和吸附强度有关。
2.4 pH值对施氏矿物及水铁矿吸附As(Ⅲ)的影响从图 4可知:Sch在pH6~12时对As(Ⅲ)有良好的吸附, 而Fh则在pH6~8时能更好地吸附As(Ⅲ), 说明Sch可在更宽的pH范围实现对As(Ⅲ)的吸附。在pH10~12时Sch的吸附量虽略有下降, 但却比Fh表现出更好的吸附能力。
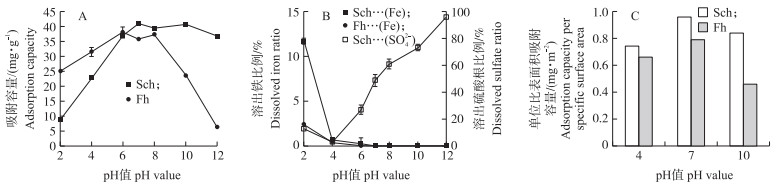
|
图 4 在不同pH值下Sch和Fh对As(Ⅲ)的吸附量(A)、铁和硫酸根的溶出比例(B)及比表面积归一化比较(C) Fig. 4 Adsorption of As(Ⅲ)at different pH value(A), dissolution ratio of iron and sulfate(B) and normalized comparison of specific surface area(C)by Sch and Fh |
对Sch和Fh吸附As(Ⅲ)的能力按比表面积进行归一化处理。当pH值分别为4、7和10时, Sch对As(Ⅲ)的单位比表面积吸附容量分别为0.75、0.96和0.84 mg·m-2, 而Fh的为0.66、0.79和0.46 mg·m-2。2种矿物的吸附行为变化趋势与前文分析相符, 在中性条件下均具有最大的吸附容量。Sch在酸性条件下吸附容量明显减少, 而Fh在酸性和碱性条件下均明显下降。
2.5 共存阴离子和腐殖酸对施氏矿物及水铁矿吸附As(Ⅲ)的影响通常情况下, 含砷废水或地下水中同时存在许多其他阴离子或有机物。Cl-、NO3-、SO42-对As(Ⅲ)吸附影响很小[19]。从实际应用出发, 我们探究了腐殖酸、磷酸根(PO43-)和碳酸根(CO32-)等环境因子在不同水平下对As(Ⅲ)吸附效果的影响(图 5)。不同离子对2种矿物吸附As(Ⅲ)的影响程度差异明显, 当腐殖酸质量浓度为0~500 mg·L-1时, 2种矿物的As(Ⅲ)吸附容量出现不同程度的下降, Sch吸附容量下降45.61%, Fh下降23.85%。腐殖酸使反应体系酸化, 促进矿物溶解, 也可能是腐殖酸占据矿物表面的吸附位点, 从而降低矿物对As(Ⅲ)的吸附量[20]。
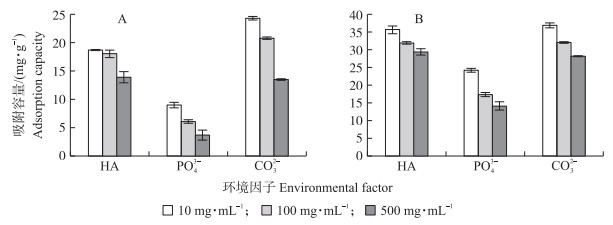
|
图 5 共存阴离子与腐殖酸(HA)对Sch(A)和Fh(B)吸附As(Ⅲ)的影响 Fig. 5 Effect of co-existing anions and humic acid(HA)on As(Ⅲ)adsorption onto Sch(A)and Fh(B)adsorbents |
PO43-对2种矿物吸附As(Ⅲ)的影响程度不同, PO43-质量浓度为10 mg·L-1时, Sch吸附容量下降64.97%, 而Fh下降37.33%。随着PO43-质量浓度增加, 对As(Ⅲ)的吸附抑制明显。这是由于P和As都属于第Ⅴ族元素, 具有相似的结构, 所以P易与As形成强烈的竞争吸附[21]。在天然水体或实际地下水中PO43-含量较低, 一般为0.01~2.00 mg·L-1[22], 对2种矿物吸附As(Ⅲ)的影响也会减少。CO32-对2种矿物吸附As(Ⅲ)也存在不同程度的抑制, 这是由于在pH7.0反应体系中, CO32-主要以HCO3-形式存在, 其会与As(Ⅲ)产生竞争吸附[17]。
2.6 施氏矿物及水铁矿吸附As(Ⅲ)的机制分析从图 6可知:2种矿物在吸附前的红外谱峰位置与文献[23-24]一致。在3 400和1 620 cm-1附近的较宽吸收峰, 为水分子及Fe(OH)3中羟基振动吸收带和伸缩弯曲振动吸收带, 表明材料具有丰富的表面羟基[8]。1 120、1 088、979和610 cm-1分别属于SO42-的v3、v1、v4特征峰, 710 cm-1处为Fe-O吸收峰, 1 381 cm-1处为水铁矿制备过程中吸附的NO3-[23]。在吸附As(Ⅲ)后, Sch中羟基和硫酸根特征峰均明显减弱。

|
图 6 As(Ⅲ)吸附前后Sch(A)和Fh(B)的傅里叶红外光谱图谱 Fig. 6 Fourier transform infrared spectrometer characterization of Sch(A)and Fh(B) before and after adsorption As(Ⅲ) |
施氏矿物和水铁矿由于对砷的吸附性能强而广受关注。本研究通过XRD等表征手段确定制备矿物分别为施氏矿物和水铁矿, 同时发现Fh的比表面积为212.15 m2·g-1, 明显大于Sch的172.18 m2·g-1。根据SEM结果分析, 这是由Fh具有更小的颗粒引起的。
从吸附动力学发现, Sch的平衡吸附容量为22.52 mg·g-1, 而Fh的为36.89 mg·g-1, 这可能是由于Fh具有更大的比表面积。另外, Sch反应后溶液pH值降为3.5左右, 这也可能是Sch平衡吸附容量低于Fh的原因。
进一步研究pH值对2种矿物吸附As(Ⅲ)的影响发现, 在酸性(pH2~4)条件下, 2种矿物的吸附能力明显下降, 这是因为在酸性条件下矿物发生部分溶解(Sch和Fh在pH2条件下分别溶出了11.77%和2.39%的铁), 导致矿物结构的坍塌与表面活性位点数量减少。溶液pH值不仅影响矿物形态也影响As(Ⅲ)在水溶液中的存在形态。As(Ⅲ)的各级电离常数分别为:pKa1=9.2, pKa2=12.1, pKa3=13.4[24]。因此, 在pH < 9.2时, As(Ⅲ)主要以H3AsO3分子存在; 在9.2≤pH < 12.1时, 主要以H2AsO3-形式存在。而Sch和Fh的等电点分别为6.3、5.9, 在pH10~12时, 2种矿物表面带有较多的负电荷, 静电斥力的增加及溶液中OH-的竞争吸附将减少As(Ⅲ)在矿物表面的吸附[25]。
Sch在pH10~12范围内吸附量大于Fh, 是因为Sch中含有丰富的硫酸根和特殊的孔道结构; 在pH12条件下, Sch释放了95.91%的SO42-。一般认为, Sch中的SO42-仅1/3吸附在表面, 另外2/3在内部隧道结构中[26], 从而导致Sch吸附As(Ⅲ)时, 表面和隧道结构中SO42-的释出会促进对As(Ⅲ)的吸附。有研究表明, Sch隧道结构孔洞直径(0.5 nm)与As(Ⅲ)分子(0.496 nm)非常相近[26], 因此, Sch中隧道结构孔洞对中性分子的镶嵌可能会促进对As(Ⅲ)的吸附[27]。Fh在碱性条件下吸附性能急剧下降, 说明其主要的吸附机制为表面羟基的络合配位作用[28]。经过归一化处理, 在中性和碱性条件下, Sch的单位比表面积吸附容量明显大于Fh, 说明Sch对As(Ⅲ)的吸附能力更强, 比表面积是影响吸附容量的关键因素, 通过调控Sch的形貌来改善比表面积从而增强吸附容量。
2种矿物吸附前、后的FTIR图也说明了Sch除砷机制:As(Ⅲ)与矿物表面金属羟基的表面络合; As(Ⅲ)与矿物表面及隧道结构内SO42-的配位体交换作用[29]。Fh主要除砷机制为表面羟基的络合配位作用[30]。在吸附后没有出现As—O或者As—O—Fe的特征峰, 这可能与矿物上吸附的As(Ⅲ)含量太低有关。
综上所述, 施氏矿物对As(Ⅲ)的吸附速率远大于水铁矿, 且最大吸附容量为165.73 mg·g-1, 同样大于水铁矿(133.50 mg·g-1)。同时, 施氏矿物对As(Ⅲ)的吸附还具有更宽的pH适用范围, 但是腐殖酸、磷酸根和碳酸根对水铁矿吸附过程的影响小于施氏矿物。水铁矿吸附As(Ⅲ)的主要机制为表面羟基的络合配位作用, 而施氏矿物主要是As(Ⅲ)与矿物表面金属羟基的表面络合、As(Ⅲ)与矿物表面及隧道结构内SO42-的配位体交换作用。施氏矿物对As(Ⅲ)的吸附性能要优于水铁矿, 是一种高效修复砷污染水体的吸附材料
| [1] |
Mandal B K, Suzuki K T. Arsenic round the world:a review[J]. Talanta, 2002, 58(1): 201-235. DOI:10.1016/S0039-9140(02)00268-0 |
| [2] |
冯树屏. 砷的分析化学[M]. 北京: 中国环境科学出版社, 1986. Feng S P. Analytical Chemistry of Arsenic[M]. Beijing: China Environmental Science Press, 1986 (in Chinese). |
| [3] |
Jang M, Chen W F, Cannon F S. Preloading hydrous ferric oxide into granular activated carbon for arsenic removal[J]. Environmental Science & Technology, 2008, 42(9): 3369-3374. |
| [4] |
吴灿.铁基纳米材料去除水中低浓度砷性能和机理研究[D].广州: 华南理工大学, 2017. Wu C. Adsorption performance and mechanism of iron-based nano-materials towards low concentration arsenic in water[D]. Guangzhou: South China University of Technology, 2017(in Chinese with English abstract). |
| [5] |
陈婷, 朱志良. 铁基水处理材料除砷技术的研究进展[J]. 化学通报, 2018, 81(10): 880-889. Chen T, Zhu Z L. Research progress in arsenic removal technology of iron-based water treatment materials[J]. Chemistry, 2018, 81(10): 880-889 (in Chinese). |
| [6] |
Jönsson J, Persson P, Sjöberg S, et al. Schwertmannite precipitated from acid mine drainage:phase transformation, sulphate release and surface properties[J]. Applied Geochemistry, 2005, 20(1): 179-191. |
| [7] |
邵金秋, 温其谦, 阎秀兰, 等. 天然含铁矿物对砷的吸附效果及机制[J]. 环境科学, 2019, 40(9): 4072-4080. Shao J Q, Wen Q Q, Yan X L, et al. Adsorption and mechanism of arsenic by natural iron-containing minerals[J]. Environmental Science, 2019, 40(9): 4072-4080 (in Chinese with English abstract). |
| [8] |
Liao Y H, Liang J R, Zhou L X. Adsorptive removal of As(Ⅲ)by biogenic schwertmannite from simulated As-contaminated groundwater[J]. Chemosphere, 2011, 83(3): 295-301. DOI:10.1016/j.chemosphere.2010.12.060 |
| [9] |
马玉玲, 马杰, 陈雅丽, 等. 水铁矿及其胶体对砷的吸附与吸附形态[J]. 环境科学, 2018, 39(1): 179-186. Ma Y L, Ma J, Chen Y L, et al. Arsenic adsorption and its species on ferrihydrite and ferrihydrite colloid[J]. Chinese Journal of Environmental Science, 2018, 39(1): 179-186 (in Chinese with English abstract). |
| [10] |
Bai S Y, Xu Z H, Wang M, et al. Both initial concentrations of Fe(Ⅱ)and monovalent cations jointly determine the formation of biogenic iron hydroxysulfate precipitates in acidic sulfate-rich environments[J]. Materials Science and Engineering:C, 2012, 32(8): 2323-2329. DOI:10.1016/j.msec.2012.07.003 |
| [11] |
Schwertmann U, Cornell R M. Iron Oxides in the Laboratory:Preparation and Characterization[M]. Weinheim: EILEY-VCH, 2008.
|
| [12] |
丁秘, 康文晶, 冯程龙, 等. 人工合成水铁矿对水中六价铬的吸附特征研究[J]. 工业水处理, 2017, 37(2): 29-33. Ding M, Kang W J, Feng C L, et al. Research on the adsorption characteristics of synthetic ferrihydrite for hexavalent chromiumon in water[J]. Industrial Water Treatment, 2017, 37(2): 29-33 (in Chinese). |
| [13] |
Storck S, Bretinger H, Maier W F. Characterization of micro- and mesoporous solids by physisorption methods and pore-size analysis[J]. Applied Catalysis A:General, 1998, 174(1/2): 137-146. |
| [14] |
Zhang Z, Guo G L, Li X T, et al. Effects of hydrogen-peroxide supply rate on schwertmannite microstructure and chromium(Ⅵ)adsorption performance[J]. Journal of Hazardous Materials, 2019, 367: 520-528. DOI:10.1016/j.jhazmat.2018.12.116 |
| [15] |
谢越, 周立祥. 生物成因次生铁矿物对酸性矿山废水中三价砷的吸附[J]. 土壤学报, 2012, 49(3): 481-490. Xie Y, Zhou L X. Thermodynamics and kinetics of adsorption of arsenite in acid mining drainage by biogenic secondary iron minerals[J]. Acta Pedologica Sinica, 2012, 49(3): 481-490 (in Chinese with English abstract). |
| [16] |
Chang M Y, Juang R S. Adsorption of tannic acid, humic acid, and dyes from water using the composite of chitosan and activated clay[J]. Journal of Colloid and Interface Science, 2004, 278(1): 18-25. DOI:10.1016/j.jcis.2004.05.029 |
| [17] |
韩一杰.多元金属复合硫氧化物的制备及其对水中As(Ⅲ)和As(Ⅴ)吸附去除的研究[D].南京: 南京农业大学, 2018. Han Y J. Synthesis of poly-metal complex oxysulfide: a novel adsorbent for arsenic removal from solution[D]. Nanjing: Nanjing Agricultural University, 2018(in Chinese with English abstract). |
| [18] |
孙林.含铁矿物对As(Ⅲ)和As(Ⅴ)的吸附及氧化还原转化研究[D].合肥: 安徽农业大学, 2015. Sun L. Adsorption and oxidation-reduction of As(Ⅲ)and As(Ⅴ)by iron-bearing minerals[D]. Hefei: Anhui Agricultural University, 2015(in Chinese with English abstract). |
| [19] |
Song J, Jia S Y, Ren H T, et al. Application of a high-surface-area schwertmannite in the removal of arsenate and arsenite[J]. International Journal of Environmental Science and Technology, 2015, 12(5): 1559-1568. DOI:10.1007/s13762-014-0528-9 |
| [20] |
常春英, 滑晓赞, 吕贻忠. 氧化铁对腐殖酸的吸附机制研究[J]. 中国农业大学学报, 2010, 15(1): 79-83. Chang C Y, Hua X Z, Lü Y Z. Sorption mechanism of humic acid on iron oxide minerals[J]. Journal of China Agricultural University, 2010, 15(1): 79-83 (in Chinese with English abstract). |
| [21] |
Namasivayam C, Senthilkumar S. Removal of arsenic(Ⅴ)from aqueous solution using industrial solid waste:adsorption rates and equilibrium studies[J]. Industrial & Engineering Chemistry Research, 1998, 37(12): 4816-4822. |
| [22] |
马红梅, 朱志良, 张荣华, 等. β-FeO(OH)对水中砷的吸附作用[J]. 同济大学学报(自然科学版), 2007, 35(12): 1656-1660. Ma H M, Zhu Z L, Zhang R H, et al. Adsorption study of As(Ⅴ)from water on β-FeO(OH)[J]. Journal of Tongji University(Natural Science Edition), 2007, 35(12): 1656-1660 (in Chinese with English abstract). |
| [23] |
Mazzetti L, Thistlethwaite P J. Raman spectra and thermal transformations of ferrihydrite and schwertmannite[J]. Journal of Raman Spectroscopy, 2002, 33(2): 104-111. DOI:10.1002/jrs.830 |
| [24] |
Raven K P, Jain A A, Loeppert R H. Arsenite and arsenate adsorption on ferrihydrite:kinetics, equilibrium and adsorption envelopes[J]. Environmental Science & Technology, 1998, 32(3): 344-349. |
| [25] |
Bigham J M, Schwertmann U, Traina S J, et al. Schwertmannite and the chemical modeling of iron in acid sulfate waters[J]. Geochimica et Cosmochimica Acta, 1996, 60(12): 2111-2121. DOI:10.1016/0016-7037(96)00091-9 |
| [26] |
Regenspurg S, Peiffer S. Arsenate and chromate incorporation in schwertmannite[J]. Applied Geochemistry, 2005, 20(6): 1226-1239. DOI:10.1016/j.apgeochem.2004.12.002 |
| [27] |
李浙英, 梁剑茹, 柏双友, 等. 生物与化学成因施氏矿物吸附去除水中As(Ⅲ)效果的比较研究[J]. 环境科学学报, 2011, 31(5): 912-918. Li Z Y, Liang J R, Bai S Y, et al. Removal of As(Ⅲ)in simulated groundwater through adsorption by biosynthesized or chemosynthesized schwertmannite[J]. Acta Scientiae Circumstantiae, 2011, 31(5): 912-918 (in Chinese with English abstract). |
| [28] |
张昱, 豆小敏, 杨敏, 等. 砷在金属氧化物/水界面上的吸附机制Ⅰ:金属表面羟基的表征和作用[J]. 环境科学学报, 2006, 26(10): 1586-1591. Zhang Y, Dou X M, Yang M, et al. Adsorption mechanism of arsenic on metal oxide adsorbentⅠ:characterization and the role of metal surface hydroxyl groups[J]. Acta Scientiae Circumstantiae, 2006, 26(10): 1586-1591 (in Chinese with English abstract). |
| [29] |
廖岳华.施氏矿物的生物合成及去除水中砷的效果与机理研究[D].南京: 南京农业大学, 2008. Liao Y H. Biosynthesis of schwertmannite and its efficiency and mechanism of arsenite removal from aqueous solutions[D]. Nanjing: Nanjing Agricultural University, 2008(in Chinese with English abstract). |
| [30] |
霍丽娟.水铁矿纳米材料对土壤中砷的吸附固定及其稳定化反应机制[D].北京: 中国农业科学院, 2017. Huo L J. Study on the mechanisms of arsenic sorption and stabilization in soils using ferrihydrite nanoparticles[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017(in Chinese with English abstract). |




