文章信息
- 何超凡, 李向飞, 张丽, 郑肖川, 詹玉春, 邓登, 林海, 刘文斌
- HE Chaofan, LI Xiangfei, ZHANG Li, ZHENG Xiaochuan, ZHAN Yuchun, DENG Deng, LIN Hai, LIU Wenbin
- 膨化饲料及其添加抗应激剂对团头鲂生长性能、消化酶活性、应激及生长与摄食相关基因表达的影响
- Effects of an extruded feed with or without anti-stress additives supplementation on the growth performance, digestive enzymes activities, stress response and the expressions of growth and feeding-related genes in blunt snout bream Megalobrama amblycephala
- 南京农业大学学报, 2020, 43(6): 1087-1096
- Journal of Nanjing Agricultural University, 2020, 43(6): 1087-1096.
- http://dx.doi.org/10.7685/jnau.201910035
-
文章历史
- 收稿日期: 2019-10-23
2. 深圳市澳华集团股份有限公司, 广东 深圳 518056;
3. 江苏省淡水水产研究所, 江苏 南京 210017
2. Shenzhen Alpha Group Co. Ltd., Shenzhen 518056, China;
3. Jiangsu Freshwater Fisheries Research Institute, Nanjing 210017, China
近年来, 随着水产养殖业规模化和集约化程度的不断提高, 高效率、低成本且环境友好型水产饲料的重要性日益突出。膨化饲料是一种经高温、高压工艺处理后制得的膨松多孔的饲料[1], 其物理状态与内部有机物分子结构与硬颗粒饲料相比均有显著不同。研究表明, 膨化可以提高饲料中糖类和蛋白质的水解程度, 进而提高水产动物对饲料中淀粉、蛋白质以及非淀粉多糖的利用率[2-6]。同时, 膨化可显著降低饲料中各种抗营养因子含量, 进而进一步改善水产动物对饲料中营养物质的消化利用率[5-6]。此外, 与硬颗粒饲料相比, 膨化饲料的水稳性较高, 其可显著降低因过度投喂和饲料水稳性差而导致的水体富营养化情况, 从而减轻对养殖水体的污染[7-8]。研究表明, 与硬颗粒饲料相比, 膨化饲料可显著提高鱼的增重率与成活率, 降低饵料系数, 且鱼的出塘规格更加整齐[9-11]。鉴于上述优点, 膨化饲料在水产养殖中的应用日益广泛。然而, 由于膨化饲料的制作工艺相对复杂且成本较高, 造成其在大宗淡水鱼养殖中的推广应用程度相对较低[12]。此外, 目前, 关于膨化饲料的养殖效果尚存在一定争议。例如, 膨化饲料能够显著提高哲罗鲑(Hucho taimen)[13]、虹鳟(Oncorhynchus mykiss)[11]与花鲢(Hypophthalmichthys nobilis)[14]的生长性能, 但其在金鱼(Carassius auratus Linnaeus)[15]和湘云鲫(Carassius auratus)[16]上的使用效果与硬颗粒饲料相比并无显著差异。在鲤(Cyprinus carpio)[17]和鳊(Parabramis pekinensis)[18]的研究中发现, 硬颗粒饲料的使用效果优于膨化饲料。由此可见, 膨化饲料不一定适合所有的养殖鱼类, 其应用效果可能与鱼的种类、食性、摄食习惯和生物习性等有关。此外, 膨化过程中, 泛酸、硫胺素、叶酸、L-抗坏血酸与视黄醇等热敏性维生素含量均显著降低, 而赖氨酸、色氨酸与精氨酸等热敏性氨基酸均受到较大程度破坏, 这在一定程度上也降低了膨化饲料的使用效果[19]。因此, 如何改善膨化饲料在水产养殖中的效果意义重大。
研究表明, 某些饲料添加剂可在一定程度上提高水产动物的抗应激能力, 进而改善其免疫机能和生长性能[20]。目前, 常用的抗应激饲料添加剂主要有大蒜素、核苷酸、柠檬酸、甜菜碱、金银花提取物、虾青素和维生素等, 且其在水产动物上的应用效果已有较多研究[20]。例如, 金银花提取物能显著提高牙鲆的抗氧化能力、抗应激能力和非特异性免疫能力[20]。枯草芽胞杆菌能够减少团头鲂肠道内大肠埃希氏菌等有害菌的增殖, 并分泌多种消化酶, 进而提高水产动物对饲料中营养物质的消化率[21]。此外, 作为一种有效的免疫增强剂, 果寡糖能够显著改善团头鲂的免疫机能并降低氧化损伤, 进而维持机体的正常生理活动[21]。然而, 抗应激添加剂, 能否缓解膨化饲料引起的水产动物应激反应, 目前尚不明确。
团头鲂(Megalobrama amblycephala)是我国主要的大宗淡水经济鱼类。在生产中, 养殖户多采用硬颗粒饲料养殖团头鲂, 对膨化饲料的认可度较低。此外, 在实际调研后发现, 长期摄食膨化饲料后, 团头鲂容易出现出血、掉鳞、皮肤黏液减少甚至死亡率上升等现象, 且出塘规格不整齐。基于此, 有必要对膨化饲料在团头鲂上的使用效果进行科学评估。本试验以团头鲂为研究对象, 探讨膨化饲料及添加抗应激添加剂对团头鲂生长性能、肠道消化酶活性、应激反应及摄食基因表达的影响, 旨在为膨化饲料在淡水鱼养殖中的应用提供科学指导。
1 材料与方法 1.1 试验饲料、试验鱼及饲养管理试验所用饲料均委托浙江澳华集团生产, 所用原料包括酒糟蛋白、小麦、棉粕、菜粕、鱼粉、鸡肉粉、豆粕、鱼用预混料、米糠、大豆、磷酸二氢钙、豆油、赖氨酸与蛋氨酸等。除硬颗粒饲料与普通膨化饲料外, 本研究还增设抗应激膨化饲料, 即在普通膨化饲料的基础上添加以0.02%(质量分数)地衣芽胞杆菌、0.2%果寡糖及0.3%金银花提取物为主要成分的复合抗应激添加剂(对某些热敏性营养物质的配比进行了调整)。试验饲料配方及概略养分含量如表 1所示。试验所用团头鲂幼鱼取自湖北鄂州团头鲂原种场, 为统一品系且遗传性状统一。试验在江苏省浦口区星甸镇江苏省淡水水产研究所进行。本试验的养殖周期为180 d(2018年4月13日至10月11日)。将实验鱼驯化1周后, 于2018年4月13日选取规格整齐、体格健壮且初始体质量为(14.2±0.4)g的团头鲂幼鱼15 000尾, 随机平均放入一循环水跑道养殖系统中的3个水槽(规格为20 m×4 m×2 m)中, 每槽5 000尾。然后, 将3个水槽随机设为3组, 即间隔投喂组(pelleted and extruded feed, PE)、全程投喂普通膨化饲料组(extruded feed, EF)及全程投喂抗应激膨化饲料组(anti-stress extruded feed, AF)。其中, PE组前90 d(4月13日至7月12日)投喂普通膨化饲料, 进入7月水温升高后转投喂普通硬颗粒饲料90 d(7月13日至10月11日)。在实际生产中, 养殖户会在7月之前投喂膨化饲料以促进团头鲂生长。进入高温季节后, 膨化饲料的弊端逐渐显现, 养殖户多会更换硬颗粒饲料来避免上述情况。鉴于此, 本试验设立了前期投喂普通膨化饲料而后期投喂硬颗粒饲料组来模拟这种投喂方式。每天定时饱食投喂3次(08:00, 12:00和16:30)并定期检测水温(24~31 ℃)和水质(DO>5.0 mg·L-1, pH 7.0~7.5)。
| 组成Composition | PF | EF | AF |
| 原料组成Ingredient coposition | |||
| 鱼粉Fish meal | 4 | 4 | 4 |
| 豆粕Soybean meal | 24 | 24 | 24 |
| 棉粕Cottonseed meal | 5 | 5 | 5 |
| 菜粕Rapeseed meal | 8 | 8 | 8 |
| 干酒糟及其可溶物Distillers dried grains with solubles | 6 | 6 | 6 |
| 大豆Soybean | 12 | 12 | 12 |
| 鸡肉粉Chicken powder | 3 | 3 | 3 |
| 小麦Wheat | 21 | 21 | 21 |
| 米糠Rice bran | 8 | 8 | 8 |
| 豆油Soybean oil | 2.5 | 2.5 | 2.5 |
| 虾膏Shrimp paste | 2 | 2 | 2 |
| 磷酸二氢钙Ca(H2PO4)2 | 2.6 | 2.6 | 2.6 |
| 食盐Salt | 0.4 | 0.4 | 0.4 |
| 赖氨酸Lysine | 0.3 | 0.3 | 0.3 |
| 蛋氨酸Methionine | 0.1 | 0.1 | 0.1 |
| 金银花提取物Honeysuckle extract | — | — | 0.3 |
| 枯草芽胞杆菌Bacillus subtilis | — | — | 0.1 |
| 果寡糖Fructooligosaccharide | — | — | 0.1 |
| 预混料1) Premix | 1.1 | 1.1 | 1.1 |
| 营养组成Nutrients composition | |||
| 水分Moisture | 9.8 | 9.8 | 9.8 |
| 粗蛋白Crude protein | 28.1 | 28.4 | 28.3 |
| 粗脂肪Crude lipid | 9.1 | 9.2 | 9.2 |
| 粗纤维Crude fiber | 8.4 | 8.3 | 8.3 |
| 粗灰分Crude Ash | 9.2 | 9.2 | 9.2 |
| 无氮浸出物2) Nitrogen-free extract | 35.4 | 35.1 | 35.2 |
| 总能3) Gross energy | 19.5 | 19.4 | 19.5 |
| 注:1)预混料提供给每千克日粮:维生素A(VA)900 000 IU, VD 200 000 IU, VE 4 500 mg, VK3 220 mg, VB1 320 mg, VB2 1 090 mg, VB5 2 000 mg, VB6 500 mg, VB12 1.6 mg, VC 5 000 mg, 泛酸1 000 mg, 叶酸165 mg, 胆碱60 000 mg, 硫酸铜2.0 g, 硫酸铁25 g, 硫酸锌22 g, 硫酸锰7 g, 亚硒酸钠0.04 g, 碘化钾0.026 g, 氯化钴0.1 g; 2)无氮浸出物含量(%)=100%-水分含量-粗蛋白含量-粗脂肪含量-粗纤维含量-粗灰分含量; 3)总能单位为MJ·kg-1; 4)PF:硬颗粒饲料; EF:普通膨化饲料; AF:抗应激膨化饲料。 Note:1)Premix provided per kg of diet:VA 900 000 IU, VD 200 000 IU, VE 4 500 mg, VK3 220 mg, VB1320 mg, VB2 1 090 mg, VB5 2 000 mg, VB6 500 mg, VB12 1.6 mg, VC 5 000 mg, pantothenic acid 1 000 mg, folic acid 165 mg, choline 60 000 mg, CuSO4·5H2O 2.0 g, FeSO4·7H2O 25 g, ZnSO4·7H2O 22 g, MnSO4·4H2O 7 g, Na2SeO3 0.04 g, KI 0.026 g, CoCl2·6H2O 0.1 g; 2)Nitrogen-free extract content=100%-moisture content-crude protein content-crude fat content-crude fiber content-crude ash content; 3)The unit of gross energy is MJ·kg-1; 4)PF:Pellet feed; EF:Extruded feed; AF:Anti-stress extruded feed. | |||
养殖试验开始时, 预留30条团头鲂全鱼作为初样。养殖试验结束后, 将鱼饥饿24 h后, 用100 mg·L-1 MS-222(间氨基苯甲酸乙酯甲磺酸盐, Sigma)将鱼麻醉。以水槽为单位, 每个水槽随机选取100尾鱼, 统计生长性能。每个水槽随机选取8尾鱼进行尾部静脉采血, 在3 000 r·min-1条件下离心10 min, 吸取上清液, 于-80 ℃保存备用。随后, 迅速分离出肝脏、肠道、腹脂和脑等组织, 称质量以计算形体指标, 再于-80 ℃保存备用。
1.3 样品测定和分析 1.3.1 饲料与鱼体概率养分含量分析试验所用饲料和鱼体概率养分含量均采用美国分析化学家协会AOAC标准测定[22]:粗蛋白含量采用全自动凯氏定氮仪(FOSS KT260, 瑞士)测定; 水分含量采用105 ℃烘干法测定; 粗脂肪含量采用索氏抽提法测定; 粗灰分含量采用550 ℃灼烧法测定; 粗纤维采用全自动纤维分析仪(ANKOM A2000i, 美国)测定; 总能采用氧弹测热仪(PARR 1281, 美国)测定。
1.3.2 生长指标的测定鱼生长性能相关指标的计算公式:增重率(WG)=(终末体质量-鱼初始体质量)/初始体质量×100%;肥满度(CF, g·cm-3)=平均体质量/(平均体长)3; 平均日增重(ADG, g·d-1)=(终末体质量-初始体质量)/饲喂时间; 脏体比(VCI)=100×内脏质量/鱼体总质量; 肝体比(HSI)=100×肝脏质量/鱼体总质量; 体长增长率(BLG)=(终末体长-初始体长)/初始体长×100%。
1.3.3 肠道消化酶指标称取适量肠道样品, 与生理盐水按照1:9(质量体积比)的比例进行匀浆, 离心(4 ℃、3 000 r·min-1、10 min)后, 取上清液待测。采用福林-酚法测定蛋白酶活性, 采用碘-淀粉比色法测定淀粉酶活性[23]; 参照Furné等[24]的方法测定脂肪酶活性。
1.3.4 血浆抗应激指标测定血浆葡萄糖和乳酸水平均采用南京建成生物工程研究所的试剂盒检测, 血浆皮质醇水平采用双抗体夹心法测定。
1.3.5 生长和摄食相关基因表达量的测定组织总RNA提取:分别取50~100 mg的肝脏和垂体样品, 放入含有1 mL RNA-iso Plus(TaKaRa)的离心管中, 然后按照RNA-iso Plus试剂盒说明书提取总RNA。检测总RNA样品的D260/D280值是否在1.8~2.0。
反转录(RT):按照TaKaRa反转录试剂盒说明书进行操作, 所得cDNA样品保存于-20 ℃冰箱备用。
实时荧光定量PCR:根据GenBank数据库中已知的团头鲂相关基因序列, 使用Primer Premier 5.0软件设计内参基因EF1α、肝脏胰岛素样生长(IGF-Ⅰ)和瘦素(LEP)以及垂体生长激素(GH)、生长激素受体(GHR)、胆囊收缩素(CCK)和神经肽Y(NPY)等基因的引物。引物由上海Invitrogen公司合成, 其序列参见表 2。根据SYBR® Premix Ex Taq Ⅱ(TaKaRa公司)试剂盒说明书进行操作, 结果用2-ΔΔCT方法进行各基因相对表达量分析[25]。
| 目的基因 Target gene |
GenBank登录号 Accession No. |
序列长度/bp Sequence size |
引物对序列 Primer pairs sequence(5′→3′) |
| GH | AY170124 | 1 170 | GAGCCATCTCAAACAGCC/AGCAAGCCAGAAGACGAA |
| IGF-Ⅰ | JQ398496 | 1 474 | CCGATTTAAGGTCCGTATT/GTGCAGCCGTAGTTCAGTT |
| GHR | JN896373.1 | 2 228 | TGGCACAGATACCAAGCA/GGGAGAAGATGAGCAGGA |
| CCK | JQ290110.1 | 770 | CACTCACAGAATAAAGGACAGA/ATGATTGGCTAATCAGGTTG |
| NPY | JQ301475.1 | 760 | CTGCTTGGGAACTCTTAC/ATGGTCCTCATATCTGGT |
| LEP | KJ193853.1 | 1 676 | TGACACCCTAACTACCTTCC/CACATCACTGCGTAACTGG |
| EF1α | X77689.1 | 1 729 | CTTCTCAGGCTGACTGTGC/CCGCTAGCATTACCCTCC |
| 注:GH:生长激素基因Growth hormone gene; IGF-I:胰岛素样生长因子基因ⅠInsulin-like growth factorⅠgene; GHR:生长激素受体基因Growth hormone receptor gene; CCK:胆囊收缩素基因Cholecystokinin gene; NPY:神经肽Y基因Neuropeptide Y gene; LEP:瘦素Leptin; EF1α:延伸因子1α基因Elongation factor 1α gene.下同。The same as follows. | |||
使用SPSS 20.0软件对数据进行统计分析, 采用Tukey’s多重检验法比较各试验组数据间的差异, 试验结果均以平均值±标准误(x±SE)表示。
2 结果与分析 2.1 膨化饲料及其添加抗应激剂对团头鲂生长性能的影响由表 3可知:试验至7月12日(第91天), AF组试验鱼的终末体质量、增重率、平均日增重以及体长均显著高于其他2组(P < 0.05);7月12日至10月11日, PE组更换了相同配方的硬颗粒饲料, 第181天其增重率以及平均日增重与AF组相比差异均不显著(P>0.05), 并且都显著高于EF组(P < 0.05)。PE组在7月12日更换硬颗粒饲料后生长速度增加, 截至10月11日(第181天)采样时, PE组的终末体质量以及体长仍显著低于AF组, 但显著高于EF组(P < 0.05)。
| 指标Parameters | 月-日Month-day | 试验分组Experimental groups | ||
| EF | AF | PE | ||
| 初始体质量/g Initial weight | 04-13 | 14 | 14 | 14 |
| 终末体质量/g Final weight | 07-12 | 120.70±4.53b | 143.81±6.15a | 122.71±2.34b |
| 10-11 | 243.71±11.12c | 404.5±22.46a | 334.89±17.11b | |
| 增重率/% Weight gain | 07-12 | 757.15±15.8b | 927.22±20.4a | 771.43±11.3b |
| 10-11 | 101.91±9.22b | 181.27±15.62a | 172.91±13.94a | |
| 平均日增重/(g·d-1) Average daily gain | 07-12 | 1.18±0.06b | 1.44±0.08a | 1.21±0.03b |
| 10-11 | 1.35±0.10b | 2.87±0.21a | 2.33±0.16a | |
| 体长增长率/% Body length gain | 07-12 | 87.33±0.02b | 99.00±0.03a | 87.89±0.02b |
| 10-11 | 27.82±0.02c | 41.99±0.03a | 38.08±0.03b | |
| 注:1)EF:全程投喂普通膨化饲料组Extruded feed group; AF:全程投喂添加抗应激剂膨化饲料组Anti-stress feed group; PE:前90 d投喂普通膨化饲料后, 90 d投喂硬颗粒饲料的间隔投喂组Pellet and extruded feed group; 2)同行数据肩标不同字母表示处理组间差异显著(P < 0.05)。Means in the same line with different superscripts are significantly different(P < 0.05).下同。The same as follows. | ||||
由表 4可知:7月12日采样时, 各组间肥满度、肝体比和脏体比均无显著差异(P>0.05);10月11日采样时, 各组间肝体比无显著差异(P>0.05), PE组肥满度和脏体比均显著高于其他2组(P < 0.05), 但EF组和AF组间差异不显著(P>0.05)。
| 指标Parameters | 月-日Month-day | 试验分组Experimental groups | ||
| EF | AF | PE | ||
| 肥满度/(g·cm-3)Condition factor | 07-12 | 2.50±0.04 | 2.47±0.03 | 2.54±0.04 |
| 10-11 | 2.42±0.05b | 2.42±0.02b | 2.6±0.05a | |
| 肝体比/% Hepatosomatic index | 07-12 | 1.94±0.18 | 1.62±0.12 | 1.84±0.07 |
| 10-11 | 1.33±0.04 | 1.37±0.04 | 1.46±0.06 | |
| 脏体比/% Viscera coefficient index | 07-12 | 12.49±0.77 | 10.28±0.45 | 11.27±0.31 |
| 10-11 | 10.12±0.24b | 10.66±0.42b | 12.44±0.61a | |
由表 5可知:7月12日采样时, 各组间体组成均无显著差异(P>0.05);10月11日时, PE组粗脂肪含量显著高于其他2组(P < 0.05), 而其他成分间均无显著差异(P>0.05)。
| 指标Parameters | 月-日Month-day | 试验分组Experimental groups | ||
| EF | AF | PE | ||
| 水分含量/% Moisture | 07-12 | 71.99±1.17 | 71.13±0.42 | 71.91±0.69 |
| 10-11 | 71.34±0.65 | 70.16±0.44 | 70.74±0.46 | |
| 粗蛋白含量/% Crude protein | 07-12 | 15.58±0.37 | 15.39±0.43 | 15.84±0.72 |
| 10-11 | 16.24±0.08 | 16.59±0.28 | 16.43±0.32 | |
| 粗脂肪含量/% Crude lipid | 07-12 | 7.83±0.90 | 7.87±0.34 | 7.68±0.50 |
| 10-11 | 8.15±0.12b | 8.27±0.14b | 8.63±0.09a | |
| 粗灰分含量/% Ash | 07-12 | 2.79±0.12 | 2.81±0.09 | 2.84±0.11 |
| 10-11 | 3.09±0.14 | 3.07±0.44 | 3.14±0.48 | |
| 总能/(MJ·kg-1) Gross energy | 07-12 | 6.89±0.19 | 6.85±0.22 | 6.81±0.36 |
| 10-11 | 7.63±0.03 | 7.67±0.08 | 7.62±0.05 | |
由表 6可知:7月12日采样时, AF组的肠道蛋白酶、脂肪酶及淀粉酶活性均显著高于另外2组(P < 0.05), 且另外2组间差异不显著(P>0.05);10月11日采样时, AF组淀粉酶活性最高, 且显著高于其他2组(P < 0.05)。此外, EF组肠道蛋白酶和脂肪酶活性均显著低于其他2组(P < 0.05)。
| 指标Parameters | 月-日Month-day | 试验分组Experimental groups | ||
| EF | AF | PE | ||
| 蛋白酶活性/(U·mg-1) Protease activity | 07-12 | 55.96±2.04b | 64.85±1.09a | 57.23±1.06b |
| 10-11 | 52.10±3.37b | 68.29±3.76a | 72.51±2.77a | |
| 脂肪酶活性/(U·g-1) Lipase activity | 07-12 | 144.09±8.61b | 174.74±3.98a | 141.97±5.85b |
| 10-11 | 79.4±1.40b | 88.64±3.2a | 85.24±1.74a | |
| 淀粉酶活性/(U·mg-1) Amylase activity | 07-12 | 0.66±0.03b | 0.77±0.03a | 0.67±0.02b |
| 10-11 | 0.79±0.05b | 0.89±0.01a | 0.80±0.03b | |
由表 7可知:7月12日采样时, 各组间血糖含量无显著差异(P>0.05), 但AF组皮质醇和乳酸含量均显著低于另外2组(P < 0.05);10月11日采样时, 各组间血糖含量均无显著差异(P>0.05), 但EF组皮质醇含量和乳酸含量均显著高于其他2组(P < 0.05), 且PE组和AF组间差异不显著(P>0.05)。
| 指标Parameters | 月-日Month-day | 试验分组Experimental groups | ||
| EF | AF | PE | ||
| 血糖含量/(mmol·L-1) Glucose content | 07-12 | 15.01±1.29 | 14.75±1.24 | 13.91±0.28 |
| 10-11 | 4.87±0.47 | 4.60±0.75 | 5.05±0.42 | |
| 皮质醇含量/(pg·mL-1) Cortisol content | 07-12 | 759.97±6.26a | 707.71±3.22b | 754.46±8.16a |
| 10-11 | 1 089.73±6.66a | 945.50±5.61b | 935.20±4.68b | |
| 乳酸含量/(mmol·L-1) Lactic acid content | 07-12 | 5.54±0.06a | 5.06±0.08b | 5.48±0.12a |
| 10-11 | 5.52±0.28a | 4.62±0.30b | 4.31±0.19b | |
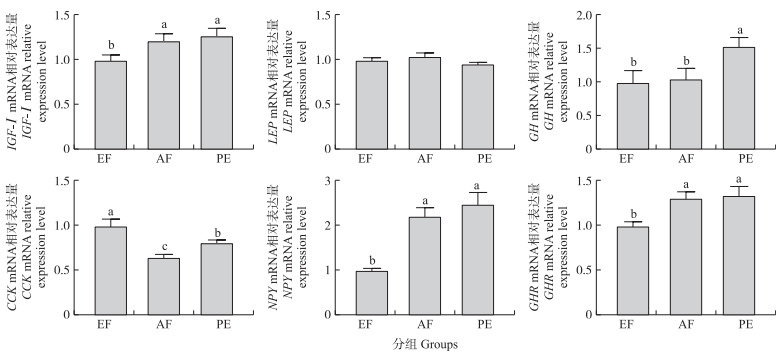
由图 1可知:养殖试验结束时, 各组间肝脏LEP mRNA表达量无显著差异(P>0.05)。然而, EF组肝脏IGF-I及垂体GHR和NPY mRNA表达量均显著低于另外2组(P < 0.05), 且另外2组间无显著差异(P>0.05)。此外, PE组GH mRNA表达量显著高于其他组(P < 0.05), 而EF组CCK mRNA表达量显著高于其他2组(P < 0.05)。
|
图 1 膨化饲料及其添加抗应激剂对团头鲂肝脏IGF-Ⅰ和LEP及垂体GH、CCK、NPY与GHR mRNA相对表达量的影响 Fig. 1 Effects of extruded feed with or without anti-stress additives supplementation on mRNA relative expressions of IGF-Ⅰ and LEP in the liver and GH, CCK, NPY and GHR in the hypophysis of blunt snout bream |
通过2次采样发现, 与全程普通膨化料组相比, 间隔投喂组生长性能更好。究其原因, 团头鲂是底栖鱼类, 膨化饲料漂浮在水体表层, 不符合其摄食习惯, 导致其采食量降低。同时, 与硬颗粒饲料相比, 膨化饲料的肠道排空时间比硬颗粒饲料长[19], 这在一定程度上降低了团头鲂的食欲和采食量, 从而降低生长性能。与此同时, 膨化加工过程中的高温高压会破坏饲料中某热敏性维生素(如VB1、VC、VA与叶酸等)和氨基酸(如赖氨酸、精氨酸与组氨酸等)[19], 造成鱼体对上述营养物质的摄入量降低, 进而降低其生长性能。此外, 相较于摄食沉性颗粒饲料, 团头鲂在摄食浮性膨化饲料时会消耗更多能量, 进而造成其生长速度降低。间隔投喂组在后90 d改投硬颗粒饲料, 其沉水性更符合团头鲂的摄食习惯, 且其摄食所消耗的能量也显著降低, 使更多能量用于体增长[26]。研究表明, 符合鱼类摄食习惯的饲料能够增加其食欲, 提高其采食量和代谢率[26-27], 进而提高饲料的消化利用率[26]。此外, 与硬颗粒饲料相比, 膨化饲料在肠道内吸水后膨大进而增加鱼体的饱腹感, 这也会降低鱼类的采食量, 进而对其生长造成负面影响[10]。此外, 全程投喂添加抗应激剂膨化料组生长性能也优于间隔投喂组。这表明添加抗应激剂可在一定程度上改善膨化饲料对鱼体造成的负面影响。究其原因在于金银花提取物、果寡糖及枯草芽胞杆菌可缓解水产动物应激反应并提高肠道消化酶活性, 进而改善了其生长性能。研究表明, 应激状态下的机体会分泌大量肾上腺素和皮质醇, 进而促进分解代谢而抑制合成代谢。此时, 鱼体营养物质的合成速度大幅降低, 但消耗量却显著增加, 导致其生长缓慢[28]。此外, 应激状态下, 鱼类的摄食量显著降低, 会显著影响其生长性能[27]。另外, 肠道消化酶活性的高低显著影响鱼体对饲料的消化利用率, 进而影响其生长性能。
3.2 膨化饲料及其添加抗应激剂对团头鲂体组成的影响2次采样发现, 与全程投喂普通膨化料组相比, 间隔投喂组鱼体粗脂肪含量明显升高。究其原因在于, 间隔投喂组后90 d投喂硬颗粒饲料, 其沉水性更符合团头鲂摄食习惯, 鱼体采食量及能量摄入量增加, 过多的能量转化为脂肪储存在鱼体, 从而提高了鱼体粗脂肪含量。
3.3 膨化饲料及其添加抗应激剂对团头鲂肠道酶活性的影响肠道在无胃鱼类的营养物质消化吸收过程中发挥重要作用, 而肠道消化酶活性可在一定程度上反映鱼体对营养素的消化能力[29]。本试验结果显示, 全程投喂添加抗应激剂膨化料组肠道蛋白酶、脂肪酶和淀粉酶活性均显著高于其他2组。此外, 间隔投喂组肠道蛋白酶和淀粉酶活性均显著高于全程投喂普通膨化料组。这表明, 膨化料与硬颗粒料间隔投喂及添加抗应激剂均可显著提高团头鲂肠道消化酶活性。一方面在于膨化饲料不符合团头鲂摄食习惯, 造成其摄食量降低, 进而肠道反馈性地降低了消化酶的分泌; 另一方面, 抗应激剂中的枯草芽胞杆菌与果寡糖等成分可显著改善鱼体肠道微生态平衡, 进而提高其对营养物质的消化吸收率。例如, 枯草芽胞杆菌能够适应动物肠道的酸碱环境, 在肠道内存活率达70%~80%[30]。其在代谢过程中可产生额外蛋白酶和淀粉酶, 这可以弥补肠道内源酶的不足, 进而改善机体对饲料中营养物质的利用率[31]。此外, 果寡糖可以促进动物肠上皮细胞生长, 进而增加内源消化酶活性[32]。
3.4 膨化饲料及其添加抗应激剂对团头鲂应激反应的影响本试验结果显示, 养殖期间全程投喂添加抗应激剂膨化料组血浆皮质醇和乳酸含量均显著低于全程投喂普通膨化料组。此外, 第2次采样时, 间隔投喂组血浆皮质醇和乳酸含量均显著低于全程普通膨化料组。这表明, 与全程使用膨化饲料相比, 膨化料饲料与硬颗粒饲料间隔投喂及添加抗应激剂均可显著降低团头鲂的应激反应。究其原因在于, 膨化饲料加工过程中的高温高压环境会破坏某些热敏性维生素及氨基酸[19], 造成鱼体对上述营养素的摄入量降低, 进而使鱼体出现了应激反应。而同等配方的硬颗粒饲料则避免了上述情况, 这可以在一定程度上解释为何间隔组在更换了硬颗粒饲料后血浆皮质醇和乳酸含量均显著降低。此外, 大量研究表明, 抗应激剂中的金银花提取物、地衣芽胞杆菌和果寡糖等成分均可以降低水产动物血液中皮质醇含量[33-35], 进而改善鱼体的免疫机能和抗应激能力。这在一定程度上解释全程投喂添加抗应激剂膨化料组血浆皮质醇和乳酸含量低于全程投喂普通膨化料组的原因。
3.5 膨化饲料及其添加抗应激剂对团头鲂生长及摄食基因表达的影响为了解释上述结果, 本试验研究了几种与鱼体生长和摄食密切相关基因的转录水平。结果表明, 全程投喂普通膨化料组CCK表达量显著高于其他2组, 而GH、GHR、NPY及IGF-Ⅰ表达量均显著下降。这表明, 全程使用普通膨化饲料会抑制鱼体生长与摄食基因的表达, 进而降低了团头鲂的摄食量和生长性能。这是因为GH具有重要的促生长作用, 其分泌量增加会刺激肝脏产生大量IGF-Ⅰ, 进而增加鱼体生长速度[36]。此外, NPY具有提高动物食欲的作用, 而CCK则抑制动物的摄食功能。出现上述结果的原因, 可能在于硬颗粒饲料的沉水性更加符合团头鲂的摄食习惯, 进而刺激下丘脑产生生长激素释放激素, 促进GH的分泌和释放, 而GH与GH受体(GHR)结合后, 促使肝脏产生更多的IGF-Ⅰ以加速鱼体生长[37]。因此, 高水平的GH可能通过GHR诱导NPY表达, 进而提高鱼体食欲。此外, 全程投喂添加抗应激剂膨化料组GH表达量显著高于全程投喂普通膨化料组, 而间隔投喂组CCK表达量显著高于全程投喂添加抗应激剂膨化料组。推测原因在于, 更换硬颗粒饲料后, 间隔投喂组鱼体的GH表达量显著增加, 促进鱼体生长。此外, 抗应激膨化饲料可以显著提高鱼体的抗应激能力, 避免了应激导致的摄食量下降问题, 进而使抑制摄食的CCK的表达量降低。
综上所述, 相较于全程使用普通膨化饲料, 膨化料与硬颗粒料间隔投喂及抗应激膨化饲料可以显著提高团头鲂的生长性能和抗应激能力。在实际生产中, 使用抗应激膨化饲料可以在一定程度上缩短团头鲂的上市周期, 提高养殖经济效益。此外, 也可以通过膨化料饲料与硬颗粒饲料间隔投喂的方式来避免或消除长期使用膨化饲料对鱼体造成的负面影响。
| [1] |
许红. 挤压膨化技术及其在水产饲料的应用[J]. 饲料工业, 2003, 24(11): 48-50. Xu H. Extrusion technology and application in aquatic feed[J]. Feed Industry, 2003, 24(11): 48-50 (in Chinese). |
| [2] |
Anguita M, Gasa J, Martín-Orúe S M, et al. Study of the effect of technological processes on starch hydrolysis, non-starch polysaccharides solubilization and physicochemical properties of different ingredients using a two-step in vitro system[J]. Animal Feed Science and Technology, 2006, 129(1/2): 99-115. |
| [3] |
Venou B, Alexis M N, Fountoulaki E, et al. Performance factors, body composition and digestion characteristics of gilthead sea bream(Sparus aurata)fed pelleted or extruded diets[J]. Aquaculture Nutrition, 2009, 15(4): 390-401. DOI:10.1111/j.1365-2095.2008.00603.x |
| [4] |
Glencross B, Blyth D, Tabrett S, et al. An assessment of cereal grains and other starch sources in diets for barramundi(Latescalcarifer)-implications for nutritional and functional qualities of extruded feeds[J]. Aquaculture Nutrition, 2012, 18(4): 388-399. DOI:10.1111/j.1365-2095.2011.00903.x |
| [5] |
Francis G, Makkar H P S, Becker K. Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish[J]. Aquaculture, 2001, 199(3/4): 197-227. |
| [6] |
Drew M D, Borgeson T L, Thiessen D L. A review of processing of feed ingredients to enhance diet digestibility in finfish[J]. Animal Feed Science and Technology, 2007, 138(2): 118-136. DOI:10.1016/j.anifeedsci.2007.06.019 |
| [7] |
Glencross B, Michael R, Austen K, et al. Productivity, carcass composition, waste output and sensory characteristics of large barramundi Latescalcarifer fed high-nutrient density diets[J]. Aquaculture, 2008, 284(1/2/3/4): 167-173. |
| [8] |
夏尚远. 膨化浮性饲料应用现状及前景[J]. 养殖与饲料, 2017(3): 47. Xia S Y. Application status and prospect of expanded floating feed[J]. Breed and Feed, 2017(3): 47 (in Chinese). |
| [9] |
吴锐全, 黄志凯, 卢迈新, 等. 膨化加工的草鱼饲料对混养家鱼生长影响的试验[J]. 广东饲料, 1999, 8(3): 28-29. Wu R Q, Huang Z K, Lu M X, et al. Experiments on the effects of expanded grass carp feed on the growth of mixed domestic fish[J]. Guangdong Feed, 1999, 8(3): 28-29 (in Chinese). |
| [10] |
吴秀峰, 任瑞军, 张旭. 虹鳟配合饲料试验[J]. 中国饲料, 2000(3): 24-25. Wu X F, Ren R J, Zhang X. Experiment on rainbow trout formula feed[J]. China Feed, 2000(3): 24-25 (in Chinese). |
| [11] |
何川. 虹鳟膨化饲料饲喂效果试验[J]. 渔业现代化, 2004(3): 43-44. He C. Feeding effect of extruded feed forrainbow trout[J]. Modernization of Fisheries, 2004(3): 43-44 (in Chinese). |
| [12] |
冷向军. 水产膨化饲料应用中的几个问题[J]. 饲料工业, 2014, 35(8): 1-5. Leng X J. Several problems in the application of aquatic expanded feed[J]. Feed Industry, 2014, 35(8): 1-5 (in Chinese with English abstract). |
| [13] |
王常安, 徐奇友, 包玉龙, 等. 不同饲料对哲罗鲑生长性能和营养成分的影响[J]. 水产养殖, 2011, 32(1): 5-9. Wang C A, Xu Q Y, Bao Y L, et al. Effects of different diets on growth performance and nutrient composition of Philodendron salmon(Hucho taimen)[J]. Aquaculture, 2011, 32(1): 5-9 (in Chinese). |
| [14] |
姚大龙, 刘勇. 粉状饲料和膨化饲料对水库网箱养殖花鲢生产性能及经济效益的影响[J]. 科学养鱼, 2013(9): 73-74. Yao D L, Liu Y. Effects of powdered feed and expanded feed on production performance and economic benefit of silver carp in cage culture of reservoir[J]. Scientific Fish Culture, 2013(9): 73-74 (in Chinese). |
| [15] |
张思朋. 金鱼养殖投喂膨化饲料的试验[J]. 渔业致富指南, 2008(1): 32. Zhang S P. Experiment on feeding puffed feed to goldfish breeding[J]. Fishery Guide to be Rich, 2008(1): 32 (in Chinese). |
| [16] |
林仕梅, 罗莉, 龙勇, 等. 膨化与非膨化饲料对湘云鲫生长的影响[J]. 渔业现代化, 2003(1): 27-29. Lin S M, Luo L, Long Y, et al. Effects of expanded and non-expanded feed on the growth of Carassius auratus[J]. Fishery Modernization, 2003(1): 27-29 (in Chinese). |
| [17] |
冷永智, 刘正华, 高启平. 膨化与非膨化鲤鱼育成料的养殖效果比较[J]. 淡水渔业, 2001(1): 53-56. Leng Y Z, Liu Z H, Gao Q P. Comparison of the culture effects of puffed and non-puffed carps[J]. Freshwater Fisheries, 2001(1): 53-56 (in Chinese). |
| [18] |
唐东东. 广东鳊鱼饲料风波[J]. 内陆水产, 2009, 34(8): 8-11. Tang D D. Guangdong bream feed disturbance[J]. Inland Fisheries, 2009, 34(8): 8-11 (in Chinese). |
| [19] |
魏旭光.膨化和非膨化饲料对大菱鲆生长代谢的影响[D].保定: 河北农业大学, 2015. Wei X G. Effects of expanded and non-expanded feed on growth and metabolism of turbot(Scophthalmus maximus)[D]. Baoding: Hebei Agricultural University, 2015(in Chinese with English abstract). |
| [20] |
谢少林, 邹青, 姚东林. 抗应激饲料添加剂对草鱼生长、免疫和抗应激能力的影响[J]. 水产科技情报, 2013, 40(6): 312-316. Xie S L, Zou Q, Yao D L. Effects of anti-stress feed additives on growth, immunity and anti-stress ability of grass carp[J]. Fisheries Science and Technology Information, 2013, 40(6): 312-316 (in Chinese). |
| [21] |
吴阳, 鲁康乐, 刘文斌. 饲料中添加低聚木糖与枯草芽孢杆菌对团头鲂生长、消化、免疫和抗氧化功能的影响[J]. 江苏农业科学, 2013, 41(3): 183-186. Wu Y, Lu K L, Liu W B. The effect of xylo-oligosaccharide and Bacillus subtilis on the growth, digestion, immunity and antioxidant function of Megalobrama amblycephala[J]. Jiangsu Agricultural Sciences, 2013, 41(3): 183-186 (in Chinese with English abstract). |
| [22] |
Cunniff P. Official methods of analysis of AOAC international[J]. AOAC Official Method, 1995, 6(11): 382-382. |
| [23] |
Lowry O H, Rosebrough N J, Farr A L, et al. Protein measurement with the Folin phenol reagent[J]. The Journal of Biological Chemistry, 1951, 193(1): 265-275. |
| [24] |
Furné M, Hidalgo M C, López A, et al. Digestive enzyme activities in Adriatic sturgeon Acipenser naccarii and rainbow trout Oncorhynchus mykiss:a comparative study[J]. Aquaculture, 2005, 250(1/2): 391-398. |
| [25] |
Kenneth J L, Thomas D S. Analysis of relative gene expression data using real-time quantitative PCR the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [26] |
Johansen S J S, Jobling M. The influence of feeding regime on growth and slaughter traits of cage-reared Atlantic salmon[J]. Aquaculture International, 1998, 6(1): 1-17. DOI:10.1023/A:1009250118318 |
| [27] |
姜志强, 贾泽梅, 韩延波. 美国红鱼继饥饿后的补偿生长及其机制[J]. 水产学报, 2002, 26(1): 67-72. Jiang Z Q, Jia Z M, Han Y B. Compensatory growth and mechanism of American red fish after hunger[J]. Journal of Fisheries of China, 2002, 26(1): 67-72 (in Chinese with English abstract). |
| [28] |
Weerd J H. The effects of chronic stress on growth in fish:a critical appraisal[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 1998, 120(1): 107-112. |
| [29] |
胡亮.可消化必需氨基酸平衡模式下不同蛋白源替代鱼粉对花鲈生长性能、生理功能及肉品质的影响[D].北京: 中国农业科学院, 2010. Hu L. Effects of fish-meal replacement by various protein sources on growth, physiologic function, flesh quality of Japanese seabass(Lateolabrax japonicus)under ideal digestible amino acids profile[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010(in Chinese with English abstract). |
| [30] |
Palmer M F, Rolls B A. The activities of some metabolic enzymes in the intestines of germ-free and conventional chicks[J]. British Journal of Nutrition, 1983, 50(3): 783-790. DOI:10.1079/BJN19830149 |
| [31] |
Sen S K. Characterization of bacilli isolated from the gut of rohu, Labeo rohita, fingerlings and its significance in digestion[J]. Journal of Applied Aquaculture, 2002, 12(3): 33-42. DOI:10.1300/J028v12n03_04 |
| [32] |
唐胜球, 彭冬秋, 董小英. 果寡糖的生物学功能及其在水产养殖中的应用[J]. 北京水产, 2007(5): 47-52. Tang S Q, Peng D Q, Dong X Y. Biological function of fructooligosaccharide and its application in aquaculture[J]. Journal of Beijing Fisheries, 2007(5): 47-52 (in Chinese). |
| [33] |
蒋向辉, 苑静. 金银花饲料对家鱼生长的影响[J]. 江苏农业科学, 2016, 44(8): 309-312. Jiang X H, Yuan J. Effect of honeysuckle feed on growth of domestic fish[J]. Jiangsu Agricultural Sciences, 2016, 44(8): 309-312 (in Chinese with English abstract). |
| [34] |
Hsu H F, Hsiao P C, Kuo T C, et al. Antioxidant and anti-inflammatory activities of Lonicera japonica Thunb. var. sempervillosa Hayata flower bud extracts prepared by water, ethanol and supercritical fluid extraction techniques[J]. Industrial Crops and Products, 2016, 89: 543-549. DOI:10.1016/j.indcrop.2016.05.010 |
| [35] |
Ku S K, Seo B I, Park J H, et al. Effect of Lonicerae Flos extracts on reflux esophagitis with antioxidant activity[J]. World Journal of Gastroenterology, 2009, 15(38): 4799. DOI:10.3748/wjg.15.4799 |
| [36] |
Zhong H, Zhou Y, Liu S J, et al. Elevated expressions of GH/IGF axis genes in triploid crucian carp[J]. General and Comparative Endocrinology, 2012, 178(2): 291-300. |
| [37] |
Butler A A, Roith D L. Control of growth by the somatropic axis:growth hormone and the insulin-like growth factors have related and independent roles[J]. Annual Review of Physiology, 2001, 63(1): 141-164. DOI:10.1146/annurev.physiol.63.1.141 |




