文章信息
- 李冉, 顾建锋, 李红梅, 张晓梅, 王暄
- LI Ran, GU Jianfeng, LI Hongmei, ZHANG Xiaomei, WANG Xuan
- 番茄光尾拟短体线虫的形态和分子鉴定
- Morphological and molecular identification of Pratylenchoides leiocauda in tomato
- 南京农业大学学报, 2020, 43(6): 1033-1041
- Journal of Nanjing Agricultural University, 2020, 43(6): 1033-1041.
- http://dx.doi.org/10.7685/jnau.202003011
-
文章历史
- 收稿日期: 2020-03-05
2. 宁波海关技术中心, 浙江 宁波 315100;
3. 青海省西宁市蔬菜技术服务中心, 青海 西宁 810016
2. Technical Center of Ningbo Customs, Ningbo 315100, China;
3. Xining Vegetable Technical Service Center of Qinghai Province, Xining 810016, China
拟短体属线虫(Pratylenchoides spp.)是一类植物根系迁移性内寄生线虫, 主要危害根的皮层细胞, 导致根部变色、坏死及腐烂, 根部营养吸收受阻, 地上部长势衰弱且黄化[1]。拟短体线虫属有效种迄今有31个[2-4], 分布广泛, 例如, 阿尔肯拟短体线虫(P.alkani)在希腊野生橄榄[5]以及土耳其大麦、小麦、西瓜和烟草的根际[6]均有分布; 棒尾拟短体线虫(P.clavicauda)在韩国紫苏根际有分布[7]; 埃尔祖鲁姆拟短体线虫(P.erzurumensis)在土耳其草料作物[8]以及伊朗野生葡萄藤[9]的根部有分布; 西班牙拟短体线虫(P. hispaniensis)在西班牙软木树根际有分布[10]; 侧尾拟短体线虫(P.laticauda)在斯洛伐克果园土壤中有分布[11]; 光尾拟短体线虫(P. leiocauda)在阿尔及利亚鹰嘴豆、蚕豆和扁豆[12]、保加利亚小麦[13]以及西班牙牧草[14]的根部均有分布; 奥伊楚夫拟短体线虫(P. ojcowensis)在波兰三叶草及披碱草的根部有分布[4]; 波斯拟短体线虫(P. persicus)在伊朗牛至的根围土壤中有分布[15]; 大尾拟短体线虫(P. magnicauda)和多变拟短体线虫(P. variabilis)在伊朗的苹果根围有分布[16]; 里特拟短体线虫(P. ritteri)在大麦、苜蓿、大豆、番茄等作物的根围有分布; 尤他拟短体线虫(P. utahensis)在牧草根部有分布[16]。
我国已报道的拟短体线虫种共7个, 刘维志等[17-18]分别从辽宁省的红松根围土中分离到河谷拟短体线虫(P. riparius), 野生大豆根部分离到阿尔肯拟短体线虫, 番茄根围分离到尤他拟短体线虫, 玉米根围分离到欧石南拟短体线虫(P. heathi)。张绍升等[19]从河北省卢龙县甘薯根围分离到1种拟短体属线虫, 并将其命名为甘薯拟短体线虫(P. batatae)。闫超杰等[20]和徐春玲等[21]分别从辽宁省沈阳市的草莓和建平县的马铃薯根际分离到光尾拟短体线虫。此外, 闫超杰等[22]从辽宁省辽中县、山东省周口市以及内蒙古通辽市的草莓根际土壤中分离到棒尾拟短体线虫。
拟短体线虫属早期隶属于小杆目(Rhabditida)、垫刃亚目(Tylenchina)、垫刃总科(Tylenchoidea)、短体线虫科(Pratylenchidae)[23], 但根据侧线延伸至尾端、雄虫交合伞包裹至尾端以及尾感器位置等特征, 拟短体线虫属被新归属于默林线虫科(Merliniidae)[24-25]。Ghaderi等[9]通过构建28S系统进化树表明拟短体线虫种类与大默林线虫属(Amplimerlinius)成员有较近的亲缘关系, 为拟短体属线虫与大默林属线虫的形态特征相似性[25]提供了分子数据的支持。Azizi等[15]构建的28S系统进化树揭示了拟短体线虫属与楯垫线虫属(Scutylenchus)和默林线虫属(Merlinius)为近源属, 同样支持了拟短体线虫属的新分类地位。
2019年6月在青海省西宁市生物园区蔬菜所一试验大棚内, 大量番茄植株出现长势衰弱, 并伴有萎蔫及黄化症状。采集发病番茄植株根际土样及部分根系, 从中分离到1种拟短体线虫群体, 利用形态学和分子生物学鉴定方法明确该青海群体为光尾拟短体线虫(P. leiocauda)。本文对光尾拟短体线虫青海群体进行详细的形态特征描述和分子特征分析, 以丰富我国植物寄生线虫的分类学信息, 也为今后拟短体线虫种类的鉴定和分子检测提供更多的参考依据。
1 材料与方法 1.1 样品采集与线虫分离采集发病番茄植株表层土下5~20 cm的根围土及部分根系组织, 将同一大棚不同取样点的样品混合到1个取样袋中, 带回实验室备检。取约250 g土样, 均匀平铺于双层纱布上, 用改良漏斗法分离线虫[26]。25 ℃静置24 h, 用凹面皿接取约10 mL线虫悬浮液, 在体视显微镜下镜检。重复分离根围土样及根系组织1次。
1.2 形态学鉴定体视显微镜下挑取线虫制成临时玻片, 在光学显微镜下观察线虫的形态特征并拍照。挑取数条线虫于凹面皿无菌水滴中, 加入预热95 ℃的TAF溶液(4%福尔马林溶液+1%甘油)快速杀死线虫, 冷却后放置24 h以上固定线虫。采用乙醇-甘油脱水法[27]对固定的线虫进行脱水, 将脱水后的线虫挑入甘油液滴中, 用石蜡封片后制成永久玻片。用Zeiss Imager Z1显微镜和Zeiss Axio Cam MRm数码相机进行形态观察、拍照, 并采用de Man公式[28]对雌虫和雄虫进行形态特征测计。
1.3 分子生物学鉴定青海群体的单条线虫DNA提取参照王江岭等[29]的方法。核糖体DNA(rDNA)18S区扩增所用的2对引物分别为上游引物988F和下游引物1912R, 以及上游引物1813F和下游引物2646R[30]; rDNA 28S-D2/D3区扩增所用的引物对为上游引物D2A和下游引物D3B[31]; rDNA ITS区扩增所用的引物对为上游引物F1和下游引物V2[32]。参考Ye等[33]的方法PCR扩增DNA片段, 并将扩增产物送至上海华大生物医药科技有限公司进行测序。
用MEGA 6.0软件拼接序列后提交至GenBank, 并下载已提交的相关拟短体线虫属种类和群体的18S、28S-D2/D3以及ITS序列, 用MAFFT在线版进行序列比对, 采用CIPRES在线版利用贝叶斯法[34]以及最大似然法[35]构建系统进化树。选择鳞球茎茎线虫(Ditylenchus dipsaci)、喜悦平滑垫刃线虫(Psilenchus hilarulus)以及细小头垫刃线虫(Cephalenchus leptus)作为外群。采用Boostrap值检验分支聚类的可靠性, 进化树显示置信度大于50%的数值, 最后用FigTree v.1.4.3和Inkscape软件对系统进化树进行查看和编辑。
2 结果与分析 2.1 青海线虫群体的形态学特征从青海番茄根系组织及根围土样中2次都分离到同一种拟短体线虫, 群体密度为每100 g样品7~9条线虫。对分离到的青海群体进行形态特征观察和测计, 测计值见表 1。将青海群体与原始描述的光尾拟短体线虫法国杂草群体[36]以及我国报道的辽宁草莓[20]和马铃薯[21]群体进行核查和比对分析。从表 1可以看出:与法国杂草群体相比, 青海群体除雌虫体长和b′值略大外, 其他测计值范围基本重叠; 与辽宁草莓群体相比, 青海群体除了雌虫的口针长、a值和头前端至排泄孔距离以及雄虫的体长和MB值略大外, 其他测计值范围基本重叠; 与辽宁马铃薯群体相比, 青海群体除了雌虫a值略大外, 其他测计值范围基本重叠。因此我们初步将青海群体鉴定为光尾拟短体线虫。
| 测计值 Measurement |
雌虫 Females | 雄虫 Males | ||||||
| 本文群体 Population inthis study |
法国杂草群体[36] French populationon grass |
辽宁草莓群体[20] Liaoning populationon strawberry |
辽宁马铃薯群体21] Liaoning populationon potato |
本文群体 Population inthis study |
法国杂草群体[36] French populationon grass |
辽宁草莓群体[20] Liaoning populationon strawberry |
||
| n | 7 | 15 | 7 | 8 | 6 | 11 | 6 | |
| L/μm | 810±99.7(679~920) | 600(530~670) | 662±53(568~728) | 718.0±59.7(640~825) | 675.0±28.3(651~711) | 570(470~720) | 556±49(490~609) | |
| a | 36.1±1.4(34.0~37.4) | 31(22~37) | 28.6±2.0(26.5~31.3) | 29.18±0.82(28.16~30.55) | 33.3±2.1(29.9~35.8) | 30(28~33) | 31.5±2.4(28.0~33.2) | |
| b | 5.8±0.5(5.2~6.3) | 4.8(3.6~5.6) | 5.0±0.3(4.6~5.2) | 5.04±0.47(4.22~5.69) | 6.4±1.5(5.4~7.4) | 5.5(4.8~6.8) | 4.8±0.9(4.1~5.4) | |
| b′ | 5.0±0.5(4.3~5.5) | 3.8(2.9~4.1) | 4.2±0.3(3.7~4.5) | 4.37±0.38(3.79~5.01) | 5.4±1.0(4.7~6.1) | 5.0(3.8~6.0) | 3.9±0.2(3.7~4.1) | |
| c | 19.5±0.9(17.9~20.1) | 19(17~22) | 16.9±1.7(15.1~19.4) | 16.33±1.36(14.55~18.55) | 16.8±1.2(15.1~18.3) | 14(12~16) | 14.1±0.9(12.8~14.8) | |
| c′ | 2.3±0.1(2.1~2.4) | — | 2.5±0.4(1.9~3.0) | 2.51±0.30(2.14~3.00) | 2.9±0.4(2.2~3.3) | — | 3.1±0.3(2.9~3.5) | |
| V/% | 59.1±2.9(56.7~63.7) | 59(55~62) | 57.5±3.4(53.7~64.0) | 56.32±1.97(52.98~59.07) | — | — | — | |
| MB/% | 42.6±2.4(40.1~47.7) | — | 40.6±2.8(38.4~45.8) | 48.44±2.24(45.08~51.28) | 50.6±8.7(44.4~56.8) | — | 41±1.5(39.4~42.6) | |
| 口针长/μm Stylet | 20.4±1.0(18.8~21.3) | 20(19~21) | 17.5±0.7(17.0~18.5) | 19.0±0.93(18.00~20.00) | 19.1±1.5(16.8~20.5) | 17(15~19) | 17.5±0.7(17.0~18.5) | |
| DGO/μm | 2.8±0.5(2.2~3.3) | — | 3.3±0.4(2.6~3.8) | 2.56±0.73(2.00~4.00) | 2.7±0.4(2.4~3.4) | — | 2.8±0.1(2.7~2.9) | |
| 肠交接至食道腺末距离/μm Pharyngeal glands overlapping length |
23.7±4.3(16.0~28.0) | — | — | 21.8±5.82(15.00~30.00) | 20.0±0.1(19.9~20.0) | — | — | |
| 中食道球宽/μm Width of oesophageal bulb |
12.3±0.8(11.5~13.5) | — | — | 11.14±0.69(10.00~12.00) | 8.2±0.6(7.7~8.8) | — | — | |
| 中食道球长/μm Length of oesophageal bulb |
17.8±1.5(15.5~19.7) | — | — | 16.14±1.07(15.00~18.00) | 13.5±0.8(12.7~14.2) | — | — | |
| 头前端至排泄孔距离/μm Excretory pore from anterior end |
121.2±10.1(111.0~134.0) | — | 95.8±9.1(80.1~107.3) | 109.00±6.80(102.50~121.25) | 112.0±7.5(105.0~120.0) | — | 97.6±5.1(91.1~101.8) | |
| G1/% | 22.0±1.7(19.0~23.7) | — | 24.3±2.6(19.8~26.7) | 25.60±2.87(19.93~28.87) | — | — | — | |
| G2/% | 18.9±3.1(15.2~22.1) | — | 21.5±2.9(17.8~24.9) | 25.77±4.37(21.40~30.14) | — | — | — | |
| 尾长/μm Tail length | 42.7±2.8(39.2~46.7) | — | 39.3±4.2(34.3~45.6) | 44.22±5.30(37.50~52.50) | 40.4±4.5(35.6~47.1) | — | — | |
| 肛门处体宽/μm Body width at anus | 18.5±1.6(15.1~19.7) | — | — | 17.69±1.96(15.00~20.00) | 14.2±2.1(11.6~16.6) | — | — | |
| 透明尾长/μm Hyaline tail length | 10.7±0.3(10.3~11.1) | — | 7.8±1.6(5.2~10.0) | 9.57±1.04(8.00~11.00) | — | — | 9.1±0.5(8.1~9.6) | |
| 交合刺长/μm Spicule length | — | — | — | — | 20.9±1.8(19.3~23.5) | 21(18~23) | 23.4±0.7(22.9~23.9) | |
| 引带长/μm Gubernaculum length | — | — | — | — | 6.5±0.4(6.0~7.1) | 7(6~8) | 6.7±0.7(6.0~7.5) | |
| 注:n代表样本数; L为体长; a为体长与最大体宽的比值; b为体长与头端至食道与肠连接处长度的比值; c为体长与尾长的比值; c′为尾长与肛门处体宽的比值; V为阴门至头端的长度与体长的比值×100;MB为头端至中食道球中央的距离与体长的比值×100;DGO为背食道腺开口至口针基部球的距离; G1为阴门至前生殖腺末端的距离与体长的比值×100;G2为阴门至后生殖腺末端的距离与体长的比值×100。 Note:n=Number of specimens; L=Total body length; a=Body length/body width; b=Body length/distance from anterior end to junction of oesophagus and intestine; b′=Body length/distance from anterior end to pharyngeal glands end; c=Body length/tail length; c′=Tail length/body width at anus; V=Distance of vulva from anterior end/body length×100;MB=oesophageal bulb from anterior end/body length×100;DGO=Dorsal pharyngeal gland opening from stylet konbs; G1=Distance from anterior genital branch/body length×100;G2=Distance from posterior genital branch/body length×100. |
||||||||
对青海线虫群体永久玻片进行形态特征观察, 光学显微照片见图 1, 形态特征描述如下:

|
图 1 光尾短体线虫的光学显微镜照片 Fig. 1 Light photomicrographs of P. leiocauda A.雌虫整体Female entire body; B.雄虫整体Male entire body; C.侧线Lateral line; D.雌虫体前端Anterior body of female; E.雌虫头部Female head region; F.雄虫头部Male head region; G.雌虫食道腺Female pharyngeal glands; H.雄虫食道腺Male pharyngeal glands; I.雌虫生殖管Female gonad; J-L.雌虫尾Female tail; M, N.雄虫尾Male tail; O.交合刺Spicule.标尺Scar bar=10 μm. |
雌虫:杀死固定后, 虫体腹弯呈阔“C”型, 虫体较大(图 1-A)。体环明显, 侧区6条侧线(图 1-C)。唇区无明显缢缩, 前端较平, 宽9.1~11.1 μm, 高3.4~5.1 μm, 有3~4个唇环, 头架中等发达; 口针强壮, 长18.8~21.3 μm, 锥部长9.8~12.1 μm, 占口针总长的50%~60%;口针基部球发达, 阔圆形, 明显向后倾斜(图 1-D、E)。背食道腺开口位于口针基部球后2.2~3.3 μm; 中食道球发达, 椭圆形, 占该处体宽的1/2, 瓣门明显; 食道腺双叶状, 背侧覆盖肠端, 覆盖长为最大体宽的1~2倍; 背食道腺核位于食道腺与肠交接处之前, 至少有1个亚腹食道腺核位于肠与食道腺交接处后方(图 1-D、G)。半月体2~3个体环长, 位于距头端107.8~124.0 μm处; 排泄孔发达, 位于半月体后2~3个体环处(图 1-D); 双生殖管, 卵母细胞单行排列, 受精囊圆形, 其中包含卵圆形精子, 阴门位于虫体中部(图 1-I)。尾圆柱形, 尾部环纹16~21个, 末端宽圆, 无环纹或具1~3条不规则环纹(图 1-J、K、L)。
雄虫:杀死固定后虫体略向腹弯(图 1-B)。侧区6条侧线。虫体前部的形态与雌虫基本相似, 唇区较雌虫窄且高(图 1-F), 食道腺及中食道球不发达(图 1-H)。单精巢前伸, 精子卵圆形。尾部呈圆锥形, 向尾端渐细, 末端较钝, 交合刺略弯曲, 长19~23 μm, 一般不伸出泄殖腔口, 引带长6.0~7.1 μm, 交合伞较大, 包裹至尾端(图 1-M、N、O)。
2.2 青海线虫群体的分子特征分析拟短体线虫属种类间的形态特征差别比较细微, 近似种之间较难区分, 仅靠形态学鉴定难度较大, 因此对青海线虫群体进行分子生物学特征鉴定。青海群体18S序列长度为1 456 bp, GenBank登录号为MN510991。用贝叶斯法构建的18S区序列系统进化树(图 2)显示:青海群体形成1个单独小支, 与阿尔肯拟短体线虫、齿尾拟短体线虫(P.crenicauda)、埃尔祖鲁姆拟短体线虫、耐瓦登拟短体线虫(P.nevadensis)以及里特拟短体线虫等聚类在1个大分支上, 且这些拟短体线虫与内格尔线虫属(Nagelus)、大默林线虫属、默林线虫属、居中线虫属(Geocenamus)以及楯垫线虫属成员亲缘关系较近。
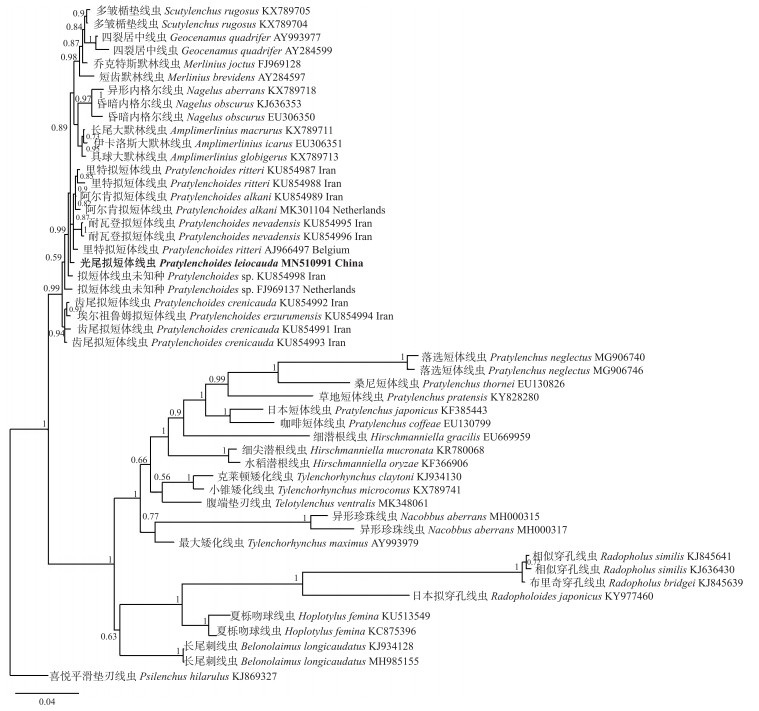
|
图 2 基于rDNA 18S区序列构建的拟短体属线虫系统进化树 Fig. 2 Phylogeny tree of Pratylenchoides populations based on partial rDNA 18S sequences |
青海线虫群体测序所得28S-D2/D3序列长度为776 bp, GenBank登录号为MN510993。用贝叶斯法构建的28S-D2/D3区序列系统进化树(图 3)显示:青海群体与1种拟短体线虫中国群体(KY424321)聚类在1个单独小支上, 与阿尔肯拟短体线虫、齿尾拟短体线虫、埃尔祖鲁姆拟短体线虫、侧尾拟短体线虫、大尾拟短体线虫、耐瓦登拟短体线虫、波斯拟短体线虫、里特拟短体线虫、尤他拟短体线虫以及多变拟短体线虫等聚类在1个大分支上, 而且这些拟短体线虫与内格尔线虫属、大默林线虫属、默林线虫属、居中线虫属以及楯垫线虫属成员亲缘关系较近。
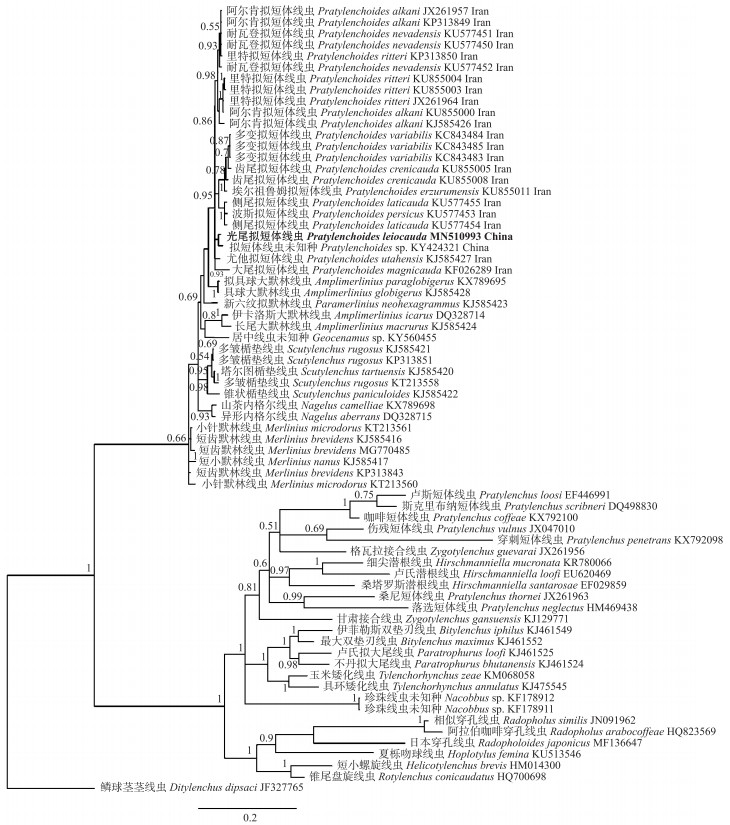
|
图 3 基于rDNA 28S-D2/D3区序列构建的拟短体属线虫系统进化树 Fig. 3 Phylogeny tree of Pratylenchoides populations based on partial rDNA 28S-D2/D3 sequences |
青海线虫群体测序所得ITS序列长度为842 bp, GenBank登录号为MT509390。用最大似然法构建的ITS区序列系统进化树(图 4)显示:青海群体与1种拟短体线虫中国群体(KY424249)聚类在1个单独的小支上, 与另外2个拟短体线虫韩国群体(KY468918、KY468919)聚类在1个大分支上, 而且这些拟短体线虫与大默林线虫属、默林线虫属、居中线虫属以及螺旋线虫属(Helicotylenchus)成员亲缘关系较近。
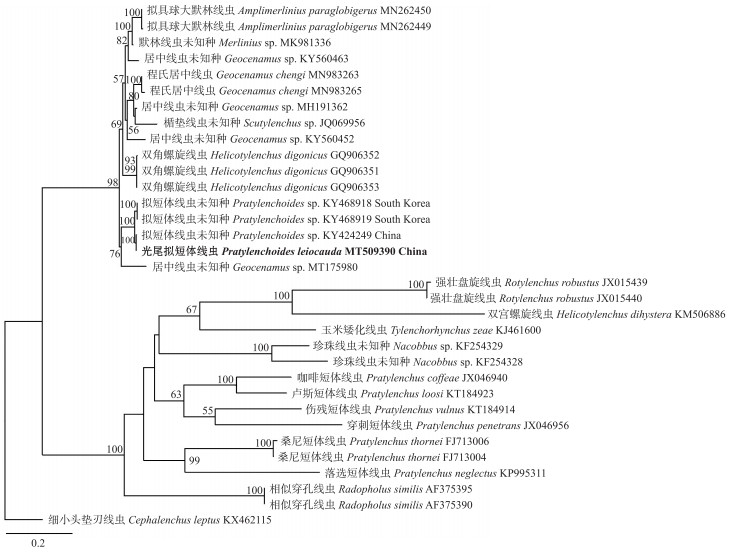
|
图 4 基于rDNA ITS区序列构建的拟短体属线虫系统进化树 Fig. 4 Phylogeny tree of Pratylenchoides populations based on partial rDNA ITS sequences |
根据拟短体线虫属种类的鉴别特征:侧线数、唇环数、口针长度、口针基部球形态、食道腺形态、尾部形态以及尾纹数等[3], 通过拟短体线虫属检索表[2]发现青海群体特征符合原始描述中光尾拟短体线虫法国杂草群体的基本特征, 将青海群体与法国杂草群体[36], 以及我国辽宁草莓群体[20]和辽宁马铃薯群体[21]进行核查和比对分析, 发现除青海群体个别测计值范围大于其他群体外, 大部分测计值范围基本重叠, 考虑到这可能是由于不同地理来源的种群间存在差异所致, 因此将青海群体鉴定为光尾拟短体线虫。
拟短体属线虫的食道腺存在明显分化, 是十分重要的分类特征[3], 可分为4个类型:1)3个食道腺细胞核均位于食道与肠交接之前, 食道腺不覆盖或稍覆盖肠端, 覆盖长度为0.5倍体宽; 2)背食道腺细胞核位于食道与肠交接处之前, 至少有1个亚腹食道腺细胞核位于食道与肠交接处之后, 食道腺覆盖长度为0.5~1.5倍体宽; 3)背食道腺细胞核位于食道与肠交接处之前或水平处, 2个亚腹食道腺细胞核位于食道与肠交接处之后, 食道腺覆盖长度为1.5~3.0倍体宽; 4)3个食道腺细胞核均位于食道与肠交接处之后, 食道腺覆盖长度至少为3倍体宽。光尾拟短体线虫青海群体的食道腺形态属于第2种类型, 此外根据头区形态及唇环数等特征, 光尾拟短体线虫与卡马乔拟短体线虫(P. camachoi)[37]、齿尾拟短体线虫[36]及侧尾拟短体线虫[38]这3个种最为相近, 形态特征较难区分, 容易混淆。
光尾拟短体线虫与卡马乔拟短体线虫[37]的区别如下:1)光尾拟短体线虫口针为19~21 μm, 而卡马乔拟短体线虫口针为21~25 μm, 且十分强壮; 2)光尾拟短体线虫雄虫尾圆锥形, 而卡马乔拟短体线虫雄虫尾圆柱形或棍棒形; 3)光尾拟短体线虫雄虫交合刺长19~23 μm, 而卡马乔拟短体线虫交合刺长24~28 μm。
光尾拟短体线虫与齿尾拟短体线虫[36]的区别如下:1)光尾拟短体线虫受精囊明显, 其中包含着卵圆形的精子, 而齿尾拟短体线虫受精囊通常不明显, 精子圆形; 2)光尾拟短体线虫尾环数为19~21个, 尾部末端或具1~3条不规则环纹, 而齿尾拟短体线虫尾环数为28~36个, 尾部末端具有明显的环纹。
光尾拟短体线虫与侧尾拟短体线虫[38]的区别如下:1)光尾拟短体线虫口针为19~21 μm, 而侧尾拟短体线虫口针为23~24 μm; 2)光尾拟短体线虫口针基部球阔圆形, 明显向后倾斜, 而侧尾拟短体线虫口针基部球凸缘状, 稍向后倾斜; 3)光尾拟短体线虫尾圆柱形, 末端无环纹或具1~3条不规则环纹, 而侧尾拟短体线虫尾部圆柱形或棍棒形, 末端粗糙, 具不规则条纹; 4)光尾拟短体线虫交合刺长19~23 μm, 而侧尾拟短体线虫交合刺长24~28 μm。
从18S、28S-D2/D3和ITS系统进化树可以看出, 青海线虫群体与拟短体线虫各种类都聚类在一大分支, 各小分支之间距离也十分相近。然而, 青海群体的形态特征明显有别于上述拟短体线虫种类, 青海群体雌虫尾部形态与阿尔肯拟短体线虫、埃尔祖鲁姆拟短体线虫以及里特拟短体线虫不同, 青海群体雌虫尾末端光滑, 无环纹或有1~3条不规则环纹, 而阿尔肯拟短体线虫、埃尔祖鲁姆拟短体线虫以及里特拟短体线虫的雌虫尾末端粗糙, 有不规则环纹[3]。此外, 青海群体的食道腺特征属于第2类型, 而大尾拟短体线虫、耐瓦登拟短体线虫、尤他拟短体线虫以及多变拟短体线虫的食道腺特征均属于第3类型[3], 波斯拟短体线虫的食道腺特征属于第1类型[15]。
综合形态学特征比较以及分子特征分析的结果, 青海番茄根围土中分离到的拟短体线虫种类鉴定为光尾拟短体线虫。
3 讨论拟短体线虫与短体线虫(Pratylenchus spp.)引起地下根组织腐烂坏死的危害方式一样, 主要寄生在根的皮层组织, 引起根系表皮破损和内部组织的腐烂, 并且能诱发土壤中其他病原真菌或细菌对作物的二次侵染, 严重时会在根组织表面产生大的连片病斑[17]。光尾拟短体线虫在豆类、小麦、牧草等作物上均有报道, 并发现该线虫与阿尔及利亚豆类作物的减产有一定关联性[12]。2005年从沈阳草莓根际[20]和2012年从沈阳马铃薯根际[21]分别发现过该线虫并进行了形态描述, 但缺少相关的分子信息。本文将青海群体与沈阳的2个群体进行形态特征比较, 除个别测计值存在一定差异外, 大部分测计值范围基本重叠, 均符合原始文献中关于光尾拟短体线虫的形态描述; 并进行光尾拟短体线虫与近似种的形态特征比较, 对光尾拟短体线虫的分子生物学信息进行补充, 完善了该线虫的种类鉴定信息。
基于18S、28S以及ITS序列构建的系统进化树均显示光尾拟短体线虫青海群体与拟短体线虫属其他成员聚类为一支, 并且与默林线虫科成员内格尔线虫属、大默林线虫属、默林线虫属、居中线虫属以及楯垫线虫属相距较近, 但与短体线虫科成员相聚较远, 无明显近缘关系。本研究进一步证实拟短体线虫与默林线虫科的近缘关系, 与Azizi等[3]的结果相一致, 支持了拟短体线虫属隶属于默林线虫科的分类新地位。
虽然前人在沈阳草莓和马铃薯根际土壤中曾经分离到光尾拟短体线虫, 但是并没有描述该线虫对这2种作物的危害情况。我们从青海西宁市长势衰弱并伴有萎蔫及黄化症状的番茄植株根系及根际土样中分离到少量的光尾拟短体线虫, 但其对番茄植株的致病性还有待进一步研究。拟短体线虫的侵染危害方式与短体属线虫类似, 而短体线虫侵染和破坏寄主植物根系引起腐烂, 造成严重的产量损失, 因此有必要进一步了解光尾拟短体线虫在我国的分布范围以及对寄主植物的危害程度, 为今后更好地控制我国农作物根部线虫病害提供理论依据。
| [1] |
Di Vito M, Greco N, Ores G, et al. Plant parasitic nematodes of legumes in Turkey[J]. Nematologia Mediterranea, 1994, 22(2): 245-251. |
| [2] |
Geraert E. The Pratylenchidae of the World:Identification of the Family Pratylenchidae(Nematoda:Tylenchida)[M]. Ghent: Academia Press, 2013: 123-168.
|
| [3] |
Azizi K, Eskandari A, Karegar A, et al. Morphological and molecular data support the monophyletic nature of the genus Pratylenchoides Winslow, 1958(Nematoda:Merliniidae)and reveal its intrageneric structuring[J]. Nematology, 2016, 18(10): 1165-1183. DOI:10.1163/15685411-00003023 |
| [4] |
Winiszewska G, Dobosz R, Malewski T, et al. Description of Pratylenchoides ojcowensis sp. nov.(Nematoda:Merlinidae)from Polish Jurassic Highland[J]. Zootaxa, 2020, 4742(1): 117-128. DOI:10.11646/zootaxa.4742.1.7 |
| [5] |
Tzortzakakis E A, Cantalapiedra-Navarrete C, Kormpi M, et al. First report of Bitylenchus hispaniensis, Pratylenchoides alkani, and Helicotylenchus vulgaris in association with cultivated and wild olives in Crete, Greece and molecular identification of Helicotylenchus microlobus and Merlinius brevidens[J]. Journal of Nematology, 2018, 50(3): 413-418. DOI:10.21307/jofnem-2018-020 |
| [6] |
Uludamar E B K, Yildiz Ş, Imren M, et al. Occurrence of plant parasitic nematode species in important crops in the Southeast Anatolia Region of Turkey[J]. Turkish Journal of Entomology, 2018, 42(1): 63-74. DOI:10.16970/entoted.359616 |
| [7] |
Geraert E, Choi Y E, Choi D R. New tylenchs(Nematoda)from Korea[J]. Nematologica, 1990, 36(1): 273-291. |
| [8] |
Yildiz S, Handoo Z A, Carta L K, et al. A survey of plant-parasitic nematodes associated with forage crops in Bingol, Turkey[J]. Nematologia Mediterranea, 2012, 40(1): 73-77. |
| [9] |
Ghaderi R, Karegar A, Niknam G, et al. Phylogenetic relationships of Telotylenchidae Siddiqi, 1960 and Merliniidae Siddiqi, 1971(Nematoda:Tylenchida)from Iran, as inferred from the analysis of the D2D3 expansion fragments of 28S rRNA gene sequences[J]. Nematology, 2014, 16(7): 863-877. DOI:10.1163/15685411-00002815 |
| [10] |
Troccoli A, Vovlas N, Castillo P. Pratylenchoides hispaniensis n. sp.(Nemata:Pratylenchidae)[J]. Journal of Nematology, 1997, 29(3): 349-355. |
| [11] |
Lišková M, Sasanelli N, D'Addabbo T. Some notes on the occurrence of plant parasitic nematodes on fruit trees in Slovakia[J]. Plant Protection Science, 2007, 43(1): 26-32. |
| [12] |
Di Vito M, Greco N, Halila H M, et al. Nematodes of cool-season food legumes in North Africa[J]. Nematologia Mediterranea, 1994, 22(1): 3-10. |
| [13] |
Budurova L, Baicheva O, Milkova M. Formation of the wheat nematode fauna under monoculture conditions in the region of Razgrad[J]. Biotechnology and Biotechnolgical Equipment, 1996, 10(2/3): 34-37. |
| [14] |
Navas A, Talavera M. Incidence of plant-parasitic nematodes in natural and semi-natural mountain grassland and the host status of some common grass species[J]. Nematology, 2002, 4(4): 541-552. DOI:10.1163/156854102760290518 |
| [15] |
Azizi K, Eskandari A, Karegar A, et al. Morphological and molecular characterization of Pratylenchoides persicus n. sp.(Nematoda:Merliniidae)and additional data on two other species of the genus from Iran[J]. Zootaxa, 2016, 4205(5): 459-474. DOI:10.11646/zootaxa.4205.5.4 |
| [16] |
Ghaderi R, Karegar A, Niknam G. An updated and annotated checklist of the Dolichodoridae(Nematoda:Tylenchoidea)of Iran[J]. Zootaxa, 2014, 3784(4): 445-468. DOI:10.11646/zootaxa.3784.4.5 |
| [17] |
刘维志. 植物线虫志[M]. 北京: 中国农业出版社, 2004: 165-170. Liu W Z. Plant Nematode Sinica[M]. Beijing: China Agriculture Press, 2004: 165-170 (in Chinese). |
| [18] |
刘维志, 段玉玺, 赵洪海, 等. 我国北方地区玉米根寄生线虫的种类鉴定研究[J]. 玉米科学, 1996, 4(4): 65-67. Liu W Z, Duan Y X, Zhao H H, et al. Species of the nematode associated with the corn roots from northern China[J]. Maize Science, 1996, 4(4): 65-67 (in Chinese with English abstract). |
| [19] |
张绍升, 章淑玲. 拟短体线虫属一新种[J]. 植物病理学报, 2003, 33(4): 317-322. Zhang S S, Zhang S L. Description of Pratylenchoides batatae n. sp.(Nematoda:Pratylenchidae)[J]. Acta Phytopathologica Sinica, 2003, 33(4): 317-322 (in Chinese with English abstract). |
| [20] |
闫超杰, 段玉玺, 陈立杰. 草莓寄生线虫新记录种——光尾拟短体线虫[J]. 沈阳农业大学学报, 2005, 36(3): 301-303. Yan C J, Duan Y X, Chen L J. A new recorded species of strawberry parasitic nematodes:Pratylenchoides leiocauda Sher, 1970[J]. Journal of Shenyang Agricultural University, 2005, 36(3): 301-303 (in Chinese with English abstract). |
| [21] |
徐春玲, 陈淳, 周春娜, 等. 马铃薯根际3种植物线虫种类记述[J]. 华南农业大学学报, 2012, 33(2): 167-170. Xu C L, Chen C, Zhou C N, et al. Description of three new recorded species of plant parasitic nematodes extracted from rhizosphere of potato in China[J]. Journal of South China Agricultural University, 2012, 33(2): 167-170 (in Chinese with English abstract). |
| [22] |
闫超杰, 段玉玺, 李俊环. 棒尾拟短体线虫记述[J]. 动物分类学报, 2009, 34(2): 397-400. Yan C J, Duan Y X, Li J H. Description of Pratylenchoides clavicauda[J]. Acta Zootaxonomica Sinica, 2009, 34(2): 397-400 (in Chinese). |
| [23] |
Loof P A A. The family Pratylenchidae[M]//Manual of Agricultural Nematology. New York:Marcel Dekker, 1991:363-421.
|
| [24] |
Ryss A Y. Phylogeny of the order Tylenchida(Nematoda)[J]. Russian Journal of Nematology, 1993, 1(2): 74-95. |
| [25] |
Sturhan D. Contribution to a revision of the family Merliniidae Ryss, 1998, with proposal of Pratylenchoidinae subfam. n., Paramerlinius gen. n., Macrotylenchus gen. n. and description of M. hylophilus sp. n.(Tylenchida)[J]. Journal of Nematode Morphology and Systematics, 2012, 15(2): 127-147. |
| [26] |
Whitehead A G, Hemming J R. A comparison of some quantitative methods of extracting small vermiform nematodes from soil[J]. Annals of Applied Biology, 1965, 55(1): 25-38. DOI:10.1111/j.1744-7348.1965.tb07864.x |
| [27] |
Seinhorst J W. A rapid method for the transfer of nematodes from fixative to anhydrous glycerin[J]. Nematologica, 1959, 4(1): 67-69. DOI:10.1163/187529259X00381 |
| [28] |
谢辉. 植物线虫分类学[M]. 2版. 北京: 高等教育出版社, 2005: 38-41. Xie H. Taxonomy of Plant Nemadodes[M]. 2nd ed. Beijing: Higher Education Press, 2005: 38-41 (in Chinese). |
| [29] |
王江岭, 张建成, 顾建锋. 单条线虫DNA提取方法[J]. 植物检疫, 2011, 25(2): 32-35. Wang J L, Zhang J C, Gu J F. Method of extract DNA from a single nematode[J]. Plant Quarantine, 2011, 25(2): 32-35 (in Chinese with English abstract). |
| [30] |
Holterman M, van der Wurff A, van der Elsen S, et al. Phylum-wide analysis of SSU rDNA reveals deep phylogenetic relationships among nematodes and accelerated evolution toward crown clades[J]. Molecular Biology and Evolution, 2006, 23(9): 1792-1800. DOI:10.1093/molbev/msl044 |
| [31] |
de Ley P, Félix M A, Frisse L M, et al. Molecular and morphological characterisation of two reproductively isolated species with mirror-image anatomy(Nematoda:Cephalobidae)[J]. Nematology, 1999, 1(6): 591-612. DOI:10.1163/156854199508559 |
| [32] |
何洁, 顾建锋. 松材线虫组DNA条形码筛选[J]. 植物检疫, 2016, 30(1): 14-20. He J, Gu J F. Screening DNA barcode markers for the xylophilus group of the genus Bursaphelenchus[J]. Plant Quarantine, 2016, 30(1): 14-20 (in Chinese with English abstract). |
| [33] |
Ye W M, Giblin-Davis R M, Braasch H, et al. Phylogenetic relationships among Bursaphelenchus species(Nematoda:Parasitaphelenchidae)inferred from nuclear ribosomal and mitochondrial DNA sequence data[J]. Molecular Phylogenetics and Evolution, 2007, 3(43): 1185-1197. |
| [34] |
Wang Z, Bert W, Gu J F, et al. Aphelenchoides medicagus n. sp.(Tylenchina:Aphelenchoididae)found in Medicago sativa imported into China from the USA[J]. Nematology, 2019, 21(7): 709-723. DOI:10.1163/15685411-00003247 |
| [35] |
Huelsenbeck J P, Rannala B. Phylogenetic methods come of age:testing hypotheses in an evolutionary context[J]. Science, 1997, 276(5310): 227-232. DOI:10.1126/science.276.5310.227 |
| [36] |
Sher S A. Revision of the genus Pratylenchoides Winslow, 1958(Nematoda:Tylenchoidea)[J]. Proceedings of the Helminthological Society of Washington, 1970, 37(2): 154-165. |
| [37] |
Gomez Barcina A, Castillo P, Gonzalez Pais M A. Description of Pratylenchoides camachoi n. sp.(Tylenchida:Pratylenchidae)from Spain[J]. Journal of Nematology, 1990, 22(2): 214-219. |
| [38] |
Braun A L, Loof P A A. Pratylenchoides laticauda n. sp., a new endoparasitic phytonematode[J]. Netherlands Journal of Plant Pathology, 1966, 72: 241-245. DOI:10.1007/BF02650210 |




