文章信息
- 毛志强, 焦姣, 魏婷婷, 王宇, 王悦, 赵宪成, 周繁
- MAO Zhiqiang, JIAO Jiao, WEI Tingting, WANG Yu, WANG Yue, ZHAO Xiancheng, ZHOU Fan
- 一种新型生物延缓剂对小麦穗发芽及其籽粒品质的影响
- Effect of biological retardant on the pre-harvest sprouting and quality of wheat grains
- 南京农业大学学报, 2020, 43(6): 998-1005
- Journal of Nanjing Agricultural University, 2020, 43(6): 998-1005.
- http://dx.doi.org/10.7685/jnau.202004011
-
文章历史
- 收稿日期: 2020-04-08
穗发芽(pre-harvest sprouting, PHS)是指小麦在收获前期遭遇连续阴雨天气而导致穗部籽粒发芽的现象, 是小麦产区面临的世界性农业气候挑战之一[1-2]。小麦穗发芽会导致产量损失6%~10%, 且发芽的小麦不能用于制种和制粉, 仅能作为饲料, 造成经济效益减少20%~50%[3-4]。因此, 延缓小麦穗发芽已成为农业育种和栽培研究的主要研究方向。
作为一个世界性的农业问题, 近几十年来国内外学者对小麦穗发芽进行了大量研究, 包括外部环境、种子自身的特性、生理机制及基因调控等方面, 并得出了许多重要的结论。影响小麦穗发芽的外部环境包括水分、温度、湿度、土壤条件等。空气湿度大、种子水分含量过高会导致小麦种子吸水膨胀皮层软化, 储藏物质被水解成可溶性物质[5-6]。在小麦穗发芽的生理机制研究中, 发现水解酶在小麦种子发芽过程中起重要作用, 其中α-淀粉酶活性可作为鉴定小麦穗发芽抗性的一个关键因素[7]。在小麦发芽过程中α-淀粉酶通过水解淀粉中的α-1, 4-葡萄糖苷键, 将淀粉水解成长度不同的短链糊精和可溶性糖类, 并且小麦种子的发芽率与α-淀粉酶活性呈显著正相关[8-10]。Appleford等[11]和Pérez-Flores等[12]研究发现α-淀粉酶的合成也会受到赤霉素(GA)和脱落酸(ABA)的调控, ABA可通过关闭α-淀粉酶基因的转录来抑制α-淀粉酶合成, 而GA可诱导α-淀粉酶合成。因此, 抑制或降低小麦籽粒的内源α-淀粉酶活性是解决小麦穗发芽的一个主要途径。
穗发芽不仅降低小麦的产量, 而且严重影响小麦的加工品质和种用价值[13]。研究发现穗发芽小麦蛋白质含量显著降低, 并且随发芽程度加剧蛋白含量不断降低, 且面筋品质劣化, 网络结构松散, 面团黏性降低[14-17]。除此之外, 小麦千粒质量、出粉率[18]等指标也会因为小麦穗发芽而降低。
针对小麦穗发芽这一农业问题, 国内外学者已经从分子育种、栽培方式等方面进行解决, 虽然取得了一些成绩, 但仍面临严峻的挑战[3, 9-21]。在生产上, 化学调控也是一种比较有效的方式, 通过喷施外源化学物质来调节作物体内的酶代谢过程及激素平衡, 从而降低穗发芽的发生概率[22]。小麦穗发芽延缓剂多为生长抑制剂和激素类药剂, 且市场上延缓小麦穗发芽的产品较少, 主要包括青鲜素、烯效唑、脱落酸。尽管农民尝试一些延缓剂用于穗发芽的防治, 但是效果不明显且成本较高, 即使药剂显著抑制了穗发芽, 但籽粒的发育也会受到影响, 且药剂浓度高将导致作物种子失活[22-23]。针对上述情况, 本试验采用自主合成的一种生物延缓剂, 探究该生物延缓剂对小麦穗发芽的影响及其对籽粒品质的影响, 为产品的研发和推广奠定基础。
1 材料与方法 1.1 试验材料与试验设计试验于2019年6—11月在沈阳化工研究院实验室中进行, 供试小麦品种为‘泛麦8号’, 取自河南省开封市祥符区半坡店乡(114°26′E, 34°45′N), 2018—2019年生长季田间管理方法与当地相同, 于小麦籽粒蜡熟期取样, 取样时保留茎秆和根系, 7 d后进行穗发芽诱导。
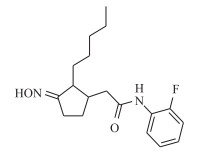
生物延缓剂为化学合成的化合物(E)-N-(2-氟苯基)-2-(3-(羟亚胺)-2-戊基环戊基)乙酰胺。根据浓度筛选预试验, 本研究共设置5个试验处理和5个取样时间。5个处理分别为CK(清水)、P(1%二甲基亚砜)、P+D(1%二甲基亚砜+0.1%渗透剂)、T2(1 500 mg·L-1生物延缓剂+1%二甲基亚砜+0.1%渗透剂)、M4(1 200 mg·L-1茉莉酸甲酯+1%二甲基亚砜+0.1%渗透剂); 取样时间:分别在浸种4 h后的12、24、48、72、84 h取样分析, 每个处理3次重复, 样本量为320个麦穗。生物延缓剂为茉莉酸甲酯功能类似物, 阳性对照药剂为茉莉酸甲酯(MeJA)。生物延缓剂结构如下:
|
麦穗经过不同处理溶液浸泡后, 分别在12、24、36、60、84 h统计小麦种子发芽率, 每个处理5个生物学重复。经过处理后不同时间点的麦穗放到烘箱烘干, 统计小麦籽粒的千粒质量。
1.2.2 小麦支链淀粉、直链淀粉及总淀粉含量小麦籽粒中总淀粉、直链淀粉和支链淀粉含量参照Jiang等[24]和Zhang等[25]的方法测定。
1.2.3 小麦α-淀粉酶活性和降落数值α-淀粉酶活性采用α-淀粉酶试剂盒(苏州科铭生物技术有限公司生产)测定。参照《谷物降落数值测定法:GB/T 10361—1989》, 采用Perten 1700型降落数值仪(Perten, 瑞士)测定降落数值。
1.2.4 小麦蛋白质及其组分含量参照《现代植物生理学实验指南》[26]提取蛋白组分, 参照《谷类、豆类作物种子粗蛋白质测定法:GB/T 2905—1982》测定蛋白质含量。
1.2.5 小麦粉SDS-沉降值及面筋含量参照《小麦粉沉淀值测定法:GB/T 15685—1995》测定小麦粉SDS-沉降值; 参照《小麦粉干面筋测定法:GB/T 14607—1993》测定小麦面筋含量。
1.3 数据分析采用Excel 2010软件进行数据处理, 用Sigmaplot 10.0作图, 用SPSS 20.0统计分析软件进行差异显著性检验(LSD法, α=0.05)。每个试验处理设3次生物学重复。
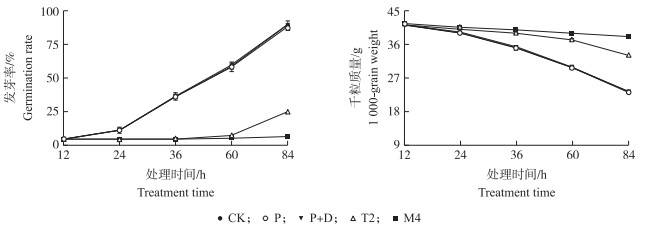
2 结果与分析 2.1 生物延缓剂对小麦种子发芽率及千粒质量的影响由图 1可知:随诱导穗发芽时间的增加, 各处理的种子发芽率均表现出增加的趋势, CK、P和P+D的发芽率基本相同, 表明1%二甲基亚砜和0.1%渗透剂对种子活力不产生影响。T2和M4与CK相比小麦种子的发芽率显著降低, 其中T2在诱导36 h后种子开始萌发, 种子发芽延缓了24~32 h, 而M4在诱导84 h后发芽率仅有1.99%, 虽然抑制了穗发芽, 但是小麦种子已经失去活力。不同处理种子的千粒质量随诱导穗发芽时间的增加呈现降低趋势, CK、P和P+D的千粒质量降低最明显。在84 h时T2的千粒质量减少21.09%。M4由于种子失去活性, 降低的千粒质量仅减少8.32%, 与CK相比差异显著。
|
图 1 生物延缓剂对小麦种子发芽率和千粒质量的影响 Fig. 1 Effect of biological retardant on germination rate and 1 000-grain weight of wheat seed CK、P、P+D、T2、M4分别表示清水、1%二甲基亚砜、1%二甲基亚砜+0.1%渗透剂、1 500 mg·L-1生物延缓剂+1%二甲基亚砜+0.1%渗透剂、1 200 mg·L-1茉莉酸甲酯+1%二甲基亚砜+0.1%渗透剂。 CK, P, P+D, T2, M4 represent treatments of water, 1% dimethyl sulfoxide(DMSO), 1% DMSO+0.1% penetrant, 1 500 mg·L-1 biological retardant+1% DMSO+0.1% penetrant, 1 200 mg·L-1 methyl jasmonate+1% DMSO+0.1% penetrant, respectively. |
由图 2可知:随诱导穗发芽时间增加, 各处理α-淀粉酶活性均增加, CK、P和P+D的α-淀粉酶活性升高最为明显, T2和M4的α-淀粉酶活性显著低于CK, 而T2的α-淀粉酶活性较M4显著提高1.31倍。不同处理的降落数值随诱导发芽时间增加呈降低趋势, CK、P、P+D的降低幅度显著大于T2和M4, 且在诱导60 h后达到稳定状态, T2和M4的降落数值在36 h后表现出急剧下降的趋势, T2下降的幅度大于M4。

|
图 2 生物延缓剂对小麦α-淀粉酶活性和降落数值的影响 Fig. 2 Effect of biological retardant on the activity of α-amylase and falling number of wheat |
由表 1可见:随诱导发芽时间增加, 不同处理小麦籽粒的总淀粉、直链淀粉和支链淀粉含量均下降, 其中总淀粉和支链淀粉含量降低幅度大于直链淀粉含量。CK、P、P+D的总淀粉含量差异均不显著, 在84 h时分别降低32.07%、30.95%和30.92%。T2、M4在36 h后的总淀粉含量降低明显, 其中T2的总淀粉含量在60和84 h分别降低9.72%和16.15%, M4的在60和84 h降低3.73%和7.32%, 均与CK、P、P+D差异显著, 且T2与M4间差异显著。不同处理穗发芽诱导后的支链淀粉含量与总淀粉含量表现出相同的趋势, 在84 h时T2、M4的支链淀粉含量与CK差异显著, 且T2与M4间差异显著。不同处理间的直链淀粉含量未表现显著降低的趋势, 说明小麦穗发芽对总淀粉和支链淀粉的影响较明显, 对直链淀粉的影响较小。
| 处理时间/h Treatment time |
处理 Treatment |
总淀粉含量/% Total starch content |
支链淀粉含量/% Amylopectin content |
直链淀粉含量/% Amylose content |
| 12 | CK | 61.11±1.20a | 45.58±1.38a | 15.53±0.19a |
| P | 61.14±1.00a | 45.73±3.25a | 15.41±0.47a | |
| P+D | 60.99±1.56a | 45.34±1.87a | 15.65±0.91a | |
| T2 | 62.00±0.98a | 46.13±1.37a | 15.88±0.60a | |
| M4 | 62.48±1.63a | 46.51±0.94a | 15.96±0.98a | |
| 24 | CK | 59.02±0.82b | 43.77±2.61ab | 15.25±0.69ab |
| P | 58.63±2.05b | 43.30±2.24b | 15.33±0.64ab | |
| P+D | 58.65±2.09b | 43.63±1.29ab | 15.02±0.79b | |
| T2 | 61.97±0.62ab | 45.81±0.34ab | 16.16±0.53ab | |
| M4 | 63.04±0.29a | 46.77±1.09a | 16.20±0.40a | |
| 36 | CK | 57.55±2.66b | 42.60±2.11b | 14.95±0.58b |
| P | 57.15±2.62b | 42.22±2.12b | 14.94±0.88b | |
| P+D | 56.84±1.44b | 42.22±1.58b | 14.61±0.42b | |
| T2 | 60.89±1.41ab | 45.21±1.10ab | 15.68±0.45ab | |
| M4 | 62.89±1.37a | 46.69±1.64a | 16.13±0.60a | |
| 60 | CK | 47.87±0.43c | 33.52±0.63c | 14.35±0.60b |
| P | 48.82±0.95c | 34.06±0.44c | 14.77±0.66b | |
| P+D | 48.64±0.95c | 34.17±0.86c | 14.47±0.61b | |
| T2 | 55.97±0.82b | 40.97±1.17b | 15.00±0.23ab | |
| M4 | 60.15±0.47a | 44.25±1.18a | 15.90±0.51a | |
| 84 | CK | 41.51±1.43c | 27.35±1.10c | 14.16±0.60b |
| P | 42.22±1.48c | 28.15±1.10c | 14.07±0.77b | |
| P+D | 42.14±0.46c | 27.97±0.86c | 14.16±0.24b | |
| T2 | 51.99±0.72b | 37.24±1.74b | 14.74±0.54ab | |
| M4 | 57.90±0.18a | 42.21±0.22a | 15.69±0.73a | |
| 注:不同小写字母表示处理间差异显著(P<0.05)。下同。 Note:The different lowercase letters indicate significant difference at 0.05 level. The same as follows. | ||||
由表 2可见:随诱导穗发芽时间增加, 不同处理小麦籽粒总蛋白含量均减少。在蛋白组分中, 醇溶蛋白和谷蛋白含量降低, 而清蛋白和球蛋白含量增加。CK、P、P+D的总蛋白含量差异不显著, 而T2和M4的总蛋白含量与CK相比差异显著, 在60和84 h时分别降低1.56%、0.52%和3.17%、1.58%, 且T2和M4间差异不显著。不同处理的清蛋白和球蛋白含量在12、24、36 h差异不显著, CK、P、P+D在84 h时清蛋白和球蛋白含量分别增加11.37%~16.76%和8.16%~8.88%, 而T2的清蛋白和球蛋白含量分别增加6.06%和2.42%, M4增加2.39%和0.57%。不同处理小麦的醇溶蛋白和谷蛋白含量随诱导发芽时间的增加呈现下降的趋势, 在84 h时T2和M4与CK相比差异显著, 但T2和M4差异不显著。T2的醇溶蛋白和谷蛋白含量分别降低5.95%和6.86%, 谷蛋白降低的幅度大于醇溶蛋白, 表明谷蛋白受发芽的影响更明显。
| 处理时间/h Treatment time |
处理 Treatment |
清蛋白含量/% Albumin content |
球蛋白含量/% Globulin content |
醇溶蛋白含量/% Gliadin content |
谷蛋白含量/% Glutelin content |
总蛋白含量/% Total protein content |
| 12 | CK | 2.45±0.19a | 2.06±0.10a | 3.51±0.14a | 4.37±0.22a | 13.55±0.40a |
| P | 2.37±0.14a | 2.04±0.12a | 3.47±0.14a | 4.40±0.12a | 13.50±0.25a | |
| P+D | 2.34±0.10a | 2.11±0.12a | 3.55±0.12a | 4.36±0.24a | 13.48±0.44a | |
| T2 | 2.37±0.07a | 2.10±0.12a | 3.50±0.14a | 4.36±0.32a | 13.50±0.40a | |
| M4 | 2.39±0.11a | 2.08±0.04a | 3.52±0.17a | 4.48±0.18a | 13.52±0.47a | |
| 24 | CK | 2.40±0.12a | 2.08±0.12a | 3.49±0.11a | 4.34±0.21a | 13.43±0.37a |
| P | 2.42±0.14a | 2.06±0.10a | 3.48±0.11a | 4.42±0.21a | 13.48±0.45a | |
| P+D | 2.42±0.12a | 2.09±0.10a | 3.54±0.11a | 4.32±0.35a | 13.47±0.57a | |
| T2 | 2.35±0.09a | 2.09±0.06a | 3.51±0.15a | 4.40±0.13a | 13.43±0.28a | |
| M4 | 2.37±0.10a | 2.03±0.12a | 3.53±0.14a | 4.45±0.12a | 13.45±0.41a | |
| 36 | CK | 2.51±0.03a | 2.12±0.09a | 3.23±0.12c | 4.03±0.24b | 12.94±0.39a |
| P | 2.45±0.12a | 2.11±0.07a | 3.20±0.07c | 4.06±0.21ab | 12.95±0.17a | |
| P+D | 2.51±0.09a | 2.15±0.07a | 3.28±0.08bc | 4.08±0.27ab | 13.01±0.29a | |
| T2 | 2.43±0.07a | 2.08±0.05a | 3.44±0.13ab | 4.38±0.11ab | 13.31±0.33a | |
| M4 | 2.40±0.05a | 2.06±0.10a | 3.51±0.14a | 4.43±0.12a | 13.43±0.41a | |
| 60 | CK | 2.55±0.14ab | 2.14±0.07a | 3.05±0.14b | 3.48±0.16b | 12.36±0.34b |
| P | 2.60±0.11ab | 2.22±0.05a | 3.02±0.07b | 3.43±0.14b | 12.38±0.31b | |
| P+D | 2.63±0.08a | 2.15±0.10a | 3.00±0.10b | 3.46±0.16b | 12.30±0.38b | |
| T2 | 2.46±0.10ab | 2.11±0.12a | 3.37±0.12a | 4.25±0.12a | 13.28±0.33a | |
| M4 | 2.42±0.10b | 2.08±0.12a | 3.46±0.13a | 4.39±0.12a | 13.45±0.44a | |
| 84 | CK | 2.78±0.11a | 2.25±0.07a | 2.66±0.07b | 2.68±0.05b | 11.27±0.33b |
| P | 2.76±0.18a | 2.21±0.05ab | 2.69±0.10b | 2.67±0.12b | 11.14±0.19b | |
| P+D | 2.60±0.08ab | 2.28±0.06a | 2.68±0.05b | 2.69±0.12b | 11.29±0.26b | |
| T2 | 2.51±0.07ab | 2.16±0.07ab | 3.29±0.07a | 4.06±0.21a | 13.08±0.60a | |
| M4 | 2.45±0.09b | 2.10±0.10b | 3.39±0.16a | 4.31±0.17a | 13.34±0.46a |
由图 3可知:随着诱导穗发芽时间的增加, 各处理的SDS-沉降值均表现降低的趋势, 其中CK、P、P+D间差异不显著, 降低的幅度显著大于T2和M4。T2和M4的SDS-沉降值在36 h后降低幅度增加, T2下降更明显。在84 h时, T2和M4的SDS-沉降值与CK相比差异显著, 且T2降低的幅度与M4相比增加12.53%。

|
图 3 生物延缓剂对小麦SDS-沉降值的影响 Fig. 3 Effect of biological retardant on SDS sedimentation volume of wheat |
由表 3可知:随着诱导穗发芽时间的增加, 小麦粉的湿面筋和干面筋含量均下降。CK、P、P+D的湿面筋和干面筋含量降低明显, 且在诱导后36 h后面筋含量下降速率加快; 在60~84 h, CK、P、P+D的干面筋和湿面筋含量分别降低19.15%~20.57%、16.13%~18.44%。与CK相比, T2和M4干、湿面筋含量降低趋势显著减小。在60~84 h, T2的干面筋和湿面筋含量分别降低9.58%和5.36%, M4的干面筋和湿面筋含量分别降低6.40%和2.02%, 且在84 h时, T2和M4与CK相比差异显著, 且T2和M4之间差异显著。生物延缓剂在保证小麦种子活力的同时, 缓解小麦穗发芽导致的干、湿面筋含量的下降。
| 处理时间/h Treatment time |
处理 Treatment |
湿面筋含量/% Wet gluten content |
干面筋含量/% Dry gluten content |
| 12 | CK | 26.89±0.80a | 9.75±0.29a |
| P | 27.07±0.95a | 9.67±0.23a | |
| P+D | 27.30±0.66a | 9.85±0.20a | |
| T2 | 26.81±0.60a | 9.71±0.26a | |
| M4 | 27.03±0.85a | 9.77±0.29a | |
| 24 | CK | 26.16±0.84a | 9.50±0.31ab |
| P | 26.33±0.52a | 9.46±0.14ab | |
| P+D | 25.94±0.34a | 9.25±0.34b | |
| T2 | 26.88±0.62a | 9.69±0.23a | |
| M4 | 27.17±0.70a | 9.81±0.25a | |
| 36 | CK | 25.25±0.47b | 8.72±0.26b |
| P | 24.99±0.77b | 8.66±0.31b | |
| P+D | 25.11±0.34b | 8.59±0.24b | |
| T2 | 26.57±0.65a | 9.32±0.09a | |
| M4 | 26.92±0.19a | 9.40±0.17a | |
| 60 | CK | 22.34±0.44c | 7.84±0.14c |
| P | 22.01±0.11c | 7.76±0.20c | |
| P+D | 21.93±0.52c | 7.94±0.20c | |
| T2 | 25.45±0.44b | 8.94±0.20b | |
| M4 | 26.43±0.42a | 9.27±0.15a | |
| 84 | CK | 18.22±0.42c | 6.34±0.12c |
| P | 18.08±0.40c | 6.25±0.23c | |
| P+D | 18.39±0.29c | 6.30±0.15c | |
| T2 | 24.09±0.28b | 8.08±0.16b | |
| M4 | 25.89±0.34a | 8.67±0.27a |
小麦穗发芽后, 籽粒的碳水化合物水解酶和降解酶活性显著升高, 导致储藏在胚和胚乳中的营养物质被降解, 千粒质量和产量降低[27-28]。王丽娜[17]也发现随着发芽程度的增加, 储藏物质被水解和消耗, 导致小麦千粒质量下降, 出粉率降低。在本研究中, 随着小麦诱导穗发芽时间的增加, 小麦种子的发芽率显著升高, 千粒质量显著降低。经过生物延缓剂处理的小麦能够延缓穗发芽的时间, 种子发芽延缓24~32 h, 且在诱导发芽84 h后T2储藏物质被降解的速率降低, 缓解千粒质量急剧降低的趋势。而经过茉莉酸甲酯处理后, 虽然抑制了穗发芽, 但种子几乎失去活性且药性不稳定, 失去了生产意义。
α-淀粉酶广泛存在于植物体内, 参与许多植物的代谢过程, 它能够水解种子中α-1, 4-糖苷键来影响发芽率, 因此, α-淀粉酶活性与穗发芽之间被认为具有非常显著的关系[29]。降落数值是反映α-淀粉酶活性的一个重要指标, 小麦中的α-淀粉酶会降解籽粒中的淀粉, 从而影响小麦的降落数值[30]。研究发现, 小麦发芽后的淀粉颗粒遭到水解酶侵蚀, A型淀粉表面结构被破坏, 具有较明显的“赤道”槽, 导致淀粉含量降低[31]。在本研究结果中, 随着小麦穗发芽时间的增加, α-淀粉酶活性显著增高, 降落数值明显降低, 总淀粉含量、支链淀粉含量也呈现逐渐降低的趋势。而1 500 mg·L-1生物延缓剂能够缓解淀粉被水解的速率, 抑制α-淀粉酶活性, 在84 h处理T2的总淀粉和支链淀粉含量下降, 分别缓解了49.62%和51.84%。本研究中的直链淀粉含量随着发芽时间的增加也表现逐渐降低的趋势, 但未受到显著影响, 与张玉荣等[32]的研究结果一致。此外, 生物延缓剂延缓α-淀粉酶活性的原因可能与籽粒内源的激素平衡有关, 推测其能够有效调控ABA和GAs的平衡关系, 进而延缓小麦发芽时间。
3.2 生物延缓剂对小麦蛋白质含量的影响小麦籽粒中蛋白质含量仅有9%~15%, 但对小麦的品质至关重要。Osborne[33]在1907年根据蛋白质溶解性将其分为清蛋白、球蛋白、醇溶蛋白和谷蛋白。面筋蛋白的主要成分为醇溶蛋白和谷蛋白, 面筋蛋白遇水之后相互作用形成面筋网络结构[34]。Simsek等[4]研究发现小麦发芽后, 其内源蛋白酶活性显著升高, 天冬酰胺浓度受到显著影响, 蛋白质被降解, 氨基酸含量增加。研究发现小麦发芽后蛋白质被降解, 面筋品质和含量显著降低, 结构被破坏, 黏性下降[35]。在本研究中, 生物延缓剂显著缓解小麦籽粒蛋白品质降低的负效应。在诱导发芽84 h时, 经1 500 mg·L-1延缓剂处理后小麦籽粒的总蛋白、醇溶蛋白、谷蛋白含量、干面筋与湿面筋含量及SDS沉降值降低分别缓解了81.18%、75.37%、82.32%、49.96%、70.91%、53.07%, 说明生物延缓剂能够降低小麦蛋白酶活性, 缓解蛋白质被分解的速率, 在一定程度上维持小麦籽粒蛋白质含量及面筋品质。
综上, 化学调控是一种快速有效的方式, 在小麦籽粒蜡熟期经过1 500 mg·L-1生物延缓剂处理后, 小麦发芽时间延缓了24~32 h, 且保证了小麦种子的活力。随着诱导发芽时间的增加, α-淀粉酶活性被有效抑制, 小麦千粒质量和品质下降的负效应也得到缓解。小麦蜡熟期后施药是否存在药物残留以及食品的安全性需要进一步研究。
| [1] |
Groos C, Gay G, Perretant M R, et al. Study of the relationship between pre-harvest sprouting and grain colour by quantitative trait loci analysis in a white grain bread-wheat cross[J]. Theoretical and Applied Genetics, 2002, 104(1): 39-47. DOI:10.1007/s001220200004 |
| [2] |
Zhang Y J, Miao X L, Xia X C, et al. Cloning of seed dormancy genes(TaSdr)associated with tolerance to pre-harvest sprouting in common wheat and development of a functional marker[J]. Theoretical and Applied Genetics, 2014, 127(4): 855-866. DOI:10.1007/s00122-014-2262-6 |
| [3] |
朱美荣, 张如标, 王蓓蓓, 等. 小麦穗发芽生理及调控途径研究进展[J]. 金陵科技学院学报, 2010, 26(2): 49-54. Zhu M R, Zhang R B, Wang B B, et al. Wheat pre-harvest sprouting physiology and control approaches[J]. Journal of Jinling Institute of Technology, 2010, 26(2): 49-54 (in Chinese with English abstract). |
| [4] |
Simsek S, Ohm J B, Lu H Y, et al. Effect of pre-harvest sprouting on physicochemical changes of proteins in wheat[J]. Journal of the Science of Food and Agriculture, 2014, 94(2): 205-212. |
| [5] |
丁琦, 张延滨, 李集临, 等. 穗发芽小麦面团流变学特性动态研究初探[J]. 黑龙江农业科学, 2012(5): 1-5. Ding Q, Zhang Y B, Li J L, et al. Preliminary study on dynamic change of dough rheological properties of pre-harvest sprouting[J]. Heilongjiang Agricultural Sciences, 2012(5): 1-5 (in Chinese with English abstract). |
| [6] |
马丽.普通小麦穗发芽抗性与品质特性关系研究[D].雅安: 四川农业大学, 2014. Ma L. Relationship between the pre-harvest sprouting resistance and quality characteristics in common wheat[D]. Ya'an: Sichuan Agricultural University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10626-1016048672.htm |
| [7] |
王新国, 任江萍, 尹钧. 小麦抗穗发芽机理研究现状[J]. 中国农学通报, 2008, 24(1): 243-246. Wang X G, Ren J P, Yin J. The mechanism on wheat pre-harvest resistant sprouting[J]. Chinese Agricultural Science Bulletin, 2008, 24(1): 243-246 (in Chinese with English abstract). |
| [8] |
Gale M D, Flintham J E, Devos K M. Cereal comparative genetics and preharvest sprouting[J]. Euphytica, 2002, 126(1): 21-25. DOI:10.1023/A:1019675723265 |
| [9] |
Hareland G A. Effects of pearling on falling number and α-amylase activity of preharvest sprouted spring wheat[J]. Cereal Chemistry Journal, 2003, 80(2): 232-237. DOI:10.1094/CCHEM.2003.80.2.232 |
| [10] |
任江萍, 陈焕丽, 王振云, 等. 小麦穗发芽与籽粒内可溶性糖和α-淀粉酶活性的品种差异[J]. 西北农业学报, 2007, 16(1): 22-25. Ren J P, Chen H L, Wang Z Y, et al. Difference of pre-harvest sprouting and soluble sugar content and α-amylase activity in grains of some wheat varieties during grain developing[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2007, 16(1): 22-25 (in Chinese with English abstract). |
| [11] |
Appleford N E J, Lenton J R. Hormonal regulation of alpha-amylase gene expression in germinating wheat(Triticum aestivum)grains[J]. Physiologia Plantarum, 1997, 100(3): 534-542. DOI:10.1111/j.1399-3054.1997.tb03058.x |
| [12] |
Pérez-Flores L, Carrari F, Osuna-Fernández R, et al. Expression analysis of a GA 20-oxidase in embryos from two Sorghum lines with contrasting dormancy:possible participation of this gene in the hormonal control of germination[J]. Journal of Experimental Botany, 2003, 54(390): 2071-2079. DOI:10.1093/jxb/erg233 |
| [13] |
闫长生, 张海萍, 海林, 等. 中国小麦品种穗发芽抗性差异的研究[J]. 作物学报, 2006, 32(4): 580-587. Yan C S, Zhang H P, Hai L, et al. Differences of preharvest sprouting resistance among Chinese wheat cultivars[J]. Acta Agronomica Sinica, 2006, 32(4): 580-587 (in Chinese with English abstract). |
| [14] |
张艳, 王德森, 张勇, 等. 小麦籽粒发芽对品质的影响[J]. 麦类作物学报, 2006, 26(2): 58-62. Zhang Y, Wang D S, Zhang Y, et al. Effect of grain sprouting on major quality characters of wheat[J]. Journal of Triticeae Crops, 2006, 26(2): 58-62 (in Chinese with English abstract). |
| [15] |
魏雪芹, 苏东民, 李里特. 发芽处理对小麦生物化学品质的影响[J]. 河南工业大学学报(自然科学版), 2009, 30(1): 58-61, 94. Wei X Q, Su D M, Li L T. Effects of germination on wheat biochemical quality[J]. Journal of Henan University of Technology(Natural Science Edition), 2009, 30(1): 58-61, 94 (in Chinese with English abstract). |
| [16] |
李毅念, 卢大新, 丁为民, 等. 萌动小麦的干物质损耗与品质分析[J]. 农业工程学报, 2005, 21(8): 190-192. Li Y N, Lu D M, Ding W M, et al. Analysis of dry matter loss and quality of protruding wheat seeds[J]. Transactions of the Chinese Society of Agricultural Engineering, 2005, 21(8): 190-192 (in Chinese with English abstract). |
| [17] |
王丽娜.发芽小麦蛋白特性研究及其利用[D].郑州: 河南工业大学, 2011. Wang L N. The protein characteristics studies and utilizing of sprouted wheat[D]. Zhengzhou: Henan University of Technology, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10463-1012461733.htm |
| [18] |
Dziki D, Laskowski J. Study to analyze the influence of sprouting of the wheat grain on the grinding process[J]. Journal of Food Engineering, 2010, 96(4): 562-567. DOI:10.1016/j.jfoodeng.2009.09.002 |
| [19] |
苏在兴, 高闰飞, 易媛, 等. 小麦穗发芽抗性分析及相关分子标记检测[J]. 麦类作物学报, 2019, 39(10): 1173-1179. Su Z X, Gao R F, Yi Y, et al. Analysis of pre-harvest sprouting(PHS)resistance and detection on PHS associated molecular markers in wheat(Triticum aestivum L.)[J]. Journal of Triticeae Crops, 2019, 39(10): 1173-1179 (in Chinese with English abstract). |
| [20] |
孙永伟, 聂丽娜, 马有志, 等. 小麦穗发芽抗性相关Vp1基因启动子的分离及功能验证[J]. 作物学报, 2011, 37(10): 1743-1751. Sun Y W, Nie L N, Ma Y Z, et al. Cloning and functional analysis of Viviparous-1 promoter in wheat[J]. Acta Agronomica Sinica, 2011, 37(10): 1743-1751 (in Chinese with English abstract). |
| [21] |
Kulwal P L, Mir R R, Kumar S, et al. QTL analysis and molecular breeding for seed dormancy and pre-harvest sprouting tolerance in bread wheat[J]. Journal of Plant Biology, 2010, 37(1): 59-74. |
| [22] |
付金锋, 王凤宝, 董立峰, 等. 天然小麦穗发芽抑制剂——YSR的筛选[J]. 中国农学通报, 2003, 19(3): 35-38, 46. Fu J F, Wang F B, Dong L F, et al. Study on screening of natural wheat preharvest sprouting germination inhibitors[J]. Chinese Agricultural Science Bulletin, 2003, 19(3): 35-38, 46 (in Chinese with English abstract). |
| [23] |
杨光宇, 殷贵鸿, 郑继周, 等. 小麦穗发芽抑制剂及最佳施药期的研究初报[J]. 麦类作物学报, 2000, 20(2): 93-95. Yang G Y, Yin G H, Zheng J Z, et al. The premilinary report of preharvest sprouting inhibiting agent and its best spraying period[J]. Journal of Triticeae Crops, 2000, 20(2): 93-95 (in Chinese with English abstract). |
| [24] |
Jiang D, Cao W, Dai T, et al. Activities of key enzymes for starch synthesis in relation to growth of superior and inferior grains on winter wheat(Triticum aestivum L.)spike[J]. Plant Growth Regulation, 2003, 41(3): 247-257. DOI:10.1023/B:GROW.0000007500.90240.7d |
| [25] |
Zhang C, Jiang D, Liu F, et al. Starch granules size distribution in superior and inferior grains of wheat is related to enzyme activities and their gene expressions during grain filling[J]. Journal of Cereal Science, 2010, 51(2): 226-233. DOI:10.1016/j.jcs.2009.12.002 |
| [26] |
中国科学院上海植物生理研究所, 上海市植物生理学会. 现代植物生理学实验指南[M]. 北京: 科学出版社, 1999. Shanghai Institute of Plant Physiology, Chinese Academy of Sciences, Shanghai Society for Plant Physiology. Modern Plant Physiology Experiment[M]. Beijing: Science Press, 1999 (in Chinese). |
| [27] |
Mori M, Uchino N, Chono M, et al. Mapping QTLs for grain dormancy on wheat chromosome 3A and the group 4 chromosomes, and their combined effect[J]. Theoretical and Applied Genetics, 2005, 110(7): 1315-1323. DOI:10.1007/s00122-005-1972-1 |
| [28] |
Humphreys D G, Noll J. Methods for characterization of preharvest sprouting resistance in a wheat breeding program[J]. Euphytica, 2002, 126(1): 61-65. DOI:10.1023/A:1019671622356 |
| [29] |
Gao X, Hu C H, Li H Z, et al. Factors affecting pre-harvest sprouting resistance in wheat(Triticum aestivum L.):a review[J]. Journal of Animal and Plant Sciences, 2013, 23(2): 556-565. |
| [30] |
Olaerts H, Roye C, Derde L J, et al. Impact of preharvest sprouting of wheat(Triticum aestivum)in the field on starch, protein, and arabinoxylan properties[J]. Journal of Agricultural and Food Chemistry, 2016, 64(44): 8324-8332. DOI:10.1021/acs.jafc.6b03140 |
| [31] |
张钟, 缪莉, 张玲, 等. 发芽对小麦淀粉结构和性质的影响[J]. 粮食与饲料工业, 2013, 12(7): 22-25, 29. Zhang Z, Miao L, Zhang L, et al. Effect of germination on structure and properties of wheat starch[J]. Cereal and Feed Industry, 2013, 12(7): 22-25, 29 (in Chinese with English abstract). |
| [32] |
张玉荣, 寇含笑, 陈红. 小麦萌动和发芽对其营养品质的影响[J]. 食品科技, 2019, 44(12): 157-163. Zhang Y R, Kou H X, Chen H. Effects of wheat germination and sprout on its nutritional quality[J]. Food Science and Technology, 2019, 44(12): 157-163 (in Chinese with English abstract). |
| [33] |
Osborne T B. Proteins of the Wheat Kernel[M]. Washington: Carnegie Institution of Washington, 1907.
|
| [34] |
Ceresino E B, Kuktaite R, Sato H H, et al. Impact of gluten separation process and transglutaminase source on gluten based dough properties[J]. Food Hydrocolloids, 2019, 87: 661-669. DOI:10.1016/j.foodhyd.2018.08.035 |
| [35] |
Singh H, Singh N, Kaur L, et al. Effect of sprouting conditions on functional and dynamic rheological properties of wheat[J]. Journal of Food Engineering, 2001, 47(1): 23-29. |




